Композиции glp-1 пептидов и их получение
Иллюстрации
Показать всеГруппа изобретений относится к области фармацевтики и медицины и касается фармацевтической композиции для лечения диабета или ожирения, содержащей первый тип гранул и второй тип гранул, в которых указанный первый тип гранул содержит соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты и не содержит пептид GLP-1, и в которых указанный второй тип гранул содержит пептид GLP-1 и не содержит соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты, а также относится к способам получения композиции и к их применению в медицине. Группа изобретений обеспечивает улучшение биодоступности пептида GLP-1. 4 н. и 29 з.п. ф-лы, 10 пр., 12 табл.
Реферат
Настоящее изобретение направлено на композиции, содержащие фармакологически активные агенты, такие как GLP-1 (глюкагоноподобный пептид-1), и агент для доставки, а также на способы их получения и их применение в медицине.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Одной из главных проблем в пероральной доставке белков и пептидов является неспособность данных соединений легко транспортироваться через мембраны желудочно-кишечного тракта. Ранее было показано, что агент для доставки SNAC улучшает биодоступность пептидов, вводимых перорально. Настоящее изобретение относится к дальнейшему улучшению биодоступности посредством перорального введения композиций таких пептидов, в частности пептидов GLP-1.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном воплощении изобретение относится к фармацевтической композиции, содержащей первый тип и второй тип гранул, в которой указанный первый тип гранул содержит соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты и не содержит пептид GLP-1, и в которой указанный второй тип гранул содержит пептид GLP-1 и не содержит соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты. В некоторых воплощениях термин «гранула» относится к маленьким частицам, собранным в большую массу.
В одном воплощении изобретение относится к способу получения фармацевтической композиции, содержащей соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты и пептид GLP-1, где способ включает следующие стадии: а) смешивание пептида GLP-1 с наполнителем и/или связующим веществом; б) сухое гранулирование смеси со стадии а; в) смешивание гранул, полученных на стадии б, с композицией, содержащей соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты; и г) возможно добавление дополнительной смазки, где смесь со стадии а не содержит соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты.
В одном воплощении изобретение относится к способу получения фармацевтической композиции, содержащей соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты и пептид GLP-1, где способ включает следующие стадии: а) смешивание соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты со смазкой и/или наполнителем; б) сухое гранулирование смеси со стадии а; в) смешивание гранул, полученных на стадии б, с композицией, содержащей пептид GLP-1; и г) возможно добавление дополнительной смазки, где смесь со стадии а не содержит пептид GLP-1.
В одном воплощении изобретение относится к способу получения фармацевтической композиции, содержащей соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты и пептид GLP-1, где способ включает следующие стадии: а) смешивание пептида GLP-1 с наполнителем и/или связующим веществом; б) сухое гранулирование смеси со стадии а; в) смешивание соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты, возможно смазки и/или наполнителя; г) сухое гранулирование смеси со стадии в; д) смешивание гранул, полученных на стадии б, с гранулами, полученными на стадии г); и е) возможно добавление дополнительной смазки, где смесь со стадии а не содержит соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты, и где смесь со стадии в не содержит пептид GLP-1.
В одном воплощении изобретение относится к грануле, содержащей соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты, смазку, возможно наполнитель и не содержащей пептид GLP-1. В одном воплощении изобретение относится к способу получения гранулы, содержащей соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты, где способ включает следующие стадии: а) смешивание соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты (такой как SNAC) со смазкой и/или наполнителем и б) сухое гранулирование смеси со стадии а, где смесь со стадии а не содержит пептид GLP-1.
В одном воплощении изобретение относится к грануле, содержащей пептид GLP-1, наполнитель, связующее вещество и не содержащей соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты. В одном воплощении изобретение относится к способу получения гранулы, содержащей пептид GLP-1, где способ включает следующие стадии: а) смешивание пептида GLP-1, возможно наполнителя и/или связывающего вещества и б) вальцевание смеси со стадии а, где смесь со стадии а не содержит соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты.
В одном воплощении изобретение относится к фармацевтической композиции или грануле, полученной способом, как здесь определено.
В одном воплощении изобретение относится к композиции или грануле, как здесь определено, для применения в медицине, как, например, для лечения диабета или ожирения, где указанную композицию вводят перорально. В одном воплощении изобретение относится к способу лечения диабета или ожирения, включающему введение композиции, как здесь определено, пациенту, нуждающемуся в этом, при котором указанную композицию вводят перорально.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения неожиданно обнаружили, что свойства растворения таблеток, изготовленных из той же самой композиции (т.е. того же самого типа и тех же самых количеств эксципиентов и агента для доставки), определялись структурой гранул, из которых были образованы таблетки.
Кроме того, авторы настоящего изобретения обнаружили, что характеристики растворения неожиданно имели заметный эффект на биодоступность пептида GLP-1 из композиции, такой как таблетка. Таким образом, авторы настоящего изобретения показали, что биодоступность твердых таблеток, изготовленных из гранул разной структуры, можно предсказывать из данных in vitro, т.е. данных по растворению. В одном воплощении данного изобретения предложены композиции, гранулы с улучшенной биодоступностью пептида GLP-1 и способы их получения.
В общем, термин «биодоступность» в том виде, как он здесь используется, относится к доле введенной дозы активного фармацевтического ингредиента (API) и/или активных группировок, как, например, пептида GLP-1, как здесь определено, которая достигает большого круга кровообращения в неизменной или в другой активной форме. По определению при внутривенном введении API и/или активных группировок его биодоступность составляет 100%. Однако при его введении другими путями (как, например, перорально) его биодоступность снижается (из-за неполного поглощения и/или пресистемного метаболизма). Знание биодоступности является важным при расчете дозировок для невнутривенных путей введения.
Абсолютную пероральную биодоступность рассчитывают как относительную экспозицию API и/или активных группировок в большом круге кровообращения после перорального введения (оцениваемую как площадь под кривой концентрации в плазме относительно времени) по сравнению с экспозицией API после внутривенного введения.
Фармацевтические композиции
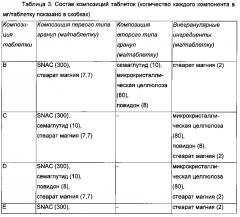
В некоторых воплощениях изобретение относится к фармацевтической композиции, содержащей первый тип и второй тип гранул, в которой указанный первый тип гранул содержит соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты, и указанный второй тип гранул содержит пептид GLP-1. В некоторых воплощениях первый тип гранул, кроме того, содержит смазку, такую как стеарат магния. В некоторых воплощениях первый тип гранул, кроме того, содержит наполнитель, такой как микрокристаллическая целлюлоза. Соответственно, первый тип гранул может, кроме того, содержать смазку и, возможно, наполнитель. В некоторых воплощениях второй тип гранул, кроме того, содержит наполнитель, такой как микрокристаллическая целлюлоза. В некоторых воплощениях второй тип гранул, кроме того, содержит связующее вещество, такое как повидон. Соответственно, второй тип гранул может, кроме того, содержать наполнитель и, возможно, связующее вещество. В некоторых воплощениях композиция, кроме того, содержит внегранулярную смазку, такую как стеарат магния.
В некоторых воплощениях N-(8-(2-гидроксибензоил)амино)каприловая кислота называется «NAC».
В некоторых воплощениях первый тип гранул, содержащих соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты, не содержит пептид GLP-1. В некоторых воплощениях второй тип гранул, содержащих пептид GLP-1, не содержит соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты. В некоторых воплощениях фармацевтическая композиция содержит первый тип и второй тип гранул, где указанный первый тип гранул содержит соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты и не содержит пептид GLP-1, и где указанный второй тип гранул содержит пептид GLP-1 и не содержит соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты.
В некоторых воплощениях термин «гранула» относится к частицам, собранным в большие частицы.
В некоторых воплощениях изобретение относится к фармацевтической композиции, содержащей соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты и пептид GLP-1, где высвобождение указанной соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты является одновременным с или более быстрым, чем высвобождение указанного пептида GLP-1, при определении путем тестирования растворения с использованием анализа (I). В некоторых воплощениях изобретение относится к фармацевтической композиции, содержащей соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты и пептид GLP-1, где высвобождение указанной соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты является одновременным с или более быстрым, чем высвобождение указанного пептида GLP-1.
В некоторых воплощениях термин «высвобождение» при использовании в отношении N-(8-(2-гидроксибензоил)амино)каприловой кислоты и, возможно, по сравнению с высвобождением пептида GLP-1 определяется в пределах 30 минут, как, например, в пределах 25, 20, 15 минут, или как, например, в пределах 10 или 5 минут при определении путем тестирования растворения с использованием анализа (I). Соответственно, высвобождение может определяться в пределах 30 минут тестирования растворения с использованием анализа (I). В некоторых воплощениях высвобождение указанной соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты, названное «более быстрым, чем» высвобождение указанного пептида GLP-1, определяют в пределах 30 минут, как, например, в пределах 25, 20, 15 минут, или как, например, в пределах 10 или 5 минут при определении путем тестирования растворения с использованием анализа (I). В некоторых воплощениях высвобождение указанной соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты, названное «более быстрым, чем» высвобождение указанного пептида GLP-1, определяют в пределах 30 минут, как, например, в пределах 25, 20, 15 минут, или как, например, в пределах 10 или 5 минут при определении путем тестирования растворения с использованием анализа (I) при pH 2,5.
В некоторых воплощениях высвобождение указанной соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты, названное «одновременным с» высвобождением указанного пептида GLP-1, определяется в пределах 30 минут, как, например, в пределах 25, 20, 15 минут, или как, например, в пределах 10 или 5 минут при определении путем тестирования растворения с использованием анализа (I). В некоторых воплощениях высвобождение указанной соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты, названное «одновременным с» высвобождением указанного пептида GLP-1, определяется в пределах 30 минут, как, например, в пределах 25, 20, 15 минут, или как, например, в пределах 10 или 5 минут при определении путем тестирования растворения с использованием анализа (I) при pH 2,5.
В некоторых воплощениях изобретение относится к фармацевтической композиции по любому из предшествующих пп., где количество растворенной соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты достигает пика в пределах первых 60 минут при определении путем тестирования растворения с использованием анализа (I) при pH 2,5. В некоторых воплощениях изобретение относится к фармацевтической композиции, где количество растворенной соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты достигает пика в пределах первых 30 минут при определении путем тестирования растворения с использованием анализа (I) при pH 2,5. В некоторых воплощениях количество растворенной соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты достигает пика в пределах 55 минут, как, например, в пределах 50, 45 или 40 минут при определении путем тестирования растворения с использованием анализа (I) при pH 2,5. В некоторых воплощениях количество растворенной соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты достигает пика в пределах 39 или 38 минут, как, например, в пределах 37, 36 или 35 минут при определении путем тестирования растворения с использованием анализа (I) при pH 2,5. В некоторых воплощениях количество растворенной соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты достигает пика в пределах 34 минут, как, например, в пределах 33, 32 или 31 минуты при определении путем тестирования растворения с использованием анализа (I) при pH 2,5. В некоторых воплощениях количество растворенной соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты достигает пика в пределах 31 минуты, как, например, в пределах 32, 33, 34, 35, 36, 37, 38, 39, 40, 45, 50, 55 или 60 минут при определении путем тестирования растворения с использованием анализа (I) при pH 2,5.
В некоторых воплощениях композиция содержит гранулы, которые были изготовлены путем сухого гранулирования. В некоторых воплощениях композиция содержит гранулы, которые были изготовлены путем вальцевания. В некоторых воплощениях формовка, полученная в результате процесса вальцевания, измельчается на гранулы. Термин «композиция» в том виде, как он здесь используется, относится к фармацевтической композиции.
В некоторых воплощениях композиция находится в виде твердой лекарственной формы. В некоторых воплощениях композиция находится в форме таблетки. В некоторых воплощениях композиция находится в форме капсулы. В некоторых воплощениях композиция находится в форме пакетика.
В некоторых воплощениях композиция или гранула содержит по меньшей мере один фармацевтически приемлемый эксципиент. Термин «эксципиент» в том виде, как он здесь используется, в широком смысле относится к любому компоненту, отличному от активного терапевтического ингредиента(тов). Эксципиент может представлять собой инертное вещество, которое является инертным в том смысле, что оно само по себе по существу не имеет какого-либо терапевтического и/или профилактического эффекта. Эксципиент может служить для разных целей, например, в качестве агента для доставки, усилителя поглощения, носителя, наполнителя (также известного как разбавители), связующего вещества, смазки, скользящего вещества, разрыхлителя, замедлителей кристаллизации, подкисляющего агента, подщелачивающего агента, консерванта, антиоксиданта, буферизующего агента, хелатора, комплексообразующих агентов, поверхностно-активного вещества, эмульгаторов и/или солюбилизаторов, подсластителей, увлажнителей, стабилизатора, красителя, корригента, и/или для улучшения введения и/или поглощения активного вещества. Специалист в данной области может выбрать один или более чем один из вышеупомянутых эксципиентов с учетом конкретных желательных свойств твердой пероральной лекарственной формы путем традиционного экспериментирования и без каких-либо чрезмерных усилий. Количество каждого использованного эксципиента может варьировать в пределах традиционных в данной области интервалов. Методики и эксципиенты, которые могут быть использованы для приготовления пероральных лекарственных форм, описаны в Handbook of Pharmaceutical Excipients, 6th edition, Rowe et al., Eds., American Pharmaceuticals Association and the Pharmaceutical Press, publications department of the Royal Pharmaceutical Society of Great Britain (2009) и Remington: the Science and Practice of Pharmacy, 21th edition, Gennaro, Ed., Lippincott Williams & Wilkins (2005).
В некоторых воплощениях композиция или гранула содержит наполнитель, такой как лактоза (например, лактоза, высушенная распылением, α-лактоза, β-лактоза, Tabletose®, разные сорта Pharmatose®, Microtose® или Fast-FloC®), микрокристаллическая целлюлоза (разные сорта Avicel®, Elcema®, Vivacel®, Ming Tai® или Solka-Floc®), другие производные целлюлозы, сахароза, сорбит, маннит, декстрины, декстраны, мальтодекстрины, декстроза, фруктоза, каолин, маннит, сорбит, сахароза, сахар, крахмалы или модифицированные крахмалы (включающие картофельный крахмал, кукурузный крахмал и рисовый крахмал), фосфат кальция (например, основной фосфат кальция, гидрофосфат кальция, дикальция фосфат гидрат), сульфат кальция, карбонат кальция или альгинат натрия. В некоторых воплощениях наполнитель представляет собой микрокристаллическую целлюлозу, такую как Avicel РН 101.
В некоторых воплощениях композиция или гранула содержит связывающее вещество, такое как лактоза (например, лактоза, высушенная распылением, α-лактоза, β-лактоза, Tabletose®, разные сорта Pharmatose®, Microtose® или Fast-FloC®), микрокристаллическая целлюлоза (разные сорта Avicel®, Elcema®, Vivacel®, Ming Tai® или Solka-Floc®), гидроксипропилцеллюлоза, L-гидроксипропилцеллюлоза (с низкой степенью замещения), гипромеллоза (НРМС) (например, Methocel Е, F и K, Metolose SH от Shin-Etsu, Ltd, такие как, например, 4000 сП (сантипуаз) Methocel Е и Metolose 60 SH, и 4000 сП Methocel F и Metolose 65 SH, 4000, 15000 и 100000 сП Methocel K; и 4000, 15000, 39000 и 100000 сП Metolose 90 SH), метилцеллюлозные полимеры (такие как, например, Methocel А, Methocel А4С, Methocel А15С, Methocel А4М), гидроксиэтилцеллюлоза, этилцеллюлоза, натрий карбоксиметилцеллюлоза, другие производные целлюлозы, сахароза, декстрины, мальтодекстрины, крахмалы или модифицированные крахмалы (включающие картофельный крахмал, кукурузный крахмал и рисовый крахмал), лактат кальция, карбонат кальция, аравийская камедь, альгинат натрия, агар, каррагенан, желатин, гуаровая камедь, пектин, PEG (полиэтиленгликоль) или повидон. В некоторых воплощениях связующее вещество представляет собой повидон, такой как повидон K 90.
В некоторых воплощениях композиция или гранула содержит разрыхлитель, такой как альгиновая кислота, альгинаты, микрокристаллическая целлюлоза, гидроксипропилцеллюлоза, другие производные целлюлозы, натрий кроскармеллоза, кросповидон, калия полакриллин, натрия крахмала гликолят, крахмал, прежелатинизированный крахмал или карбоксиметилкрахмал (например, Primogel® и Explotab®).
В некоторых воплощениях композиция или гранула содержит смазку, такую как стеариновая кислота, стеарат магния, стеарат кальция или стеарат другого металла, тальк, воска, глицериды, легкое минеральное масло, глицерилбегенат, гидрогенизированные растительные масла, стеарилфумарат натрия, полиэтиленгликоли, алкилсульфаты или бензоат натрия. В некоторых воплощениях композиция или гранула содержит смазку, такую как силикат магния, тальк или коллоидный диоксид кремния. В некоторых воплощениях смазка представляет собой стеарат магния.
В некоторых воплощениях композиция или гранула содержит один или более чем один эксципиент, выбранный из следующих: замедлители кристаллизации, такие как повидон и т.д.; солюбилизирующие агенты (также известные как поверхностно-активные вещества), такие как анионные поверхностно-активные вещества (например, плюроник или повидон), катионные поверхностно-активные вещества, неионные поверхностно-активные вещества и/или цвиттерионные поверхностно-активные вещества; красители, включающие контрастные вещества и пигменты, такие как красный или желтый оксид железа, диоксид титана и/или тальк; и/или агенты, контролирующие pH, такие как лимонная кислота, винная кислота, фумаровая кислота, цитрат натрия, двухосновный фосфат кальция и/или двухосновный фосфат натрия.
В некоторых воплощениях композиция содержит по меньшей мере 60% (масс./масс.) агента для доставки меньше чем 10% (масс./масс.) связующего вещества, 5-40% (масс./масс.) наполнителя и меньше чем 10% (масс./масс.) смазки.
В некоторых воплощениях композиция содержит по меньшей мере 60% (масс./масс.), как, например, 65-75% (масс./масс.), 60-80% (масс./масс.) или 50-90% (масс./масс.) агента для доставки. В некоторых воплощениях композиция содержит по меньшей мере 70% (масс./масс.), как, например, 70-80% (масс./масс.) агента для доставки.
В некоторых воплощениях композиция содержит 0,1-10% (масс./масс.), как, например, 0,2-4% (масс./масс.) или 0,5-3% (масс./масс.) связующего вещества. В некоторых воплощениях композиция содержит 1,5-2,5% (масс./масс.), как, например, 1,7-2,3% (масс./масс.), 1,8-2,2% (масс./масс.) или 1,9-2,1% (масс./масс.) связующего вещества. В некоторых воплощениях композиция содержит 1% (масс./масс.) или 2% (масс./масс.) связующего вещества.
В некоторых воплощениях композиция содержит 5-40% (масс./масс.), как, например, 10-30% (масс./масс.) или 5-25% (масс./масс.) наполнителя. В некоторых воплощениях композиция содержит 10-25% (масс./масс.), как, например, 17-23% (масс./масс.), 18-22% (масс./масс.) или 19-21% (масс./масс.) наполнителя. В некоторых воплощениях композиция содержит 10,9% (масс./масс.) или 18% (масс./масс.) наполнителя, или содержит 19,5% (масс./масс.) или 20,5% (масс./масс.) наполнителя.
В некоторых воплощениях композиция содержит 0,1-10% (масс./масс.) или 0,5-5% (масс./масс.), как, например, 1-3,5% (масс./масс.) или 1% (масс./масс.) смазки. В некоторых воплощениях композиция содержит 1,5-3% (масс./масс.), как, например, 2,1-2,7% (масс./масс.), 2,2-2,6% (масс./масс.) или 2,3-2,5% (масс./масс.) смазки.
Кроме того, композиция или гранула по изобретению может быть приготовлена, как известно, в области пероральных композиций инсулинотропных соединений.
Композицию или гранулу можно вводить в нескольких лекарственных формах, например, в виде таблетки; капсулы, такой как твердые капсулы, пакетика или порошка. Композицию или гранулу, кроме того, можно составлять в носителе лекарственного средства или системе доставки лекарственного средства, например, для того, чтобы улучшать стабильность и/или растворимость или дополнительно улучшать биодоступность.
В некоторых воплощениях масса таблетки находится в интервале от 150 мг до 1000 мг, как, например, в интервале 300-600 мг или 350-450 мг.
В некоторых воплощениях изобретение относится к первой грануле, содержащей по меньшей мере 75% (масс./масс.) агента для доставки, меньше чем 10% (масс./масс.) смазки и, возможно, меньше чем 20% наполнителя, и не содержащей пептид GLP-1. В некоторых воплощениях изобретение относится к первой грануле, содержащей по меньшей мере 80% (масс./масс.) агента для доставки, меньше чем 10% (масс./масс.) смазки и, возможно, меньше чем 20% наполнителя, и не содержащей пептид GLP-1. В некоторых воплощениях первая гранула содержит 75-90% (масс./масс.), как, например, 78-88% (масс./масс.), 80-86% (масс./масс.) или 82-84% (масс./масс.) агента для доставки. В некоторых воплощениях первая гранула содержит меньше чем 10% (масс./масс.), как, например 1-3% (масс./масс.), 1,5-2,5% (масс./масс.) или 1,9-2,3% (масс./масс.) смазки. В некоторых воплощениях первая гранула содержит меньше, чем 20%, как, например, 10-20% (масс./масс.), 12-18% (масс./масс.) или 14-17% (масс./масс.) наполнителя. В некоторых воплощениях первая гранула не содержит пептид GLP-1. В некоторых воплощениях гранула содержит по меньшей мере 80% (масс./масс.) агента для доставки, меньше чем 10% (масс./масс.) смазки и, возможно, меньше чем 20% наполнителя.
В некоторых воплощениях изобретение относится ко второй грануле, содержащей пептид GLP-1, по меньшей мере 15% (масс./масс.) наполнителя и меньше чем 40% (масс./масс.) связующего вещества и не содержащей соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты. В некоторых воплощениях вторая гранула содержит по меньшей мере 1%, как, например, 1-70% (масс./масс.), 2-40% (масс./масс.) или 4-30% (масс./масс.) пептида GLP-1. В некоторых воплощениях вторая гранула содержит по меньшей мере 20%, как, например, 40-80% (масс./масс.) или 50-75% (масс./масс.) наполнителя. В некоторых воплощениях вторая гранула содержит меньше чем 30%, как, например, 5-30% (масс./масс.), 10-28% (масс./масс.) или 15-25% (масс./масс.) связующего вещества. В некоторых воплощениях вторая гранула не содержит соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты. В некоторых воплощениях гранула содержит пептид GLP-1, по меньшей мере 15% (масс./масс.) наполнителя и меньше чем 40% (масс./масс.) связующего вещества. В некоторых воплощениях гранула содержит пептид GLP-1, по меньшей мере 50% (масс./масс.) наполнителя и меньше чем 40% (масс./масс.) связующего вещества.
В некоторых воплощениях изобретение относится к композиции, содержащей первый и второй тип гранул, где первый тип гранулы содержит по меньшей мере 75% (масс./масс.) агента для доставки, меньше чем 10% (масс./масс.) смазки, возможно меньше чем 20% наполнителя и не содержит пептид GLP-1, и где второй тип гранулы содержит пептид GLP-1, по меньшей мере 15% (масс./масс.) наполнителя, меньше чем 40% (масс./масс.) связующего вещества и не содержит соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты. В некоторых воплощениях изобретение относится к композиции, содержащей первый и второй тип гранул, где первый тип гранулы содержит по меньшей мере 75% (масс./масс.) агента для доставки, меньше чем 10% (масс./масс.) смазки, меньше, чем 20% наполнителя и не содержит пептид GLP-1, и где второй тип гранулы содержит пептид GLP-1, по меньшей мере 15% (масс./масс.) наполнителя, меньше чем 40% (масс./масс.) связующего вещества и не содержит соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты. В некоторых воплощениях изобретение относится к композиции, содержащей первый и второй тип гранул, где первый тип гранулы содержит по меньшей мере 75% (масс./масс.) агента для доставки, меньше чем 10% (масс./масс.) смазки и не содержит пептид GLP-1, и где второй тип гранулы содержит пептид GLP-1, по меньшей мере 15% (масс./масс.) наполнителя, меньше чем 40% (масс./масс.) связующего вещества и не содержит соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты.
Способы получения фармацевтических композиций
Композиции по изобретению можно получать, как известно, в данной области. В некоторых воплощениях композицию или гранулу можно получать, как описано в приведенных здесь примерах. В некоторых воплощениях композицию можно гранулировать до прессования в таблетки. В некоторых воплощениях гранулы по изобретению изготовляют путем сухого гранулирования, как, например, посредством вальцевания. В некоторых воплощениях формовки, полученные в результате процесса вальцевания, измельчают на гранулы. Композиция может содержать одну или более чем одну внутригранулярную часть и внегранулярную часть, где внутригранулярные части были гранулированы, и где внегранулярная часть была добавлена после гранулирования. Первая внутригранулярная часть может содержать пептид GLP-1 и один или более чем один эксципиент, и вторая внутригранулярная часть может содержать агент для доставки и, возможно, один или более чем один эксципиент. Первая внутригранулярная часть может содержать пептид GLP-1, наполнитель и/или связующее вещество, и вторая внутригранулярная часть может содержать агент для доставки, смазку и наполнитель. Первая внутригранулярная часть может содержать пептид GLP-1, наполнитель и/или связующее вещество, и вторая внутригранулярная часть может содержать агент для доставки, смазку и/или наполнитель. В некоторых воплощениях первая внутригранулярная часть содержит агонист GLP-1 (т.е. пептид GLP-1), микрокристаллическую целлюлозу и/или повидон, и вторая внутригранулярная часть содержит агент для доставки, стеарат магния и микрокристаллическую целлюлозу. В некоторых воплощениях первая внутригранулярная часть содержит агонист GLP-1 (т.е. пептид GLP-1), микрокристаллическую целлюлозу и/или повидон, и вторая внутригранулярная часть содержит агент для доставки, стеарат магния и/или микрокристаллическую целлюлозу. Внегранулярная часть может содержать смазку. В некоторых воплощениях внегранулярная часть содержит стеарат магния. В некоторых воплощениях термин «наполнитель и/или связующее вещество» относится к наполнителю и, возможно, связующему веществу. В некоторых воплощениях термин «смазка и наполнитель» или «смазка и/или наполнитель» относится к смазке и, возможно, к наполнителю.
Для получения сухой смеси вещества для таблетирования разные компоненты взвешивают, возможно избавляют от комков и затем объединяют. Смешивание компонентов можно проводить, пока не получается гомогенная смесь.
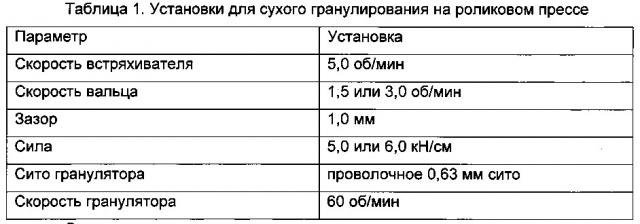
Если в веществе для таблетирования следует использовать гранулы, гранулы можно получать способом, известным специалисту в данной области, например, методиками сухого гранулирования, в которых фармацевтически активный агент и/или агенты для доставки прессуют с эксципиентами с образованием относительно больших формовок, например, кусков или полосок, которые измельчают путем растирания, и растертое вещество служит в качестве вещества для таблетирования, подлежащего последующему прессованию в таблетки. Подходящее оборудование для сухого гранулирования включает оборудование для вальцевания от Gerteis, как, например, Gerteis MINI-PACTOR, но не ограничивается им.
Для прессования вещества для таблетирования в твердую пероральную лекарственную форму, например таблетку, можно использовать таблетировочный пресс. В таблетировочном прессе веществом для таблетирования заполняют (например, посредством принудительной подачи или подачи самотеком) полость матрицы. Вещество для таблетирования затем прессуют под давлением посредством штампа. Затем образующаяся прессовка или таблетка выталкивается из таблетировочного пресса. Вышеупомянутый способ прессования затем именуется здесь «способ прессования». Подходящие таблетировочные прессы включают роторные таблетировочные прессы и эксцентриковые таблетировочные прессы, но не ограничиваются ими. Примеры таблетировочных прессов включают Fette 102i (Fette GmbH), роторный таблетировочный пресс Korsch XL100, Korsch РН 106 (Korsch AG, Германия), эксцентриковый таблетировочный пресс Korsch EK-O (Korsch AG, Germany) и Manesty F-Press (Manesty Machines Ltd., Великобритания), но не ограничиваются ими.
В некоторых воплощениях способ получения таблетки включает i) сухое гранулирование смеси, содержащей агонист GLP-1 (т.е. пептид GLP-1), наполнитель и связующее вещество; ii) сухое гранулирование смеси, содержащей агент для доставки, смазку и наполнитель; iii) смешивание гранул со смазкой и затем iv) прессование смеси в таблетки. В некоторых воплощениях способ получения таблетки включает i) сухое гранулирование смеси, содержащей агонист GLP-1 (т.е. пептид GLP-1), наполнитель и связующее вещество; ii) сухое гранулирование смеси, содержащей агент для доставки, смазку и/или наполнитель; iii) смешивание гранул со смазкой и затем iv) прессование смеси в таблетки.
В некоторых воплощениях изобретение относится к способу получения фармацевтической композиции, содержащей соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты и пептид GLP-1, где данный способ включает следующие стадии: а) смешивание пептида GLP-1 с наполнителем и/или связующим веществом; б) сухое гранулирование смеси со стадии а; в) смешивание гранул, полученных на стадии б, с композицией, содержащей соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты и г) возможно добавление дополнительной смазки. В некоторых воплощениях изобретение относится к способу получения фармацевтической композиции, содержащей соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты и пептид GLP-1, где данный способ включает следующие стадии: а) смешивание соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты со смазкой и/или наполнителем; б) сухое гранулирование смеси со стадии а; в) смешивание гранул, полученных на стадии б, с композицией, содержащей пептид GLP-1 и г) возможно добавление дополнительной смазки. В некоторых воплощениях изобретение относится к способу получения фармацевтической композиции, содержащей соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты и пептид GLP-1, где данный способ включает следующие стадии: а) смешивание пептида GLP-1 с наполнителем и/или связующим веществом; б) сухое гранулирование смеси со стадии а; в) смешивание соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты, возможно со смазкой и/или наполнителем; г) сухое гранулирование смеси со стадии в; д) смешивание гранул, полученных на стадии б, с гранулами, полученными на стадии г; и е) возможно добавление дополнительной смазки.
В одном воплощении изобретение относится к способу получения фармацевтической композиции, содержащей соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты и пептид GLP-1, где данный способ включает следующие стадии: а) смешивание пептида GLP-1 с наполнителем и/или связующим веществом; б) сухое гранулирование смеси со стадии а; в) смешивание соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты возможно со смазкой и/или наполнителем; г) сухое гранулирование смеси со стадии в; д) смешивание гранул, полученных на стадии б, с гранулами, полученными на стадии г; и е) возможно добавление дополнительной смазки, где смесь со стадии а не содержит соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты, и где смесь со стадии в не содержит пептид GLP-1.
В одном воплощении изобретение относится к грануле, содержащей соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты, смазку, возможно наполнитель и не содержащей пептид GLP-1. В одном воплощении изобретение относится к способу получения гранулы, содержащей соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты, где способ включает следующие стадии: а) смешивание соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты (такой как SNAC) со смазкой и/или наполнителем; и б) сухое гранулирование смеси со стадии а, где смесь со стадии а не содержит пептид GLP-1.
В одном воплощении изобретение относится к грануле, содержащей пептид GLP-1, наполнитель, связующее вещество и не содержащей соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты. В одном воплощении изобретение относится к способу получения гранулы, содержащей пептид GLP-1, где данный способ включает следующие стадии: а) смешивание пептида GLP-1, возможно наполнителя и/или связующего вещества и б) вальцевание смеси со стадии а, где смесь со стадии а не содержит соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты.
В некоторых воплощениях стадия смешивания, включающая смешивание соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты со смазкой и/или наполнителем до сухого гранулирования, имеет продолжительность по меньшей мере 20 минут. В некоторых воплощениях стадия смешивания, включающая смешивание соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты со смазкой и/или наполнителем до сухого гранулирования, имеет продолжительность по меньшей мере 30 минут или по меньшей мере 40 минут, как, например, 50 минут. В некоторых воплощениях стадия смешивания, включающая смешивание первого типа гранул, содержащих пептид GLP-1, со вторым типом гранул, содержащих соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты, имеет продолжительность по меньшей мере 15 минут или по меньшей мере 20 минут, как, например, по меньшей мере 25 минут или по меньшей мере 30 минут.
В некоторых воплощениях изобретение относится к фармацевтической композиции, полученной способом, как здесь определено.
В некоторых воплощениях изобретение относится к грануле, содержащей соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты и смазку. В некоторых воплощениях гранула содержит соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты, смазку и наполнитель. В некоторых воплощениях изобретение относится к грануле, содержащей пептид GLP-1, наполнитель и связующее вещество. В некоторых воплощениях гранулу получают согласно способу, как здесь определено.
В некоторых воплощениях изобретение относится к способу получения гранулы, содержащей соль N-(8-(2-гидроксибензоил)амино)каприловой кислоты, где данный способ включает следующие стадии: а) смешивание соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты (такой как SNAC) со смазкой и/или наполнителем и б) сухое гранулирование смеси со стадии а. В некоторых воплощениях стадия смешивания, включающая смешивание соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты со смазкой и/или наполнителем до сухого гранулирования, имеет продолжительность по меньшей мере 20 минут. В некоторых воплощениях стадия смешивания, включающая смешивание соли N-(8-(2-гидроксибензоил)амино)каприловой кислоты со смазкой и/или наполнителем до сухого гранулирования, имеет продолжительность по меньшей мере 30 минут или по меньшей мере 40 минут, как, например, 50 минут.
В некоторых воплощениях изобретение относится к способу получения гранулы, содержащей пептид GLP-1, где данный способ включает следующие стадии: а) смешивание пептида GLP-1, возможно наполнителя и/или связующего вещества и б) вальцевание смеси со стадии а.
В некоторых воплощениях изобретение относится к грануле, полученной способом, как здесь определено.
В некоторых воплощениях смазкой является стеарат магния. В некоторых воплощениях наполнителем является микрокристаллическая целлюлоза. В некоторых воплощениях связующим веществом является повидон.
В некоторых воплощениях термин «устойчивость таблеток к дроблению» имеет значение, определенное в разделе 2.9.8 Европейской Фармакопеи 7.5, 7-е издание 2012 г.; устойчивость к дроблению можно из