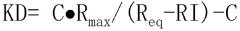Гетеродимеризованный полипептид
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии. Предложен полипептид, обладающий цитотоксической активностью, содержащий Fc-область IgG, которая состоит из гетеродимера, содержащего первый полипептид и второй полипептид, в аминокислотных последовательностях которых произведены серии мутаций. Предложена фармацевтическая композиция для лечения человеческого заболевания, связанного с антигенами, с которыми специфично взаимодействует указанный полипептид, содержащая указанный полипептид и приемлемый с медицинской точки зрения носитель. Группа изобретений позволяет оптимизировать эффекторную функцию полипептида (ADCC, ADCP, CDC) за счет изменения функции Fc-области по сравнению с функцией Fc-области полипептида, которая состоит из гомодимера, содержащего только первый или только второй полипептид. 2 н. и 5 з.п. ф-лы, 54 ил., 80 табл., 29 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к константным областям антитела, аминокислотную последовательность которых модифицируют на основании константной области природного антитела, антителам, содержащим такие константные области, фармацевтическим композициям, содержащим такие антитела, и способам их получения.
Предшествующий уровень техники
Антитела привлекают внимание в качестве фармацевтических средств вследствие того, что они являются высокостабильными в крови и обладают немногими побочными эффектами (непатентные документы 1 и 2). Практически все фармацевтические средства на основе антител, представленные в настоящее время на рынке, представляют собой антитела подкласса IgG1 человека. К настоящему времени проведено много исследований в отношении антителозависимой клеточной цитотоксичности (далее в настоящем описании обозначаемой как ADCC) и обусловленной комплементом цитотоксичности (далее в настоящем описании обозначаемой как CDC), которые представляют собой эффекторные функции антител класса IgG, и для класса IgG человека опубликовано, что антитела подкласса IgG1 обладают наибольшей активностью ADCC и активностью CDC (непатентный документ 3). Кроме того, антителозависимый клеточный фагоцитоз (ADCP), который представляет собой фагоцитоз клеток-мишеней, опосредованный антителами класса IgG, также показан в качестве одной из эффекторных функций антитела (непатентные документы 4 и 5).
Для того чтобы антитело IgG проявляло ADCC, CDC или ADCP, необходимо, что бы Fc-область антитела связывалась с рецептором антитела, который находится на поверхности эффекторных клеток, таких как клетки-киллеры, естественные клетки-киллеры и активированные макрофаги (далее в настоящем описании обозначаемые как FcγR), и различных компонентах комплемента. У людей изоформы FcγRIa, FcγRIIa, FcγRIIb, FcγRIIIa и FcγRIIIb были опубликованы в качестве семейства белков FcγR, а также были опубликованы соответствующие аллотипы (непатентный документ 6).
Повышение цитотоксических эффекторных функций, таких как ADCC, ADCP и CDC, привлекает внимание в качестве перспективных способов повышения противоопухолевых эффектов антител. С использованием моделей на мышах описали важную роль FcγR-опосредованных эффекторных функций антител для их противоопухолевых эффектов (непатентные документы 7 и 8). Кроме того, наблюдали корреляцию между клиническими эффектами у людей и высокоаффинным полиморфным аллотипом (V158) и низкоаффинным полиморфным аллотипом (F158) FcγRIIIa (непатентный документ 9). Эти опубликованные данные продемонстрировали, что антитела, содержащие Fc-область, которую оптимизировали для специфического связывания с FcγR, опосредуют более выраженную эффекторную функцию, вследствие этого демонстрируют более выраженные противоопухолевые эффекты.
Баланс активностей связывания антитела в отношении активирующего рецептора, состоящего из FcγRIa, FcγRIIa, FcγRIIIa и FcγRIIIb, и ингибирующего рецептора, состоящего из FcγRIIb, является важным элементом при оптимизации эффекторной функции антитела. Использование Fc-области, которая повышает активность связывания с активирующими рецепторами и снижает активность связывания с ингибирующими рецепторами, может обеспечить возможность придания антителам оптимальных эффекторных функций (непатентный документ 10). Наоборот, использование Fc-области, которая обладает пролонгированной или сниженной активностью связывания с активирующими рецепторами и повышенной активностью связывания с ингибирующими рецепторами, может обеспечивать возможность придания антителам иммуносупрессивного эффекта (непатентный документ 11). В отношении связывания Fc-области и FcγR продемонстрировано, что несколько аминокислотных остатков в шарнирной области антитела и домене CH2 и цепь сахаров, добавляемые к Asn в положении 297 (нумерация EU), который связан с доменом CH2, являются важными для связывания Fc-области и FcγR (непатентные документы 12, 13 и 14). Это исследование проводили в отношении вариантов Fc-области, которые обладают различными свойствами связывания с FcγR в основном на этом участке связывания, и получали варианты Fc-области, которые обладают более высокими активностями связывания с активацией FcγR (патентные документы 1 и 2). Например, Lazar et al. успешно увеличивали связывание FcγRIIIa (V158) человека приблизительно в 370 раз заменой Ser в положении 239, Ala в положении 330 и Ile в положении 332 (нумерация EU) IgG1 человека на Asp, Leu и Glu, соответственно (непатентный документ 15 и патентный документ 2). Отношение связывания с FcγRIIIa к связыванию с FcγIIb (отношение A/I) этого варианта является повышенным приблизительно в 9 раз по сравнению с таким отношением для дикого типа. Кроме того, Lazar et al. успешно увеличивали связывание с FcγIIb приблизительно в 430 раз (непатентный документ 16). Shinkawa et al. успешно увеличивали связывание FcγRIIIa приблизительно в 100 раз удалением фукозы из цепи сахаров, добавляемой к Asn в положении 297 (нумерация EU) (непатентный документ 17).
Однако опубликованные в настоящее время функциональные модификации Fc-областей имеют ограничения, и существует необходимость в лучших функциональных модификациях Fc-областей.
Документы известного уровня техники
[Патентные документы]
[Патентный документ 1] WO 2000/042072
[Патентный документ 2] WO 2006/019447
[Патентный документ 3] WO 2009/041062
[Патентный документ 4] WO 2006/106905
[Непатентные документы]
[Непатентный документ 1] Nature Biotechnology, 23, 1073-1078 (2005)
[Непатентный документ 2] Eur. J. Pharm. Biopharm, 59(3), 389-96 (2005)
[Непатентный документ 3] Chemical Immunology, 65, 88 (1997)
[Непатентный документ 4] Cancer Res., 68, 8049-8057 (2008)
[Непатентный документ 5] Blood, 113, 3735-3743 (2009)
[Непатентный документ 6] Immunol. Lett., 82, 57-65 (2002)
[Непатентный документ 7] Pro. Nat. Acad. Sci., 95: 652-656 (1998)
[Непатентный документ 8] Nature Medicine, 6: 443-446 (2000)
[Непатентный документ 9] Blood, 99:754-758 (2002)
[Непатентный документ 10] Science, 310, 1510-1512 (2005)
[Непатентный документ 11] Science, 291, 484-486 (2001)
[Непатентный документ 12] Chemical Immunology, 65, 88 (1997)
[Непатентный документ 13] Eur. J. Immunol., 23, 1098 (1993)
[Непатентный документ 14] Immunology, 86, 319 (1995)
[Непатентный документ 15] Pro. Nat. Acad. Sci., 103, 4005-4010 (2006)
[Непатентный документ 16] Mol. Immun., 45, 3926-3933 (2008)
[Непатентный документ 17] J. Biol. Chem., 278, 3466-3473 (2003)
Сущность изобретения
Задачи, подлежащие решению посредством изобретения
Настоящее изобретение выполнено с учетом указанных выше обстоятельств. Задачей настоящего изобретения является предоставление полипептидов с улучшенной функцией Fc-области по сравнению с общепринятыми гомодимеризованными полипептидами, содержащими Fc-область; фармацевтических композиций, содержащих полипептиды; терапевтических средств или профилактических средств для иммуновоспалительных заболеваний, содержащих фармацевтические композиции; терапевтических средств или профилактических средств для различных типов злокачественных опухолей и способов их получения. Кроме того, целью настоящего изобретения является предоставление способов улучшения функции Fc-области по сравнению с общепринятыми гомодимеризованными полипептидами, содержащими Fc-область.
Средства решения задач
Авторы настоящего изобретения провели исследование, посвященное решению указанных выше проблем. В результате авторы настоящего изобретения получили гетеродимеризованные полипептиды, содержащие Fc-область, состоящую из двух полипептидов с различными аминокислотными последовательностями (первого полипептида и второго полипептида), и, таким образом, успешно получили гетеродимеризованный полипептид, содержащий Fc-область с улучшенной функцией Fc-области по сравнению с общепринятыми гомодимерами, в которых Fc-область состоит только из первого полипептида или только из второго полипептида.
Более конкретно, настоящее изобретение относится к [1]-[78], указанным ниже:
[1] полипептиду, содержащему Fc-область, где полипептид отличается тем, что Fc-область состоит из гетеродимера, содержащего первый полипептид и второй полипептид, и где полипептид отличается тем, что функция Fc-области является измененной по сравнению с функцией Fc-области полипептида, отличающегося тем, что Fc-область состоит из гомодимера, содержащего только первый полипептид, по сравнению с функцией Fc-области полипептида, отличающегося тем, что Fc-область состоит из гомодимера, содержащего только второй полипептид;
[2] полипептиду [1], где в Fc-область вводят по меньшей мере одну или более мутаций аминокислот;
[3] полипептиду [1] или [2], где мутация аминокислоты включает по меньшей мере одну мутацию аминокислоты, которая улучшает функцию Fc-области, когда мутацию вводят только в одну из Fc-областей по сравнению с тем, когда мутацию вводят Fc-области первого полипептида и второго полипептида, и когда мутацию не вводят;
[4] полипептиду [2] или [3], где по меньшей мере одну или более мутаций аминокислот вводят в домен CH2 Fc-области;
[5] полипептиду [4], где по меньшей мере одну или более мутаций аминокислот вводят в аминокислотный участок, выбранный из группы, состоящей из:
Ala в положении 231 (нумерация EU);
Pro в положении 232 (нумерация EU);
Glu в положении 233 (нумерация EU);
Leu в положении 234 (нумерация EU);
Leu в положении 235 (нумерация EU);
Gly в положении 236 (нумерация EU);
Gly в положении 237 (нумерация EU);
Pro в положении 238 (нумерация EU);
Ser в положении 239 (нумерация EU);
Val в положении 240 (нумерация EU);
Asp в положении 265 (нумерация EU);
Val в положении 266 (нумерация EU);
Ser в положении 267 (нумерация EU);
His в положении 268 (нумерация EU);
Glu в положении 269 (нумерация EU);
Asp в положении 270 (нумерация EU);
Pro в положении 271 (нумерация EU);
Gln в положении 295 (нумерация EU);
Tyr в положении 296 (нумерация EU);
Ser в положении 298 (нумерация EU);
Tyr в положении 300 (нумерация EU);
Ser в положении 324 (нумерация EU);
Asn в положении 325 (нумерация EU);
Lys в положении 326 (нумерация EU);
Ala в положении 327 (нумерация EU);
Leu в положении 328 (нумерация EU);
Pro в положении 329 (нумерация EU);
Ala в положении 330 (нумерация EU);
Pro в положении 331 (нумерация EU);
Ile в положении 332 (нумерация EU);
Glu в положении 333 (нумерация EU);
Lys в положении 334 (нумерация EU);
Thr в положении 335 (нумерация EU);
Ile в положении 336 (нумерация EU) и
Ser в положении 337 (нумерация EU) в домене CH2 Fc-области;
[6] полипептиду по любому из [1]-[5], где изменение функции Fc-области представляет собой по меньшей мере одно или более изменений, выбранных из группы, состоящей из повышения активности связывания и улучшения селективности связывания с рецептором Fcγ;
[7] полипептиду [6], где изменение функции Fc-области представляет собой повышение активности связывания с рецептором Fcγ;
[8] полипептиду [7], где рецептор Fcγ представляет собой по меньшей мере один или более рецепторов, выбранных из группы, состоящей из FcγRIa, FcγRIIa R, FcγRIIa H, FcγRIIb и FcγRIIIa;
[9] полипептиду [8], где рецептор Fcγ представляет собой FcγRIa;
[10] полипептиду [9], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области i таблиц 2-1 и 2-2 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[11] полипептиду [9], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области ii таблиц 2-1, 2-2 и 2-3 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[12] полипептиду [8], где рецептор Fcγ представляет собой FcγRIIa R;
[13] полипептиду [12], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области i таблиц 3-1 и 3-2 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[14] полипептиду [12], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области ii таблиц 3-1 и 3-2 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[15] полипептиду [8], где рецептор Fcγ представляет собой FcγRIIa H;
[16] полипептиду [15], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области i таблицы 4 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[17] полипептиду [15], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области ii таблицы 4 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[18] полипептиду [8], где рецептор Fcγ представляет собой FcγRIIb;
[19] полипептиду [18], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области i таблицы 5 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[20] полипептиду [18], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области ii таблицы 5 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[21] полипептиду [8], где рецептор Fcγ представляет собой FcγRIIIa;
[22] полипептиду [21], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области i таблицы 6 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[23] полипептиду [21], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области ii таблицы 6 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[24] полипептиду [6], где изменение функции Fc-области представляет собой улучшение селективности активности связывания с рецептором Fcγ;
[25] полипептиду [24], где улучшение селективности активности связывания с рецептором Fcγ относится к селективности в отношении активирующего рецептора Fcγ и ингибирующего рецептора Fcγ;
[26] полипептиду [25], где в числе рецептором Fcγ активирующий рецептор Fcγ представляет собой по меньшей мере один или более рецепторов, выбранных из группы, состоящей из FcγRIa, FcγRIIa R, FcγRIIa H и FcγRIIIa, и ингибирующий рецептор Fcγ представляет собой FcγRIIb;
[27] полипептиду [26], где активирующий рецептор Fcγ представляет собой FcγRIa, и ингибирующий рецептор Fcγ представляет собой FcγRIIb, который отличается тем, что активность связывания с FcγRIa является селективно повышенной по сравнению с активностью связывания с FcγRIIb;
[28] полипептиду [27], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области a таблиц 19-1, 19-2, 19-3 и 19-4 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[29] полипептиду [27], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области b таблиц 19-1, 19-2, 19-3, 19-4 и 19-5 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[30] полипептиду [26], где активирующий рецептор Fcγ представляет собой FcγRIa, и ингибирующий рецептор Fcγ представляет собой FcγRIIb, который отличается тем, что активность связывания с FcγRIa является селективно сниженной по сравнению с активностью связывания с FcγRIIb;
[31] полипептиду [30], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области c таблиц 23-1 и 23-2 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[32] полипептиду [30], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области d таблиц 23-1 и 23-2 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[33] полипептиду [26], где активирующий рецептор Fcγ представляет собой FcγRIIa R, и ингибирующий рецептор Fcγ представляет собой FcγRIIb, который отличается тем, что активность связывания с FcγRIIa R является селективно повышенной по сравнению с активностью связывания с FcγRIIb;
[34] полипептиду [33], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области a таблицы 20-1 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[35] полипептиду [33], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области b таблиц 20-1, 20-2 и 20-3 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[36] полипептиду [26], где активирующий рецептор Fcγ представляет собой FcγRIIa R, и ингибирующий рецептор Fcγ представляет собой FcγRIIb, который отличается тем, что активность связывания с FcγRIIa R является селективно сниженной по сравнению с активностью связывания с FcγRIIb;
[37] полипептиду [36], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области c таблицы 24-1 настоящего описания, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[38] полипептиду [36], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области d таблиц 24-1 и 24-2 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[39] полипептиду [26], где активирующий рецептор Fcγ представляет собой FcγRIIa H, и ингибирующий рецептор Fcγ представляет собой FcγRIIb, который отличается тем, что активность связывания с FcγRIIa H является селективно повышенной по сравнению с активностью связывания с FcγRIIb;
[40] полипептиду [39], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области a таблицы 21-1 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[41] полипептиду [39], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области b таблиц 21-1, 21-2 и 21-3 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[42] полипептиду [26], где активирующий рецептор Fcγ представляет собой FcγRIIa H, и ингибирующий рецептор Fcγ представляет собой FcγRIIb, который отличается тем, что активность связывания с FcγRIIa H является селективно сниженной по сравнению с активностью связывания с FcγRIIb;
[43] полипептиду [42], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области c таблиц 25-1 и 25-2 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[44] полипептиду [42], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области d таблиц 25-1, 25-2 и 25-3 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[45] полипептиду [26], где активирующий рецептор Fcγ представляет собой FcγRIIIa, и ингибирующий рецептор Fcγ представляет собой FcγRIIb, который отличается тем, что активность связывания с FcγRIIIa является селективно повышенной по сравнению с активностью связывания с FcγRIIb;
[46] полипептиду [45], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области a таблицы 22-1 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[47] полипептиду [45], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области b таблиц 22-1, 22-2 и 22-3 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[48] полипептиду [26], где активирующий рецептор Fcγ представляет собой FcγRIIIa, и ингибирующий рецептор Fcγ представляет собой FcγRIIb, который отличается тем, что активность связывания с FcγRIIIa является селективно сниженной по сравнению с активностью связывания с FcγRIIb;
[49] полипептиду [48], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области c таблиц 26-1 и 26-2 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[50] полипептиду [48], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в области d таблиц 26-1, 26-2, 26-3 и 26-4 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[51] полипептиду [1], [21] или [45], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из:
замены аминокислоты L в положении 234 (нумерация EU) на Y;
замены аминокислоты L в положении 235 (нумерация EU) на Y или Q;
замены аминокислоты G в положении 236 (нумерация EU) на W;
замены аминокислоты S в положении 239 (нумерация EU) на M;
замены аминокислоты H в положении 268 (нумерация EU) на D;
замены аминокислоты D в положении 270 (нумерация EU) на E;
замены аминокислоты S в положении 298 (нумерация EU) на A;
замены аминокислоты K в положении 326 (нумерация EU) на D;
замены аминокислоты A в положении 327 (нумерация EU) на D;
замены аминокислоты L в положении 328 (нумерация EU) на W;
замены аминокислоты A в положении 330 (нумерация EU) на M или K, и
замены аминокислоты K в положении 334 (нумерация EU) на E или L, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[52] полипептиду [1], [21] или [45], где мутацию вводят по меньшей мере в одну аминокислоту, выбранную из Leu в положении 234, Leu в положении 235, Gly в положении 236, Ser в положении 239, His в положении 268, Asp в положении 270, Ser в положении 298, Lys в положении 326, Ala в положении 327, Leu в положении 328, Ala в положении 330 и Lys в положении 334 (нумерация EU), в аминокислотной последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[53] полипептиду [1], [21] или [45], где мутацию вводят по меньшей мере в одну аминокислоту, выбранную из Leu в положении 234, Leu в положении 235, Gly в положении 236, Ser в положении 239, His в положении 268, Asp в положении 270, Ser в положении 298, Ala в положении 327, Leu в положении 328 и Lys в положении 334 (нумерация EU), в аминокислотной последовательности любого полипептида из первого полипептида и второго полипептида, составляющих Fc-область; и мутацию вводят по меньшей мере в одну аминокислоту, выбранную из Asp в положении 270, Lys в положении 326, Ala в положении 330 и Lys в положении 334 (нумерация EU), в аминокислотной последовательности другого полипептида;
[54] полипептиду [1], [21] или [45], где по меньшей мере одну мутацию аминокислоты, выбранную из группы, состоящей из:
замены аминокислоты L в положении 234 (нумерация EU) на Y;
замены аминокислоты L в положении 235 (нумерация EU) на Y или Q;
замены аминокислоты G в положении 236 (нумерация EU) на W;
замены аминокислоты S в положении 239 (нумерация EU) на M;
замены аминокислоты H в положении 268 (нумерация EU) на D;
замены аминокислоты D в положении 270 (нумерация EU) на E;
замены аминокислоты S в положении 298 (нумерация EU) на A;
замены аминокислоты A в положении 327 (нумерация EU) на D;
замены аминокислоты L в положении 328 (нумерация EU) на W и
замены аминокислоты K в положении 334 (нумерация EU) на L,
вводят в аминокислотную последовательность любого полипептида из первого полипептида и второго полипептида, составляющих Fc-область, и по меньшей мере одну мутацию аминокислот, выбранную из группы, состоящей из:
замены аминокислоты D в положении 270 (нумерация EU) на E;
замены аминокислоты K в положении 326 (нумерация EU) на D;
замены аминокислоты A в положении 330 (нумерация EU) на M или K и
замены аминокислоты K в положении 334 (нумерация EU) на E,
вводят в аминокислотную последовательность другого полипептида;
[55] полипептиду [1], [21] или [45], где любую одну группу мутаций от (i) до (vi) вводят в аминокислотную последовательность любого полипептида из первого полипептида и второго полипептида, составляющих Fc-область, и любую одну группу мутаций от (vii) до (ix) вводят в аминокислотную последовательность другого полипептида:
(i) замены аминокислоты L в положении 234 (нумерация EU) на Y;
замены аминокислоты L в положении 235 (нумерация EU) на Y;
замены аминокислоты G в положении 236 (нумерация EU) на W;
замены аминокислоты H в положении 268 (нумерация EU) на D и
замены аминокислоты S в положении 298 (нумерация EU) на A;
(ii) замены аминокислоты L в положении 234 (нумерация EU) на Y;
замены аминокислоты L в положении 235 (нумерация EU) на Y;
замены аминокислоты G в положении 236 (нумерация EU) на W;
замены аминокислоты H в положении 268 (нумерация EU) на D;
замены аминокислоты D в положении 270 (нумерация EU) на E и
замены аминокислоты S в положении 298 (нумерация EU) на A;
(iii) замены аминокислоты L в положении 234 (нумерация EU) на Y;
замены аминокислоты L в положении 235 (нумерация EU) на Q;
замены аминокислоты G в положении 236 (нумерация EU) на W;
замены аминокислоты S в положении 239 (нумерация EU) на M;
замены аминокислоты H в положении 268 (нумерация EU) на D;
замены аминокислоты D в положении 270 (нумерация EU) на E и
замены аминокислоты S в положении 298 (нумерация EU) на A;
(iv) замены аминокислоты L в положении 234 (нумерация EU) на Y;
замены аминокислоты L в положении 235 (нумерация EU) на Y;
замены аминокислоты G в положении 236 (нумерация EU) на W;
замены аминокислоты H в положении 268 (нумерация EU) на D;
замены аминокислоты S в положении 298 (нумерация EU) на A и
замены аминокислоты A в положении 327 (нумерация EU) на D;
(v) замены аминокислоты L в положении 234 (нумерация EU) на Y;
замены аминокислоты L в положении 235 (нумерация EU) на Y;
замены аминокислоты G в положении 236 (нумерация EU) на W;
замены аминокислоты S в положении 239 (нумерация EU) на M;
замены аминокислоты H в положении 268 (нумерация EU) на D;
замены аминокислоты S в положении 298 (нумерация EU) на A и
замены аминокислоты A в положении 327 (нумерация EU) на D;
(vi) замены аминокислоты L в положении 234 (нумерация EU) на Y;
замены аминокислоты L в положении 235 (нумерация EU) на Y;
замены аминокислоты G в положении 236 (нумерация EU) на W;
замены аминокислоты S в положении 239 (нумерация EU) на M;
замены аминокислоты H в положении 268 (нумерация EU) на D;
замены аминокислоты S в положении 298 (нумерация EU) на A;
замены аминокислоты A в положении 327 (нумерация EU) на D;
замены аминокислоты L в положении 328 (нумерация EU) на W и
замены аминокислоты K в положении 334 (нумерация EU) на L;
(vii) замены аминокислоты K в положении 326 (нумерация EU) на D;
замены аминокислоты A в положении 330 (нумерация EU) на M и
замены аминокислоты K в положении 334 (нумерация EU) на E;
(viii) замены аминокислоты D в положении 270 (нумерация EU) на E;
замены аминокислоты K в положении 326 (нумерация EU) на D;
замены аминокислоты A в положении 330 (нумерация EU) на M и
замены аминокислоты K в положении 334 (нумерация EU) на E;
(ix) замены аминокислоты D в положении 270 (нумерация EU) на E;
замены аминокислоты K в положении 326 (нумерация EU) на D;
замены аминокислоты A в положении 330 (нумерация EU) на K и
замены аминокислоты K в положении 334 (нумерация EU) на E;
[56] полипептиду, содержащему Fc-область, где полипептид отличается тем, что Fc-область состоит из гетеродимера, содержащего первый полипептид и второй полипептид, и где полипептид отличается тем, что функция Fc-области является измененной по сравнению с функцией Fc-области полипептида, отличающегося тем, что Fc-область состоит из гомодимера, содержащего только первый полипептид, или по сравнению с функцией Fc-области полипептида, отличающегося тем, что Fc-область состоит из гомодимера, содержащего только второй полипептид;
[57] полипептиду [56], где изменение функции Fc-области представляет собой по меньшей мере одно или более изменений, выбранных из группы, состоящей из повышения активности связывания, снижения связывания и улучшения селективности связывания полипептида с рецептором Fcγ;
[58] полипептиду [57], где изменение функции Fc-области дополнительно представляет собой изменение, которое улучшает физико-химическую стабильность;
[59] полипептиду [58], где изменение, которое улучшает физико-химическую стабильность, означает, что Tm полипептида, отличающегося тем, что Fc-область состоит из гетеродимера, содержащего первый полипептид и второй полипептид, является выше, чем Tm полипептида, отличающегося тем, что Fc-область состоит из гомодимера, содержащего только первый полипептид, или Tm полипептида, отличающегося тем, что Fc-область состоит из гомодимера, содержащего только второй полипептид;
[60] полипептиду любого из [57]-[59], где изменение функции Fc-области представляет собой повышение активности связывания с рецептором Fcγ, и рецептор Fcγ представляет собой по меньшей мере один или более рецепторов, выбранных из группы, состоящей из FcγRIa, FcγRIIa R, FcγRIIa H, FcγRIIb и FcγRIIIa;
[61] полипептиду [60], где рецептор Fcγ представляет собой FcγRIa;
[62] полипептиду [61], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в таблицах 31-1, 31-2 и 31-3 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[63] полипептиду [60], где рецептор Fcγ представляет собой FcγRIIa R;
[64] полипептиду [63], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в таблицах 32-1 и 32-2 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[65] полипептиду [60], где рецептор Fcγ представляет собой FcγRIIa H;
[66] полипептиду [65], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в таблицах 33-1 и 33-2 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[67] полипептиду [60], где рецептор Fcγ представляет собой FcγRIIb;
[68] полипептиду [67], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в таблицах 34-1 и 34-2 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[69] полипептиду [60], где рецептор Fcγ представляет собой FcγRIIIa;
[70] полипептиду [69], где по меньшей мере одну или более мутаций аминокислот, выбранных из группы, состоящей из мутаций аминокислот, описанных в таблицах 35-1 и 35-2 в графической части, вводят в аминокислотные последовательности первого полипептида и/или второго полипептида, составляющих Fc-область;
[71] полипептиду любого из [1]-[70], где дополнительно вводят изменение аминокислоты для обеспечения различий изоэлектрических точек первого полипептида и второго полипептида;
[72] полипептиду [71], где изменение аминокислоты для обеспечения различия изоэлектрических точек, отличается тем, что введение по меньшей мере одной мутации аминокислоты на участке аминокислот, выбранных из группы, состоящей из Gly в положении 137, Gly в положении 138, Thr в положении 139, Lys в положении 147, Ser в положении 192, Leu в положении 193, Gln в положении 196, Tyr в положении 198, Ile в положении 199, Asn в положении 203, Lys в положении 214, Val в положении 263, Glu в положении 272, Lys в положении 274, Tyr в положении 278, Lys в положении 288, Lys в положении 290, Gly в положении 316, Lys в положении 317, Lys в положении 320, Lys в положении 324, Thr в положении 335, Ser в положении 337, Lys в положении 340, Leu в положении 358, Lys в положении 360, Gln в положении 362, Ser в положении 364, Ser в положении 383, Asn в положении 384, Gly в положении 385, Gln в положении 386, Pro в положении 387, Asn в положении 390, Val в положении 397 и Val в положении 422 (нумерация EU), в аминокислотной последовательности первого полипептида и/или второго полипептида;
[73] полипептиду [71], где изменение аминокислоты для обеспечения различия изоэлектрических точек отличается введением мутации по меньшей мере в одной аминокислоте, выбранной из группы, состоящей из Gln в положении 196, Ile в положении 199, Val в положении 263, Glu в положении 272, Gly в положении 316, Leu в положении 358, Ser в положении 364, Ser в положении 383, Pro в положении 387 и Val в положении 397 (нумерация EU), в аминокислотной последовательности любого полипептида из первого полипептида и второго полипептида, и введением мутации по меньшей мере в одной аминокислоте, выбранной из группы, состоящей из Gly в положении 137, Gly в положении 138, Thr в положении 139, Lys в положении 147, Ser в положении 192, Leu в положении 193, Tyr в положении 198, Ile в положении 199, Asn в положении 203, Lys в положении 214, Lys в положении 274, Tyr в положении 278, Lys в положении 288, Lys в положении 290, Gly в положении 316, Lys в положении 317, Lys в положении 320, Lys в положении 324, Thr в положении 335, Ser в положении 337, Lys в положении 340, Leu в положении 358, Lys в положении 360, Gln в положении 362, Ser в положении 383, Asn в положении 384, Gly в положении 385, Gln в положении 386, Asn в положении 390 и Val в положении 422 (нумерация EU), в аминокислотной последовательности другого полипептида;
[74] полипептиду любого из [1]-[73], где полипептид представляет собой антигенсвязывающую молекулу;
[75] полипептиду [74], где антигенсвязывающая молекула представляет собой антитело, биспецифическое антитело или слитую с Fc молекулу, такую как слитый с пептидом Fc белок или слитый с каркасной областью Fc белок;
[76] фармацевтической композиции, содержащей полипептид [74] или [75] и приемлемому носителю с медицинской точки зрения;
[77] способу изменения функции полипептида, содержащего Fc-область, который включает стадии гетеродимеризации Fc-области введением мутации аминокислот в первом полипептиде и/или втором полипептиде, из которого состоит Fc-область, и введением мутации аминокислот для изменения функции Fc-области по сравнению со случаем, когда Fc-область образует гомодимер, и
[78] способу получения полипептида, содержащего Fc-область, который включает стадии гетеродимеризации Fc-области введением мутации аминокислоты в первом полипептиде и/или втором полипептиде, из которого состоит Fc-область, и введением мутации аминокислоты для изменения функции Fc-области по сравнению со случаем, когда Fc-область образует гомодимер.
Эффекты изобретения
Настоящее изобретение относится к полипептидам, которые являются подходящими в качестве фармацевтических средств, где их активности связывания и физические свойства (например, стабильность и однородность) улучшили изменением аминокислотной последовательности константной области антитела.
Краткое описание чертежей
На фиг. 1 представлена структура комплекса Fc-области и FcRn. FcRn связывается с CH2 и CH3 каждой H-цепи антитела и связан со всем антителом симметричным образом.
На фиг. 2 представлена структура комплекса IgA и FcαR, который представляет собой рецептор IgA. FcαR связывается с Cα2 и Cα3 каждой H-цепи IgA и связан со всем антителом симметричным образом.
На фиг. 3 представлена структура комплекса Fc-области и FcγRIII. H-цепь, CH2 и CH3, которые находятся с левой стороны фигуры, обозначают как HA-цепь, CHA2 и CHA3 и те, которые находятся с правой стороны, обозначают как HB-цепь, CHB2 и CHB3, соответс