Антисептическое лекарственное средство
Иллюстрации
Показать всеИзобретение относится к химии органических гетероциклических соединений, а именно к новой четвертичной аммониевой соли, содержащей фрагмент производного витамина В6 формулы I, проявляющей антибактериальные, антимикотические, противовирусные и антипротозойные свойства. Соединение может найти применение в медицине и ветеринарии. 1 з.п. ф-лы, 2 ил., 16 табл.
Реферат
Изобретение относится к химии органических гетероциклических соединений, а именно к новой четвертичной аммониевой соли, содержащей фрагмент производного витамина В6 формулы I, проявляющей антибактериальные, противогрибковые, противовирусные и антипротозойные свойства. Соединение может найти применение в медицине и ветеринарии.
Профилактика и лечение инфекционных заболеваний в настоящее время является одной из важнейших задач здравоохранения. При этом их эффективная терапия возможна лишь при комплексном использовании антибиотиков и антисептических лекарственных средств [Морозова Н.С. Современный взгляд на роль антисептиков в профилактике и лечении гнойно-септических осложнений у пациентов хирургического профиля. журнал медицини iменi , 2012 - Т. 13, №2. - С. 6-9].
Необходимым требованием к антисептикам является широта спектра их действия: они должны обладать антибактериальной, противогрибковой, противовирусной и противопаразитарной активностью [Фармакология: учебник / Под ред. проф. Р.Н. Аляутдина. - 4-е изд., перераб. и доп. - М.: ГЭОТАР-Медиа, 2010. - 832 с.]. Вследствие их широкого спектра действия антисептики применяются по многим медицинским показаниям.
Четвертичные аммониевые соединения (ЧАС) являются одним из важнейших классов антисептических средств и имеют широкую область применения, в частности, в терапии местных гнойно-воспалительных процессов, обработке неповрежденной кожи перед операциями, консервировании глазных капель, инъекционных растворов, зубных паст, косметических средств, дезинфекции и очистке поверхностей. Современные ЧАС характеризуются широким спектром противомикробной активности по отношению к грамположительным и грамотрицательным микроорганизмам, грибам, вирусам и простейшим. Механизм антибактериального действия ЧАС заключается в их адсорбции и проникновении через клеточную стенку бактерий с последующим взаимодействием с фосфолипидами цитоплазматической мембраны, что приводит к полной структурной дезорганизации и последующей гибели бактериальной клетки [McDonnell G, Russell AD. Antiseptics and Disinfectants: Activity, Action, and Resistance. Clinical Microbiology Reviews. - 1999 - V. 12 (1). - P. 147-179].
Недостатками используемых ЧАС являются неэффективность в отношении спор [Шандала М.Г. Перспективы и проблемы современной дезинфектологии. Журн. Дезинфекционное дело. - 2002, №4. - С 13-19] и простых вирусов [Райнбабен, Фридрих фон. Основы противовирусной дезинфекции: перевод с немецкого языка Москва.: Самарово: Летний сад. - 2014. - С. 525], а также недостаточная активность по отношению к грамотрицательным бактериям, микобактериям и грибам. Также следует отметить недостаточную изученность применяемых антисептиков [Federal Register / Vol. 81, No. 126 / Thursday, June 30, 2016 / Proposed Rules] и их высокую токсичность [Rasmussen, С.А., Kaufman P.L., Kiland J.A. Benzalkonium Chloride and Glaucoma. Journal of Ocular Pharmacology and Therapeutics. - 2014 - V. 30. - P. 163-169].
Среди лекарственных препаратов, содержащих фрагменты четвертичных аммониевых солей, следует выделить:
Мирамистин ((бензилдиметил[3-(миристоиламино)пропил]-аммонийхлорид моногидрат) - разработанный в СССР антисептик, обладающий широким спектром бактерицидного действия в отношении грамположительных (Staphylococcus spp., Streptococcus spp., Streptococcus pneumoniae и др.), грамотрицательных (Pseudomonas aeruginosa, Escherichia coli, Klebsiella spp.и др.), аэробных и анаэробных бактерий, патогенных грибов и вирусов, включая клинические штаммы с полирезистентностью к антибиотикам [Регистр лекарственных средств России РЛС. Энциклопедия лекарств. - 20-й вып. Гл. ред. Г.Л. Вышковский. - М.: ЛИБРОФАРМ, 2011. - С. 1368]. Применяется в профилактике нагноений и лечении гнойных ран, лечении и профилактике кандидозов кожи и слизистых оболочек, комплексном лечении острых и хронических отитов, лечении и профилактике инфекционно-воспалительных заболеваний полости рта (стоматитов, гингивитов, пародонтитов, периодонтитов), индивидуальной профилактике заболеваний, передаваемых половым путем (сифилиса, гонореи, хламидиоза, генитального герпеса и др.) [Блатун Л.А. Мирамистин в комплексной программе борьбы с госпитальной инфекцией в хирургическом стационаре // В сб.: Мирамистин: применение в хирургии, травматологии и комбустиологии. М. - 2006. - С. 27-33; Макеева И.М. Е.В. Боровский, М.В. Матавкина, Е.А. Бровенко. Применение препарата Мирамистин в комплексном лечении заболеваний слизистой оболочки рта. Фарматека. - 2013. - №3 - С. 1].
Флуомизин (хлорид деквалиния) - антисептик широкого спектра действия, активен в отношении большинства грамположительных бактерий Streptococcus spp., Staphylococcus aureus, Listeria spp., анаэробов Peptostreptococcus (группы D), грибов рода Candida (Candida tropicalis, Candida aMXicans, Candida glabrata), грамотрицательных бактерий Gardnerella vaginalis, Escherichia coli, Serratia spp., Klebsiella spp., Pseudomonas spp., Proteus spp., и простейших (Trichomonas vaginalis). Используется при бактериальном вагинозе, кандидозе кожи, ногтевых валиков, слизистой оболочки полости рта, воспалительных процессах в полости рта и глотки (тонзиллит, стоматит, в т.ч. афтозный, глоссит, фарингит) [Справочник Видаль «Лекарственные препараты в России». https://www.vidal.ru/drugs/fluomisin_22520].
Бензалкония хлорид (алкилдиметил(фенилметил)аммония хлорид) - антисептическое средство активное в отношении грамположительных (Staphylococcus spp., Streptococcus spp., Streptococcus pneumoniae и др.), грамотрицательных (Pseudomonas aeruginosa, Escherichia coli, Klebsiella spp.и др.) и анаэробных бактерий, грибов и плесеней. Применяется при первичной и первично-отсроченной обработке ран, профилактике вторичного инфицирования ран госпитальными штаммами микроорганизмов, бактериальном вагинозе, дренировании костных полостей после операции при остеомиелите [Справочник Видаль «Лекарственные препараты в России». https://www.vidal.ru/drugs/dettol_benzalkonium_chloride_30527].
Следует отметить, что описанные выше лекарственные препараты, по мнению заявителя, не могут рассматриваться в качестве аналогов к заявленному изобретению вследствие того, что они не совпадают с заявляемым соединением по химической структуре, хотя и обладают антибактериальной, антимикотической, противовирусной и антипротозойной активностью (совпадают по назначению), сопоставимой с заявленным изобретением в большей или меньшей степени.
Заявленное техническое решение поясняется Фиг. 1, 2 и шестнадцатью (16) таблицами, приведенными в тексте описания (для улучшения понимания текста заявки экспертизой).
На Фиг. 1 представлен сравнительный анализ антибактериальной активности соединения I, бензалкония хлорида и мирамистина в отношении клеток грамположительных бактерий, погруженных в матрикс биопленки.
На Фиг. 2 представлен сравнительный анализ антибактериальной активности соединения I, бензалкония хлорида и мирамистина в отношении клеток грамотрицательных бактерий, погруженных в матрикс биопленки.
Задачей изобретения является новое соединение, обладающее высокой антибактериальной, антимикотической, противовирусной и антипротозойной активностью, сопоставимой с существующими антисептиками, но при этом существенно меньшей токсичностью.
Техническим результатом заявленного изобретения является получение нового соединения формулы I, содержащего в своем составе как фрагмент природного соединения (витамина В6), так и четвертичный аммониевый фрагмент.
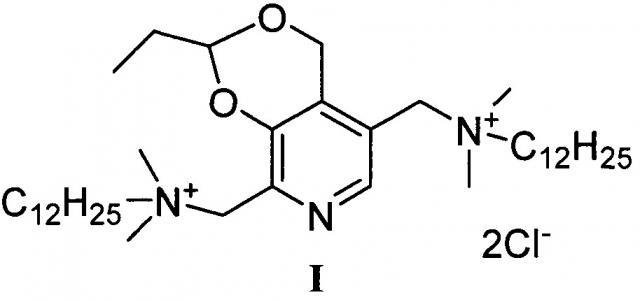
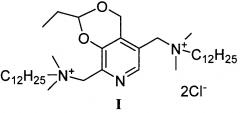
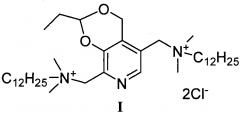
Задача решается, и указанный технический результат достигается получением заявляемого нового производного витамина В6 формулы I:
согласно нижеприведенной схеме 1, где заявляемое соединение обозначено номером I.
Характеристики нового соединения приведены далее в примерах конкретного выполнения. Структура полученного соединения подтверждена методами масс-спектрометрии, 1Н и 13C ЯМР спектроскопии. Спектры ЯМР регистрировали на приборе AVANCE-400 (Bruker, Германия). Химический сдвиг определялся относительно сигналов остаточных протонов дейтерированных растворителей (1Н и 13С). Температуры плавления определялись с помощью прибора Stanford Research Systems МРА-100 OptiMelt. Контроль за ходом реакций и чистотой соединений проводили методом ТСХ на пластинах Sorbfil Plates. HRMS-эксперимент был проведен с использованием масс-спектрометра TripleTOF 5600, АВ Sciex (Германия) из раствора в метаноле методом ионизации - турбоионный спрей (TIS) - при энергии столкновения с молекулами азота 10 еВ.
Пример 1. Получение 5,8-(Бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4Н-[1,3]диоксино[4,5-с]пиридиний дихлорида (I)
Стадия 1: Получение 5-(гидроксиметил)-2-этил-8-метил-4Н-[1,3]диоксино[4,5-с]пиридина (1)
В 500 мл толуола кипятили 28.1 г (146.0 ммоль) моногидрата n-толуолсульфокислоты с насадкой Дина-Старка в течение 2 часов. Далее раствор охлаждали до комнатной температуры и добавляли 30.0 г (146.0 ммоль) гидрохлорида, пиридоксина и 15.0 мл (209.5 ммоль) пропионового альдегида. Реакционную смесь кипятили 8 часов с насадкой Дина-Старка. Далее растворитель отгоняли в вакууме. К осадку добавляли раствор 18.0 г (450.0 ммоль) гидроксида натрия в 100 мл воды при перемешивании. Далее, водную часть промывали 500 мл хлороформа, органическую часть отделяли, высушивали в вакууме и перекристаллизовывали из 100 мл толуола. Выход 17.0 г (56%), бесцветное кристаллическое вещество, т.пл. 111-112°C.
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м.д.: 1.00 т (3H, 3JH-H=7.5 Гц, СН3СН2), 1.77-1.83 кв д (2Н, 3JH-H=7.5 Гц, 3JH-H=5.0 Гц, СН3СН2), 2.30 с (3Н, СН3), 4.38 д (2Н, 3JH-H=4.3 Гц, СН2ОН), 4.95 с (2Н, CH2O), 5.06 т (1Н, 3JH-H=5.0 Гц, CHC2H5), 5.18 т (1H, 3JH-H=4.3 Гц, СН2ОН), 7.93 с (1Н, СНпир).
Спектр ЯМР 13С (100 МГц, ДМСО-d6) δ, м.д.: 7.78 с (СН3СН2), 18.16 с (СН3), 27.06 с (СН3СН2), 58.21 с (CH2O), 63.43 с (CH2O), 100.02 с (СНС2Н5), 126.88 с (Спир), 130.94 с (Спир), 138.95 с (СНпир), 145.09 с (Спир), 146.91 с (Спир).
Масс-спектр (HRMS-ESI): Найдено [М+Н]+ 210.1125, C11H16NO3. Вычислено [М+Н]+ 210.1130.
Стадия 2: Получение 5-(ацетоксиметил)-2-этил-8-метил-4Н-[1,3]диоксино[4,5-с]пиридина (2)
К раствору 10.0 г (47.8 ммоль) соединения 1, 7.64 мл (55.1 ммоль) триэтиламина в 150 мл дихлорметана при перемешивании по каплям добавляли раствор 3.74 мл (52.6 ммоль) хлористого ацетила в 30 мл дихлорметана в течение 20 минут. Полученный раствор перемешивали при комнатной температуре 3 часа. Реакционную смесь промывали последовательно 200 мл 5% раствора гидрокарбоната натрия и 100 мл воды. Органическую часть отделяли и высушивали в вакууме. Выход 12.0 г (количественный), бесцветное маслоообразное вещество.
Спектр ЯМР 1Н (400 МГц, CDCl3) δ, м.д.: 1.08 т (3Н, 3JH-H=7.5 Гц, СН3СН2), 1.89-1.93 м (2Н, СН3СН2), 2.07 с (3Н, СН3), 2.44 с (3Н, СН3), 4.91, 4.95 АВ-система (2Н, 3JH-H=16.0 Гц, СН2), 4.97 с (2Н, СН2), 4.97 т (1Н, 3JH-H=5.0 Гц, СНС2Н5), 8.04 с (1H, СНпир).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 7.94 с (СН3СН2), 18.42 с (СН3), 20.91 с (СН3), 27.64 с (CH3CH2), 61.16 с (CH2O), 64.07 с (CH2O), 100.95 с (СНС2Н5), 124.85 с (Спир), 127.75 с (Спир), 140.78 с (СНпир), 147.95 с (Спир), 148.34 с (Спир), 170.58 с (С(О)).
Стадия 3: Получение 5-(ацетоксиметил)-2-этил-8-метил-4Н-[1,3]диоксино[4,5-с]пиридина N-оксида (3)
К раствору 12.0 г (47.8 ммоль) соединения 2 в 300 мл дихлорметана добавляли 19.2 г (66.8 ммоль) 60% м-хлорпербензойной кислоты и перемешивали без доступа света при комнатной температуре 24 часа. Затем реакционную смесь последовательно промывали 10% раствором сульфита натрия (2*150 мл), 5% раствором гидрокарбоната натрия (2*150 мл) и водой (75 мл). Отделяли органический слой и растворитель удаляли в вакууме. Выход продукта 11.91 г (93%), бесцветные кристаллы.
Спектр ЯМР 1Н (400 МГц, CDCl3) δ, м.д.: 1.07 т (3Н, 3JH-H=7.5 Гц, СН3СН2), 1.89-1.93 м (2Н, CH3CH2), 2.10 с (3Н, СН3), 2.41 с (3Н, СН3), 4.88 с (2Н, СН2), 4.89 с (2Н, СН2), 4.99 т (1Н, 3JH-H=5.0 Гц, СНС2Н5), 7.98 с (1Н, СНпир).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 7.75 с (СН3СН2), 10.21 с (СН3), 20.71 с (СН3), 27.41 с (CH3CH2), 59.88 с (CH2O), 63.76 с (CH2O), 101.50 с (СНС2Н5), 117.89 с (Спир), 126.71 с (Спир), 132.06 с (СНпир), 139.29 с (Спир), 149.52 с (Спир), 170.16 с (С(О)).
Стадия 4: Получение 5,8-бис(ацетоксиметил)-2-этил-4Н-[1,3]диоксино[4,5-с]пиридина (4)
Раствор 11.9 г (44.6 ммоль) соединения 3 в 40 мл (424 ммоль) уксусного ангидрида и 60 мл дихлорметана нагревали в течение 6 часов при 50°C. Затем растворитель удаляли в вакууме, а оставшееся масло растворяли в дихлорметане. Полученный раствор последовательно промывали 5% раствором гидрокарбоната натрия (150 мл) и водой (100 мл). Отделяли органический слой и растворитель удаляли в вакууме. Продукт без дальнейшей очистки использовали в следующей стадии. Выход продукта 13.5 г (97%), черное маслообразное вещество.
Стадия 5: Получение 5,8-бис(гидроксиметил)-2-этил-4Н-[1,3]диоксино[4,5-с]пиридина (5)
13.5 г (43.7 ммоль) соединения 4 растворяли в 140 мл этанола. К полученной смеси добавляли раствор 3.48 г (87.0 ммоль) гидроксида натрия в 30 мл воды. Раствор перемешивали 1 час при 50°C, подкисляли соляной кислотой до рН=6.5 и отгоняли растворитель в вакууме. Сухой остаток заливали 150 мл воды и кипятили 15 минут. Нерастворившийся смолообразный осадок отфильтровывали при 80°C, а растворитель концентрировали до 80 мл и оставляли в холодильнике на 12 часов. Выпавший осадок отфильтровывали. Выход продукта 3.7 г (38%), коричневое кристаллическое вещество.
Спектр ЯМР 1Н (400 МГц, ДМСО-d6) δ, м.д.: 1.00 т (3H, 3JH-H=7.5 Гц, СН3СН2), 1.78-1.82 м (2Н, CH3CH2), 4.42 д (2H, 3JH-H=4.2 Гц, CH2OH), 4.48 д (2H, 3JH-H=5.6 Гц, CH2OH), 4.86 т (1H, 3JH-H=5.6 Гц, СН2ОН), 4.97 с (2Н, СН2), 5.07 т (1Н, 3JH-H=5.0 Гц, СН2ОН), 5.23 т (1Н, 3JH-H=4.8 Гц, СНС2Н5), 8.04 с (1H, СНпир).
Спектр ЯМР 13С (100 МГц, ДМСО-d6) δ, м.д.: 7.68 с (CH3CH2), 26.94 с (CH3CH2), 58.14 с (СН2), 59.02 с (СН2), 63.44 с (СН2), 100.02 с (СНС2Н5), 127.37 с (Cпир), 132.24 с (СНпир), 138.68 с (Спир), 146.52 с (Спир), 146.94 с (Спир).
Стадия 6: Получение 5,8-бис(хлорметил)-2-этил-4Н-[1,3]диоксино[4,5-с]пиридиний хлорида (6)
В суспензию 3.7 г (16.4 ммоль) вещества 5 в 40 мл толуола добавляли по каплям 5.0 мл (68.9 ммоль) хлористого тионила. Реакционную смесь перемешивали при 70°C 2 ч. Добавляли к смеси 50 мл диэтилового эфира и отфильтровывали осадок. Выход продукта 4.66 г (95%), желтое кристаллическое вещество.
Стадия 7: Получение 5,8-(Бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4Н-[1,3]диоксино[4,5-с]пиридиний дихлорида (I)
К раствору 1.1 г (13.1 ммоль) гидрокарбоната натрия в 40 мл воды при перемешивании добавляли 3.8 г (12.7 ммоль) соединения 6. Полученный осадок отфильтровывали и высушивали в вакууме. Полученные 2.9 г (11.1 ммоль) продукта (88% выход) растворяли в 50 мл этанола и добавляли 5.98 мл (22.2 ммоль) N,N-диметилдодециламина. Реакционную смесь перемешивали 8 ч при 70°C. Растворитель отгоняли в вакууме. Полученный остаток кипятили в 120 мл ацетона. После охлаждения до комнатной температуры осадок отфильтровывали и высушивали в вакууме. Выход 5.64 г (74%), белое кристаллическое вещество.
Спектр ЯМР 1Н (400 МГц, CDCl3) δ, м.д.: 0.84 т (6Н, 3JHH=6.7 Гц, 2СН3С11Н22), 1.00 т (3Н, 3JH-H=7.5 Гц, CH3CH2), 1.22-1.33 м (32Н, 16СН2), 1.70-1.84 м (6Н, 3СН2), 2.96 м (2Н, СН2), 3.29-3.32 м (12Н, 4CH3N+), 3.50-3.83 м (4Н, 2CH2N+), 4.69, 4.74 (АВ-система, 2Н, 2JHH=-13.6 Гц, CH2), 5.10, 5.55 (АВ-система, 2Н, 2JHH=-16.7 Гц, СН2), 5.11, 5.21 (АВ-система, 2Н, 2JHH=-13.6 Гц, СН2), 8.60 с (1H, СНпир).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 8.01 с (СН3), 14.21 с (СН3), 22.77 с (СН3), 23.18 с (СН2), 26.46 с (СН2), 27.57 с (СН2), 29.43 с (СН3), 29.46 с (СН2), 29.53 с (СН2), 29.62 с (СН2), 29.70 (с, СН2), 31.99 с (СН2), 49.60 с (CH3N+), 49.76 с (CH3N+), 51.11 с (CH3N+), 51.34 с (CH3N+), 61.94 с (СН2), с 62.26 (СН2), 65.60 с (СН2), 65.66 с (CH2N+), 66.34 с (CH2N+), 102.04 с (С(СН3)2), 122.92 с (Спир), 134.60 с (Спир), 136.87 с (Спир), 146.54 с (Спир), 150.88 с (Спир).
Пример 2. Исследование антибактериальной активности четвертичной аммониевой соли I in vitro
Сравнительную оценку спектра антибактериального действия проводили на музейных и клинических штаммах грамположительных и грамотрицательных микроорганизмов в соответствии с [Определение чувствительности микроорганизмов к антибактериальным препаратам (Методические указания МУК 4.2.1890-04). Утверждены и введены в действие Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 04.03.2004 г.].
Значение минимальной подавляющей концентрации (МПК) определяли методом серийных разведений на среде Мюллера-Хинтона с использованием 96-луночных стерильных планшетов. Готовили двукратные разведения исследуемых веществ в питательной среде. Конечные концентрации составляли 1-128 мкг/мл. Оценку роста культур проводили визуально, сравнивая рост микроорганизмов в присутствии изучаемых тест-соединений с ростом культуры без них. Наличие роста микроорганизма в бульоне (помутнение бульона) свидетельствует о том, что данная концентрация исследуемого препарата недостаточна, чтобы подавить его жизнеспособность. Первую наименьшую концентрацию исследуемого вещества (из серии последовательных разведений), где визуально не определяется бактериальный рост, считают минимальной подавляющей концентрацией. МПК определяли методом серийных разведений в бульоне с шагом 2, поэтому различия соседних разведений не считаются существенными. В каждом опыте присутствуют положительный (бульон с растущей культурой) и отрицательный (бульон без растущей культуры) контроли.
Для определения МПК брали 10 мкл культуральной среды из тех лунок, в которых не наблюдался рост, и проводили посев на плотную среду Мюллера-Хинтона. Для приготовления инокулюма использовали чистую, суточную культуру грамположительных и грамотрицательных микроорганизмов, выросших на плотной питательной среде. Питательная среда - бульон Мюллера-Хинтона, который готовили из сухих сред (Mueller Hinton broth, Acumedia, Baltimore), культивирование осуществляли на агаризованной среде Мюллера-Хинтона, включающей дополнительно 2% агара. Среды стерилизовали автоклавированием при 121°C в течение 15 минут. В стерильном изотоническом растворе хлорида натрия готовили взвесь микроорганизмов, доводя плотность инокулюма до 0.5 по стандарту МакФарланда (1.5*108 КОЕ/мл). Затем полученный инокулят разводили до концентрации 107 КОЕ/мл средой Мюллера-Хинтона. Инокулюм использовали в течение 15 минут после приготовления; чистоту бактериальных штаммов контролировали перед каждым экспериментом.
В лунки каждого планшета вносили по 100 мкл бульона Мюллера-Хинтона; в первую лунку вносили испытуемое вещество в концентрации 128 мкг/мл в объеме 100 мкл и последовательным двукратным разведением доводили его концентрацию до 0.5 мкг/мл. Затем в каждую лунку вносили приготовленный инокулюм (100 мкл), разводя тем самым вдвое концентрацию изучаемых соединений. В качестве контроля включали лунки, не содержащие тестируемых веществ (контроль роста культуры). Кроме того, ставили контроль чистоты питательных сред и растворителей. Планшеты инкубировали в термостате при 37°C в течение 24 часов. Оценку роста культур проводили визуально, сравнивая рост микроорганизмов в присутствии изучаемых тест-соединений с ростом культуры без них.
За МПК принимали минимальную концентрацию исследуемых соединений, обеспечивающую полное подавление видимого роста исследуемых штаммов микроорганизмов. В качестве МПК соединения принимали его максимальное значение, полученное в трех независимых экспериментах.
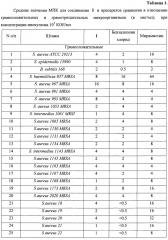
В результате скрининга антибактериальной активности соединения I выявлено, что МПК в отношении клинических стафилококков 1-8 мкг/мл, и только в одном случае 16 мкг/мл (штамм S. aureus 967 MRSA), для клинических энтерококков МПК в пределах 0.03-4 мкг/мл. Эти значения сопоставимы с показателями, выявленными для бензалкония хлорида, и в среднем в (2-4) раза лучше, чем показатели мирамистина (таблица 1).
В отношении грамотрицательных бактерий препарат был менее активен, МПК у 11 штаммов был 2-4 мкг/мл, 8-16 мкг/мл - у 18 штаммов, 32-64 мкг/мл - у 12 штаммов. Тестируемый новый препарат по своей активности был сопоставим с бензалкония хлоридом, а в случае некоторых штаммов и превосходил его (особенно в случае штаммов Ps. aeruginosa). Соединение I было намного более активным по сравнению с мирамистином, у которого МПК находится в интервале 32-64 мкг/мл, за исключением музейного штамма E. coli АТСС 25922.
Необходимо отметить, что к соединению I были чувствительны все бактериальные штаммы (МПК100<64 мкг/мл), в то время как у мирамистина МПК89<64 мкг/мл, а у бензалкония хлорида МПК92<64 мкг/мл.
Пример 3. Определение антибактериальной активности соединения I в отношении клеток, погруженных в матрикс биопленки
Для определения эффективности антибиотика против бактерий в составе клетки бактерии выращивали в среде Basal medium в течение 3 суток при температуре 37°C без качания для получения плотной биопленки [A.R. Kayumov, Khakimullina Е., Sharafutdinov I., Trizna E., Latypova L., Lien Thi, Margulis A., Bogachev M., Kurbangalieva A. Inhibition of biofilm formation in Bacillus subtilis by new halogenated furanones. J. Antibiotics. - 2014. - V. 68. - №5. - P. 297-301.]. Затем биопленку промывали стерильным 0.9% раствором NaCl и заливали свежую стерильную среду. Вносили антисептики до концентраций (1-16)×МБК (минимальная бактерицидная концентрация) и инкубировали в течение суток. После удаляли культуральную жидкость из лунок, однократно промывали 0.9% раствором NaCl для удаления неадгезированных клеток и оценивали жизнеспособность клеток в составе биопленок подсчетом КОЕ методом Drop plate анализа [В. Herigstad, М. Hamilton, J. Heersink How to optimize the drop plate method for enumerating bacteria. J Microbiol Methods. - 2001. - V. 44. - P. 121-129]. Для этого биопленку механически снимали с поверхности и гомогенизировали в 0.9% NaCl путем пипетирования и ультразвуковой обработки. Затем готовили серийные 10-кратные разведения бактериальной суспензии в 0.9% NaCl и по 5 мкл суспензии переносили на чашки с твердой питательной средой. КОЕ подсчитывали из капель, содержащих 5-10 колоний.
Результаты исследования противомикробной активности в отношении клеток исследуемых штаммов, погруженных в матрикс биопленки, по сравнению с мирамистином и хлоридом бензалкония представлены на Фиг. 1 и 2.
В отношении грамположительных микроорганизмов в составе биопленки соединение I демонстрировало в 2 раза более высокую активность по сравнению с мирамистином и хлоридом бензалкония: одинаковое снижение количества КОЕ происходило при дважды меньшем превышении МБК у соединения I по сравнению с мирамистином и хлоридом бензалкония. При этом мирамистин проявлял активность в 2 раза ниже, чем бензалкония хлорид.
В отношении грамотрицательных микроорганизмов в составе биопленки соединение I демонстрировало одинаковую с мирамистином и хлоридом бензалкония активность в отношении K. pneumonia, S. marcescens, E. coli. Что касается штамма P. aeruginosa, активность соединения I значительно выше, чем у антисептиков сравнения. Снижение количества КОЕ на 3 порядка происходило при превышении МБК в 4-8 раз для соединения I и в 16 раз для мирамистина и хлорида бензалкония, что является несомненным преимуществом разработанного антисептика.
Пример 4. Исследование противовирусной активности соединения I in vitro
Исследование противовирусной активности соединения I in vitro проводили в соответствии с [Д.Л. Кузнецов, А.Я. Самуйленко, В.И. Белоусов Иммуноферментная диагностика ИРТ КРС. Ветеринария. - 2002. - №3. - С. 22-25].
Клетки легкого эмбриона коровы (ЛЭК) получены из ФГБНУ «Всероссийский институт экспериментальной ветеринарии», г. Москва. Вирус ринотрахеита крупного рогатого скота (семейство герпесвирусов), вакцинный штамм "ТК-А(ВИЭВ)-В2» получен из ФГБНУ «Всероссийский институт экспериментальной ветеринарии», г. Москва.
Оценка противовирусной активности соединения I проводилась в соответствующей среде на клетках ЛЭК, которые инфицировались вирусом инфекционного ринотрахеита крупного рогатого скота, относящегося к семейству герпесвирусов типа 1.
Вирус инкубировали в присутствии соединения I в культуральной среде при 37°C в течение одного часа в различных концентрациях, контрольными препаратами служили мирамистин и бензалкония хлорид. После инкубации вируса с веществами его добавляли к культуре клеток, которые затем инкубировали при 37°C, 5% СО2 в течение 72 часов.
Оценка цитопатогенного действия проводилась визуально по состоянию клеточного монослоя по сравнению с контролями (вирус без инкубации с препаратом, исследуемые концентрации препаратов без вируса). Титр вируса рассчитывали по методу Рида и Менча в модификации Ашмарина и выражали в lg ТЦД50/мл..
В результате проведенных исследований по изучению противовирусной активности соединения I выявлено, что вещество обладает вирулицидным действием в отношении герпесвируса типа 1 с инфекционным титром 6.0 lg ТЦД50/мл (таблица 2). Вирулицидное действие соединения I несколько слабее (200 мкг/мл), чем у мирамистина (150 мкг/мл) и сопоставимо с эффектами бензалкония хлорида.
Где:
++++ - 90-100% разрушения монослоя;
+++ - 70-90% разрушения монослоя;
++ - 40-70% разрушения монослоя;
+ 10-40% разрушения монослоя;
- 0-10% разрушения монослоя.
Пример 5. Определение антипротозойной активности соединения I in vitro
Оценку антипротозойной активности соединения I определяли по жизнеспособности простейших рода брюхоресничных инфузорий стилонихии Stylonychia mytilus в питательной среде в присутствии исследуемых веществ. Готовили маточный раствор соединения I (10 мг/мл) в смеси ДМСО и 96% этилового спирта (1:1). Отрицательным контролем служил 1% водный раствор ДМСО и этилового спирта, а в качестве препаратов сравнения использовали мирамистин, бензалкония хлорид и хлоргексидин. Затем из маточных растворов путем неоднократных разведений водой готовили рабочие растворы, соответствующие дозам в 5; 10; 20; 25; 50; 75; 100 и 150 мкг/мл. На предметное стекло наносили 10 мкл питательной среды с простейшими и 10 мкл раствора исследуемого вещества. Эксперимент делали в пяти повторностях.
Стекла просматривали под световым микроскопом, антипротозойную активность веществ (МПК и IC50) определяли по гибели простейших. Для анализа использовали регрессионную модель Хилла с 5 параметрами.
В результате проведенных исследований выявлено, что соединение I обладает ярко выраженным антипротозойным действием в отношении Stylonychia mytilus (таблица 3). Антипротозойное действие соединения I в отношении брюхоресничных инфузорий стилонихии (Stylonychia mytilus) было сопоставимо (25 мкг/мл) с хлоргексидином (20 мкг/мл), бензалкония хлоридом (30 мкг/мл) и превосходило мирамистин (50 мкг/мл).
Пример 6. Исследование противогрибковой активности соединения I in vitro
Исследование противогрибковой активности соединения I in vitro проводили в соответствии с [Методические рекомендации №2. Микологическое исследование объектов окружающей среды и определение противогрибковой активности различных веществ. - ГОУ ДПО СПбМАПО НИИ медицинской микологии им. П.Н. Кашкина, ГБОУ ВПО СЗГМУ им. И.И. Мечникова Минздрава. СПб.: Изд. Дом СПбМАПО. - 2008. - С. 16].
Изучение противогрибковой активности веществ in vitro проводили в жидкой питательной среде (глюкозный бульон Сабуро) в биологических пробирках методом 2-х кратных серийных разведений. В пробирках готовили три параллельных ряда разведений исследуемого вещества следующим способом.
Жидкую среду Сабуро разливали стерильно по 3 мл в каждую пробирку; в первую пробирку ряда наливали 4.5 мл. Всего в ряду использовали 14 пробирок; из них последняя контрольная. В качестве стандартной навески брали 400 мг испытуемого вещества и растворяли в 10 мл дистиллированной воды. Таким образом, исходное разведение содержало испытуемое вещество в концентрации 40000 мкг/мл. Затем 0.5 мл этого разведения вносили в первую пробирку ряда (с 4.5 мл среды), разводя тем самым концентрацию вещества еще в 10 раз. Следовательно, первая пробирка ряда содержала 4000 мкг/мл испытуемого вещества. Затем из первой пробирки брали по 3 мл раствора и переносили его во вторую пробирку, тщательно продув, затем снова брали 3 мл раствора уже из второй пробирки и переносили в третью пробирку и т.д.; из предпоследней пробирки 3 мл выливали. В последнюю пробирку, как в контрольную, вещество не вносили. Таким образом, получали следующие разведения в мкг/мл: 4000; 2000; 1000; 500; 250; 125; 62,5; 31,2; 15,6; 7,8; 3,9; 1,9. Оценку роста культур проводили первоначально визуально, сравнивая рост микроорганизмов в присутствии изучаемых тест-соединений с ростом культуры без них. Наличие роста микроорганизма в жидкой среде (помутнение или образование мицелия) свидетельствовало о том, что данная концентрация испытуемого вещества недостаточна, чтобы подавить его жизнеспособность. Первую наименьшую концентрацию вещества (из серии последовательных разведений), где визуально не определялся или подавлялся рост грибов, считали минимальной подавляющей концентрацией (МПК).
Для приготовления инокулюма использовали чистые, (2-5) суточные культуры дрожжевых и мицелиальных грибов соответственно, выросшие на плотной питательной среде Сабуро. Инокулят для засева готовили по-разному, в зависимости от вида грибов. Так, дрожжевые культуры Candida albicans РКПГ Y-401/NCTC-885-653 (С. albicans) готовили путем смыва культуры с агарового косяка. Культуры мицелиальных грибов Rhizopus oryzae РКПГ F-1537/1722 (Rh. oryzae), Aspergillus fumigates РКПГ F-1248/880 (Asp. fumigatus) предварительно растирали в ступке. В стерильном изотоническом растворе хлорида натрия готовили взвесь микроорганизмов, доводя плотность инокулюма до 2 млрд. по стандарту МакФарланда (2⋅108 КОЕ/мл), учитывая, что величина грибковых элементов примерно в 10 раз превышает величину бактерий. Конечная концентрация клеток в опыте составляла (1-5)×103 для дрожжевых грибов и (0.4-5.0)×104 для мицелиальных. Инокулюм использовали в течение 15 минут после приготовления; чистоту грибковых штаммов контролировали перед каждым экспериментом.
В пробирки с тремя параллельными рядами разведений исследуемого вещества (как описано выше) и в контрольные пробирки в отсутствии испытуемых веществ оттитрованной пипеткой, содержащей 25 капель в 1 мл, вносили по одной капле взвеси инокулюма. После засева штатив энергично встряхивали и помещали в термостат с температурой 27°C на (2-4) суток для дрожжевых грибов и (7-14) суток для мицелиальных грибов, соответственно.
Оценку роста культур проводили визуально, применяя ступенчатую шкалу, сравнивая рост микроорганизмов в присутствии изучаемых тест-соединений с ростом культуры без них.
0 = оптическая прозрачность, полное визуально отсутствие роста;
1 = слабый рост (25% от уровня контроля);
2 = существенное подавление роста (50% от уровня контроля);
3 = слабое подавление роста(75% от уровня контроля)
4 = отсутствие подавление роста
За МПК принимали минимальную концентрацию исследуемых соединений, обеспечивающую полное подавление видимого роста исследуемых штаммов микроорганизмов (шкала роста = 0).
В результате проведенного исследования определены значения МПК тестируемого соединения I, которое обладает выраженной фунгицидной активностью в отношении всех видов микроскопических грибов. Мирамистин проявляет сопоставимую активность в отношении Asp. fumigates и Rh. nigricans, при этом будучи неактивным для С. albicans. Бензалкония хлорид в отношении всех видов грибов был существенно более активен, чем соединение I и мирамистин.
Полученные результаты представлены в таблицах 4 и 5.
Принимая во внимание целесообразность представления табличных материалов, их описания заявителем оставлены в тексте, т.к. это упрощает понимание заявочных материалов.
Пример 7. Определение чувствительности микроскопических грибов к соединению I в растворе
Для приготовления инокулюма использовали чистые, (2-5) суточные культуры дрожжевых и мицелиальных грибов соответственно, выросших на плотной питательной среде Сабуро. Инокулят для засева готовили по-разному, в зависимости от вида грибов. Так, дрожжевые культуры (С. albicans) готовили путем смыва культуры с агарового косяка. Культуры мицелиальных грибов (Rh. oryzae, Asp. fumigatus) предварительно растирали в ступке. В стерильном изотоническом растворе хлорида натрия готовили взвесь микроорганизмов, доводя плотность инокулюма до 5 ЕД (ГИСК им. Л.А. Тарасевича) или по стандарту МакФарланда 1 ЕД с концентрацией не менее 1×106 КОЕ/мл учитывая, что величина грибковых элементов примерно в 10 раз превышает величину бактерий (это обеспечивало возможность создания смеси биоцида с суспензией, концентрация микроорганизмов порядка 1×105 КОЕ/мл).
Растворы соединения I, мирамистина и бензалкония хлорида в рабочих концентрациях (0.1%, 0.2%, 0.3%) разливали в стерильные пробирки по 0.9 мл. В пробирки с растворами дезинфектантов вносили по 0.1 мл микробной взвеси и перемешивали встряхиванием несколько секунд. Выдерживали экспозицию в течение 1,5, 15 минут. После действия дезинфектанта в необходимой временной экспозиции, вносили по 0.5 мл раствора нейтрализатора и перемешивали встряхиванием.
Затем осуществляли посев на плотную питательную среду по 0.1 мл смеси и помещали чашки с посевами в термостат с температурой 27°C на (2-4) суток для дрожжевых грибов и (5-7) суток мицелиальных грибов, соответственно.
Параллельно с проведением опыта ставили следующие контроли:
1) контроль жизнеспособности микроорганизма (посев микробной культуры на питательную среду);
2) контроль стерильности раствора дезинфектанта без добавления культуры (посев приготовленного раствора дезинфектанта на питательную среду);
3) контроль полноты нейтрализации дезинфектанта (1 - к раствору дезинфицирующего средства (ДС) добавляли нейтрализатор, 2 - в полученную смесь вносили микробную суспензию, 3 - выдерживали с необходимой экспозицией, 4 - высевали смесь на питательную среду).
По истечении времени, необходимого для культивирования микроорганизмов данного вида, проводили учет результатов по количеству выросших на чашке Петри колоний. При отсутствии роста увеличивали сроки культивирования микроорганизмов в 2 раза. Выросшие колонии подвергали микроскопии.
Тестируемые вещества исследовали на клинических и музейных штаммах дрожжевых и мицелиальных грибов. В качестве препаратов сравнения использовали часто применяемые в клинической практике препараты: мирамистин и бензалкония хлорид. После действия дезинфектанта в необходимой временной экспозиции проводили посев стерильно на поверхность плотной питательной среды в чашки Петри по 0.1 мл смеси. По истечении времени культивирования микроорганизмов, проводили учет результатов по количеству выросших на чашке Петри колоний. Полученные результаты представлены в таблице 6.
Результаты данного исследования показали, что по фунгицидному действию соединение I превосходит мирамистин и незначительно уступает бензалконию хлориду. Соединение I обладает выраженной активностью в отношении всех видов в концентрации 0.2%, тогда как мирамистин не проявлял активность даже в концентрации 0.3% на Rh. oryzae.
Таким образом, согласно полученным результатам, соединение I и бензалконий хлорид имеют одинаковую антифунгальную активность в концентрации 0.2% с экспозицией 5 минут.
Пример 8. Определение дезинфицирующей активности соединения I в суспензионном тесте
Для приготовления бактериальной суспензии культуры микроорганизмы, выращенные на плотной питательной среде в течение (18-24) часов, смывали стерильным изотоническим раствором хлорида натрия. Бактериальную суспензию каждого микроорганизма доводили до мутности, соответствующей концентрации 1×109 клеток/мл, что соответствует 3 единицам Мак-Фарланда.