Композиция для лечения гиперлипидемии, содержащая производное оксинтомодулина
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии, конкретно к композициям на основе конъюгата производного оксинтомодулина, и может быть использовано в медицине для снижения уровней липидов в крови при предупреждении или лечении гиперлипидемии, жировой болезни печени или артериосклероза. Получают производное оксинтомодулина с SEQ ID NO: 24, 25 или 26, слитое с Fc-областью иммуноглобулина через непептидильный полимер, который ковалентно связывает производное оксинтомодулина и Fc-область иммуноглобулина. Изобретение позволяет получить конъюгат производного оксинтомодулина, обладающего высокой способностью активировать рецептор GLP-1 и рецептор глюкагона по сравнению с природным оксинтомодулином и позволяющего эффективно снижать уровни общего холестерина, холестерина низкой плотности и триглицеридов в крови, которые были повышены вследствие рациона с высоким содержанием жира, и повышать уровни холестерина высокой плотности и соотношения холестерин высокой плотности/холестерин низкой плотности. 3 н. и 10 з.п. ф-лы, 10 ил., 3 табл., 6 пр.
Реферат
Область техники
Настоящее изобретение относится к композиции для предупреждения или лечения гиперлипидемии, жировой болезни печени или артериосклероза, содержащей производное оксинтомодулина в качестве активного ингредиента, и к способу лечения гиперлипидемии, жировой болезни печени или артериосклероза с использованием этой композиции.
Предшествующий уровень техники
За последние годы в Корее в результате экономического роста и преобразования пищевых привычек по западному образцу увеличились потребление жиров из продуктов питания и число метаболических заболеваний, таких как гиперлипидемия, диабет, гипертензия, артериосклероз и жировая болезнь печени, которые возникают в результате недостаточной физической нагрузки.
Гиперлипидемия относится к состоянию, ассоциированному с повышенными уровнями липидов в крови, таких как свободный холестерин, сложные эфиры холестерина, фосфолипиды и триглицериды. Гиперлипидемия может проявляться в трех формах: (1) гиперхолестеринемия, (2) гипертриглицеридемия и (3) комбинированная гиперлипидемия (гиперхолестеринемия и гипертриглицеридемия). Гиперлипидемию обычно классифицируют на первичную гиперлипидемию и вторичную гиперлипидемию. Первичная гиперлипидемия обычно вызывается генетическими дефектами, в то время как вторичная гиперлипидемия вызывается различными болезненными состояниями, лекарственными средствами и диетическими привычками. Кроме того, гиперлипидемия также вызывается комбинацией причин первичной и вторичной гиперлипидемии. В качестве критериев диагностики гиперлипидемии обычно используют уровень общего холестерина 220 мг/дл или выше и уровень триглицеридов 150 мг/дл или выше.
Существуют различные формы холестерина, которые естественным образом встречаются у млекопитающих. Известен холестерин низкой плотности (LDL), который является опасным для здоровья, и известно, что увеличение LDL-холестерина увеличивает риск заболевания сердца (Assman et al., Am. J. Card, 1996). Кроме того, холестерин высокой плотности (HDL) считается хорошим холестерином и является необходимым для здоровья, так как он предупреждает артериосклероз или т.п.
Хотя сама по себе гиперлипидемия не проявляет особые симптомы, избыточные липиды в крови прилипают к стенкам кровеносного сосуда с уменьшением размера кровеносного сосуда и вызывают артериосклероз посредством воспалительных реакций. По этой причине может иметь место ишемическая болезнь сердца, сердечнососудистое заболевание, непроходимость периферических кровеносных сосудов и т.д. (Е. Falk et al., Circulation, 1995). Кроме того, избыточные липиды крови накапливаются в ткани печени и, таким образом, могут вызывать жировую болезнь печени. Жировая инфильтрация печени относится к состоянию, при котором отношение жиров к массе печени составляет более 5%. Жировая инфильтрация печени может быть вызвана не только избыточным потреблением жиров, но также и потреблением алкоголя.
Современные способы, которые используют для снижения уровней липидов в крови, включают диетическую терапию, лечебную физкультуру и лекарственную терапию. Однако диетическую терапию или лечебную физкультуру трудно строго контролировать и выполнять, а их терапевтический эффект также ограничен.
Лекарственные средства для снижения уровней липидов, разработанные до настоящего времени, включают секвестрант желчных кислот, снижающие уровень холестерина лекарственные средства, такие как ингибиторы HMG-CoA (гидроксиметилглутарил кофермент А) редуктазы, играющие важную роль в биосинтезе холестерина, снижающие уровень триглицеридов лекарственные средства, такие как производные фиброевой кислоты и никотиновая кислота, и т.д. Однако сообщалось, что эти лекарственные средства имеют побочные эффекты, такие как гепатотоксичность, желудочно-кишечное расстройство и канцерогенез. Таким образом, существует настоятельная необходимость в разработке лекарственных средств, которые можно использовать для лечения гиперлипидемии и родственных заболеваний (например артериосклероза и жировой болезни печени), имеющих при этом незначительные побочные эффекты.
В последнее время в качестве кандидата для таких лекарственных средств обратил на себя внимание оксинтомодулин. Оксинтомодулин получают из преглюкагона, и он представляет собой пептид, который может связываться с рецептором как глюкагоноподобного пептида-1 (GLP-1), так и глюкагона с выполнением двойной функции. Вследствие таких характеристик оксинтомодулин был изучен в отношении различных целей, включая лечение ожирения, гиперлипидемии и жировой болезни печени. Однако оксинтомодулин имеет проблему, поскольку его следует вводить в высокой дозе, так как он имеет короткий период полувыведения in vivo, и его активность является недостаточной для применения в лечении ожирения, гиперлипидемии и жировой болезни печени.
Исходя из этого, авторы настоящего изобретения разработали производное оксинтомодулина, обладающее повышенной активностью по сравнению с нативным оксинтомодулином, и обнаружили, что производное оксинтомодулина снижало содержание и соотношение липидов в крови у модели хомяка с индуцированной гиперлипидемией, указывая на то, что это производное можно эффективно применять для лечения гиперлипидемических заболеваний, таким образом осуществляя настоящее изобретение.
Описание изобретения
Техническая проблема
Цель настоящего изобретения заключается в представлении композиции для предупреждения или лечения гиперлипидемии, жировой болезни печени или артериосклероза, которая содержит производное оксинтомодулина в качестве активного ингредиента.
Другая цель настоящего изобретения заключается в представлении способа лечения гиперлипидемии, жировой болезни печени или артериосклероза, включающего стадию введения субъекту производного оксинтомодулина.
Еще одна цель настоящего изобретения заключается в то, чтобы предложить применение производного оксинтомодулина в изготовлении лекарственного средства для предупреждения или лечения гиперлипидемии, жировой болезни печени или артериосклероза.
Техническое решение
Для достижения указанных выше целей в одном аспекте настоящего изобретения предложена композиция для предупреждения или лечения гиперлипидемии, жировой болезни печени или артериосклероза, которая содержит производное оксинтомодулина в качестве активного ингредиента.
При использовании в описании изобретения термин "оксинтомодулин" относится к пептиду, получаемому из преглюкагона, который является предшественником глюкагона. В настоящем изобретении подразумевается, что оксинтомодулин включает нативный оксинтомодулин и его предшественник, аналог (производное), фрагмент и вариант. Предпочтительно, оксинтомодулин имеет аминокислотную последовательность SEQ ID NO: 1 (HSQGTFTSDYSKYLDSRRAQDFVQWLMNTKRNRNNIA).
При использовании в данном описании термин "вариант оксинтомодулина" означает пептид, который имеет один или более чем один аминокислотный остаток, отличный от такового аминокислотной последовательности нативного оксинтомодулина, и имеет функцию активирования рецепторов GLP-1 и глюкагона. Вариант оксинтомодулина может быть получен посредством любого из замены, добавления, делеции, модификации нескольких аминокислот нативного оксинтомодулина или комбинации этих способов.
При использовании в данном описании термин "производное оксинтомодулина" относится к пептиду, производному пептида или миметику пептида, который получен посредством добавления, делеции или замены нескольких аминокислот нативного оксинтомодулина и который может активировать как рецептор GLP-1, так и рецептор глюкагона до высокого уровня в сравнении с уровнем, активируемым нативным оксинтомодулином.
При использовании в данном описании термин "фрагмент оксинтомодулина" относится к фрагменту, имеющему добавление или делецию одной или более чем одной аминокислоты на амино- или карбокси-конце нативного оксинтомодулина, в котором добавленные аминокислоты также могут представлять собой не встречающиеся в природе аминокислоты (например аминокислоту D-типа). Такие аминокислоты обладают функцией регулирования уровней глюкозы в крови in vivo.
Способы получения варианта, производного и фрагмента оксинтомодулина можно применять по отдельности или в комбинации. Например, настоящее изобретение включает пептид, который имеет одну или более чем одну аминокислоту, отличную от таковой в нативном пептиде, и дезаминирование N-концевых аминокислотных остатков и обладает функцией активирования как рецептора GLP-1, так и рецептора глюкагона.
Аминокислоты, указанные в данном описании, сокращают согласно правилам системы условных обозначений IUPAC-IUB следующим образом:
| Аланин А | Аргинин R |
| Аспарагин N | Аспарагиновая кислота D |
| Цистеин С | Глутаминовая кислота Е |
| Глутамин Q | Глицин G |
| Гистидин Н | Изолейцин I |
| Лейцин L | Лизин К |
| Метионин М | Фенилаланин F |
| Пролин Р | Серии S |
| Треонин Т | Триптофан W |
| Тирозин Y | Валин V |
В настоящем изобретении производное оксинтомодулина охватывает любой пептид, который получен посредством замены, добавления, делеции или посттрансляционной модификации (например метилирования, ацилирования, убиквитинирования или внутримолекулярного ковалентного связывания) аминокислот в аминокислотной последовательности SEQ ID NO: 1 и который может активировать рецепторы как глюкагона, так и GLP-1. При замене или добавления аминокислот могут быть использованы не только 20 аминокислот, обычно обнаруживаемых в белках человека, но также и атипичные или не встречающиеся в природе аминокислоты. Коммерческие поставщики атипичных аминокислот включают Sigma-Aldrich, ChemPep Inc. и Genzyme Pharmaceuticals. Пептиды, содержащие эти аминокислоты и атипичные пептидные последовательности, могут быть синтезированы и приобретены у коммерческих поставщиков, например American Peptide Company, или Bachem (USA), или Anygen (Korea).
В конкретном воплощении настоящего изобретения производное оксинтомодулина по настоящему изобретению представляет собой новый пептид, содержащий аминокислотную последовательность следующей формулы 1:
[Формула 1]
R1-Х1-X2-GTFTSD-X3-X4-X5-X6-X7-X8-X9-X10-Х11-Х12-Х13-Х14-Х15-Х16-X17-X18-X19-X20-X21-X22-X23-X24-R2 (SEQ ID NO: 54), где
R1 представляет собой гистидин, дезаминогистидил, диметилгистидил (N-диметилгистидил), бета-гидроксиимидазопропионил, 4-имидазоацетил, бета-карбоксиимидазопропионил или тирозин;
X1 представляет собой Aib (аминоизомасляную кислоту), d-аланин, глицин, Sar (N-метилглицин), серии или d-серин;
Х2 представляет собой глутаминовую кислоту или глутамин;
Х3 представляет собой лейцин или тирозин;
Х4 представляет собой серии или аланин;
Х5 представляет собой лизин или аргинин;
Х6 представляет собой глутамин или тирозин;
Х7 представляет собой лейцин или метионин;
Х8 представляет собой аспарагиновую кислоту или глутаминовую кислоту;
Х9 представляет собой глутаминовую кислоту, серии, альфа-метилглутаминовую кислоту или делетирован;
Х10 представляет собой глутамин, глутаминовую кислоту, лизин, аргинин или серин или делетирован;
X11 представляет собой аланин, аргинин или валин или делетирован;
Х12 представляет собой аланин, аргинин, серин или валин или делетирован;
Х13 представляет собой лизин, глутамин, аргинин или альфа-метилглутаминовую кислоту или делетирован;
Х14 представляет собой аспарагиновую кислоту, глутаминовую кислоту или лейцин или делетирован;
Х15 представляет собой фенилаланин или делетирован;
Х16 представляет собой изолейцин или валин или делетирован;
Х17 представляет собой аланин, цистеин, глутаминовую кислоту, лизин, глутамин или альфа-метилглутаминовую кислоту или делетирован;
Х18 представляет собой триптофан или делетирован;
Х19 представляет собой аланин, изолейцин, лейцин, серии или валин или делетирован;
Х20 представляет собой аланин, лизин, метионин, глутамин или аргинин или делетирован;
Х21 представляет собой аспарагин или делетирован;
Х22 представляет собой аланин, глицин или треонин или делетирован;
Х23 представляет собой цистеин или лизин или делетирован;
Х24 представляет собой пептид, имеющий от 2 до 10 аминокислот, состоящих из комбинации аланина, глицина и серина, или делетирован; и
R2 представляет собой KRNRNNIA (SEQ ID NO: 35), GPSSGAPPPS (SEQ ID NO: 36), GPSSGAPPPSK (SEQ ID NO: 37), HSQGTFTSDYSKYLD (SEQ ID NO: 38), HSQGTFTSDYSRYLDK (SEQ ID NO: 39), HGEGTFTSDLSKQMEEEAVK (SEQ ID NO: 40) или делетирован (за исключением случая, когда аминокислотная последовательность формулы 1 идентична аминокислотной последовательности SEQ ID NO: 1).
С целью увеличения активности оксинтомодулина дикого типа в отношении рецептора глюкагона и рецептора GLP-1 производное оксинтомодулина по настоящему изобретению может быть замещено 4-имидазоацетилом, полученным посредством делетирования альфа-углерода гистидина в положении 1 аминокислотной последовательности SEQ ID NO: 1, дезаминогистидилом, полученным посредством делетирования N-концевой аминогруппы, диметилгистидилом (N-диметилгистидилом), полученным посредством модификации N-концевой аминогруппы при помощи двух метильных групп, бета-гидроксиимидазопропионилом, полученным посредством замещения N-концевой аминогруппы гидроксильной группой, или бета-карбоксиимидазопропионилом, полученным посредством замещения N-концевой аминогруппы карбоксильной группой. Кроме того, область связывания с рецептором GLP-1 может быть заменена аминокислотами, которые усиливают гидрофобные и ионные связи или их комбинацию. Участок последовательности оксинтомодулина может быть заменен аминокислотной последовательностью GLP-1 или эксендина-4 для увеличения активности рецептора GLP-1.
Кроме того, участок последовательности оксинтомодулина может быть заменен последовательностью, которая стабилизирует альфа-спираль. Предпочтительно, аминокислоты в положениях 10, 14, 16, 20, 24 и 28 аминокислотной последовательности формулы 1 могут быть заменены аминокислотами или производными аминокислот, состоящими из Tyr(4-Ме), Phe, Phe(4-Me), Phe(4-Cl), Phe(4-CN), Phe(4-NO2),Phe(4-NH2), Phg, Pal, Nal, Ala(2-тиенил) и Ala (бензотиенил), которые, как известно, стабилизируют альфа-спираль, и нет никаких ограничений по типу и числу встраиваемых стабилизирующих альфа-спираль аминокислот или производных аминокислот.
Предпочтительно, аминокислоты в положениях 10 и 14, 12 и 16, 16 и 20, 20 и 24, и 24 и 28 аминокислотной последовательности также могут быть заменены глутаминовой кислотой или лизином для того, чтобы происходило образование колец, и нет никакого ограничения по числу встраиваемых колец. Наиболее предпочтительно, производное оксинтомодулина может иметь аминокислотную последовательность, выбранную из числа следующих формул 1-6.
В конкретном воплощении производное оксинтомодулина по настоящему изобретению представляет собой новый пептид, содержащий аминокислотную последовательность следующей формулы 2, полученную посредством замены аминокислотной последовательности оксинтомодулина на аминокислотную последовательность эксендина или GLP-1:
[Формула 2]
R1-A-R3 (SEQ ID NO: 55).
В другом конкретном воплощении производное оксинтомодулина по настоящему изобретению представляет собой новый пептид, содержащий аминокислотную последовательность следующей формулы 3, которая получена посредством связывания участка аминокислотной последовательности оксинтомодулина и участка аминокислотной последовательности эксендина или GLP-1 через подходящий аминокислотный линкер:
[Формула 3]
R1-B-C-R4 (SEQ ID NO: 56).
В еще одном конкретном воплощении производное оксинтомодулина по настоящему изобретению представляет собой новый пептид, содержащий аминокислотную последовательность следующей формулы 4, где участок аминокислотной последовательности оксинтомодулина заменен аминокислотой, способной усиливать аффинность связывания в отношении рецептора GLP-1, например, Leu в положении 26, который связывается с рецептором GLP-1 посредством гидрофобного взаимодействия, заменен гидрофобным остатком Не или Val:
R1-SQGTFTSDYSKYLD-D1-D2-D3-D4-D5-LFVQW-D6-D7-N-D8-R3
[Формула 4]
(SEQ ID NO: 57).
В еще одном конкретном воплощении производное оксинтомодулина по настоящему изобретению представляет собой новый пептид, содержащий аминокислотную последовательность следующей формулы 5, где часть аминокислотной последовательности нативного оксинтомодулин делетирована, добавлена или заменена, на другие аминокислоты для увеличения способностей нативного оксинтомодулина активировать рецептор GLP-1 и рецептор глюкагона:
R1-Е1-QGTFTSDYSKYLD-E2-E3-RA-E4-E5-FV-E6-WLMNT-E7-R5
[Формула 5]
(SEQ ID NO: 58).
В формулах 2-5 R1 является таким же, как описано в формуле 1;
А выбран из группы, состоящей из
SQGTFTSDYSKYLDSRRAQDFVQWLMNT (SEQ ID NO: 41),
SQGTFTSDYSKYLDEEAVRLFIEWLMNT (SEQ ID NO: 42),
SQGTFTSDYSKYLDERRAQDFVAWLKNT (SEQ ID NO: 43),
GQGTFTSDYSRYLEEEAVRLFIEWLKNG (SEQ ID NO: 44),
GQGTFTSDYSRQMEEEAVRLFIEWLKNG (SEQ ID NO: 45),
GEGTFTSDLSRQMEEEAVRLFIEWAA (SEQ ID NO: 46) и
SQGTFTSDYSRQMEEEAVRLFIEWLMNG (SEQ ID NO: 47);
В выбран из группы, состоящей из
SQGTFTSDYSKYLDSRRAQDFVQWLMNT (SEQ ID NO: 41),
SQGTFTSDYSKYLDEEAVRLFIEWLMNT (SEQ ID NO: 42),
SQGTFTSDYSKYLDERRAQDFVAWLKNT (SEQ ID NO: 43),
GQGTFTSDYSRYLEEEAVRLFIEWLKNG (SEQ ID NO: 44),
GQGTFTSDYSRQMEEEAVRLFIEWLKNG (SEQ ID NO: 45),
GEGTFTSDLSRQMEEEAVRLFIEWAA (SEQ ID NO: 46),
SQGTFTSDYSRQMEEEAVRLFIEWLMNG (SEQ ID NO: 47),
GEGTFTSDLSRQMEEEAVRLFIEW (SEQ ID NO: 48) и
SQGTFTSDYSRYLD (SEQ ID NO: 49);
С представляет собой пептид, имеющий от 2 до 10 аминокислот, состоящих из комбинации аланина, глицина и серина;
D1 представляет собой серин, глутаминовую кислоту или аргинин;
D2 представляет собой аргинин, глутаминовую кислоту или серин;
D3 представляет собой аргинин, аланин или валин;
D4 представляет собой аргинин, валин или серин;
D5 представляет собой глутамин, аргинин или лизин;
D6 представляет собой изолейцин, валин или серин;
D7 представляет собой метионин, аргинин или глутамин;
D8 представляет собой треонин, глицин или аланин;
Е1 представляет собой серин, Aib, Sar, d-аланин или d-серин;
Е2 представляет собой серин или глутаминовую кислоту;
Е3 представляет собой аргинин или лизин;
Е4 представляет собой глутамин или лизин;
Е5 представляет собой аспарагиновую кислоту или глутаминовую кислоту;
Е6 представляет собой глутамин, цистеин или лизин;
Е7 представляет собой цистеин или лизин или делетирован;
R3 представляет собой KRNRNNIA (SEQ ID NO: 35), GPSSGAPPPS (SEQ ID NO: 36) или GPSSGAPPPSK (SEQ ID NO: 37);
R4 представляет собой HSQGTFTSDYSKYLD (SEQ ID NO: 38), HSQGTFTSDYSRYLDK (SEQ ID NO: 39) или HGEGTFTSDLSKQMEEEAVK (SEQ ID NO: 40); и
R5 представляет собой KRNRNNIA (SEQ ID NO: 35), GPSSGAPPPS (SEQ ID NO: 36) или GPSSGAPPPSK (SEQ ID NO: 37) или делетирован (за исключением случая, когда аминокислотные последовательности формул 2-5 идентичны аминокислотной последовательности SEQ ID NO: 1).
Предпочтительно, производное оксинтомодулина по настоящему изобретению может представлять собой новый пептид следующей формулы 6.
[Формула 6]
R1-Х1-X2-GTFTSD-X3-X4-X5-X6-X7-X8-X9-X10-Х11-Х12-Х13-Х14-Х15-Х16-X17-X18-X19-X20-X21-X22-X23-X24-R2 (SEQ ID NO: 59),
где R1 представляет собой гистидин, дезаминогистидил, 4-имидазоацетил или тирозин;
X1 представляет собой Aib (аминоизомасляную кислоту), глицин, серии или d-серин;
Х2 представляет собой глутаминовую кислоту или глутамин;
Х3 представляет собой лейцин или тирозин;
Х4 представляет собой серии или аланин;
Х5 представляет собой лизин или аргинин;
Х6 представляет собой глутамин или тирозин;
Х7 представляет собой лейцин или метионин;
Х8 представляет собой аспарагиновую кислоту или глутаминовую кислоту;
Х9 представляет собой глутаминовую кислоту или альфа-метилглутаминовую кислоту или делетирован;
Х10 представляет собой глутамин, глутаминовую кислоту, лизин или аргинин или делетирован;
X11 представляет собой аланин или аргинин или делетирован;
Х12 представляет собой аланин или валин или делетирован;
Х13 представляет собой лизин, глутамин, аргинин или альфа-метилглутаминовую кислоту или делетирован;
Х14 представляет собой аспарагиновую кислоту, глутаминовую кислоту или лейцин или делетирован;
Х15 представляет собой фенилаланин или делетирован;
Х16 представляет собой изолейцин или валин или делетирован;
Х17 представляет собой аланин, цистеин, глутаминовую кислоту, глутамин или альфа-метилглутаминовую кислоту или делетирован;
Х18 представляет собой триптофан или делетирован;
Х19 представляет собой аланин, изолейцин, лейцин или валин или делетирован;
Х20 представляет собой аланин, лизин, метионин или аргинин или делетирован;
Х21 представляет собой аспарагин или делетирован;
Х22 представляет собой треонин или делетирован;
Х23 представляет собой цистеин, лизин или делетирован;
Х24 представляет собой пептид, имеющий от 2 до 10 аминокислот, состоящих из глицина, или делетирован; и
R2 представляет собой KRNRNNIA (SEQ ID NO: 35), GPSSGAPPPS (SEQ ID NO: 36), GPSSGAPPPSK (SEQ ID NO: 37), HSQGTFTSDYSKYLD (SEQ ID NO: 38), HSQGTFTSDYSRYLDK (SEQ ID NO: 39) или HGEGTFTSDLSKQMEEEAVK (SEQ ID NO: 40) или делетирован (за исключением случая, когда аминокислотная последовательность формулы 6 идентична аминокислотной последовательности SEQ ID NO: 1).
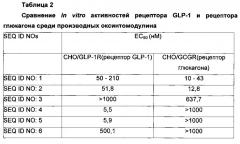
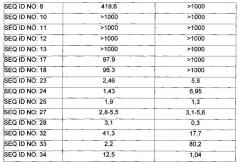
Более предпочтительно, производное оксинтомодулина по настоящему изобретению может быть выбрано из группы, состоящей из пептидов SEQ ID NO: 2-34. Еще более предпочтительно, производное оксинтомодулин по настоящему изобретению может представлять собой производное оксинтомодулина, описанное в Таблице 1 из Примера 2-1.
В одном примере настоящего изобретения получали производные оксинтомодулина, имеющие аминокислотные последовательности SEQ ID NO: 2-34, соответственно, и было обнаружено, что производные оксинтомодулина демонстрировали превосходные активности в отношении рецептора GLP-1 и рецептора глюкагона по сравнению с нативным оксинтомодулином (Пример 2). Другими словами, из вышеуказанных результатов можно увидеть, что производное оксинтомодулина по настоящему изобретению показывало превосходные терапевтические эффекты в отношении гиперлипидемии, жировой болезни печени или артериосклероза посредством активирования рецептора GLP-1 и рецептора глюкагона.
Производные оксинтомодулина по настоящему изобретению присутствуют в форме конъюгатов, содержащих различные полимеры, для улучшения терапевтического эффекта и периода полувыведения производных in vivo.
Конъюгат по настоящему изобретению демонстрирует увеличение продолжительности эффектов по сравнению с нативным оксинтомодулином, и длительно действующие конъюгаты включают оксинтомодулин, полученный посредством модификации, замены, добавления или делеции аминокислот нативного оксинтомодулина, оксинтомодулин, конъюгированный с биоразлагаемым полимером, таким как полиэтиленгликоль (ПЭГ), оксинтомодулин, конъюгированный с полисахаридом, таким как альбумин, антителом, эластином, фибронектином или хитином или с длительно действующим белком, таким как фрагмент иммуноглобулина, оксинтомодулин, конъюгированный с жирной кислотой, имеющей способность связываться с альбумином in vivo, или оксинтомодулин, инкапсулированный в биоразлагаемые наночастицы, и тип длительно действующего конъюгата, который используют в настоящем изобретении, не ограничен.
Предпочтительно, конъюгат представляет собой конъюгат, где производное оксинтомодулина, имеющее аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2-34, связано с Fc-областью иммуноглобулина через непептидильный полимер.
Fc-область иммуноглобулина представляет собой биоразлагаемый полипептид, который метаболизируется in vivo, и, таким образом, является безопасным для применения в качестве носителя для лекарственного средства. Fc-область иммуноглобулина имеет низкую молекулярную массу по сравнению с целой молекулой иммуноглобулина и, таким образом, является полезной с точки зрения получения, очистки и выхода конъюгатов. Кроме того, поскольку между антителами аминокислотная последовательность отличается, а участок Fab показывает высокую негомогенность, его отсутствие может значительно увеличивать гомогенность вещества, а также может снижать вероятность индуцирования антигенных свойств в крови.
При использовании в данном описании термин "Fc-область иммуноглобулина" относится к белку, который содержит константную область 2 тяжелой цепи (СН2) и константную область 3 тяжелой цепи (СН3) иммуноглобулина, исключая вариабельные области тяжелой цепи и легкой цепи, константную область 1 тяжелой цепи (СН1) и константную область 1 легкой цепи (CL1) иммуноглобулина. Он может дополнительно содержать шарнирную область в константной области тяжелой цепи. Также Fc-область иммуноглобулина по настоящему изобретению может представлять собой расширенную Fc-область, содержащую часть или всю константную область 1 тяжелой цепи (СН1) и/или константную область 1 легкой цепи (CL1), исключая вариабельные области тяжелой цепи и легкой цепи, при условии, что он обладает эффектом, который является по существу равным эффекту нативного белка или лучше. Также Fc-область иммуноглобулина может представлять собой область, имеющую делецию участка сравнительно длинной аминокислотной последовательности, соответствующей СН2 и/или СН3. Конкретно, Fc-область иммуноглобулина по настоящему изобретению может содержать 1) СН1-домен, СН2-домен, СН3-домен и СН4-домен, 2) СН1-домен и СН2-домен, 3) СН1-домен и СН3-домен, 4) СН2-домен и СН3-домен, 5) комбинацию одного или более чем одного домена и шарнирную область иммуноглобулина (или участок шарнирной области) или 6) димер каждого домена константных областей тяжелой цепи и константной области легкой цепи.
Fc-область иммуноглобулина по настоящему изобретению включает нативную аминокислотную последовательность и производное (мутант) этой последовательности. При использовании в данном описании термин "производное аминокислотной последовательности" относится к последовательности, которая отличается от нативной аминокислотной последовательности вследствие делеции, инсерции, неконсервативной или консервативной замены одного или более чем одного аминокислотного остатка нативной аминокислотной последовательности или их комбинации. Например, в случае Fc IgG аминокислотные остатки в положениях 214-238, 297-299, 318-322 или 327-331, которые, как известно, являются важными для связывания, могут быть использованы в качестве подходящих сайтов для модификации.
Кроме того, возможны другие различные производные, включая такое производное, которое имеет делецию области, способной образовывать дисульфидную связь, или делецию некоторых аминокислотных остатков на N-конце нативного Fc или добавление остатка метионина на N-конце нативного Fc. Кроме того, для устранения эффекторных функций, делеция может иметь место в сайте связывания комплемента, таком как C1q-связывающий сайт и сайт ADCC (антителозависимой клеточно-опосредованной цитотоксичности). Способы получения таких производных последовательности Fc-области иммуноглобулина раскрыты в международных патентных публикациях №WO 97/34631 и WO 96/32478.
Замены аминокислот в белках и пептидах, которые в основном не изменяют активность белков или пептидов, известны в данной области техники (Н. Neurath, R.L. Hill, The Proteins, Academic Press, New York, 1979). Наиболее часто встречающимися заменами являются Ala/Ser, Val/lle, Asp/Glu, Thr/Ser, Ala/Gly, Аlа/Thr, Ser/Asn, Ala/Val, Ser/Gly, Thy/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/lle, LeuA/al, Ala/Glu и Asp/Gly, в обоих направлениях. Кроме того, Fc-область может быть при необходимости модифицирована посредством фосфорилирования, сульфатирования, акрилирования, гликозилирования, метилирования, фарнезилирования, ацетилирования, амидирования и т.п.
Вышеописанные производные Fc демонстрируют биологическую активность, идентичную активности Fc-области по настоящему изобретению, или имеют повышенную структурную устойчивость к нагреванию, рН или т.п.
Кроме того, эта Fc-область может быт получена из нативных форм, выделенных из людей и других животных, включая коров, коз, свиней, мышей, кроликов, хомяков, крыс и морских свинок, или она может представлять собой их рекомбинанты или производные, полученные из трансформированных животных клеток или микроорганизмов. В данном описании изобретения Fc-область может быть получена из нативного иммуноглобулина посредством выделения целого иммуноглобулина из живого организма человека или животного и обработки его протеиназой. Когда целый иммуноглобулин подвергают обработке папаином, он расщепляется на Fab- и Fc-области, а когда целый иммуноглобулин подвергают обработке пепсином, он расщепляется на pF'c- и F(аb)2-фрагменты. Fc или pF'c могут быть выделены с использованием эксклюзионной хроматографии или т.п. Предпочтительно, имеющая происхождение из человека Fc-область представляет собой рекомбинантную Fc-область иммуноглобулина, полученную из микроорганизма.
Кроме того, Fc-область иммуноглобулина по настоящему изобретению может находиться в форме, имеющей нативные сахарные цепи либо увеличенные или уменьшенные по сравнению с нативной формой сахарные цепи, или может находиться в дегликозилированной форме. Увеличение, уменьшение или удаление сахарных цепей Fc иммуноглобулина может быть достигнуто посредством обычных способов, таких как химический способ, ферментативный способ и способ генной инженерии с использованием микроорганизма. Fc-область, полученная посредством удаления сахарных цепей из Fc, демонстрирует значительное уменьшение аффинности связывания с частью C1q первого компонента комплемента С1 и уменьшение или потерю антителозависимой клеточно-опосредованной цитотоксичности или комлементзависимой цитотоксичности и, таким образом, не индуцирует ненужные иммунные ответы in vivo. В связи с этим Fc-область иммуноглобулина в дегликозилированной или агликозилированной форме может быть более подходящей для цели настоящего изобретения в качестве носителя лекарственного средства.
При использовании в данном описании изобретения термин "дегликозилирование" относится к ферментативному удалению сахарных группировок из Fc-области, а термин "агликозилирование" относится к негликозилированной Fc-области, продуцируемой в прокариотах, предпочтительно Е. coli.
В то же время Fc-область иммуноглобулина может иметь происхождение из людей или других животных, включая коров, коз, свиней, мышей, кроликов, хомяков, крыс и морских свинок, и предпочтительно из людей.
Кроме того, Fc-область иммуноглобулина может иметь происхождение из IgG, IgA, IgD, IgE, IgM или их комбинации или гибрида. Предпочтительно, она имеет происхождение из IgG или IgM, которые входят в число наиболее часто встречающихся белков в крови человека, и наиболее предпочтительно из IgG, который, как известно, усиливает периоды полувыведения лиганд-связывающих белков.
При использовании в данном описании термин "комбинация" означает, что полипептиды, кодирующие одноцепочечные Fc-области иммуноглобулина одинакового происхождения, связаны с одноцепочечным полипептидом другого происхождения с образованием димера или мультимера. Конкретно, димер или мультимер может быть образован из двух или более фрагментов, выбранных из группы, состоящей из фрагментов IgG Fc, IgA Fc, IgM Fc, IgD Fc и IgE Fc.
При использовании в данном описании термин "гибрид" означает, что последовательности, соответствующие двум или более Fc-фрагментам иммуноглобулина разного происхождения, присутствуют в одноцепочечной Fc-области иммуноглобулина. В настоящем изобретении возможными являются различные формы гибрида. Другими словами возможен гибрид, состоящий из 1-4 доменов, выбранных из группы, состоящей из СН1, СН2, СН3 и СН4 из IgG Fc, IgM Fc, IgA Fc, IgE Fc и IgD Fc, и он может включать шарнир.
В то же время IgG может быть разделен на подклассы lgG1, lgG2, lgG3 и lgG4, и в настоящем изобретении также возможна комбинация или гибрид этих подклассов. Предпочтительно, IgG представляет собой подкласс lgG2 и lgG4, и наиболее предпочтительно он представляет собой Fc-область lgG4, которая по существу не имеет эффекторных функций, таких как комплементзависимая цитотоксичность (CDC).
Другими словами наиболее предпочтительная Fc-область иммуноглобулина, которую используют в настоящем изобретении в качестве носителя лекарственного средства, представляет собой Fc-область, имеющая происхождение из человеческого lgG4. Имеющая происхождение из человека Fc-область является более предпочтительной, чем Fc-область, имеющая происхождение не из человека, которая может действовать как антиген в организме человека и вызывать нежелательные иммунные ответы, такие как продуцирование новых антител против антигена.
При использовании в данном описании термин "непептидильный полимер" относится к биосовместимому полимеру, содержащему две или более чем две повторяющиеся единицы, связанные друг с другом посредством любой ковалентной связи вместо пептидной связи. В настоящем изобретении непептидильный полимер может быть использован взаимозаменяемо с непептидильным линкером.
Непептидильный полимер, который можно использовать в настоящем изобретении, может быть выбран из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, сополимера этиленгликоль/пропиленгликоль, полиоксиэтилированного полиола, поливинилового спирта, полисахаридов, декстрана, поливинилэтилового эфира, биоразлагаемых полимеров, таких как PLA (поли(молочная кислота)) и PLGA (поли(молочная-гликолевая) кислота), липидных полимеров, хитинов, гиалуроновой кислоты и их комбинаций. Предпочтительно, непептидильный полимер представляет собой полиэтиленгликоль. Кроме того, его производные, известные в данной области техники, и производные, которые могут быть легко получены посредством способа, известного в данной области техники, включены в объем настоящего изобретения.
Пептидный линкер, который используют в слитом белке, полученном посредством общепринятого способа слияния в рамке, имеет недостатки, поскольку он легко расщепляется протеиназой in vivo, и, таким образом, как и следовало ожидать, не может быть получен достаточный эффект увеличения периода полувыведения активного лекарственного средства из сыворотки посредство носителя. Однако в настоящем изобретении полимер, имеющий устойчивость к протеиназе, может быть использован для сохранения периода полувыведения пептида из сыворотки аналогичным таковому периоду для носителя. Поэтому любой непептидильный полимер может быть использован без ограничения в настоящем изобретении до тех пор, пока он является полимером, обладающим вышеупомянутой функцией, т.е. полимером, имеющим устойчивость к протеиназе in vivo. Непептидильный полимер имеет молекулярную массу в диапазоне от 1 до 100 кДа и предпочтительно от 1 до 20 кДа. Непептидильный полимер по настоящему изобретению, который связан с Fc-областью иммуноглобулина, может представлять собой один вид полимера или комбинацию различных полимеров.
Непептидильный полимер, который используют в настоящем изобретении, может иметь реакционноспособную группу, способную связываться с Fc-областью иммуноглобулина и белковым лекарственным средством. Реакционноспособную группу на обоих концах непептидильного полимера предпочтительно выбирают из группы, состоящей из реакционноспособной альдегидной группы, пропиональдегидной группы, бутиральдегидной группы, малеимидной группы и производного сукцинимида.
Производное сукцинимида может представлять собой сукцинимидилпропионат, гидроксисукцинимидил, сукцинимидилкарбоксиметил, или сукцинимидилкарбонат. В частности, когда непептидильный полимер имеет реакционноспособную альдегидную группу на обоих своих концах, неспецифические реакции могут быть минимизированы, а физиологически активный полипептид и иммуноглобулин могут быть эффективно соединены с одним и с другим концом непептидильного полимера, соответственно. Конечный продукт, созданный посредством восстановительного алкилирования при помощи альдегидной связи, является гораздо более стабильным, чем продукт, соединенный посредством амидной связи. Альдегидная реакционно-способная группа селективно связывается с N-концом при низком значении рН и может образовывать ковалентную связь с остатком лизина при высоком значении рН, таком к