Одноразовая система для стерильного получения частиц из липидов и нуклеиновых кислот
Иллюстрации
Показать всеНастоящая группа изобретений относится к области медицины, в частности фармакологии, и раскрывает систему для стерильного получения наночастиц липидов и нуклеиновых кислот и способ стерильного получения наночастиц липидов и нуклеиновых кислот. Настоящая группа изобретений позволяет получать однородные частицы липидов и нуклеиновых кислот с помощью простых стадий, воспроизводимо и в асептических условиях и может быть использована для доставки этого класса терапевтических молекул в клетки-мишени. 2 н. и 21 з.п. ф-лы, 13 табл., 7 пр, 1 ил.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Настоящая заявка испрашивает приоритет по предварительной заявке США 61/556124, поданной 4 ноября 2011, которая включена в настоящее описание посредством ссылки во всей ее полноте.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Описание касается системы для процесса формирования наночастиц липидов и нуклеиновых кислот просто и воспроизводимо в асептических условиях, включающей компоненты одноразового применения.
УРОВЕНЬ ТЕХНИКИ
Липиды являются потенциально полезными в качестве носителей для доставки терапевтических молекул, в частности для доставки нуклеиновых кислот. Липиды образуют липосомы, которые могут инкапсулировать, образовывать комплексы или захватывать молекулы нуклеиновых кислот, и таким образом улучшать доставку этого класса терапевтических молекул в клетки-мишени после введения, например, внутривенно для циркуляции. Их полезность в фармацевтических композициях ограничивается доступными методами для получения наночастиц липидов и нуклеиновых кислот воспроизводимым образом. Были разработаны различные методы для получения таких наночастиц.
Один способ для получения наночастиц, содержащих только липиды (везикулы) просто и воспроизводимо без обработки ультразвуком использует этанольную инжекцию, описанный Batzri et al., 1973, Biophys Biochem Acta 298: 1015-19, и Kremer et al., 1977, Biochemistry 16: 3932-35, в котором липиды, солюбилизированные в этаноле, инжектируют в водный раствор, что приводит к самопроизвольному образованию липосом.
Van Buitenen et al. US 7468151 описывает систему с замкнутым циклом для стерилизации микрочастиц, включая липосомы. Система включает в себя смесительную камеру, соединенную с ячейкой для тангенциальной фильтрации (TFF, фильтрование тангенциальным потоком). TFF-ячейка очищает жидкую дисперсию микрочастиц в асептических условиях. Жидкость закачивается асептически из смесительной камеры через TFF. Материал, остающийся в TFF (ретентат), рециркулируется через смесительную камеру и TFF-ячейку до тех пор, пока не будет очищен. Процесс очистки осуществляется в асептических условиях в одном аппарате без удаления микрочастиц в TFF-ретентате.
Другие описывают процесс получения частиц нуклеиновых кислот с липосомами с помощью специальных методов для комбинирования липидов и нуклеиновых кислот. Hirota et al., 1999, BioTechniques 27: 286-89, показывает, что липосомы, покрытые молекулами нуклеиновых кислот, образуются спонтанно, когда катионные липиды в этаноле вводят в водный раствор нуклеиновой кислоты. Maurer et al., 2001, Biophysical J, 80: 2310-26 и Maurer et al. US 7094423 описывают способ инкапсуляции молекулы нуклеиновых кислот в липосомы. Этот метод включает использование предварительно полученных липосом, содержащих катионный липид. Липосомы дестабилизируются добавлением этанола к водному раствору. Молекулы нуклеиновых кислот добавляются к дестабилизированному липиду. После удаления этанола липосома инкапсулирует нуклеиновую кислоту по мере того, как происходит риформинг. Альтернативный метод для инкапсуляции нуклеиновых кислот в липосомы демонстрируется в Semple et al., 2001, Biophys Biochem Acta 1510: 152-66 и Semple et al. US 6858225. Этот способ повышает эффективность инкапсуляции посредством использования ионизируемого катионного липида для образования липосом. Этанольный раствор липидов комбинируется с нуклеиновыми кислотами в забуференном водном растворе при низком значении рН. Этанол затем удаляют при повышении рН до нейтрального значения. Оба способа требуют дополнительной обработки полученных липосом, потому что агрегация во время восстановления приводит к широкому разбросу по размерам.
MacLachlan et al. US 7901708 описывает способ и устройство для получения однородных по размеру липосом, которые инкапсулируют нуклеиновую кислоту. Поток РНК в водном буфере смешивается с потоком катионных липидов в этаноле при приблизительно равных скоростях потока в Т-образном соединении, в котором липидные везикулы образуются мгновенно при высокой концентрации этанола (45%). Концентрации растворителя и растворенных веществ поддерживаются постоянными в течение всего процесса смешивания. Не используются никакие статические смесители, в которых липосомы разбавляются. Стабильные липосомы с нуклеиновой кислотой стерилизуют в конце процесса, непосредственно перед стадией стерильного заполнения.
Способы, описанные выше, требуют значительных трудозатрат, чтобы минимизировать бактериальное загрязнение в процессе получения липосом, в том числе автоклавирования, промывания, и удовлетворения бремени нормативно-правового соответствия. Таким образом, остается неудовлетворенной потребность в способе инкапсуляции нуклеиновых кислот без необходимости в интенсивных механических стадий обработки для приготовления предварительно полученных липосом и без необходимости в стадии обработки для уменьшения размера частиц липидов с нуклеиновой кислоты, чтобы получать монодисперсных образцы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Одним объектом настоящего изобретения является система стерильного приготовления наночастиц липидов с нуклеиновой кислоты, включающая:
первый узел хранения органического липидного раствора, содержащего липиды в смешивающемся с водой органическом растворителе;
второй узел хранения водного раствора, содержащего терапевтическое лекарственное средство;
узел смешивания со статическим смесителем,
инжекционное средство для добавления органического раствора липидов в смесительную камеру;
третий узел хранения водного буфера;
узел разбавления;
концентрирующий узел, содержащий тангенциальный фильтр для концентрирования суспензии липосом и удаления органического растворителя; и
одноразовую подложку для сбора концентрированной суспензии липосом после удаления органического растворителя;
в которой узел смешивания содержит водный раствор лекарственного средства, и липидный раствор добавляется постепенно к раствору лекарственного средства в узле смешивания в течение по меньшей мере 5 минут с получением смеси липида и лекарственного средства, имеющей отношение липид: РНК не больше 12:1,
в которой смесь липида и лекарственного средства переносится в узел разбавления и разбавляется посредством добавления водного буфера;
и где система состоит из компонентов, которые являются стерилизуемыми и одноразовыми таким образом, чтобы быть адаптированными для одноразового использования. Система может дополнительно содержать узел приготовления органического раствора липидов, соединенный с первым узлом хранения. Система может дополнительно содержать фильтр для стерилизации органического раствора липидов в то время как указанный раствор переносится в первый узел хранения. Система может дополнительно содержать липидный раствор, раствор лекарственного средства, смесь липидов и лекарственного средства и суспензию, которые являются стерильными. Концентрирующий узел может содержать в себе диафрагменный дозировочный насос с насосной камерой одноразового использования. Липиды могут содержат катионный липид, вспомогательный липид, стерол, и конъюгат полиэтиленгликоль (РЕО)-липид, и дополнительно содержать нацеливающий липид. Терапевтическое лекарственное средство представляет собой молекулу дцРНК. Концентрация липидов и дцРНК в смеси состоит из липида: РНК с соотношением зарядов 2,5. Смешивающимся с водой органическим растворителем может быть этанол. Первый и второй растворы могут быть объединены при температуре от 35 до 40°С. Второй узел хранения может содержать терапевтическое лекарственное средство в водном буфере при рН от 3,5 до рН 4,5. Третий узел хранения может содержать водный буфер при нейтральном рН. Средний диаметр частицы липосомы, инкапсулирующей терапевтическое лекарственное средство, может составлять от 80 нм до 150 нм. Инжекционное средство содержит инжекционное отверстие, которое подает органический раствор к поверхности раздела воздух-вода водного раствора в узле смешивания или, альтернативно, инжекционное отверстие, которое погружено в водный раствор в узле смешивания и подает органический раствор туда. Система может дополнительно включать стадию лиофилизации. Стадия лиофилизации может включать стадию замораживания и стадию высушивания. Водный буфер может содержать сахарозу или трегалозу. Стадия замораживания может охлаждать смесь липидов и лекарственного средства на 1°С/минуту от 20 до -40°С.Стадия высушивания содержит стадию высушивания смеси липидов и лекарственного средства при температуре от около -15 до около -35°С.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 показывает одноразовую систему настоящего описания.
ПОДРОБНОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВАРИАНТОВ ВЫПОЛНЕНИЯ
Приведенное в настоящем изобретении описание относится к способу изготовления липид-инкапсулированных терапевтических молекул, включая отрицательно заряженные терапевтические полимеры, например, нуклеиновые кислоты, белки и пептиды. Приведенное в настоящем изобретении описание включает способ получения липид-инкапсулированных молекул нуклеиновых кислот. Способ особенно подходит для крупномасштабного производства частиц, состоящих из инкапсулированных в липосом терапевтических молекул. Способ обеспечивает неожиданный и удивительный результат, заключающийся в том, что полученные частицы являются монодисперсными (т.е. коэффициент полидисперсности менее 0,2 (PDI, ИПД), как определено в настоящем описании), узкое и равномерное распределение по размерам от 50 до 150 нм. Этот способ обеспечивает средство инкапсуляции посредством объединения липидов, солюбилизированных в смешивающемся с водой органическом растворителе, таком как этанол, с отрицательно заряженными терапевтическими полимерами, солюбилизированными в водном растворе, и удаления органического растворителя. Абсолютные и относительные концентрации липидов и отрицательно заряженных терапевтических полимеров являются достаточными для получения мелких частиц. Частицы, полученные способом, приведенным в описании, не требуют механической обработки, например, экструзии для получения монодисперсной популяции.
Способ в соответствии с настоящим описанием имеет преимущество по сравнению с предыдущими способами по простоте, с которой можно масштабировать до больших объемов и тем, что он малочувствителен к широкому диапазону температур, растворов, рН и времени обработки.
Способ в соответствии с настоящим описанием имеет преимущество по сравнению с предыдущими способами воспроизводимо производить однородную популяцию частиц без дополнительных стадий, требуемых для получения предварительно приготовленных везикул.
Способ в соответствии с настоящим описанием имеет преимущество по сравнению с предыдущими способами воспроизводимо производить однородную популяцию наночастиц без дополнительных стадий, требуемых для механического обработки частиц, образующихся при смешении липидов и отрицательно заряженных терапевтических полимеров. Эти дополнительные стадии включают в себя, например, обработку ультразвуком, гомогенизацию или экструзию, чтобы уменьшить их размер и достигнуть единообразия в терапевтически приемлемом диапазоне.
Способ в соответствии с настоящим описанием имеет преимущество достижения эффективности инкапсуляции нуклеиновой кислоты, равной или лучшей, чем предшествующие способы без дополнительных стадий обработки для получения наночастиц.
Другие преимущества способа в соответствии с настоящим описанием станут очевидными по мере того, как дополнительные детали будут обеспечиваться в приведенном в настоящем изобретении описании, касающегося липидных компонентов и условий.
Следующие сокращения используются в настоящем описании.
VF: продувочный фильтр
TG: датчик температуры
SUB: насадка одноразового использования
TFF: тангенциальный фильтр
РР: перистальтический насос
PG: манометр
Scale: средство измерения массы
Фиг. 1 показывает одноразовую систему, включающую в себя следующие элементы.
Липидный сток-раствор: этот сосуд содержит выбранные липиды в органическом, смешивающемся с водой растворителе. Этанол показан в качестве предпочтительного растворителя. Концентрация липидов может регулироваться для увеличения производительности. Сосуд состоит из одноразового мешка с TG и смесительных средств. Мешок имеет отверстия для добавления липидов в 96-100% этанол, VF, и выпускную трубку, которая контролируется с помощью клапана. Мешок находится в обогреваемом, многоразовом, электрически заземленном контейнере. Мешок имеет приспособление для добавления дополнительного этанола, чтобы разбавить липидный раствор до рабочей концентрации.
РР1: перистальтический насос 1. Он качает липидный сток-раствор из сосуда для липидного сток-раствора через фильтр 0,45/0,22 мкм в сосуд для отфильтрованного липидного сток-раствора.
Отфильтрованный липидный сток-раствор: этот сосуд содержит липиды при рабочей концентрации. Сосуд представляет собой одноразовый мешок со смесительными средствами и TG. Он имеет отверстия для ввода липидного сток-раствора в VF и выпускную трубку, которая регулируется с помощью клапана. Мешок расположен в обогреваемом, многоразовом, электрически заземленном контейнере со средством измерения массы.
Сток-раствор малой РНК: этот сосуд содержит выбранное лекарственное средство в водном буфере. миРНК является предпочтительным лекарственным средством, и цитратный буфер является предпочтительным буфером. Концентрация может регулироваться для увеличения производительности. Сосуд представляет собой одноразовый мешок со смесительными средствами. Мешок имеет отверстия для добавления растворенного вещества и растворителя, а также выпускную трубку, которая управляется посредством клапана. Мешок имеет приспособление для добавления дополнительного буфера для разбавления раствора РНК до рабочей концентрации.
РР2: перистальтический насос 2. Он качает сток-раствор миРНК из сосуда для миРНК через фильтр 0,45/0,22 мкм в сосуд для отфильтрованной миРНК.
Сток-раствор отфильтрованной миРНК: этот сосуд содержит миРНК в рабочей концентрации. Этот элемент содержит средство измерения массы. Сосуд представляет собой одноразовый мешок, расположенный в многоразовом контейнере. Он имеет отверстие(я) для сток-раствора миРНК и выпускной трубки, которая управляется с помощью клапана. Мешок расположен в многоразовом контейнере со средством измерения массы.
РР3: перистальтический насос 3 для передачи отфильтрованного липидного сток-раствора в сосуд с надписью Липосомальная миРНК в 35% этаноле. Он оборудован PG (PG1).
РР4: перистальтический насос 4 для передачи отфильтрованного сток-раствора миРНК в сосуд липосомальной миРНК в 35%-ном этаноле. Он также оборудован PG (PG2).
Липосомальная миРНК в 35% этаноле: этот сосуд содержит смесь липосом и лекарственного средства в 35%-ном этаноле. Этот узел содержит VF и TG. Отверстия для отфильтрованного сток-раствора липидов и миРНК отделены от выпускной трубки, которая контролируется с помощью клапана. Предпочтительный узел представляет собой одноразовый мешок, расположенный в многоразовой таре.
Фосфатный буфер: этот сосуд содержит буфер (предпочтительно фосфатный буфер), смесительные средства и средство измерения массы. Это большой сосуд с открывающейся крышкой, и выпускной трубкой с клапаном.
Отфильтрованный фосфатный буфер: этот сосуд соединен с сосудом для фосфатного буфера трубкой с фильтром 0,45/0,22 мкм и перистальтическим насосом. Он имеет средство смешивания и выпускную трубку с клапаном, ведущей к трубке через РР5 к сосуду с Липосомальной миРНК в 10%-ном этаноле и сосуду TFF SUB. Сосуд представляет собой многократно используемый контейнер, выстеленный одноразовым покрытием.
РР5: он качает отфильтрованный фосфатный буфер из сосуда для отфильтрованного фосфатного буфера в сосуд для липосомальной миРНК в 35%-ном этаноле и к сосуду TFF SUB. РР5 соединен с PG (PG4).
Липосомальная миРНК в 10% этаноле: этот сосуд содержит смесь липосом и лекарственного средства в 10%-ном этаноле после разбавления липосом и лекарственного средства в 35%-ном этаноле буфере в сосуде для отфильтрованного фосфатного буфера. Сосуд представляет собой многократно используемый контейнер, выстеленный одноразовым покрытием, с входом для раствора липосомальной миРНК, VF, со средством измерения массы и выпускным отверстием с клапаном, ведущим к сосуду TFF SUB.
РР6: он качает липосомы и лекарственное средство в 10% этаноле из сосуда для липосомальной миРНК в 10% этаноле через фильтр 0,45/0,22 мкм в сосуд TFF SUB.
TFF SUB: это сосуд содержит порты ввода для липосом и лекарственного средства в 10%-ном этаноле из сосуда для липосомной миРНК в 10%-ном этаноле, для буфера из сосуда для отфильтрованного фосфатного буфера и для ретентата из узла TFF, каждый с клапаном. Он также содержит VF и выпускное отверстие с его клапаном.
Дозировочный насос с одноразовым выходным патрубком насоса: этот насос высокого давления соединен с двумя PG (PG 3 и PG 4). Он передает липосомы и лекарственное средство от TFF SUB к узлу TFF.
TFF: данный узел идентифицируется как пара прямоугольников с диагональной линией. Во время работы этанольный раствор липосомы/лекарственное средство проходит через узел TFF для удаления этанола. Этанол, удаленный с помощью узла TFF, выходит из системы. Может работать параллельно более одного TFF, соединенных посредством вентилей. Раствор, не пропущенный мембраной (ретентат), выходит из TFF, рециркулирует к TFF SUB и возвращается через узел TFF, так как необходимо удалить весь этанол. Манометр (PG 4) контролирует давление ретентата. Газообразный азот, хранящийся в танке N2, используется для усиления дозирующего насоса, так как это необходимо для создания противодавления, и в конечном итоге облегчает передачу TFF-ретентата к первому 10 л SUB сосуду.
10 л SUB: это одноразовый сосуд, снабженный средством измерения массы. При необходимости SUS включают серию из трех 10 л SUB сосудов. TFF-ретентат прокачивают через 0,45/0,22 мкм фильтр для снижения общего количества микробов и для того, чтобы убедиться, что продукт полностью свободен от микробной контаминации в результате микробного загрязнения, которое может произойти при процессинге потока. Если вся технологическая линия действительно асептическая, то возможно опустить последние стадии фильтрации. Полученный TFF-ретентат упаковывается в процессе асептического розлива.
Асептический розлив: Эта стадия предшествует лиофилизации, которая выполняется как отдельный процесс с использованием различного оборудования. Стадия асептического заполнения до лиофилизации может включать добавление вещества-носителя, например, маннозы, глюкозы или других материалов для обеспечения объема или для стабилизации РНК в процессе стадии лиофилизации.
Система обеспечивает возможность ручной регулировки движением материалов через каждую стадию. Все детали, контактирующие с липидами, лекарственны средством, растворителями и буферами, являются одноразовыми и заменяемыми. Система показана для партии 10 л, и является масштабируемой до более чем 1000 л. Компоненты предназначены для использования один раз для партии липосома/лекарственное средство.
Способы для выполнения процесса производства представляют собой последовательность стадий, как показано в схеме (Фиг. 1) следующим образом.
Сток-растворы липидов и лекарственного средства получают По-отдельности в сосудах для сток-растворов липидов и миРНК. Сток-растворы могут быть получены при высокой концентрации. Смешивание происходит посредством перемешивания в сосудах для сток-растворов. Температуру липидного сток-раствора можно подогнать к заданной температуре. Сосуд, используемый для приготовления липидного сток-раствора, выбирается так, чтобы иметь минимальное количество испаряющегося вещества, если используется чистый органический растворитель при повышенной температуре.
Сток-растворы По-отдельности прокачивают через фильтр 0,45/0,22 мкм в сосуд для отфильтрованного липидного сток-раствора и в сосуд для отфильтрованного сток-раствора миРНК. Сток-растворы могут быть объединены с большим количеством растворителя, чтобы разбавить сток-раствор до или во время передачи в сосуды для отфильтрованных сток-растворов.
Таким же образом водный буфер получают в сосуде для фосфатного буфера, и проводят стерилизующую фильтрацию посредством прокачки в сосуд для отфильтрованного фосфатного буфера.
Отфильтрованный раствор миРНК перекачивается в сосуд для липосомальной миРНК в 35%-ном этаноле.
Липиды в органическом растворителе закачивают в водный раствор миРНК в сосуд для липосомальной миРНК в 35%-ном этаноле со скоростью, эффективной для образования частиц липиды-лекарственное средство в конечной концентрации 35% этанола при контролируемой заданной температуры при перемешивании водного раствора.
Добавление липида можно осуществлять через одно входное отверстие или несколько входных отверстий, через иглу или набор игл. Это может быть осуществлено сверху на поверхность водного раствора, или может вводиться в водный раствор ниже поверхности. Посредством введения или смешивания концентрация этанола раствора в сосуде для липосомальной миРНК в 35%-ном этаноле увеличивается до 30%, до 40%, предпочтительно до 35%. Увеличение происходит постепенно, образуя градиент от начального (предпочтительно 0%) до конечного (предпочтительно 35%) значения. Этот градиент может длиться от 1 минуты до 60 минут или дольше.
Как только раствор в сосуде для липосомной миРНК в 35%-ном этаноле достигает конечной концентрации этанола (предпочтительно 35%), раствор закачивается из сосуда для липосомной миРНК в 35%-ном этаноле и смешивается в линии с буфером, отдельно перекачиваемом из сосуда с отфильтрованным фосфатным буфером таким образом, чтобы разбавить смесь, в смешивающимся с водой спирте, предпочтительно от 10% до 20% этанола, наиболее предпочтительно 10% этанола, и передается в сосуд для липосомальной миРНК в 10%-ном этаноле.
10%-ный раствор этанола подвергается диафильтрации против водного буфера для удаления этанола.
TFF-Ретентат (0% этанола, 100% водный буфер) хранится в первом 10 л SUB.
TFF-Ретентат может быть при необходимости отфильтрован, чтобы уменьшить общее количество микробов для асептического розлива.
Асептический розлив включает стадию лиофилизации. Стадия лиофилизации отделена от процесса генерирования стерильного TFF-ретентата на стадии 10. То есть, эта стадия предпочтительно осуществляется в месте, отличном от SUS-узла, обеспечивающего TFF-ретентат. Углеводы, такие как сахароза или глюкоза, возможно добавлять до лиофилизации для стабилизации наночастиц и/или для добавления объема.
Липидная смесь, используемая в способе настоящего описания, содержит по меньшей мере положительно заряженный липид (катионный липид) в комплексе с отрицательно заряженными терапевтическими полимерами и липидным конъюгатом, содержащим полиэтиленгликоль (PEG-липид) для предотвращения агрегации. Катионный липид может иметь постоянный катионный заряд в широком диапазоне значений рН, может быть ионизируемым катионным липидом, который является заряженным при низком рН (менее чем рН 6) и без суммарного заряда при нейтральном рН (рН от 6,5 до 8), или комбинацией постоянно заряженных и ионизируемых катионных липидов. Липидная смесь может также содержать нацеливающий липид, полимер, стероид, фосфолипид или члена другой липидной группы, включающей жир, воск, жирорастворимый витамин, моноглицерид или диглицерид, жирные ацилы, глицеролипиды, глицерофосфолипиды, сфинголипиды, сахаролипиды и поликетиды. Этот способ также может быть использован для формирования липосом только с нейтральными или отрицательно заряженными компонентами.
Предпочтительно компоненты липидной смеси могут быть выбраны из следующих групп.
Катионный липид
В рамках настоящего описания раскрываются катионные липиды формулы I
в которых
Z = алкильный линкер, С2-С4алкил
Y = алкильный линкер, C1-С6алкил
R1 и R2 представляют собой каждый независимо, С10-С30алкил, С10-С30алкенил, или С10-С30алкинил, С10-С30алкил, С10-С20алкил, С12-С18алкил, С13-С17алкил, С13алкил, С10-С30алкенил, С10-С20алкенил. С12-С18алкенил, С13-С17алкенил, С17алкенил; R3 и R4 представляют собой каждый независимо, водород, C1-С6алкил, или -СН2СН2ОН, C1-С6алкил, C1-С3алкил; n равно 1-6; и X представляет собой противоион, включая любой азотный противоион, как этот термин легко понимается в данной области техники. Предпочтительные азотные противоионы включают галогены, с особенно предпочтительными хлоридом и бромидом. Другим предпочтительным противоионом является мезилат (-SO3CH3).
Примеры соединений формулы I включают:
и
и
Другие катионные липиды, заряженные при физиологическом значении рН, включают, но не ограничиваются этим, N,N-диолеил-N,N-диметиламмоний хлорид ("DODAC"); N-(2,3-диолеилокси)пропил)-N,N,N-триметиламмоний хлорид ("DOTMA"); N,N-дистеарил-N,N-диметиламмоний бромид ("DDAB"); N-(2,3-диолеилокси)пропил)-N,N,N-триметиламмоний хлорид ("DOTAP"); N-(1,2-димиристилоксипроп-3-ил)-N,N-диметил-N-гидроксиэтиламмоний бромид ("DMRIE»), 3β-(N-(N',N'-диметиламиноэтан)карбамоил)холестерин ("DC-Chol"), диоктадециламидоглицил карбоксиспермидин («DOGS»); и N-(L-(2,3-диолеилокси)пропил)-N-(2-(сперминкарбоксиамидо)этил)-N,N-диметиламмоний трифторацетат ("DOSPA»).
Ионизируемые катионные липиды
В рамках настоящего изобретения раскрываются ионизируемые катионные липиды формулы II
в которых
Z = алкильный линкер, С2-С4алкил, -CH2SCH2CH2-,
Y = алкильный линкер, C1-С6алкил,
R1 и R2 каждый независимо представляют собой С10-С30алкил, С10-С30алкенил, или С10-С30алкинил, С10-С30алкил, С10-С20алкил, С12-С18алкил, С13-С17алкил, С13алкил, С10-С30алкенил, С10-С20алкенил, С12-С18алкенил, С13-С17алкенил, С17алкенил; R3 и R4, каждый независимо представляют собой водород, C1-С6алкил, или -СН2СН2ОН, C1-С6алкил, C1-С3алкил.
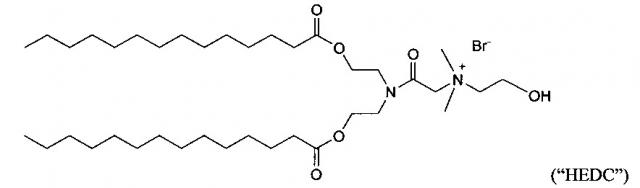
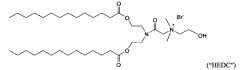
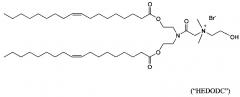
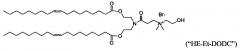
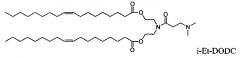
Некоторые положительно заряженные липиды имеют pKa равным или около физиологического рН и являются катионными в мягких кислых условиях и слабо катионным при физиологическом значении рН. Такие ионизируемые катионные липиды включают, но не ограничиваются этим, ((2-((2-(диметиламино)этил)тио)ацетил)азанедиил) бис(этан-2,1-диил)дитетрадеканоат ("S104"), (Z)-((3-(диметиламино)пропаноил)азанедиил) бис(этан-2,1-диил)диолеат («i-Et-DODC»), N-(2,3-диолеилокси) пропил) N,N-диметиламмоний хлорид ("DODMA") и 1,2-диолеоил-3-диметиламмоний-пропан («DODAP»).
Признается, что ионизируемые липиды могут способствовать связыванию и/или высвобождению активного фармацевтического ингредиента (API), как показано ниже.
Нейтральные липиды
Примеры нейтральных липидов включают, но не ограничиваются этим, фосфолипиды, аминолипиды и сфинголипиды. Нейтральные липиды включают амфипатические липиды. Типичные примеры фосфолипидов включают, но не ограничиваются этим, фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозит, фосфатидная кислота, пальмитоилолеоилфосфатидилхолин, лизофосфатидилхолин, лизофосфатидилэтаноламин, дипальмитоилфосфатидилхолин, диолеоилфосфатидилхолин, дистеароилфосфатидилхолин или дилинолеоилфосфатидилхолин. Другие соединения, несодержащие фосфора, такие как сфинголипиды, семейство гликосфинголипидов, диацилглицериды и 3-ацилоксикислоты, также находятся в группе, обозначенной как амфипатические липиды. Кроме того, амфипатический липид, описанный выше, можно смешивать с другими липидами, включая триглицериды и стеролы.
PEG-липиды
Компонентом, стабилизирующим бислой, является полиэтиленгликоль ("PEG"), конъюгированный с полярной головкой липида, например, фосфатидилэтаноламина. Другой компонент, стабилизирующий бислой, представляет собой PEG, конъюгированный с церамидом. PEG может быть конъюгирован с фосфатидилэтаноламином или, альтернативно, с церамидом с использованием стандартных реакций сочетания, известных и используемых специалистам в данной области техники. Кроме того, являются коммерчески доступными предварительно полученные конъюгаты PEG-фосфатидилэтаноламин («PEG-РЕ»).
ПЭГи различной молекулярной массы могут быть использованы для формирования компонентов, стабилизирующих бислой в соответствии с настоящим изобретением. ПЭГи различной молекулярной массы коммерчески доступны из нескольких различных источников или, альтернативно, они могут быть синтезированы с использованием стандартных методов полимеризации, хорошо известных специалистам в данной области техники. В предпочтительном в настоящее время варианте полиэтиленгликоль имеет молекулярную массу в диапазоне от 200 до 10000 Да, предпочтительно от 500 до 4000 Да и наиболее предпочтительно от 1000 до 2000 Да. В общем, было обнаружено, что увеличение молекулярной массы PEG снижает концентрацию компонента, стабилизирующего бислой, необходимую для достижения стабилизации.
Фосфатидилэтаноламин, имеющий различные жирнокислотные группы с различной длиной цепи и степенью насыщенности, может быть конъюгирован с PEG с образованием компонента, стабилизирующего бислой. Такие фосфатидилэтаноламины являются коммерчески доступными, или могут быть изолированы или синтезированы с использованием традиционных методов, известных специалистам в данной области техники. Предпочтительными являются фосфатидилэтаноламины, содержащие насыщенные или ненасыщенные жирные кислоты с длиной углеродной цепи в интервале от С10 до С20. Фосфатидилэтаноламины с моно- или диненасыщенными жирными кислотами и смеси насыщенных и ненасыщенных жирных кислот также могут быть использованы. Подходящие фосфатидилэтаноламины включают, но не ограничиваются этим, следующие: димиристоилфосфатидилэтаноламин (DMPE), дипальмитоилфосфатидилэтаноламин (DPPE), диолеоилфосфатидилэтаноламин (DOPE) и дистеароилфосфатидилэтаноламин (DSPE).
Приведенные выше композиции могут также включать PEG-конъюгированные липиды, которые известны в данной области техники, как таковые, включая PEG-фосфолипиды и PEG-церамиды, в том числе одну или несколько молекул, выбранных из следующих: PEG2000-DSPE, PEG2000-DPPE, PEG2000-DMPE, PEG2000-DOPE, PEG1000-DSPE, PEG1000-DPPE, PEG1000-DMPE, PEG1000-DOPE, PEG550-DSPE, PEG550-DPPE, PEG-550DMPE, PEG-1000DOPE, PEG-холестерин, РЕО2000-церамиды, PEG1000-церамиды, PEG750-церамиды и PEG550-церамиды.
Кроме того, композиции могут также включать монодисперсные (md) PEG-липиды, с общей формулой mdPEG-линкер-липид, с примерами включающими, но не ограничиваясь этим, 83-гидрокси-3,6,9,12,15,18,21,24,27,30,33,36,39,42,45,48,51,54,57,60,63,66,69,72,75,78,81-гептакозаоксатриоктаконтил (2,3-бис(тетрадецилокси)пропил)карбамат ("HO-PEG1251-cBTP") и 134-гидрокси-3,6,9,12,15,18,21,24,27,30,33,36,39,42,45,48,51,54,57,60,63,66,69,72,75,78,81,84,87,90,93,96,99,102,105,108,111,114,117,120,123,126,129,132-тетратетраконтаоксатетратриаконтагектил (2,3-бис(тетрадецилокси)пропил)карбамат ("HO-PEG2000-cBTP") в качестве примеров.
Стероиды
Стероиды включают холестаны (например, холестерин), холаны и желчные кислоты (например, хенодезоксихолат и холат), эргостерол, ланостерин, кортикостероиды (например, глюкокортикоиды), прегнан (например, прогестерон), и фитостеролы. Они могут быть включены также в виде конъюгата с гидрофильным остатком, например полиэтиленгликолем. Предпочтительным стероидом является холестерин.
Нацеливающий липид
Пример нацеливающего липида представляет собой соединение формулы (А),
в котором липид (L) выбирается из группы, состоящей из DSPE, DOPE и DC; линкер (X) выбирается из группы, состоящей из отсутствия линкера, PEG550, PEG2000, PEG-глутамат (-Glu), Glu, С6, глицина и GluNH, N1,N19-бис(3-(2-(2-(3-аминопропокси)этокси)этокси)пропил)-4,7,10,13,16-пентаоксанонадекан-1,19-диамида; и ретиноид (R) выбирается из группы, состоящей из третиноина, адапалена, ретинола, 4-гидрокси(фенил)ретинамида (4-HPR), ретиноевой кислоты (витамина А), 9-(2,6,6-триметилциклогекс-1-ен-1-ил)нонановой кислоты, 3,7-диметил-9-(2,6,6-триметилциклогекс-1-ен-1-ил)нонановой кислоты, 3,7-диметил-9-(2,2,6-триметилциклогексил)нонановой кислоты, и любого частично или полностью насыщенного ретиноида или его производного.
Другой пример нацеливающего липида представляет собой соединение формулы (В),
в котором линкер (X) представляет собой N1,N19-бис(3-(2-(2-(3-аминопропокси)этокси)этокси)пропил)-4,7,10,13,16-пентаоксанонадекан-1,19-диамид ("бисамидо-PEG") или N1,N19-бис(16,20-диамино-15-оксо-4,7,10-триакса-14-азаикозил)-4,7,10,13,16-пентаоксанонадекан-1,19-диамид ("lys-бисамидо-PEG-lys"); и ретиноид (R) выбирается из группы, состоящей из третиноина, адапалена, ретинола, 4-гидрокси(фенил) ретинамида (4-HPR) и ретиноевой кислоты (витамина А), 9-(2,6,6-триметилциклогекс-1-ен-1-ил)нонановой кислоты, 3,7-диметил-9-(2,6,6-триметилциклогекс-1-ен-1-ил) нонановой кислоты, 3,7-диметил-9-(2,2,6-триметилциклогексил)нонановой кислоты, и любого частично или полностью насыщенного ретиноида или его производного.
Другие нацеливающие молекулы могут быть включены в липидную смесь, например, фолиевая кислота, витамин Е, пептидные лиганды и/или моноклональные антитела.
Композиции РНК-липидные частицы и составы
Настоящее описание включает композиции, содержащие липидную частицу с и без активного агента, в которой активный агент, если присутствует, ассоциирован с липидной частицей. В конкретных вариантах выполнения активный агент представляет собой терапевтический агент. В конкретных вариантах выполнения активный агент инкапсулирован в водном внутреннем пространстве липидной частицы. В других вариантах выполнения активный агент присутствует в одном или нескольких липидных слоях в липидной частице. В других вариантах выполнения активный агент связывается с внешней или внутренней липидной поверхностью липидной частицы.
В некоторых вариантах выполнения липидные частицы в соответствии с настоящим изобретением ассоциированы с нуклеиновой кислотой, что приводит к частице нуклеиновая кислота-липид. В конкретных вариантах выполнения нуклеиновая кислота полностью инкапсулирована в липидную частицу. Как используется в настоящем описании, термин "нуклеиновая кислота" означает включение любого олигонуклеотида или полинуклеотида. Фрагменты, содержащие до 50 нуклеотидов, обычно называются олигонуклеотидами, а более длинные фрагменты называются полинуклеотидами. В конкретных вариантах выполнения олигонуклеотиды в соответствии с настоящим изобретением имеют 15-50 нуклеотидов в длину.
Термины «полинуклеотид» и «олигонуклеотид» относятся к полимеру или олигомеру нуклеотидных или нуклеозидных мономеров, состоящих из природных оснований, сахаров и межсахаридных (остов) связях. Термины «полинуклеотид» и «олигонуклеотид» также включает полимеры или олигомеры, содержащие неприродные мономеры или их части, которые функционируют аналогичным образом. Такие модифицированные или замещенные олигонуклеотиды часто предпочтительнее, чем нативные формы из-за таких свойств, как, например, усиленное клеточное поглощение и повышенная стабильность в присутствии нуклеаз.
Олигонуклеотиды могут быть как олигодезоксирибонуклеотиды, так и олигорибонуклеотиды. Олигодезоксирибонуклеотид состоит из дезоксирибозы, соединенной ковалентно с фосфатом при 5'- и 3'-атомах углерода этого сахара с образованием неразветвленного полимера с регулярным чередованием мономерных единиц. Олигорибонуклеотид состоит из подобной повторяющейся структуры, где каждый нуклеотид имеет рибозную сахарную групп