Селективные антибактериальные агенты, представляющие собой 3-(азол-1-ил)-6-аминозамещенные 1,2,4,5-тетразины
Иллюстрации
Показать всеИзобретение относится к 3-(азол-1-ил)-6-аминозамещенным 1,2,4,5-тетразинам формулы:
где Het = имидазол-1-ил, NHR = аллиламино (Ia); Het = 4-метилимидазол-1-ил, NHR = аллиламино (Ib); Het = бензимидазол-1-ил, NHR = аллиламино (Ic); Het = индазол-1-ил, NHR = аллиламино (Id); Het = имидазол-1-ил, NHR = пропаргиламино (Ie); Het = 4-метилимидазол-1-ил, NHR = пропаргиламино (If); Het = бензимидазол-1-ил, NHR = пропаргиламино (Ig); Het = индазол-1-ил, NHR = пропаргиламино (Ih). Также изобретение относится к антибактериальным агентам. Технический результат: получены новые соединения формулы I, активные в отношении грамотрицательных бактерий Neisseria gonorrhoeae и клинически значимых патогенных и условно-патогенных микроорганизмов. 2 н.п. ф-лы, 2 табл., 8 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к фармацевтической химии и касается дизамещенных производных 1,2,4,5-тетразина, содержащих в 3 положении тетразинового цикла азолильные заместители, такие как имидазол-1-ил, 4-метилимидазол-1-ил, индазол-1-ил и бензимидазол-1-ил, а в 6-м положении пропаргиламино- или аллиламиногруппы. Указанные соединения могут быть использованы в качестве антибактериальных средств и, в первую очередь, для лечения больных гонококковой инфекцией.
Уровень техники
Мировая тенденция борьбы с гонококковой инфекцией складывается так, что к настоящему времени, по данным мониторинга резистентности гонококка к разным антибиотикам, целые группы антибактериальных препаратов (АБП) больше не могут быть рекомендованы для лечения, в том числе фторхинолоны, пенициллин, макролиды. Не обнадеживают и результаты, опубликованные в обзоре шведских и словенских ученых [М Unemo, D Golparian, , S Jeverica / Treatment failure of pharyngeal gonorrhoea with internationally recommended first-line ceftriaxone verified in Slovenia, September 2011 // Euro Surveill. 2012, 25, 17], согласно которым в Канаде, Франции, Японии, Норвегии, Словении, Южной Африке, Швеции, Великобритании и Северной Ирландии зафиксированы случаи неэффективности в лечении гонококковой инфекции препаратов «последней надежды» - III поколения антибиотиков цефалоспоринов. В недавно опубликованном исследовании китайских ученых резистентность к широко используемому в последнее время во врачебной практике цефтриаксону в Китае составляет уже более 4,4% [Shao-Chun Chen, Yue-Ping Yin, Xiu-Qin Dai, Magnus Unemo, Xiang-Sheng Chen / First nationwide study regarding ceftriaxone resistance and molecular epidemiology of Neisseria gonorrhoeae in China // J. Antimicrob. Chemother. 2016; 71: 92-99]. Почти такой же уровень резистентности (3.2%) к цефтриаксону наблюдается и в Японии, причем даже при увеличении в 4 раза лечебной дозы препарата [Shin Ito, Milsuru Yasuda, Kyoko Hatazaki, Kosuke Mizutani, Tomohiro Tsuchiya, Shigeaki Yokoi, Masahiro Nakano and Takashi Deguchi / Microbiological efficacy and tolerability of a single-dose regimen of 1 g of ceftriaxone in men with gonococcal urethritis // J. Antimicrob. Chemother. 2016, 71, 9, 2559-2562]. He лучшим образом дела обстоят и в России. В настоящий момент, согласно данным о профиле резистентности гонококка, в Российской Федерации наблюдаются однонаправленные тенденции роста устойчивости к пенициллинам, тетрациклинам, фторхинолонам, азитромицину. Данные исследователей и ВОЗ говорят о грядущей эпидемии гонококковой инфекции. Поэтому преодоление проблем в дерматовенерологии, урологии, акушерстве и гинекологии в связи с появлением множественной лекарственной устойчивости, является задачей первостепенной важности. К настоящему времени в мире активно используют при лечении гонококковой инфекции не более 4-5 антибиотиков цефалоспоринов, в том числе самый активный - цефтриаксон. В России, в схемах лечения больных гонококковой инфекцией, основными лекарственными препаратами являются цефтриаксон, цефиксим, цефотаксим и спектиномицин [Федеральные клинические рекомендации. Дерматовенерология 2015: Болезни кожи. Инфекции, передаваемые половым путем, 5-е изд., перераб. и доп. М.: Деловой экспресс, 2016, с. 674]. Все они действуют, угнетая синтез клеточной стенки микроорганизмов, и при этом обладают целым рядом побочных действий для пациента, таких как нарушение функции почек, дисбактериоз, лейкоцитоз, лимфопения, нейтропения, тромбоцитопения, анафилактический шок, бронхоспазм и др. Очевидно, что нужны новые подходы и поиск новых мишеней для лекарств следующего поколения. И еще один аспект данной проблемы: по данным ВОЗ за последние 30 лет не было открыто ни одного нового класса антибактериальных препаратов, и если даже разработки начнутся сегодня, лекарство появится не раньше чем через 15 лет.
Таким образом, актуальность поиска новых антибактериальных средств, в том числе и против бактерий Neisseria gonorrhoeae, не вызывает никаких сомнений.
Раскрываемые в настоящем изобретении соединения являются новыми, не описанными ранее производными [1, 2, 4, 5]тетразинов, представляют собой вещества общей формулы I
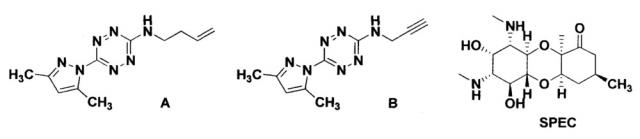
где Het = имидазол-1-ил; 4-метилимидазол-1-ил; бензимидазол-1-ил; индазол-1-ил; NHR = аллиламино, пропаргиламино. Заявляемые в качестве селективных антибактериальных средств соединения могут быть получены по известному способу, описанному [ЖОрХ, 2006, 42 (5), с. 757], но их активность в отношении бактерий Neisseria gonorrhoeae неизвестна и не описана. Аналогами заявляемых соединений по строению является 3-аллиламино-6-(3,5-диметилпиразол)-1,2,4,5-тетразин формулы (A) и 3-(3,5-диметилпиразол)-6-пропаргиламино-1,2,4,5-тетразин формулы (B), синтез которых описан [ЖОрХ, 1999, 35 (9), с. 1391; И.Н. Ганебных. Диссерт. на соиск. степени канд. хим. наук. Екатеринбург, 2003, с. 45]
Аналог по назначению - спектиномицин (SPEC) используется в медицинской практике для лечения острого гонококкового уретрита и простатита у мужчин, острого гонококкового цервицита и проктита у женщин, вызванных чувствительными штаммами Neisseria gonorrhoeae, при непереносимости или неэффективности бета-лактамных антибиотиков.
Недостатками этого препарата являются его высокая токсичность и различные побочные эффекты при применении. Уже после однократного введения у пациентов наблюдается тошнота, головная боль, головокружение, бессонница, уменьшение диуреза, лихорадка, озноб, кожные высыпания, при курсовом применении фиксируется снижение уровня гемоглобина, повышение уровня печеночных трансаминаз, мочевины в крови и т.д. [М.Д. Машковский, Лекарственные средства, 15-е изд., перераб., испр. и доп. - М.: РИА «Новая волна»: издатель Умеренков, 2007, с. 821].
Новые соединения, раскрываемые в настоящем изобретении, отличаются от известных и близких по структуре соединений A и B тем, что заместитель 3,5-диметилпиразол-1-ил в 3-м положении 1,2,4,5-тетразина заменен на имидазол-1-ил, 4-метилимидазол-1-ил, бензимидазол-1-ил и индазол-1-ил. Структуры представленных в изобретении новых соединений подтверждаются данными спектроскопии ЯМР 1H, 13C (спектрометр Avance DRX-400 (Bruker) с рабочей частотой 400 МГц) и элементного анализа (автоматический анализатор CHN PE 2400 сер. II (Perkin Elmer)).
Общая методика получения 3-(азол-1-ил)-6-аллиламино- и 3-(азол-1-ил)-6-пропаргиламино-1,2,4,5-тетразинов
В плоскодонную колбу с 20 мл ацетонитрила вносят 1.0 ммоль 3,6-ди-(азол-1-ил)-1,2,4,5-тетразина и добавляют 1.1 ммоль аллиламина или пропаргиламина. Реакционную массу выдерживают при перемешивании на магнитной мешалке в течение 30 минут (контроль ТСХ, элюент бензол-ацетонитрил 1:1). Растворитель отгоняют на роторном испарителе, закристаллизовавшийся остаток перекристаллизовывают из ацетонитрила. Выход 58-92%.
Примеры конкретного выполнения
Пример 1
3-Аллиламино-6-(имидазол-1-ил)-1,2,4,5-тетразин (Ia)
В плоскодонную колбу с 20 мл ацетонитрила вносят 214 мг (1.0 ммоль) 3,6-ди(имидазол-1-ил)-1,2,4,5-тетразина и при перемешивании добавляют 63 мг (1.1 ммоль) аллиламина. Реакционную массу выдерживают при перемешивании в течение 30 минут до исчезновения исходного тетразина (контроль ТСХ), растворитель отгоняют на роторном испарителе. Остаток перекристаллизовывают из ацетонитрила. Выход 185 мг (92%). Красные кристаллы, т. пл. 144-145°C. Найдено, %: C 47.59; Н 4.21; N 48.53. C8H9N7. Вычислено, %: C 47.29; H 4.46; N 48.25. Спектр ЯМР 1H (CDCl3, δ, м.д., J/Гц): 8.60, 8.00, 7.27 (все c, 3 H в имдазолиле); 6.25 (уш.с, 1Н, NH); 6.01 (м, 1 Н, ); 5.38 (д.к, 1 Н, в , J1=17.1, J2=1.2); 5.29 (д.к, 1 Н, в , J1=10.3, J2=1.2); 4.28 (т, 2 Н, , J=5.8). Спектр ЯМР 13C (CDCl3, δ, м.д.): 43.90, 115.60, 117.80, 131.13, 132.53, 134.68, 154.81, 162.46.
Пример 2
3-Аллиламино-6-(4-метилимидазол-1-ил)-1,2,4,5-тетразин (Ib)
Получают аналогично соединению Ia. Из 242 мг 3,6-ди-(4-метилимидазол-1-ил)-1,2,4,5-тетразина и 63 мг аллиламина получают 140 мг (65% от теор.) кристаллического вещества оранжевого цвета с т. пл. 135-137°C. Найдено, %: C 49.72; Н 4.81; N 45.09. C9H11N7. Вычислено, %: C 49.76; H 5.10; N 45.13. Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 8.51, 7.58 (все с, 2 Н в имидазолиле); 6.23 (уш.с, 1Н, NH); 6.00 (м, 1 Н, -СН=CН2-); 5.36 (д, 1 Н, , J=17.1); 5.27 (д, 1 Н, в , J1=10.3); 4.29 (т.т, 2 Н, , J1=5.8, J2=1.5). Спектр ЯМР 13C (CDCl3, δ, м.д.): 13.72, 43.87, 111.78, 117.69, 132.63, 133.98, 140.57, 154.68, 162.35.
Пример 3
3-Аллиламино-6-(бензимидазол-1-ил)-1,2,4,5-тетразин (Ic)
Получают аналогично соединению Ia. Из 314 мг 3,6-ди-(бензимидазол-1-ил)-1,2,4,5-тетразина и 63 мг аллиламина получают 200 мг (79%) кристаллического вещества красного цвета с т. пл. 205-206°C. Найдено, %: C 56.88; H 4.18; N 38.60. C12H11N7. Вычислено, %: C 56.91; Н 4.38; N 38.71. Спектр ЯМР 1H (CDCl3, δ, м.д., J/Гц): 9.02 (с, 1H при C7 бензимидазолила); 8.41 (д, 1Н при C2 бензимидазолила, J=7.3); 7.89 (д, 1Н при C5 бензимидазолила, J=7.1); 7.43 (м, 2Н при C3 и C4 индазолила, J=7.8); 6.04 (м, 2 Н, -NH-, -); 5.40 (дд, 1 Н, , J=17.1, J2=1.1); 5.31 (дд, 1 Н, в , J1=10.3, J2=1.2); 4.32 (тт, 2 Н, ,.J1=5.8, J2=1.5). Спектр ЯМР 13C (CDCl3, δ, м.д.): 43.91, 114.70. 117.78, 120.75, 124.23, 125.09, 131.04, 132.61. 139.77, 144.58, 156.44, 161.89.
Пример 4
3-Аллиламино-6-(индазол-1-ил)-1,2,4,5-тетразин (Id)
Получают аналогично соединению Ia. Из 314 мг 3,6-ди-(индазол-1-ил)-1,2,4,5-тетразина и 63 мг аллиламина получают 167 мг (66%) кристаллического вещества красного цвета с т. пл. 165-166°C. Найдено, %: C 56.75; Н 4.30; N 38.63. C12H11N7. Вычислено, %: C 56.91; Н 4.38; N 38.71. Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 8.51 (д, 1Н при C2 индазолила, J=8.6); 8.39 (с, 1Н при C6 индазолила); 7.84 (д, 1H при C5 индазолила. J=8.0); 7.58 (т, 1Н при С3 индазолила, J=7.8); 7.35 (т, 1Н при C4 индазолила, J=7.5); 6.04 (м, 1 Н, ); 5.89 (уш.с, 1H, NH); 5.34 (дд, 1 Н, , J1=17.1, J2=1.1); 5.27 (дд, 1 Н, в . J1=10.3, J2=1.1); 4.32 (т, 2 Н, , J=5.8). Спектр ЯМР 13C (CDCl3, δ, м.д.): 43.89, 114.18, 117.54, 121.26, 123.40, 126.07, 128.70, 132.89, 138.71, 139.35, 158.32, 161.53.
Пример 5
3-(имидазол-1-ил)-6-пропаргиламино-1,2,4,5-тетразин (Ie)
В плоскодонную колбу с 20 мл ацетонитрила вносят 214 мг (1.0 ммоль) 3,6-ди(имидазол-1-ил)-1,2,4,5-тетразина и при перемешивании добавляют 61 мг (1.1 ммоль) пропаргиламина. Реакционную массу выдерживают при перемешивании в течение 30 минут до исчезновения исходного тетразина (контроль ТСХ), растворитель отгоняют на роторном испарителе. Остаток перекристаллизовывают из ацетонитрила. Выход 149 мг (74%). Кристаллы красного цвета, т. пл. 208-211°C. Найдено, %: C 47.49; Н 3.50; N 48.68. C8H7N7. Вычислено, %: C 47.75; Н 3.51; N 48.74. Спектр ЯМР 1H (DMCO-d6, δ, м.д., J/Гц): 9.18 (т, 1Н, протон при тройной связи, J=5.90); 8.56 (с, 1Н при C2 имидазолила); 7.96, 7.23 (оба н/р дд, по 1Н при С4 и при C5 имидазолила); 4.26 (дд, 2 Н, в , J1=5.9, J2=2.4); 3.20 (т, 1 Н, , J=2.4). Спектр ЯМР 13C (DMCO-d6, δ, м.д.): 30.24, 73.50. 80.12, 116.15, 130.53, 134.66, 154.36, 161.98.
Пример 6
3-(4-метил-имидазол-1-ил)-6-пропаргиламино-1,2,4,5-тетразин-3-амин (If)
Получают аналогично соединению Iе. Из 242 мг 3,6-ди-(4-метилимидазол-1-ил)-1,2,4,5-тетразина и 61 мг пропаргиламина получают 181 мг (84% от теор.) кристаллического вещества оранжевого цвета с т. пл. 206-208°C. Найдено, %: C 50.09; Н 4.39; N 45.18. C9H9N7. Вычислено, %: C 50.22; Н 4.22; N 45.56. Спектр ЯМР 1H (DMCO-d6, δ, м.д., J/Гц): 9.12 (т, 1Н, протон при тройной связи, J=5.80); 8.43 (д, 1Н при C2 имидазолила); 7.66 (м, 1Н при С5 имидазолила); 4.26 (дд, 2 Н, в , J1=5.8, J2=2.4); 3.20 (т, 1 Н, , J=2.4). Спектр ЯМР 13C (DMCO-d6, δ, м.д.): 13.49, 30.23, 73.46, 80.18, 112.09, 133.92, 139.29, 154.19, 161.89.
Пример 7
3-(бензимидазол-1-ил)-6-пропаргиламино-1,2,4,5-тетразин-3-амин (Ig)
Получают аналогично соединению Ie. Из 314 мг 3,6-ди-(бензимидазол-1-ил)-1,2,4,5-тетразина и 61 мг пропаргиламина получают 200 мг (80%) кристаллического вещества оранжевого цвета с т. пл. 224-226°C. Найдено, %: C 57.22; Н 3.43; N 38.65. C12H9N7. Вычислено, %: C 57.36; Н 3.61; N 39.03. Спектр ЯМР 1H (DMCO-d6, δ, м.д., J/Гц): Спектр ЯМР 1Н (DMCO-d6, δ, м.д., J/Гц): 9.19 (т, 1Н, протон при тройной связи, J=5.80); 9.05 (с, 1Н при C2 бензимидазолила); 8.24, 7.84 (оба д, по 1H при C4 и при C7 бензимидазолила, J=8.1 и J=7.9, соответственно); 4.30 (дд, 2Н, в , J1=5.8, J2=2.4); 3.22 (т, 1 Н, , J=2.4). Спектр ЯМР 13C (DMCO-d6, δ, м.д.): 30.26, 73.51, 80.23, 114.21, 120.12, 123.66, 124.54, 130.96, 140.76, 144.00, 155.77, 161.45.
Пример 8
3-(индазол-1-ил)-6-пропаргиламино-1,2,4,5-тетразин (Ih)
Получают аналогично соединению Ie. Из 314 мг 3,6-ди-(бензимидазол-1-ил)-1,2,4,5-тетразина и 61 мг пропаргиламина получают 207 мг (83% от теор.) кристаллического вещества оранжевого цвета с т. пл. 231-232°C. Найдено, %: C 57.53; Н 3.72; N 38.78. C12H9N7. Вычислено, %: C 57.36; Н 3.61; N 39.03. Спектр ЯМР 1H (DMCO-d6, δ, м.д., J/Гц): 9.10 (т, 1Н, протон при тройной связи, J=5.80); 8.59 (с, 1Н при C3 индазолила); 8.30, 7.96 (оба д, по 1Н при C7 и при C4 индазолила, J=8.5 и J=8.0, соответственно); 7.62, 7.39 (оба т, по 1Н при C6 и при C5 индазолила, J=8.3 и J=7.8, соответственно) 4.31 (дд, 2Н, в , J1=5.8, J2=2.4); 3.23 (т, 1H, , J=2.4). Спектр ЯМР 13C (DMCO-d6, δ, м.д.): 30.27, 73.48, 80.34, 121.49, 123.07, 125.50, 128.39, 138.25, 138.75, 157.65, 161.07.
Изучение антибактериальной активности in vitro заявляемых соединений Ia-h
Антибактериальную активность химических соединений в отношении облигатного патогена N. gonorrhoeae определяют методом двукратных серийных разведений в агаре (золотой стандарт). В качестве ростовой среды используют питательную среду - гонококковый агар «Комплегон» (Россия). Разведения АБП в агаре проводят в 24 луночных планшетах, рабочий объем лунки 2 мл.
Для каждого химического соединения готовят не менее 12 точек с разведениями: 250 мкг/мл - 0,03 мкг/мл. Растворитель - ДМСО, разбавители дистиллированная стерильная вода (для инъекций), ростовая среда на агаровой основе. Посевная доза (конечная концентрация) инокулюма из суточной культуры N. gonorrhoeae - 105 КОЕ/мл. Инкубируют планшеты при условиях T=37°C, [CO2=5%]. Оценку результатов проводят через 18-24 часа. Критерии интерпретации результатов: новые химические соединения рассматриваются перспективными для дальнейшего изучения, если значения МИК in vitro для тест-штаммов не превышают 10-20 мкг/мл [Стандарт ГОСТ Р ИСО 20776-1-2010; Методические указания по изучению противомикробной активности фармакологических веществ. С. 265]. В исследованиях использовали эталонные штаммы:
Neisseria gonorrhoeae NCTC 12700 /ATCC 49226;
Neisseria gonorrhoeae NCTC8375/ATCC 19424.
А также 2 клинических штамма:
Neisseria gonorrhoeae: №1 - SpeS PenI Tetl AzmR (чувствительный к спектиномицину, с умеренной чувствительностью к пенициллину, умеренной чувствительностью к тетрациклину, резистентный к азитромицину)
Neisseria gonorrhoeae: №2 - SpeS PenI Tetl CipR (чувствительный к спектиномицину, с умеренной чувствительностью к пенициллину, умеренной чувствительностью к тетрациклину, резистентный к ципрофлоксацину)
В качестве аналога по действию для сравнения используют чистое химическое соединение (субстанцию) спектиномицин (Sigma-Aldrich, USA; Lot Number 102K05447V). Полученные результаты представлены в табл.1.
Дополнительно для всех заявляемых соединений Ia-h, были определены минимальные ингибирующие концентрации в отношении следующих эталонных штаммов клинически-значимых патогенных и условно-патогенных микроорганизмов из международных коллекций ATCC и Государственной коллекции патогенных микроорганизмов (ГКПМ, Россия):
Грамотрицательные палочки (энтеробактерии):
Escherichia coli ATCC 8739
Citrobacter braakii ATCC 101/57
Shigella flexneri 1a8516
Proteus vulgaris ГКПМ 160125 (222)
Serratia marcescens ATCC 13880
Klebsiella pneumoniae ATCC 13883
Неферментатирующие грамотрицательные палочки:
Pseudomonas aeruginosa ATCC 9027
Грамположительные кокки:
Staphylococcus aureus ATCC 25923
Антибактериальную активность химических соединений в отношении клинически-значимых патогенных и условно-патогенных микроорганизмов проводят методом последовательных микроразведений - референсным методом, регламентированным международным стандартом ISO 20776-1:2006. В Российской Федерации действует Национальный Стандарт ГОСТ P ИСО 20776-1-2010, идентичный международному стандарту: в стерильных 96-луночных планшетах готовят разведения препаратов в бульоне Мюллера-Хинтон (Mueller Hinton Broth (HiMedia, Индия). Готовят инокулюмы контрольных штаммов, в соответствии со стандартом 0,5 ЕД по МакФарланду (что соответствует 1,5×108 КОЕ/мл, затем разбавляют в 100 раз до концентрации 106 КОЕ/мл. В каждую лунку горизонтального ряда вносят по 50 мкл инокулюма соответствующего штамма (в т.ч. и в контрольную). Инкубация планшета в термостате при 37°C 18-24 часа. Учет результатов визуально или спектрофотометрически. Последняя лунка с задержкой роста (прозрачный бульон) соответствует минимальной ингибирующей концентрации (МИК) в отношении данного штамма.
Результаты скрининга представлены в таблице 2.
Из таблиц 1 и 2 видно, что в отношении контрольных и клинических штаммов грамотрицательных бактерий Neisseria gonorrhoeae заявляемые 3-(азол-1-ил)-6-аминозамещенные 1,2,4,5-тетразины проявляют в ряде случаев активность, превышающую активность спектиномицина более чем в 8 раз, а в отношении энтеробактерий Shigella flexneri 1а8516 активность соединений Ic и Ie в 65 раз выше активности спектиномицина. Кроме того, соединения Ic, Ie и Ib умеренно активны в отношении Proteus vulgaris 222 и Staphylococcus aureus ATCC 25923.
Заявляемые соединения сравнительно легкодоступны, получаются из товарного, многотоннажного сырья, синтез не требуют больших энергозатрат. По своему биологическому действию заявляемые вещества превосходят аналог по действию спектиномицин и могут быть использованы в практической медицине для лечения больных с заболеваниями мочеполовой системы, вызванными гонококками, а также клинически значимыми патогенными и условно-патогенными микроорганизмами.
1. 3-(Азол-1-ил)-6-аминозамещенные 1,2,4,5-тетразины формулы:
где Het = имидазол-1-ил, NHR = аллиламино (Ia);
Het = 4-метилимидазол-1-ил, NHR = аллиламино (Ib);
Het = бензимидазол-1-ил, NHR = аллиламино (Ic);
Het = индазол-1-ил, NHR = аллиламино (Id);
Het = имидазол-1-ил, NHR = пропаргиламино (Ie);
Het = 4-метилимидазол-1-ил, NHR = пропаргиламино (If);
Het = бензимидазол-1-ил, NHR = пропаргиламино (Ig);
Het = индазол-1-ил, NHR = пропаргиламино (Ih);
2. Антибактериальные агенты, активные в отношении грамотрицательных бактерий Neisseria gonorrhoeae и клинически значимых патогенных и условно-патогенных микроорганизмов, представлящие собой соединения формулы I, где Het = имидазол-1-ил; 4-метилимидазол-1-ил; бензимидазол-1-ил; индазол-1-ил, NHR = аллиламино (Ia-d); Het = имидазол-1-ил; 4-метилимидазол-1-ил; бензимидазол-1-ил; индазол-1-ил, NHR = пропаргиламино (Ie-h).