Ингибитор рецептора фрф для применения в лечении гипофосфатемических заболеваний
Иллюстрации
Показать всеНастоящая группа изобретений относится к медицине, а именно к терапии, и касается применения ингибитора рецептора фактора роста фибробластов (FGF) для лечения гипофосфатемических заболеваний. Вводят эффективное количество 3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримид-4-ил}-1-метилмочевины (BGJ398). Это обеспечивает нормализацию кальциевого и фосфорного обмена за счет селективного ингибирования FGF23. 3 н. и 8 з.п. ф-лы, 9 ил., 9 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится в основном к 3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримид-4-ил}-1-метилмочевине или к ее фармацевтически приемлемой соли или сольвату или к фармацевтической композиции, включающей 3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримид-4-ил}-1-метилмочевину или ее фармацевтически приемлемую соль или сольват для применения в лечении заболеваний, опосредованных рецептором фактора роста фибробластов.
Уровень техники
Семейство факторов роста фибробластов (ФРФ) и их сигнальных рецепторов связано с множеством биологических активностей (пролиферацией, выживанием, апоптозом, дифференцировкой, подвижностью), которые контролируют ключевые процессы (развитие, ангиогенез и метаболизм) для роста и поддержания организмов от червей до людей. Было идентифицировано 22 отдельных ФРФ, каждый из которых содержит общий консервативный 120-аминокислотный основной домен с 15-65% идентичностью. ФРФ23 представляет собой ключевой медиатор гомеостаза фосфата костного происхождения, который функционирует в почках для регуляции биосинтеза витамина D и адсорбции фосфата в почках. В эпителиальных клетках проксимальных канальцев почки передача сигнала через ФРФ23 контролирует экспрессию метаболизирующих витамин D ферментов CYP27B1 и CYP24A1, что приводит к снижению биосинтеза и повышению обмена активного метаболита витамина D 1,25-дигидроксивитамина D3 (1,25[ОН]2D3). Кроме того, ФРФ23 ослабляет экспрессию котранспортеров фосфата натрия NPT2A и NPT2C в мембране щеточной каймы клеток проксимального канальца, которые опосредуют реадсорбцию фосфата мочи.
Избыточные уровни или увеличенная функция ФРФ23 приводят к гипофосфатемии наряду с нарушением биосинтеза 1,25(OH)2D3 (витамина D) и связаны с несколькими наследственными гипофосфатемическими заболеваниями со скелетными аномалиями как следствие нарушения минерализации кости, включающими X-сцепленный гипофосфатемический рахит (ХГР), аутосомно-доминантный гипофосфатемический рахит (АДГР) и аутосомно-рецессивный гипофосфатемический рахит (АРГР). Кроме того, было показано, что в редких случаях секреция ФРФ23 клетками опухоли вызывает гипофосфатемию, приводящую к развитию индуцированной опухолью остеомаляции (ИОО). Повышенные уровни ФРФ23 также обычно наблюдают у пациентов после трансплантации почки, что приводит к тяжелой гипофосфатемии. ФРФ23 играет роль в нескольких других гипофосфатемических синдромах, таких как синдром эпидермального невуса, остеоглофоническая дисплазия и синдром Маккьюна-Олбрайта, ассоциированных с повышенными уровнями ФРФ23. ХГР и другие ФРФ23-опосредованные гипофосфатемические заболевания, такие как АДГР и АРГР, обычно клинически проявляются в раннем детстве в виде низкого роста и искривления ног.
В настоящее время терапевтические подходы к данным заболеваниям в основном ограничиваются добавлением в рацион витамина D и фосфата. Хотя терапия улучшает рост и рахит у пациентов, улучшение носит ограниченный характер и приводит к нарушению роста в постпубертатный период. В зависимости от степени тяжести заболевания из-за продолжающейся. передачи сигнала через ФРФ23, создающей постоянную противодействующую силу, для медикаментозного лечения ХГР и других ФРФ23-связанных гипофосфатемических заболеваний часто требуется введение высоких доз фосфата и витамина D, что создает необходимость тщательного мониторинга и корректировки дозы с целью предотвращения токсических рисков, таких как абдоминальная боль и диарея или вторичный гиперпаратироидизм, гиперкальциемия и эктопические кальцификации.
Следовательно, существует необходимость в надежном и эффективном лекарстве для лечения искривляющих фигуру заболеваний, и прямое воздействие на патологическую передачу сигнала через ФРФ23 посредством блокирования передачи сигнала через рецептор ФРФ может представлять собой терапевтический подход, имеющий преимущество перед принятыми в настоящее время стандартами лечения.
Сущность изобретения В настоящее время было неожиданно обнаружено, что соединение 3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримид-4-ил}-1-метилмочевина, как указано в формуле I (описанной в примере 145 WO 2006/000420), представляющее собой высокоселективный ингибитор рецептора ФРФ, также известное как BGJ389, является особенно клинически активным и может быть использовано для лечения заболеваний, опосредованных другими рецепторами фактора роста фибробластов.
В первом аспекте настоящее изобретение таким образом представляет 3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримид-4-ил}-1-метилмочевину или ее фармацевтически приемлемую соль, N-оксид или сольват для применения в лечении Х-сцепленного гипофосфатемического рахита (ХГР), аутосомно-доминантного гипофосфатемического. рахита (АДГР), аутосомно-рецессивного гипофосфатемического рахита (АРГР), индуцированную опухолью остеомаляции, гипофосфатемии после трансплантации почки, синдрома эпидермального невуса, остеоглофонической дисплазии или синдрома Маккьюна-Олбрайта. В частности, соединение, его фармацевтически приемлемая соль или сольват можно применять для лечения Х-сцепленного гипофосфатемического рахита (ХГР), аутосомно-доминантного гипофосфатемического рахита (АДГР), аутосомно-рецессивного гипофосфатемического рахита (АРГР) или индуцированной опухолью остеомаляции, гипофосфатемии после трансплантации почки.
Предпочтительно вводить пациентам 3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримид-4-ил}-1-метилмочевину или ее фармацевтически приемлемую соль или сольват в виде более чем одной дозы.
При применении соединения 3-(2, 6-дихлор-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримид-4-ил}-1-метилмочевины или ее фармацевтически приемлемой соли, N-оксида или сольвата, как описано выше, предпочтительно, чтобы лечение продолжалось по меньшей мере 8 недель, возможно, с перерывами. Время между двумя последовательными дозами соединения может быть более 24 часов, возможно, 48 часов.
Соединение из формулы I можно в дальнейшем применять для лечения в сочетании с другим ингибитором рецептора ФРФ, фосфатом, кальцием, остеопонтином (ΟΠΗ), паратиреоидным гормоном или его аналогом (ПТГ) и/или витамином D или аналогом витамина D, предпочтительно в сочетании с фосфатом, кальцием и/или витамином D или аналогом витамина D, в частности с витамином D или аналогом витамина D.
Во втором аспекте настоящее изобретение представляет фармацевтическую композицию, включающую 3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино] пиримид-4-ил}-1-метилмочевину или ее фармацевтически приемлемую соль, N-оксид или сольват для применения, как описано выше.
Другим аспектом настоящего изобретения является 3-(2,6-дихлор-3,5-диметоксифенил)-1-{б-[4-(4-этилпиперазин-1-ил)фениламино]пиримид-4-ил}-1-метилмочевина или ее фармацевтически приемлемую соль, N-оксид или сольват для применения для увеличения объема и толщины компактного вещества кости при сравнении с контролем или с объемом и толщиной компактного вещества кости перед началом лечения.
Еще одним аспектом настоящего изобретения является применение 3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримид-4-ил}-1-метилмочевины или ее фармацевтически приемлемой соли, N-оксида или сольвата для увеличения массы тела у пациентов, у которых наблюдается повышенная активность ФРФ23 по сравнению с контролем.
Следующим аспектом настоящего изобретения является применение 3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримид-4-ил}-1-метилмочевины или ее фармацевтически приемлемой соли, N-оксида или сольвата для ингибирования экспрессии ФРФ23 в кости или для ингибирования активности ФРФ23 в кости.
Краткое описание чертежей
Фиг. 1. Обработка ингибитором рецептора ФРФ индуцирует биосинтез 1,25(OH)2D3 и уменьшает гипокальциемию и гипофосфатемию у мышей Hyp. Показана регуляция генов-мишеней ФРФ23 в почках Cyp27b1 (А) и Сур24а1 (В) при ингибировании рецептора ФРФ в течение 7 часов in vivo. Данные представлены в виде относительных уровней по сравнению с контрольной группой дикого типа, получавшей наполнитель (относительная экспрессия из 100). (С) Уровни 1,25(OH)2D3 в сыворотке мышей дикого типа и Hyp, обработанных, как описано в А и В, определяли при помощи радиографического анализа рецепторов. Уровни кальция (D) и фосфата (Е) через 24 ч после введения препаратов мышам дикого типа и Hyp, обработанным однократной пероральной дозой BGJ398 (50 мг/кг) или наполнителем. Уровни фосфата и кальция определяли в сыворотке. Данные представлены в виде среднего и стандартной ошибки среднего (n≥6). Данные сравнивали при помощи непарного критерия Стьюдента; *р<0,05; **р<0,01; ***р<0,001; нд - недостоверно.
Фиг. 2. Обработка ингибитором рецептора ФРФ регулирует экспрессию генов-мишеней ФРФ23 в почках и уменьшает гипокальциемию и гипофосфатемию у мышей Dmp1-null. Регуляция генов-мишеней ФРФ23 в почках Cyp27b1 (А) и Сур24а1 (В) при ингибировании рецептора ФРФ in vivo. Данные показаны в виде относительных уровней по сравнению с контрольной группой дикого типа, получавшей наполнитель (относительная экспрессия из 100) и представлены в виде среднего и стандартной ошибки среднего (n≥6) - Эффект фармакологического ингибирования рецептора ФРФ на уровень кальция (С) и фосфата (D) в сыворотке у мышей дикого типа и Dmp1-null. Данные представлены в виде среднего и стандартной ошибки среднего (n≥6). Данные сравнивали при помощи непарного критерия Стьюдента; *р<0,05; **р<0,01; ***р<0,001; нд - недостоверно.
Фиг. 3 показывает регуляцию экспрессии ФРФ23 в кости с помощью передачи сигнала через рецептор ФРФ23. Уровни мРНК ФРФ23 в кости (А) и в сыворотке (В) у мышей дикого типа и Hyp, обработанных BGJ398 в течение 7 ч.
Фиг. 4 показывает, что обработка ингибитором рецептора ФРФ приводит к устойчивому повышению уровней кальция и фосфата в сыворотке. Определение уровней кальция (А) и фосфата (В) в сыворотке мышей дикого типа или Hyp через 48 ч после введения соединения формулы I. (С) Концентрация соединения в почках через 7 ч и 24 ч после обработки.
Фиг. 5. Длительное ингибирование рецептора ФРФ увеличивает массу тела и продольный рост хвоста и восстанавливает гомеостаз минеральных ионов у мышей Hyp. Мышей дикого типа или Hyp обрабатывали ингибитором рецептора ФРФ BGJ398 (50 мг/кг) или наполнителем 3 раза в неделю на протяжении 5 6 дней и наблюдали за массой тела и удлинением хвоста (С). Общая масса тела (В) и прибавка длины хвоста (D) на протяжении курса лечения. Уровни кальция (Е) и фосфата (F) в конце 8-недельного лечения определяли в сыворотке через 2 4 ч после последнего введения. Данные представлены в виде среднего и стандартной ошибки среднего (n≥6). Данные сравнивали при помощи непарного критерия Стьюдента; *р<0,05; **р<0,01; ***р<0,001; нд - недостоверно.
Фиг. 6. Уровни ФРФ23, паратиреоидного гормона (ПТГ) и 1,25(OH)2D3 в сыворотке после длительного ингибирования рецептора ФРФ с помощью BGJ398. Мышей дикого типа или Hyp обрабатывали ингибитором рецептора ФРФ BGJ398 (50 мг/кг) или наполнителем 3 раза в неделю на протяжении 56 дней и определяли уровни ФРФ23 (А), ПТГ (В) и 1,25(OH)2D3 (С) в сыворотке через 24 ч после введения последней дозы. Данные представлены в виде среднего и стандартной ошибки среднего (n≥4). Данные сравнивали при помощи непарного критерия Стьюдента; *р<0,05; **р<0,01; ***р<0,001; нд - недостоверно.
Фиг. 7. Длительное ингибирование рецептора ФРФ улучшает рост длинных костей у мышей Hyp.Рентгенограмма бедренной (А) и большеберцовой (В) костей мышей дикого типа или Hyp, обработанных ингибитором рецептора ФРФ BGJ398 (50 мг/кг) или наполнителем 3 раза в неделю на протяжении 56 дней. Количественная оценка длины бедренной кости (С) и большеберцовой кости (D). Данные представлены в виде среднего и стандартной ошибки среднего (n≥6). Данные сравнивали при помощи непарного критерия Стьюдента; *р<0,05; **р<0,01; ***р<0,001; нд недостоверно.
Фиг. 8. Длительное ингибирование рецептора ФРФ улучшает целостность компактного вещества бедренной кости у мышей Hyp. (А) Полученные с помощью компьютерной микротомографии сканированные изображения компактного вещества бедренной кости (область около эпифизарной пластинки) мышей дикого типа или мышей Hyp, обработанных ингибитором рецептора ФРФ BGJ398 (50 мг/кг) или наполнителем 3 раза в неделю на протяжении 56 дней. Количественный анализ относительного объема компактного вещества кости (В) и средняя толщина компактного вещества (С). Данные представлены в виде среднего и стандартной ошибки среднего (n≥6). Данные сравнивали при помощи непарного критерия Стьюдента; *р<0,05; **р<0,01; ***р<0,001; нд - недостоверно.
Фиг. 9 показывает окрашивание по Голднеру (Goldner) срезов большеберцовой кости у мышей дикого типа или Hyp, обработанных ингибитором рецептора ФРФ BGJ398 (50 мг/кг) или наполнителем 3 раза в неделю на протяжении 56 дней (А). Минерализованная ткань показана белыми стрелками, неминерализованный остеоид показан черными стрелками. (В) Поверхность остеоида/поверхность кости и ширина остеоида (С), определенные гистоморфометрически в эпифизе большеберцовой кости у мышей дикого типа или Hyp, обработанных ингибитором рецептора ФРФ BGJ398 (50 мг/кг) или наполнителем 3 раза в неделю на протяжении 56 дней. Данные представлены в виде среднего и стандартной ошибки среднего (n≥6). Данные сравнивали при помощи непарного критерия Стьюдента; *р<0,05; **р<0,01; ***р<0,001.
Подробное описание изобретения
Известен фактор роста фибробластов 23 (ФРФ23). Он считается членом семейства факторов роста фибробластов с широким спектром биологических активностей. Последовательность белка и/или кодирующую белок последовательность можно получить из общедоступных баз данных, известных в данной области техники. Человеческий ФРФ32 также известен в данной области техники как ADHR; HYPF; HYDR2; РНРТС.ФРФ23 является фактором, вызывающим заболевание при некоторых гипофосфатемических состояниях. Неожиданно было обнаружено, что фармакологическое ингибирование рецепторов ФРФ с помощью ингибитора рецептора ФРФ 3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримид-4-ил}-1-метилмочевины (BGJ398) противодействует патологической передаче сигнала через ФРФ23, таким образом представляя собой новый терапевтический подход к лечению связанных с ФРФ23 гипофосфатемических заболеваний. Мы обнаружили, что 3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримид-4-ил}-1-метилмочевина или ее фармацевтически приемлемая соль, N-оксид или сольват могут быть очень эффективными при применении в лечении Х-сцепленного гипофосфатемического рахита (ХГР), аутосомно-доминантного гипофосфатемического рахита (АДГР), аутосомно-рецессивного гипофосфатемического рахита (АРГР), индуцированной опухолью остеомаляции, гипофосфатемии после трансплантации почки, синдрома эпидермального невуса, остеоглофонической дисплазии или синдрома Маккьюна-Олбрайта. Соединение может быть особенно полезным для лечения Х-сцепленного гипофосфатемического рахита (ХГР), аутосомно-доминантного гипофосфатемического рахита (АДГР) или аутосомно-рецессивного гипофосфатемического рахита (АРГР), гипофосфатемии после трансплантации почки, в частности, X-сцепленного гипофосфатемического рахита (ХГР), аутосомно-доминантного гипофосфатемического рахита (АДГР) или аутосомно-рецессивного гипофосфатемического рахита (АРГР).
В данном контексте термин «лечить», «обработка» или «лечение» любого заболевания или нарушения относится в одном воплощении изобретения к улучшению заболевания или нарушения (т.е. замедлению или прекращению или снижению развития заболевания, или по меньшей мере одного из его клинических симптомов). В другом воплощении изобретения «лечить», «обработка» или «лечение» относится к облегчению или улучшению по меньшей мере одного физического параметра, включая такие параметры, которые могут быть не очевидны для пациента. В еще одном воплощении изобретения «лечить», «обработка» или «лечение» относится к регулированию заболевания или нарушения либо физически (например, к стабилизации очевидного симптома), либо физиологически (например, к стабилизации физического параметра), либо обоими способами. В другом воплощении изобретения «лечить», «обработка» или «лечение» относится к предотвращению или отсрочке начала развития или прогрессии заболевания или нарушения.
Термин «фармацевтически приемлемые соли» относится к солям, которые сохраняют биологическую активность и свойства соединения при применении в соответствии с настоящим изобретением и которые обычно не являются биологически или иначе неприемлемыми. Фармацевтически приемлемые кислотно-аддитивные соли можно образовать с помощью неорганических кислот и органических кислот, например, ацетата, аспартата, бензоата, безилата, бромида/гидробромида, бикарбоната/карбоната, бисульфата/сульфата, камфорсульфоната, хлорида/гидрохлорида, хлортеофиллоната, цитрата, этандисульфоната, фумарата, глюцептата, глюконата, глюкуроната, олеата, оксалата, пальмитата, памоата, фосфата/гидрофосфата/дигидрофосфата, пропионата, стеарата, сукцината, сульфосалицилата, тартрата, тозилата, трифторацетатной соли или подобного. Неорганические кислоты, из которых можно получить соли, включают, например, соляную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и подобные. В одном воплощении изобретения фармацевтически приемлемой солью является монофосфорная кислая соль (или фосфат) соединения 3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримид-4-ил}-1-метилмочевины, которая может быть при необходимости в безводной кристаллической форме. В частном воплощении изобретения солью соединения является любая соль или форма, описанная в WO 2011/071821. В одном воплощении изобретения 3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримид-4-ил}-1-метилмочевина находится в форме свободного основания.
Термин «сольват» относится к молекулярному комплексу соединения с одной или несколькими молекулами растворителя. Такими молекулами растворителя являются молекулы, широко используемые в фармацевтике, известные как нейтральные по отношению к соединению, например вода, этанол и подобные.
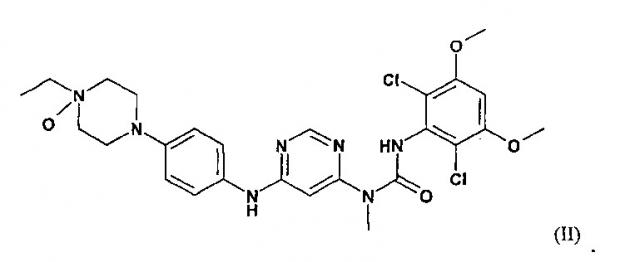
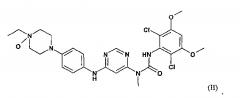
Один из N-оксидов соединения 3-(2,6-дихлоро-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримид-4-ил}-1-метилмочевины имеет следующую формулу II
Ранее однократная эффективная доза BGJ398 приводила к существенному увеличению уровней 1,25(OH)2D3 в сыворотке как у мышей дикого типа, так и у мышей Hyp через 7 ч после приема BGJ398. Кроме того, также увеличивались уровни кальция и фосфата. Данные результаты указывают на то, что фармакологическое ингибирование рецептора ФРФ достаточно для противодействия нарушенной передаче сигнала через ФРФ23 у млекопитающих. Мы обнаружили, что однократная доза ингибитора рецептора ФРФ уже вызывает эффект в виде противодействия активности ФРФ23 и выравнивания уровней кальция и фосфата в организме. Более того, длительная обработка BGJ398 приводила к полной нормализации уровней как кальция, так и фосфата у мышей Hyp. Таким образом, в предпочтительном варианте осуществления настоящего изобретения BGJ398 или его фармацевтически приемлемую соль, N-оксид или сольват вводят пациенту, нуждающемуся в этих препаратах, в более чем одной терапевтически эффективной дозе. Термин «терапевтически эффективная доза» соединения относится к количеству BGJ398, которое будет вызывать биологический или медицинский ответ у субъекта, например снижение или ингибирование киназной активности или улучшение симптомов, облегчение состояний, замедление или отложенную прогрессию, или предотвращение заболевания и т.п .Субъектом может быть любое млекопитающее, в том числе человек. Терапевтически эффективной дозой может быть около 1-250 мг BGJ3 98 для субъекта весом около 50-70 кг или около 1-150 мг, например, доза 125 мг, или около 0,5-100 мг, или около 1-50 мг, или около 1-25 мг, или около 1-10 мг BGJ398. Терапевтически эффективная доза соединения в индивидуальном виде или в составе фармацевтической композиции или в сочетании с другими активными ингредиентами, как описано здесь и далее, зависит от видовой принадлежности субъекта, массы тела, возраста и индивидуального состояния, от подлежащего лечению заболевания или нарушения, или от степени его тяжести.
В другом аспекте настоящего изобретения 3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримид-4-ил}-1-метилмочевину или ее фармацевтически приемлемую соль, N-оксид или сольват применяют для увеличения объема или толщины компактного вещества кости при сравнении с контролем или с объемом или толщиной компактного вещества кости перед началом лечения. Проведенные эксперименты ясно показали, что объем компактного вещества кости увеличивается с патологических значений до значений, неотличимых от нормальных, при обработке субъекта BGJ398. Кроме того, существенно увеличивалась толщина компактного вещества.
Было отмечено, что введение 3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримид-4-ил}-1-метилмочевины приводит к увеличению набора массы тела пациентов, у. которых наблюдали повышенную активность ФРФ2 3 по сравнению с контролем. «Контроль» относится к значению активности или экспрессии ФРФ23 у отдельного субъекта, нескольких субъектов или в популяции без соответствующего заболевания.
В более широком смысле в одном воплощении изобретения 3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримид-4-ил}-1-метилмочевина или ее фармацевтически приемлемая соль, N-оксид или сольват применяют для ингибирования экспрессии ФРФ23 в кости или для ингибирования активности ФРФ23 в кости. «Экспрессия» относится к нуклеиновым кислотам или аминокислотам, образованным при транскрипции и трансляции гена. Например, транскрипционную активность можно оценить любым подходящим способом, включая, например, измерение количества мРНК, транскрибируемой с гена ФРФ2 3, или количества кДНК, образованной в реакции обратной транскрипции с мРНК, транскрибируемой с гена, или количества полипептида или белка, кодируемого геном. В качестве альтернативы для любого гена можно определять количество копий, транскрипцию или трансляцию, применяя известные способы. Например, способ амплификации, такой как ПЦР, может быть полезным. Влияя на экспрессию или активность ФРФ23 в кости, можно регулировать ее структуру и рост, что особенно полезно при заболеваниях, которые проявляются в виде нерегулярного или неэффективного роста и приводят к аномалиям, таким как, например, рахит, но не ограничиваясь им.
Для снижения частоты возникновения вероятного побочного эффекта от системного ингибирования рецептора ФРФ дозу можно вводить с перерывами для минимизации нежелательного вторичного эффекта, который может быть вредным для субъекта. Дозы можно вводить последовательно без перерывов или начиная с количества доз, которое позволяет достичь равновесной концентрации у пациента, нуждающегося в данных препаратах, а затем изменяя время между дозами. Альтернативно, режим дозирования можно адаптировать сразу после первой дозы. Время между двумя последовательными дозами соединения может составлять больше 24 часов, необязательно, 48 часов или даже неделю. В конкретном воплощении изобретения дозу дают повторно, необязательно, еще раз с интервалом в один, два или три дня между двумя последовательными дозами, или только после рецидива.
В предпочтительном воплощении изобретения соединение 3-(2,6-дихлор-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримид-4-ил}-1-метилмочевину можно применять для лечения в сочетании с другим ингибитором рецептора ФРФ, фосфатом, кальцием, остеопонтином (ΟΠΗ), паратиреоидным гормоном или его аналогом (ПТГ) и/или витамином D или аналогом витамина D, предпочтительно в сочетании с фосфатом, кальцием и/или витамином D или аналогом витамина D, в частности с витамином D или аналогом витамина D. BGJ398 можно применять в сочетании, чтобы получить преимущество в выработке аддитивных или даже синергических эффектов, но также для снижения необходимости применения более высоких доз BGJ398 и, как следствие, ограничения риска развития нежелательных эффектов. Фосфат можно применять в любой форме, которая при пероральном или парентеральном приеме повышает уровень неорганического фосфора (Ф) в крови, который можно измерить, например, в сыворотке с помощью ультрафиолетового способа, применяя, например, наборы реактивов от RANDOX Laboratories LTD, Великобритания, и клинический химический анализатор, такой как анализатор HITACHI 717 (Roche Diagnostics). Кальций также может быть в любой форме, которая в итоге при приеме приводит к увеличению общего уровня кальция в крови, который можно измерить, например, в сыворотке с помощью ультрафиолетового способа, применяя, например, наборы реактивов от RANDOX Laboratories LTD и клинический химический анализатор, такой как анализатор HITACHI 717. Остеопонтин (ΟΠΗ), как известно, относится к секретируемому фосфопротеину 1, костному сиалопротеину I или белку ранней активации Т-лимфоцитов 1. Он считается внеклеточным структурным белком, участвующим в перемоделировании кости. Человеческий остеопонтин известен в данной области техники как SPP1. Известен паратиреоидный гормон (ПТГ) или паратгормон. Он считается гормоном, вовлеченным в регуляцию уровня кальция в крови. Аналог ПТГ представляет собой молекулу, которая по меньшей мере частично сохраняет активность ПТГ и структурно напоминает полный ПТГ, будучи только короче или имея модифицированные или дополнительные заместители, связанные со структурным скелетом ПТГ. Витамин D представляет собой известный гормон, отвечающий за гомеостаз кальция и важный для фенотипа здоровой кости. Его аналог представляет собой структурно похожее соединение, повторяющее химическую структуру витамина D и оказывающее похожее фармакологическое действие. Примером аналога витамина D является кальципотриол.
3-(2,6-дихлор-3,5-диметоксифенил)-1-(6-[4-(4-этилпиперазин-1-ил)фениламино]пиримид-4-ил}-1-метилмочевину или ее фармацевтически приемлемую соль, N-оксид или сольват формулируют в виде фармацевтической композиции, которую в свою очередь можно применять для любого лечения, как описано выше. Фармацевтическая композиция будет, как правило, включать 3-(2,6-дихлрр-3,5-диметоксифенил)-1-{6-[4-(4-этилпиперазин-1-ил)фениламино]пиримид-4-ил}-1-метилмочевину или ее фармацевтически приемлемую соль, N-оксид или сольват и одно или более фармацевтически приемлемых вспомогательных веществ (эксципиентов). Предпочтительно, чтобы количество соединения в фармацевтической композиции было терапевтически эффективным. Необязательно, другой ингибитор рецептора ФРФ, фосфат, кальций, остеопонтин (ΟΠΗ), паратиреоидный гормон или его аналог (ПТН) и/или витамин D или аналог витамина D, предпочтительно в сочетании с фосфатом, кальцием и/или витамином D или аналогом витамина D, в частности с витамином D или аналогом витамина D, добавляют к фармацевтической композиции в соответствии с настоящим изобретением. Фармацевтическая композиция может быть сформулирована для определенных способов введения, таких как пероральное введение, парентеральное введение и местное применение, и т.п. Кроме того, фармацевтическая композиция настоящего изобретения может быть изготовлена в твердой форме (включающей, но не ограничивающейся, капсулы, таблетки, пилюли, гранулы, порошки или суппозитории) или в жидкой форме (включающей, но не ограничивающейся, растворы, суспензии или эмульсии). Фармацевтическая композиция может быть подвергнута традиционным фармацевтическим процедурам, таким как компактизация, таблетирование, фильтрование, лиофилизация, стерилизация или подобным. Вспомогательное вещество (эксципиент) может быть любым традиционным инертным растворителем, увлажняющим агентом, буферным агентом, связующим, дезинтегрирующим агентом, подсластителем, ароматизатором, а также адъювантами, такими как консервант, стабилизатор, увлажняющим веществом, эмульгатором, растворителями, диспергирующими средами, покрытием, сурфактантом, антиоксидантом, консервантом (например, антибактериальными агентами, противогрибковыми агентами), изотоническим агентом, задерживающим адсорбцию агентом, солью, консервантом, стабилизатором лекарственного препарата, красителем и подобными веществами и их комбинациями.
Пример 1
Обработка ингибитором рецептора ФРФ индуцирует биосинтез 1,25(OH)2D3 и уменьшает гипокальциемию и гипофосфатемию у мышей Hyp. Мыши дикого типа C57BL/6 и Hyp (В6.Cg-PhexHyp/J) были получены из The Jackson Laboratory. Мыши Dmp1-null были созданы Feng et al. (J.Dent.Res. 2003; 82:776-780). Всех мышей содержали в клетках в стандартных лабораторных условиях. Мыши находились на стандартной диете для грызунов без ограничения доступа к воде.
Мышам дикого типа или Hyp вводили однократную пероральную дозу ингибитора рецептора ФРФ BGJ398 в форме свободного основания (50 мг/кг) или наполнитель, и проводили наблюдения через 7 ч после введения соединения. BGJ398 или только наполнитель (ПЭГ-300/5% глюкоза, смесь 2:1) вводили перорально через зонд. При введении однократной дозы использовали мышей в возрасте 5-7 недель. Мышам делали анестезию посредством ингаляции изофлурана и собирали кровь из полой вены. Мышей умерщвляли посредством обескровливания и получали почки и большеберцовые и бедренные кости. Также определяли концентрации BGJ398 в почках через 7 ч.
Готовили образцы почек, выделяли тотальную РНК. Для выделения РНК из большеберцовой и бедренной костей отрезали эпифизы и удаляли костный мозг посредством центрифугирования при 4°С. Ткань гомогенизировали, применяя гомогенизатор Precellyis 24 с шариками, и экстрагировали РНК реактивом тризол. Затем РНК очищали посредством экстракции хлороформом, осаждения изопропанолом и при помощи набора реактивов RNeasy Mini kit. Для почечной РНК около 60 мг ткани гомогенизировали в 1,5 мл буфера RTL (Qiagen) с помощью ротор-статорного гомогенизатора и очищали РНК с помощью набора реактивов RNeasy Mini kit. кДНК на случайных гексамерных праймерах синтезировали с 0,5-2 мкг РНК и обратной транскриптазой MultiScribe MuLV.
Экспрессию генов анализировали с помощью количественной ПЦР в реальном времени (кПЦР). Тесты TaqMan Probe-Based Gene Expression применяли для анализа экспрессии мышиных Cyp27b1 (Mm01165919), Сур24а1 (Mm0048244) и Gapdh (4352339Е). Последовательности праймеров и FAM/TAMRA-меченых зондов (Microsynth) для детекции мышиного Fgf23 были следующими: 5ʹ-TTTGGATCGCTTCACTTCAG (прямой), 5ʹ-GTGATGCTTCTGCGACAAGT (обратный) и 5ʹ-CGCCAGTGGACGCTGGAGAA (зонд). Количественную ПЦР в реальном времени проводили с помощью системы детекции iQ5 Real-Time PCR Detection System, применяя основной набор реактивов для кПЦР для анализа проб и эквивалент 40 или 80 нг РНК каждого образца. Данные нормализовали к экспрессии Gapdh.
Рентгенограммы бедренной и большеберцовой костей получали ех vivo, используя радиоавтографическую систему высокого разрешения (Faxitron МХ-20). Измерения с помощью компьютерной микротомографии проводили ex vivo, применяя систему Scano vivaCT 40 (размер вокселя 6 мкм; высокое разрешение). При анализе компактного и губчатого вещества кости применяли фиксированный пороговый уровень, равный 200 для определения фракции минерализованной кости по 50 срезам. Применяли фильтр Гаусса для избавления от шума (σ=0,7; поддержка=1).
Сыворотку выделяли из цельной крови, применяя центрифужные пробирки с активатором свертывания. 100 мкл сыворотки применяли для определения уровней фосфата и кальция при помощи диагностической профилированной системы VetScan. Концентрацию 1,25(OH)2D3 в сыворотке определяли, применяя набор реактивов для радиографического анализа рецепторов. Уровни ФРФ23 в сыворотке анализировали при помощи твердофазного иммуноферментного анализа ELISA, детектируя интактный ФРФ23 (Kainos).
ФРФ23 выполняет свои гипофосфатемические функции частично посредством транскрипционной регуляции 1,25(ОН)2D3-метаболизирующих ферментов CYP27B1 и CYP24A1 в почках. Поэтому мы наблюдали за экспрессией почечных Cyp27b1 и Сур24а1 после введения однократной дозы BGJ3 98 мышам Hyp и однопометным мышам дикого типа. Несмотря на повышенные уровни ФРФ2 3 у мышей Hyp, экспрессия Cyp27b1 и Сур24а1 и уровень 1,25(OH)2D3 в сыворотке у мышей Hyp не отличались существенно от таковых у мышей дикого типа (фиг. 1А, В и С), возможно, за счет процессов адаптации, что соответствовало предыдущим сообщениям. Как у мышей дикого типа, так и у мышей Hyp обработка BGJ398 в течение 7 часов приводила к повышению уровней Cyp27b1 и к почти полной потере экспрессии Сур24а1 (фиг. 1А и В). В соответствии с этим, нарушение регуляции генов-мишеней ФРФ23 приводило к существенному росту уровней 1,25(OH)2D3 в сыворотке как у мышей дикого типа, так и у мышей Hyp через 7 ч после введения BGJ398 (фиг. 1С).
Через 24 ч после введения дозы, обработка однократной дозой BGJ398 вызывала повышение уровней кальция и фосфата в сыворотке как у мышей дикого типа, так и у мышей Hyp, уменьшая таким образом тяжесть гипокальциемии и гипофосфатемии, наблюдаемых у контрольных мышей Hyp. Уровни кальция в сыворотке обработанных BGJ398 мышей Hyp были неотличимы от таковых у обработанных наполнителем мышей дикого типа. (фиг. 1D), в то время как концентрации фосфата у мышей Hyp, обработанных ингибитором рецептора ФРФ, были все еще существенно ниже по сравнению с уровнями фосфата в сыворотке мышей дикого типа (фиг. 1Е). Данные на фиг. 1А и В показаны как относительные уровни по сравнению с контрольной группой мышей дикого типа (относительная экспрессия из 100) и представлены в виде среднего и стандартной ошибки среднего (n≥6).
Как было описано, на фиг. 1 показана регуляция генов-мишеней ФРФ23 в почках Cyp27b1 (А) и Сур24а1 (фиг. 1В) при ингибировании рецептора ФРФ in vivo. Также (С) уровни 1,25(OH)2D3 в сыворотке мышей дикого типа и Hyp, обработанных, как описано в А и В, определяли с помощью радиографического анализа рецепторов. Кроме того, показаны уровни кальция (фиг. 1Е) и фосфата (фиг. 1F) через 24 ч поле введения мышам дикого типа и Hyp однократной пероральной дозы BGJ398 (50 мг/кг) или наполнителя. Все данные показывают, что обработка ингибитором рецептора ФРФ. индуцирует биосинтез l,25(OH)2D3 и улучшает гипокальциемию и гипофосфатемию у мышей Hyp. Далее результаты указывают на то, что фармакологическое ингибирование рецептора ФРФ достаточно для противодействия нарушенной передаче сигнала через ФРФ2 3 у мышей Hyp.
Пример 2
Обработка ингибитором рецептора ФРФ регулирует экспрессию генов-мишеней ФРФ23 в почках и уменьшает гипокальциемию и гипофосфатемию у мышей Dmp1-null. Регуляция генов-мишеней ФРФ23 в почках Cyp27b1 (фиг. 2А) и Сур24а1 (фиг. 2В) при ингибировании рецептора ФРФ23 in vivo показана на фиг. 2. В дополнение к нашим данным, полученным на модели мышей Hyp без Phex, мы наблюдали похожую регуляцию экспрессии Cyp27b1 и Сур24а1 в почках мышей Dmp1-null, другой модели гипофосфатемии, связанной с ФРФ23 (фиг. 2А и В). Мышам дикого типа или Dmp1-null вводили однократную пероральную дозу ингибитора рецептора ФРФ BGJ398 (50 мг/кг) или наполнитель и снова обследовали через 7 ч после введения соединения. Как и ранее, получали образцы почек, выделяли тотальную РНК и анализировали экспрессию генов с помощью кПЦР. Значения экспрессии нормализовали к количеству копий мРНК Gapdh. Данные на А и В показывают относительные уровни по сравнению с контрольной группой дикого типа, получавшей наполнитель, и представляют собой среднее и стандартную ошибку среднего (n≥6).
Для анализа уровней кальция и фосфата мышам вводили однократную пероральную дозу ингибитора рецептора ФРФ BGJ398 (50 мг/кг) или наполнитель и обследовали через 24 ч после введения. Уровни фосфата и кальция определяли в сыворотке. Как и у мышей Hyp, фармакологическое ингибирование рецептора ФРФ приводило к повышению уровней кальция и фосфата в сыворотке у мышей Dmp-null (фиг. 2С и D, соответственно). Данные на фиг. 2 представляют собой среднее и стандартную ошибку среднего (n≥6). Данные сравнивали при помощи непарного критерия Стьюдента; *р<0,05; **р<0,01; ***р<0,001; нд - недостоверно.
Пример 3
Фиг. 3 показывает регуляцию экспрессии ФРФ23 в кости с помощью передачи сигнала через рецептор ФРФ. Кроме улучшения дефицита минеральных ионов в двух мышиных моделях связанного с ФРФ23 гипофосфатемического рахита мы также обнаружили, что обработка ингибитором рецептора ФРФ оказывает подавляющее