Дипептид, содержащий непротеиногенную аминокислоту
Иллюстрации
Показать всеИзобретение относится к дипептиду, содержащему непротеиногенную аминокислоту формулы 1, и способу получения целевого полипептида или белка, включающего одну или более непротеиногенных аминокислот, в котором используют указанный дипептид формулы 1. Дипептид обладает повышенной стабильностью, прост в обращении и его использование в химии пептидов легче по сравнению с обычным ступенчатым пептидным синтезом в твердой фазе за счет уменьшения количества стадий химической модификации, таких как стадии снятия защиты и активации. 2 н. и 17 з.п. ф-лы, 1 табл., 4 пр.
Реферат
Область техники
Изобретение относится к дипептиду, содержащему непротеиногенную аминокислоту, способам получения упомянутого дипептида и способам его применения для производства полипептида или белка, включающего одну или более непротеиногенных аминокислот.
Предшествующий уровень техники
Для применения в медицинской практике было одобрено множество полипептидов и белков. Полипептиды и белки могут быть получены при помощи технологии рекомбинантной ДНК в подходящих клетках-хозяевах или синтетическим путем с помощью хорошо налаженной технологии синтеза пептидов. Тем не менее, нативные полипептиды и белки, как правило, демонстрируют высокий уровень клиренса, который неприемлем при многих клинических состояниях, когда требуется высокая концентрация полипептида в плазме крови в течение длительного периода времени.
Природная форма нативных полипептидов и белков может быть изменена с получением их аналогов и производных для того, чтобы изменить или расширить определенные их характеристики. Например, в полипептиды или белки могут быть добавлены или подвергнуты замене непротеиногенные аминокислоты (т.е. аминокислоты, не являющиеся природными); в частности затем, чтобы придать полипептидам или белкам определенную защиту от гидролиза (например, от гидролиза глюкагоноподобного пептида-1 (GLP-1) с помощью дипептидиламинопептидазы-4 (DPP-IV)).
Полипептиды, содержащие одну или более непротеиногенных аминокислот, такие как модифицированные с N-конца аналоги GLP-1, могут быть получены путем введения непротеиногенной аминокислоты (аминокислот) при помощи ступенчатого химического синтеза, при котором стадию конденсации с последующей стадией снятия защиты применяют к каждой аминокислоте, которая добавляется к полипептиду или белку.
Однако, поскольку ступенчатый синтез отнимает много времени и затруднителен, он может привести к образованию многих побочных продуктов и понадобятся промежуточные стадии очистки, что может вызвать высокую степень рацемизации некоторых аминокислотных остатков, таких как остатки гистидина.
В качестве альтернативы остаточный полипептид или белок может быть конденсирован с пептидным фрагментом, включающим непротеиногенную(ые) аминокислоту(ы), причем в методе используют полностью защищенный фрагмент, такой как, например, защищенный фрагмент N-концевой аминогруппы и аминогрупп боковой цепи.
Такой пептидный фрагмент, однако, может быть нерастворим в водных средах, что ограничивает его применение. Кроме того, если во фрагменте присутствуют ортогональные защитные группы, то потребуется несколько шагов снятия защиты; а также, если между стадиями синтеза будут необходимы промежуточные стадии выделения и очистки, то могут возникнуть проблемы с выделением промежуточных продуктов.
WO 2009/083549 относится к способу приготовления аналогов и производных GLP-1, содержащих непротеиногенные аминокислоты. WO 2007/147816 А1 и WO 2010/125079 А2 относятся к синтетической конденсации пептидных фрагментов. Bourgault, S. и соавт. описывают применение стандартного химического синтеза пептидов в PEPTIDES, vol. 29, no. 6(1), June 2008, pages 919-932.
Таким образом, по-прежнему имеется необходимость в пептидном фрагменте для применения в усовершенствованном способе получения полипептидов, содержащих одну или более непротеиногенную аминокислоту.
Краткое описание изобретения
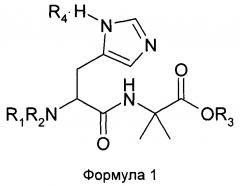
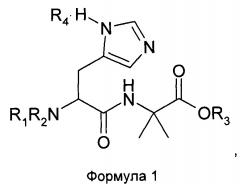
Настоящее изобретение относится к дипептидам с химической структурой согласно Формуле 1:
в которой
R1 представляет собой атом водорода Н или аминозащитную группу, R2 является аминозащитной группой; или
R1 представляет собой удаляемую алкильную группу, a R2 представляет собой атом водорода Н или удаляемую алкильную группу; или
R1 и R2 совместно образуют кольцо;
R3 представляет собой атом водорода Н или вторичный аммоний-катион, третичный аммоний-катион или катион металла, образующий соль с карбоксильной группой; и
R4 отсутствует или представляет собой кислую соль.
Также предлагаемый способ представляет собой способ получения дипептида согласно настоящему изобретению.
Кроме того, изобретение описывает способ получения полипептида или белка, содержащего одну или более непротеиногенную аминокислоту, отличающийся тем, что он включает стадию взаимодействия дипептида по настоящему изобретению с полипептидом или белком.
Изобретение также может решить дополнительные проблемы, которые будут очевидны из описания типичных воплощений изобретения.
Подробное описание изобретения
Изобретение относится к дипептиду, содержащему непротеиногенную аминокислоту, причем дипептид предназначен для проведения реакции конденсации с полипептидом или белком.
Один аспект изобретения состоит в том, что дипептид согласно настоящему изобретению, имеет свободную незащищенную имидазольную группу. Один аспект изобретения заключается в том, что дипептид согласно настоящему изобретению находится в виде соли карбоновой кислоты.
В соответствии с одним из аспектов настоящего изобретения, дипептид представляет собой Формулу 1:
в которой
R1 представляет собой атом водорода Н или аминозащитную группу, такую как, без ограничений, бутоксикарбонил (Boc), трифенилметил (Trt), 1-метил-1-(4-бифенил)-этоксикарбонил (Врос), 9-флуоренилметоксикарбонил (Fmoc), β-метилсульфонилэтоксикарбонил (Nsc), бензилоксикарбонил (Cbz), аллилоксикарбонил (Alloc), орто-нитробензолсульфонил (oNBS), пара-нитробензолсульфонил (pNBS), динитробензолсульфонил (dNBS), 1-(4,4-диметил-2,6-диоксоциклогексилиден)-3-метилбулил (ivDde) или 4-нитрофенилсульфенил (Nps), a R2 представляет собой аминозащитную группу, такую как, без ограничений, Boc, Trt, Врос, Fmoc, Nsc, Cbz, Alloc, oNBS, pNBS, dNBS, ivDde или Nps; или
R1 представляет собой удаляемую алкильную группу, такую как, без ограничений, бензил или трет-бутил, a R2 представляет собой атом водорода Н или удаляемую алкильную группу, такую как, без ограничений, бензил или трет-бутил; или
R1 и R2 совместно образуют кольцо, такое как, без ограничений, фталимидное или 1,3,5-диоксазиновое кольцо;
R3 представляет собой атом водорода Н или вторичный аммоний-катион, третичный аммоний-катион или катион металла, такой как катион щелочного или щелочноземельного металла, образующий соль с карбоксильной группой; и
R4 отсутствует или представляет собой кислую соль, такую как, без ограничений, трифторацетат (TFA), гидрохлорид (HCl), гидробромид (HBr) или гидросульфат.
В соответствии с одним из аспектов настоящего изобретения, R1 является атомом водорода Н, a R2 представляет собой аминозащитную группу, такую как, без ограничений, Boc, Trt, Врос, Fmoc, Nsc, Cbz, Alloc, oNBS, pNBS, dNBS, ivDde или Nps; или R1 и R2 вместе образуют кольцо, такое как, без ограничений, фталимидное или 1,3,5-диоксазиновое кольцо; или R1 представляет собой удаляемую алкильную группу, такую как, без ограничений, бензил или трет-бутил, a R представляет собой атом водорода Н или удаляемую алкильную группу, такую как, без ограничений, бензил или трет-бутил.
В соответствии с одним из аспектов настоящего изобретения, R1 является атомом водорода Н, a R2 представляет собой защитную группу, чувствительную к основаниям, такую как, без ограничений, Fmoc. В соответствии с одним из аспектов настоящего изобретения R1 является атомом водорода Н, a R2 представляет собой Fmoc.
Используемый в настоящем изобретении термин «аминозащитная группа» следует понимать как известную специалисту в области химии пептидов защитную группу, которую вводят в дипептид путем химической модификации (функциональной) аминогруппы, чтобы предотвратить какие-либо взаимодействия с этой аминогруппой в ходе химической реакции.
Используемый в настоящем изобретении термин «удаляемая алкильная группа» следует понимать как алкильную группу, такую, без ограничений, которая может быть удалена методом каталитического гидрогенолиза. В соответствии с одним из аспектов настоящего изобретения, R1 представляет собой бензил, a R2 является атомом водорода Н.
R3 может быть атомом водорода, вторичным аммоний-катионом, третичным аммоний-катионом или катионом металла, причем вторичный аммоний-катион, третичный катион аммония или катион металла образует соль с соседней карбоксильной группой. В соответствии с одним аспектом настоящего изобретения, катион металла представляет собой катион щелочного или щелочноземельного металла. Согласно одному аспекту настоящего изобретения, R3 выбирают из группы, включающей атом водорода Н, катионы лития, натрия, калия, цезия, кальция, магния; катион, являющийся производным вторичного амина, такого как, без ограничений, N,N-дициклогексил аммония, N,N-дитретбутил-катион аммония или катион, являющийся производным третичного амина, такого как, без ограничений, катион триэтиламмония.
В соответствии с одним аспектом настоящего изобретения R3 представляет собой атом водорода Н. Согласно одному аспекту настоящего изобретения, R3 образует с соседней карбоксильной группой соли, такие как, без ограничения, соли одновалентного и двухвалентного металла, или соли, образованные из амина.
Согласно одному аспекту настоящего изобретения, R3 может быть вторичным аммоний-катионом, третичным аммоний-катионом или катионом металла, таким как катион щелочного ли щелочноземельного металла, образуя соль с соседней карбоксильной группой. Соль между R3 и карбоксильной группой может, например, быть солью одновалентного металла, такого как, без ограничения, щелочной металл, включая соли лития, натрия, калия или цезия, солью двухвалентного металла, такой как, без ограничений, соли кальция или магния, солью вторичного амина, такого как, без ограничения, N,N-дициклогексиламин или N,N-дитретбутиламин или солью третичного амина, такого как, без ограничений, триэтиламин.
Авторы изобретения неожиданно обнаружили, что дипептид по настоящему изобретению, в котором R3 представляет собой атом водорода Н или вторичный аммоний-катион, третичный аммоний-катион или катион металла, образующий соль с соседней карбоксильной группой, a R4 отсутствует или представляет собой кислую соль, особенно пригоден, например, для проведения реакции ацилирования в водной среде, в которой дипептид подвергают взаимодействию с пептидом или полипептидом.
В соответствии с одним аспектом изобретения, R4 отсутствует. Согласно одному аспекту настоящего изобретения, R4 представляет собой кислотный компонент, образующий соль с дипептидом. Один аспект изобретения состоит в том, что R4 выбрают из группы, включающей: TFA, HCl, HBr и гидросульфат. В соответствии одним аспектом настоящего изобретения, R4 представляет собой TFA.
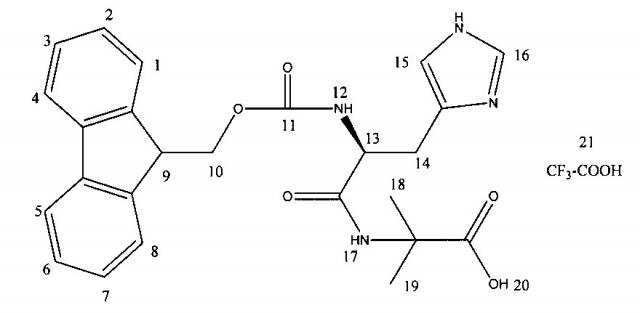
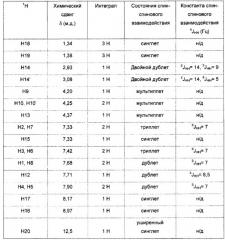
В соответствии одним аспектом настоящего изобретения, дипептид согласно настоящему изобретению является энантиомерным или рацемическим дипептидом Fmoc-His-Aib-OH согласно Формуле 2
в которой знаком * отмечен хиральный центр дипептида, a R4 отсутствует или является кислотным компонентом, таким как, без ограничения, TFA, HCl, HBr или гидросульфат; упомянутый кислотный компонент образует соль с дипептидом. Согласно одному аспекту изобретения R4 представляет собой TFA.
В данном описании термин «энантиомерный» для образца соединений, необходимо понимать как избыток в этом образце одной энантиомерной формы, то есть либо L-, либо D-формы. Используемый в настоящем изобретении термин «рацемический» следует понимать как равное количество L- и D-формы в образце соединений. Как неограничивающий пример, остаток гистидина энантиомерного Fmoc-His-Aib-OH в Формуле 2 может быть в форме L- или D-гистидина.
В соответствии с одним аспектом настоящего изобретения, дипептид Формулы 1 или Формулы 2 активируют известным специалисту в данной области активирующим агентом. Согласно одному аспекту изобретения, дипептид Формулы 1 или Формулы 2 активируют связующим реагентом на основе фосфония. В соответствии с одним из аспектов настоящего изобретения, связующий реагент на основе фосфония выбирают из группы, включающей: бензотриазол-1-ил-окси-трис-(диметиламино)фосфония гексафлюорофосфат (ВОР), (бензотриазол-1-ил-окси)трипирролидинфосфония гексафторфосфат (РуВОР), (7-азабензотриазол-1-ил-окси)трипирролидинфосфония гексафторфосфат (РуАОР), 6-хлор-бензотриазол-1-ил-окси-трис-пирролидинфосфония гексафторфосфат (PyClocK), O-[(1-циано-2-этокси-2-оксоэтилиден)амино]-окситри(пирролидин-1-ил)фосфония гексафлюорофосфат (РуОхР), O-[(1-циано-2-этокси-2-оксоэтилиден)амино]-окситри-(пирролидин-1-ил)фосфония тетрафторборат (РуОхВ). Согласно одному аспекту изобретения связующим реагентом на основе фосфония является бензотриазол-1-илокси)трипирролидинфосфония гексафторфосфатом (РуВОР).
Термин «связующий реагент на основе фосфония» в контексте данного изобретения следует понимать как связующий реагент, содержащий соль фосфония, которая при реакции in situ с карбоновой кислотой образует активированную карбоновую кислоту, способную взаимодействовать с полипептидом или белком.
Дипептид согласно настоящему изобретению удивительно стабилен и имеет длительный срок хранения.
Используемый в данном изобретении термин «стабилизированный» или «стабильный», когда речь идет о дипептиде по настоящему изобретению, относится к дипептиду с повышенной химической стабильностью, повышенной физической стабильностью, или одновременно повышенной физической и химической стабильностью.
В соответствии с одним аспектом настоящего изобретения, дипептид по данному изобретению является стабильным в течение более 6 недель использования и в течение более чем 2 лет хранения. Согласно другому аспекту настоящего изобретения дипептид по данному изобретению является стабильным в течение более 4 недель использования и в течение более чем двух лет хранения. Согласно еще одному аспекту изобретения дипептид по настоящему изобретению является стабильным в течение более 4 недель использования и в течение более чем 3 лет хранения. В соответствии с еще одним, отличным от прочих, аспектом изобретения дипептид по данному изобретению является стабильным в течение более 2 недель использования и в течение более 1 года хранения.
Используемый в данном изобретении термин «температура окружающей среды» означает температуру окружающего пространства. В условиях помещения, температура окружающей среды является такой же, как комнатная температура и может, например, составлять 25°С.
Дипептид согласно изобретению прост в обращении и его использование в химии пептидов легче по сравнению с обычным ступенчатым пептидным синтезом в твердой фазе за счет уменьшенного количества стадий химической модификации, таких как стадии снятия защиты и активации.
Согласно одному аспекту изобретения, дипептид по настоящему изобретению может быть использован в способе получения полипептида или белка, содержащего одну или более непротеиногенных аминокислот.
В соответствии с одним аспектом изобретения, дипептид по настоящему изобретению используется в процессе ковалентной конденсации дипептида с полипептидом или белком. Согласно одному аспекту изобретения, дипептид используется в процессе конденсации дипептида с N-концевым амином полипептида или белка. В соответствии с одним аспектом изобретения, дипептид используется в процессе конденсации дипептида с нуклеофилами других молекул, не принадлежащих к химической группе полипептидов и/или белков.
Согласно одному аспекту изобретения, полипептид или белок, к которому присоединяется дипептид, состоит из протеиногенных аминокислот, то есть полипептид или белок, к которому присоединяется дипептид, не содержит никаких непротеиногенных аминокислот.
В соответствии с одним аспектом настоящего изобретения, дипептид по Формуле 1 или по Формуле 2 используется для упомянутой реакции конденсации дипептида с полипептидом или белком с образованием амидной связи между карбоксильной группой дипептида из Формулы 1, т.е. функциональной группы, содержащей R3, или карбоновой кислоты Формулы 2 и свободного амина полипептида или белка. Согласно одному аспекту изобретения, дипептид по Формуле 1 или Формуле 2 подвергают взаимодействию с полипептидом или белком в водной среде с образованием амидной связи между карбоновой кислотой дипептида из Формулы 1 или Формулы 2 и N-концевым амином полипептида или белка.
В соответствии с одним аспектом настоящего изобретения, R1 и/или R2 удаляют после завершения реакции с полипептидом или белком. Согласно одному аспекту данного изобретения, R1 и/или R2 удаляют в одну химическую стадию. В соответствии с одним аспектом настоящего изобретения, R1 и/или R2 удаляют на стадии снятия защитных групп в основных условиях. По одному аспекту данного изобретения, R1 и/или R2 удаляют на стадии снятия защитных групп, включающей добавление основания в реакционную среду. Согласно одному аспекту настоящего изобретения, R1 и/или R2 удаляют на стадии снятия защитных групп, включающей добавление амина в реакционную среду. В соответствии с одним аспектом настоящего изобретения, R1 и/или R2 удаляют на стадии снятия защиты, включающей добавление пиперидина к реакционной среде.
В соответствии с одним аспектом настоящего изобретения, R1 и/или R2 удаляют in situ в одну химическую стадию после завершения реакции ацилирования с полипептидом или белком.
Согласно одному аспекту изобретения, дипептид по изобретению может быть использован в способе получения полипептида или белка, содержащего одну или более непротеиногенных аминокислот. В соответствии с одним аспектом настоящего изобретения, реакцию проводят в растворе. По одному аспекту изобретения, активированный дипептид согласно данному изобретению, подвергают взаимодействию с полипептидом или белком, растворенным в водной среде. Согласно одному аспекту настоящего изобретения, реакцию конденсации проводят путем твердофазного пептидного синтеза, известного специалистам в данной области. Изобретатели установили, что при использовании указанного способа для получения полипептида или белка, содержащего одну или более непротеиногенную аминокислоту и присоединенный к ней N-терминально гистидин, образуется полипептид или белок, в котором остаток гистидина не рацемизируется или незначительно рацемизируется.
В соответствии с одним аспектом настоящего изобретения, способ получения полипептида или белка, содержащего одну или более непротеиногенную аминокислоту, включает следующие шаги:
1. активация дипептида связующим реагентом на основе фосфония,
2. взаимодействие активированного дипептида с полипептидом или белком,
3. удаление защитной группы (групп) in situ в результате чего получают целевой полипептид или белок.
В соответствии с одним аспектом настоящего изобретения, способ получения полипептида или белка, содержащего одну или более непротеиногенную аминокислоту, включает следующие стадии:
1. активация дипептида Формулы 1 или Формулы 2 связующим реагентом на основе фосфония,
2. взаимодействие активированного дипептида с полипептидом или белком,
3. удаление защитной группы (групп) in situ в результате чего получают целевой полипептид или белок.
В соответствии с одним аспектом настоящего изобретения, активированный дипептид подвергают взаимодействию с полипептидом или белком в водной среде. Используемый в изобретении термин «водная среда» или «водные среды» включает любую водосодержащую среду, например воду, физиологический раствор, раствор сахара, трансфузионный раствор, буфер и любые другие легкодоступные водосодержащие среды. Кроме того, водные среды могут содержать один или более растворимый в воде органический растворитель, такой как, без ограничений, диметилформамид (DMF), N-метил-2-пирролидон (NMP), диметилацетамид (DMAC), диметилсульфоксид (DMSO), ацетонитрил, диоксан, водорастворимый ацеталь, такой как, например, диметилацеталь, диэтилацеталь или 1,3-диоксалан и водорастворимый спирт, такой как, например, метанол, этанол, пропанол, 2-пропанол и бутокси-2-этанол.
Согласно одному аспекту изобретения, водная среда, в которой активированный дипептид подвергают взаимодействию с полипептидом или белком, содержит 100-10% воды и, следовательно, 0-90%, дополнительного растворителя(ей), причем неограничивающие примеры дополнительных растворителей могут быть выбраны, например, из группы, включающей DMF, NMP, DMAC, DMSO, ацетонитрил, диоксан, водорастворимый ацеталь, такой как, например, диметилацеталь, диэтилацеталь или 1,3-диоксалан и водорастворимый спирт, такой как, например, метанол, этанол, пропанол, 2-пропанол и бутокси-2-этанол. В соответствии с одним аспектом настоящего изобретения, водная среда содержит 80-20% воды, например 60-30% воды. Согласно одному аспекту настоящего изобретения, водная среда содержит 50-30% воды. В соответствии с одним аспектом изобретения, водная среда содержит около 50% воды. По одному аспекту данного изобретения водная среда содержит около 40% воды. Согласно одному аспекту настоящего изобретения, водная среда содержит около 30% воды.
В соответствии с одним аспектом настоящего изобретения, дипептид растворяют в апротонном органическом растворителе или смеси таких растворителей, например, без ограничений, DMF, NMP, DMAC, DMSO, ацетонитрил и диоксан, причем перед тем, как этот пептид будет добавлен к водной среде, в которой он взаимодействует с пептидом или полипептидом.
Используемый в данном изобретении термин «апротонный» применяется для растворителей, таких как, например, ацетон или дихлорметан, которые, как правило, имеют большие дипольные моменты, то есть в них существует разделение частичных положительных и отрицательных зарядов в пределах одной и той же молекуле и сольватация положительно заряженных частиц за счет отрицательных зарядов диполей. Примеры апротонных растворителей включают, без ограничений, дихлорметан (DCM), тетрагидрофуран (THF), этилацетат, ацетон, DMF, NMP, DMAC, DMSO, ацетонитрил, диоксан и пропиленкарбонат.
Согласно одному аспекту настоящего изобретения, активированный дипептид подвергают взаимодействию с полипептидом или белком на твердой фазе с использованием процедуры, известной специалистам в области химии пептидов, как, например, описано в ISBN 0-7167-7009-1 "Synthetic Peptides", ed. Gregory A. Grant.
В соответствии с одним аспектом настоящего изобретения, связующим реагентом на основе фосфония является РуВОР. Согласно одному аспекту изобретения, защитной группой является Fmoc. По одному аспекту изобретения целевой полипептид или белок получают в растворе.
Согласно одному аспекту настоящего изобретения, защитную группу удаляют в основных условиях. В соответствии с одним аспектом изобретения, защитную группу удаляют при рН, равным, по крайней мере, 7. По одному из аспектов изобретения защитную группу удаляют с помощью пиперидина, 1,8-диазобицикло-ундец-7-ена (ДБУ) или трет-бутиламина.
В соответствии с одним аспектом настоящего изобретения, рН водной реакционной смеси на стадии ацилирования доводят до уровня между рН7 и рН14. Согласно одному аспекту настоящего изобретения, рН реакционной среды находится в диапазоне между рН8 и рН13. В соответствии с другим аспектом изобретения, уровень рН находится между рН8 и рН12. Согласно другому аспекту изобретения, уровень рН находится в диапазоне между рН8 и рН10. В соответствии с другим аспектом настоящего изобретения, уровень рН находится между рН8,3 и рН9,7.
Термин «реакционная смесь» в контексте настоящего изобретения следует понимать как смесь растворителей и реагентов, используемых при взаимодействии дипептида по настоящему изобретению с полипептидом или белком. Реакционная смесь может быть водной, то есть в этой реакционной смеси присутствует вода.
Уровень рН реакционной смеси можно регулировать с помощью средств, известных специалисту в данной области техники. Например, можно применить тест на простой рН индикаторной бумаге (рН индикаторные полоски), либо для измерения рН может быть использован рН-метр, а для того, чтобы довести рН до нужного уровня, кислота или основание могут быть добавлены вручную; либо может быть использован рН-метр с механизмом обратной связи, с помощью которого можно управлять рН раствора.
Кислоты, пригодные для регулирования рН, включают, без ограничения: хлористоводородную кислоту, серную кислоту, гидросульфат, фосфорную, лимонную и уксусную кислоты.
Основания, пригодные для регулирования рН, включают, без ограничения: третичные амины, такие как, без ограничения, триэтиламин или диизопропилэтиламин, N-метилморфолин, гидроксиды щелочных металлов, такие как, без ограничения, гидроксиды лития, натрия, калия, цезия или карбонаты щелочных металлов, такие как, без ограничения, карбонаты калия, натрия, лития, калия, гидрокарбонат натрия или гидрокарбонат лития.
В соответствии с одним аспектом настоящего изобретения, реакционная смесь содержит буфер. Согласно одному аспекту изобретения, буфер выбирают из группы, включающей: фосфатный буфер, натрий-карбонатный буфер, буфер бицин N,N-бис(2-гидроксиэтил)глицина, буфер 3-[4-(2-гидроксиэтил)-1-пиперазинил]пропансульфоновой кислоты (HEPPS), буфер 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновой кислоты (HEPES), буфер 3-(N-морфолино)пропансульфоновой кислоты (MOPS) и триэтиламиновый буфер (TEA). Согласно одному аспекту настоящего изобретения, реакционная смесь содержит триэтиламиновый буфер (TEA).
Перед добавлением к реакционной смеси дипептид может быть активирован, то есть функциональная группа карбоновой кислоты дипептида может быть превращена в активированный сложный эфир этой карбоновой кислоты. При активации дипептида согласно настоящему изобретению, температура реакционной смеси во время стадии активации может быть в пределах между -5°С и 50°С, например, в диапазоне между 0°С и 50°С. Согласно одному аспекту настоящего изобретения, температура находится в диапазоне между 5°С и 40°С. Согласно другому аспекту настоящего изобретения, температура находится в диапазоне между 10°С и 35°С. В соответствии с еще одним аспектом изобретения, температура находится в диапазоне между 15°С до 25°С. И в соответствии со следующим аспектом настоящего изобретения, температура в течение стадии активации составляет около 20°С.
Температура реакционной смеси в ходе стадии ацилирования, где активированный дипептид по настоящему изобретению реагирует с полипептидом или белком, может быть в пределах от -5°С и 50°С, например в диапазоне между 0°С и 50°С. Согласно одному аспекту настоящего изобретения, температура находится в диапазоне между 5°С и 40°С. Согласно другому аспекту настоящего изобретения, температура находится в диапазоне между 10°С и 35°С. В соответствии с еще одним аспектом изобретения, температура находится в диапазоне между 15°С до 25°С. И в соответствии со следующим аспектом настоящего изобретения, температура в течение стадии активации составляет около 20°С.
Термин «полипептид или белок», используемый в настоящем изобретении, означает соединение, состоящее, по крайней мере, из двух аминокислот-компонентов, соединенных полипептидными связями. Аминокислоты-компоненты могут быть выбраны из группы аминокислот, кодируемых генетическим кодом (протеиногенные аминокислоты), кроме того, они могут быть природными аминокислотами, которые не кодируются генетическим кодом, а также синтетическими аминокислотами (непротеиногенные аминокислоты). Протеиногенными аминокислотами являются 22 аминокислоты: аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, цистин, глутамин, глутаминовая кислота, глицин, гистидин, гидроксипролин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серии, треонин, триптофан, тирозин и валин.
Таким образом, непротеиногенная аминокислота представляет собой фрагмент, который может быть включен в полипептид или белок с помощью полипептидных связей, но при этом не является протеиногенной аминокислотой. Примерами являются γ-карбоксиглутамат, орнитин, фосфосерин, D-аминокислоты, такие как D-аланин и D-глутамин. Синтетические непротеиногенные аминокислоты включают аминокислоты, изготовленные путем химического синтеза, т.е. D-изомеры аминокислот, кодируемых генетическим кодом, например D-аланин и D-лейцин, Aib (α-аминоизомасляная кислота), Abu (α-аминомасляная кислота), орнитин, Dap (2,3-диаминопропионовая кислота), Dab (2,4-диаминобутановая кислота), Tle (трет-бутилглицин), 3-аминометилбензойную кислоту, антраниловую кислоту, дезаминогистидин, бета-аналоги аминокислот, такие как β-аланин и т.д., D-гистидин, дезаминогистидин, 2-амино-гистидин, β-гидроксигистидин, гомогистидин, N-ацетилгистидин, α-фторметилгистидин, α-метилгистидин, 3-пиридилаланин, 2-пиридилаланин или 4-пиридилаланин, 1-аминоциклопропилкарбоновую кислоту, 1-аминоциклобутилкарбоновую кислоту, 1-аминоциклопентилкарбоновую кислоту, 1-аминоциклогексилкарбоновую кислоту, 1-аминоциклогептилкарбоновую кислоту или 1-аминоциклооктилкарбоновую кислоту.
Термин "аналог", используемый в настоящем изобретении в применении к полипептиду или белку, означает модифицированный полипептид или белок, в котором один или более аминокислотных остатков полипептида или белка были замещены другими аминокислотными остатками, и/или в которых один или несколько аминокислотных остатков были удалены из полипептида или белка, и/или в котором один или несколько аминокислотных остатков были добавлены в данный полипептид или белок. Такое добавление или удаление аминокислотных остатков может иметь место на N-конце полипептида или белка и/или на С-конце полипептида или белка. Для описания аналогов часто используется простая система: например [Aib8,Arg34]GLP-1(7-37) обозначает аналог GLP-1(7-37) аминокислоты GLP-1 (гюкагоноподобный пептид), в котором находящийся обычно в положении 8 аланин замещен на альфа-аминоизомасляную кислоту, а лизин в положении 34 замещен на аргинин. Под всеми аминокислотами, для которых оптический изомер не указан, следует понимать их L-изомеры. В соответствии со всеми аспектами настоящего изобретения, модификации подверглись максимум 17 аминокислот. В соответствии со всеми аспектами настоящего изобретения, модификации подверглись максимум 15 аминокислот. В соответствии со всеми аспектами настоящего изобретения, модификации подверглись максимум 10 аминокислот. В соответствии со всеми аспектами настоящего изобретения, модификации подверглись максимум 8 аминокислот. В соответствии со всеми аспектами настоящего изобретения, модификации подверглись максимум 7 аминокислот. В соответствии со всеми аспектами настоящего изобретения, модификации подверглись максимум 6 аминокислот. В соответствии со всеми аспектами настоящего изобретения, модификации подверглись максимум 5 аминокислот. В соответствии со всеми аспектами настоящего изобретения, модификации подверглись максимум 4 аминокислоты. В соответствии со всеми аспектами настоящего изобретения, модификации подверглись максимум 3 аминокислоты. В соответствии со всеми аспектами настоящего изобретения, модификации подверглись максимум 2 аминокислоты. В соответствии со всеми аспектами настоящего изобретения, модификации подверглась 1 аминокислота.
В соответствии с одним аспектом настоящего изобретения, С-конец производного соединения по настоящему изобретению может представлять собой или кислоту, или амид. Согласно одному аспекту изобретения, С-конец производного соединения по настоящему изобретению представляет собой амид. Согласно другому аспекту изобретения, С-конец производного соединения согласно настоящему изобретению является кислотой.
Настоящее изобретение особенно пригодно для получения полипептидов или белков, содержащих одну или более непротеиногенную аминокислоту, пригодных для лечения, например, диабета, таких как глюкагоноподобные пептиды и инсулины.
Согласно одному аспекту изобретения, полипептид или белок, который должен реагировать с дипептидом, является глюкагоноподобным пептидом.
Термин «глюкагоноподобный пептид», используемый в настоящем изобретении, означает полипептиды из семейства глюкагонов, эксендинов и их аналоги. Полипептиды семейства глюкагонов, кодируются геном препроглюкагона и включают в себя три небольших полипептида с высокой степенью гомологии, а именно глюкагон (1-29), GLP-1 (1-37) и GLP-2 (1-33). Эксендины представляют собой полипептиды, экспрессируемые в организме ящериц и являющиеся подобно GLP-1 инсулинотропными. Примерами эксендинов являются эксендин-3 и эксендин-4.
Термины GLP-1, GLP-2, эксендин-3 и эксендин-4 известны специалистам в данной области. Например, термины «GLP-1 соединение» или «GLP-1 полипептид», используемые в контексте настоящего изобретения, означают человеческий GLP-1 (7-37), его инсулинотропный аналог и его инсулинотропные производные. Неограничивающими примерами аналогов GLP-1 являются амид GLP-1(7-36), Arg34-GLP-1(7-37), Aib8,Arg34-GLP-1(7-37), Gly8-GLP-1(7-37), амид Val8-GLP-1(7-36) и Val8Asp22-GLP-1(7-37). Неограничивающими примерами производных GLP-1 являются дезамино-His7, Arg26, Lys34(Nε-(γ-Glu(Nα-гексадеканоил)))GLP-1(7-37), дезамино-His7, Arg26, Lys34(Nε-октаноил)-GLP-1(7-37), Arg26,34, Lys38(Nε-(ω-карбоксипентадеканоил))-GLP-1(7-38), Arg26,34, Lys36(Nε-(γ-Glu (αN-гексадеканоил)))-GLP-1(7-36) и Arg34, Lys26(Nε-(γ-Glu(αN-гексадеканоил)))-GLP-1(7-37). По сложившейся практике в данной области номенклатура GLP-1 начинается с гистидин остатка, которому присваивается номер 7, а последующие аминокислотные остатки нумеруются соответственно, заканчиваясь глицином под номером 37. Таким образом, в данном изобретении, как правило, любое упоминание номера аминокислотного остатка или номер позиции в последовательности GLP-1(7-37) относится к этой последовательности начиная с His в положении 7 и заканчивая Gly в положении 37. Аналоги GLP-1 производных, согласно настоящему изобретению, могут быть описаны путем ссылки на
I) номер аминокислотного остатка в нативной последовательности GLP-1(7-37), который соответствует измененному аминокислотному остатку (то есть, на соответствующую позицию в нативном GLP-1), и
II) фактическое изменение.
В соответствии с одним аспектом изобретения, глюкагоноподобный пептид по настоящему изобретению является дипептидиламинопептидаза IV защищенным. В соответствии с другим аспектом изобретения, глюкагоноподобный пептид согласно изобретению является дипептидиламинопептидаза IV защищенным.
Термин «дипептидиламинопептидаза IV защищенный», используемый в настоящем изобретении, означает глюкагоноподобный пептид, например аналог GLP-1, который более устойчив к дипептидиламинопептидазе IV (DPP-IV), чем нативное соединение, например GLP-1(7-37). Такая защита может быть достигнута, например, путем мутации и/или получением производных нативного соединения. Устойчивость GLP-1 соединения по отношению к деградации дипептидиламинопептидазой IV определяется в ходе следующего анализа деградации:
Аликвоты GLP-1 соединения (5 нмоль) инкубируют при 37°С с 1 мкл очищенной дипептидиламинопептидазы IV, соответствующей ферментативной активности 5 мЕд в течение 10-180 минут в 100 мкл 0,1М триэтиламин-HCl буфера, рН 7,4. Ферментативные реакции останавливают добавлением 5 мкл 10% трифторуксусной кислоты, а продукты разложения полипептида разделяют и количественно определяют с помощью ВЭЖХ-анализа. Один метод проведения этого анализа: смеси наносят на 250×4,6 мм колонку Vydac С18 widepore (30 нм поры, 5 мкм частицы) и элюируют при скорости потока 1 мл/мин с линейным и ступенчатым градиентами ацетонитрила в 0,1% трифторуксусной кислоте (0% ацетонитрила в течение 3 мин, 0-24% ацетонитрила в течение 17 мин, 24-48% ацетонитрила в течение 1 мин) в соответствии с Siegel et al., Regul. Pept. 1999;79: 93-102 and Mentlein et al. Eur. J. Biochem. 1993;214: 829-35. Полипептиды и продукты их распада можно мониторировать по их поглощению при 220 нм (пептидные связи) или 280 нм (ароматические аминокислоты) и количественно определять путем интегрирования площадей их пиков относительно стандартных пиков. Скорость гидролиза GLP-1 соединения под действием дипептидиламинопептидазы IV оценивают по време