Пролекарство ингибитора ns5b hcv полимеразы, способ его получения и применения
Иллюстрации
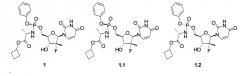
Показать всеНастоящее изобретение относится к новому пролекарству, представляющему собой циклобутил (S)-2-{[(2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-4-фтор-3-гидрокси-4-метил-тетрагидрофуран-2-илметокси]-фенокси-фосфориламино}-пропаноат общей формулы 1, его стереоизомер, кристаллическую или поликристаллическую форму. Пролекарство обладает свойствами ингибитора NS5B HCV полимеразы и может быть использовано при лечении гепатита С. Стереоизомеры указанного соединения представляют собой циклобутил (S)-2-{(S)-[(2R,3R,4R,5R)-5-(3,4-дигидро-2,4-диоксо-2H-пиримидин-1-ил)-3-гидрокси-4-метил-4-фтор-тетрагидрофуран-2-илметокси]-фенокси-фосфориламино}-пропаноат формулы 1.1 или циклобутил (S)-2-{(R)-[(2R,3R,4R,5R)-5-(3,4-дигидро-2,4-диоксо-2H-пиримидин-1-ил)-3-гидрокси-4-метил-4-фтор-тетрагидрофуран-2-илметокси]-фенокси-фосфориламино}-пропаноат формулы 1.2. Поликристаллическая форма указанных соединений представляет собой смесь ромбической и моноклинной форм. Кристаллическая форма представляет собой ромбическую форму. Способ получения пролекарства формул 1, 1.1 и 1.2 заключается во взаимодействии циклобутил (S)-2-(пентафторфенилокси-фенокси-фосфориламино)-пропионата формулы 2 или циклобутил (S)-2-((S)-пентафторфенилокси-фенокси-фосфориламино)-пропионата формулы 2.1 или циклобутил (S)-2-((R)-пентафторфенилокси-фенокси-фосфориламино)-пропионата формулы 2.2 с трет-бутил (2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-(гидроксиметил)-4-метил-4-фтор-тетрагидрофуран-3-ил карбонатом формулы 7 в присутствии алкилмагнийгалогенида с последующим снятием защитной группы. 5 н. и 5 з.п. ф-лы, 3 табл., 10 пр.
Реферат
Настоящее изобретение относится к химиотерапевтическим средствам и их применению для лечения вирусных и раковых заболеваний. Эти соединения являются пролекарствами ингибиторами NS5B HCV полимеразы и предназначены для лечения гепатита С у млекопитающих.
Гепатит С, вызываемый вирусом гепатита С (ВГС), является одним из наиболее распространенных заболеваний печени и широко распространен по всему миру. На основе ежегодных докладов Всемирной организации здравоохранения (ВОЗ) более 130-150 миллионов человек инфицированы ВГС, и более 700 тысяч лиц умирают от ВГС [WHO. Hepatitis С. WHO fact sheet №164. Updated July 2016, http://www.who.int/mediacentre /factsheets/fs164/en/]. ВГС демонстрирует высокое генетическое разнообразие и характеризуется региональными вариациями генотипов (gT) ВГС. Генотип 1 (gT1) является наиболее распространенным во всем мире (83,4 миллиона человек, что составляет 46,2% всех случаев инфицированных ВГС, приблизительно одна треть из которых находится в Восточной Азии). Следующим наиболее распространенным является генотип 3 (gT3). Этим генотипом инфицированы во всем мире 54,3 миллиона человек (30,1%). Генотипы 2, 4, 6 составляют 22,8% всех случаев инфицированных ВГС человек, а генотип 5 (gT5) составляет оставшиеся <1%. В то время как генотипы 1 и 3 доминируют в большинстве стран независимо от экономического статуса, наибольшие доли генотипов 4 и 5 находятся в странах с низким уровнем дохода [Messina, J.P. at al. Global Distribution and Prevalence of Hepatitis С Virus Genotypes. Hepatology 2015, 61(1), 77-87.].
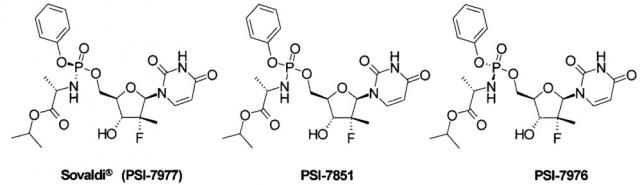
Значительный прогресс в лечении гепатита С был достигнут в последние годы, который связан в первую очередь с открытием Софосбувира (Sofosbuvir, Sovaldi®, PSI-7977, GS-7977), который является пролекарством ингибитором нуклеозида NS5B HCV и Sp-изомером пролекарства PSI-7851 [Sofia, М.J. et al. Discovery of a β-D-20-Deoxy-20-rfluoro-2 0-β-C-methyluridine Sovaldi Nucleotide Prodrug (PSI-7977) for the Treatment of Hepatitis С Virus. J. Med. Chem. 2010, 53, 7202-7218. Sofia, M. J. et al. Nucleoside phosphoramidate prodrugs. Патент US 7964580 (2011), Патент US 8334270 (2012). Патент RU 2478104 (2013)],
Sovaldi® в настоящее время широко используется для комбинированного лечения гепатита С, в том числе совместно с ингибиторами NS5A HCV. Sovaldi® стал первым нуклеотидом, одобренным обоими регулирующими органами FDA и ЕС для комбинированного лечения больных гепатитом С, инфицированных различными генотипами (gT) вируса гепатита С. В клинических испытаниях он показал высокую эффективность против шести генотипов HCV (gT1-gT6) [I.M. Jacobson et al. Sofosbuvir for hepatitis С genotype 2 or 3 in patients without treatment options. Engl. J. Med. 2013, 368, 1867-1877. E. Lewirz et al. Sofosbuvir for previously untreated chronic hepatitis С infection. Engl. J. Med. 2013, 368, 1878-1887].
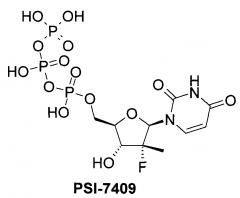
PSI-7851 и его стереоизомеры PSI-7976 и PSI-7977 метаболизируют до трифосфата PSI-7409, который и является ингибитором NS5B HCV полимеразы [Е. Murakami et al. Mechanism of activation of PSI-7851 and its diastereoisomer PSI-7977. J. Biol. Chem. 2010, 285(45), 34337-34347],
.
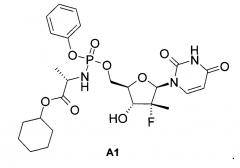
Известны и другие аналоги Sovaldi® [Патент US 8334270 (2012). М.J. Sofia et al. Discovery of a β-D-20-Deoxy-20-r-fluoro-20-β-C-methyluridine Nucleotide Prodrug (PSI-7977) for the Treatment of Hepatitis С Virus. J. Med. Chem. 2010, 53, 7202-7218.], в том числе циклогексил (S)-2-{[(2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-4-фтор-3-гидрокси-4-метил-тетрагидрофуран-2-илметокси]-фенокси-фосфориламино}-пропионат формулы А1, который, как и PSI-7851 и его фосфорные стереоизомеры PSI-7976 и PSI-7977 (Sovaldi®), также метаболизируют до трифосфата PSI-7409,
Несмотря на прогресс, достигнутый в последние годы в терапии гепатита С, остается актуальной задача поиска новых пролекарств ингибитора NS5B ВГС с улучшенными свойствами.
Авторы неожиданно обнаружили, что неизвестное ранее соединение общей формулы 1 и его фосфорный стереоизомер формулы 1.1 или формулы 1.2 (Sp-стереоизомер формулы 1.1 или Rp-стереоизомер формулы 1.2) являются эффективными пролекарствами ингибитора NS5B HCV полимеразы, представляющими интерес в качестве противовирусного средства, в том числе для лечения гепатита С,
Ниже приведены определения различных терминов, используемых для описания данного изобретения. Эти определения применимы к терминам, как они использованы в данном описании и формуле изобретения, если иным не ограничены в конкретных случаях либо по отдельности, либо как часть большей группы.
Термин «кристаллическая форма» означает структуру вещества, характеризующуюся упаковкой образующих ее молекул в один из видов кристаллической решетки.
Термин «поликристаллическая форма» означает структуру вещества, имеющую поликристаллическое строение, т.е. состоящую из множества мелких монокристаллов, т.е. кристаллитов определенной кристаллической формы.
Термин «активный компонент» (лекарственное вещество) относится к физиологически активному веществу синтетического или иного (биотехнологического, растительного, животного, бактерицидного и так далее) происхождения, обладающему фармакологической активностью, которое является активным ингредиентом фармацевтической композиции.
Термин «лекарственный препарат» означает вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, инъекций, мазей и др. готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.
Термин «терапевтический коктейль» представляет одновременно администрируемую комбинацию двух и более лекарственных препаратов, обладающих различным механизмом фармакологического действия и направленных на различные биомишени, участвующие в патогенезе заболевания.
Термин «фармацевтическая композиция» обозначает композицию, включающую в себя соединение формулы 1 и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих и воспринимающих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например, сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например, моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие, как оливковое масло) и инъекционные органические сложные эфиры (такие, как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, альгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного компонента, одного или в комбинации с другим активным компонентом, может быть введена животным и людям в стандартной форме введения, в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения.
Термин «инертный наполнитель», используемый в данном описании, относится к соединению, которое используют для получения фармацевтической композиции, и, как правило, безопасному, нетоксичному и ни биологически, ни иным образом нежелательному, и включает в себя вспомогательные вещества, которые являются приемлемыми для применения в ветеринарии, а также фармакологически приемлемыми для человеческого использования. Соединения по данному изобретению могут быть введены отдельно, но обычно их будут вводить в смеси с одним или более фармацевтически приемлемыми эксципиентами, разбавителями или носителями, выбранными с учетом предполагаемого пути введения и стандартно фармацевтической практики.
Термин «терапевтически эффективное количество», используемый здесь, означает количество субстанции, пролекарства или лекарства, необходимое для уменьшения симптомов заболевания у субъекта. Доза субстанции, пролекарства или лекарства будет соответствовать индивидуальным требованиям в каждом конкретном случае. Эта доза может варьироваться в широких пределах в зависимости от многочисленных факторов, таких как тяжесть заболевания, подлежащего лечению, возраста и общего состояния здоровья пациента, других лекарственных средств, с помощью которых пациент проходит лечение, способа и формы введения и опыта лечащего врача. Для перорального введения суточная доза составляет приблизительно от 0,01 до 10 г, включая все значения между ними, в день в монотерапии и/или в комбинированной терапии. Предпочтительная суточная доза составляет примерно от 0,1 до 7 г в день. Как правило, лечение начинают с большой начальной «нагрузочной дозы», чтобы быстро уменьшить или устранить вирус, сопровождающей убывающую дозу до уровня, достаточного для предотвращения всплеска инфекции.
Термин «субъект» означает млекопитающее, которое включает, но не ограничивается ими, крупный рогатый скот, свиней, овец, кур, индеек, буйволов, лам, страусов, собак, кошек и человека, предпочтительно субъектом является человек. Предполагается, что в способе лечения субъекта может быть пролекарство общей формулы 1, его стереоизомер, изотопно-обогащенный аналог, его фармацевтически приемлемая соль, гидрат, сольват, кристаллическая и полиморфная форма, либо в сочетании их с другим соединением, в том числе с ингибитором NS5A HCV.
Предметом данного изобретения являются циклобутил (S)-2-{[(2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-4-фтор-3-гидрокси-4-метил-тетрагидрофуран-2-илметокси]-фенокси-фосфориламино}-пропаноат общей формулы 1, его фосфорные стереоизомеры (Sp-стереоизомер формулы 1.1 или Rp-стереоизомер формулы 1.2), их изотопно-обогащенный аналог, кристаллическая и поликристаллическая форма.
Предметом данного изобретения являются пролекарство ингибитора NS5B HCV полимеразы, представляющее собой соединение общей формулы 1, его фосфорный стереоизомер (Sp-стереоизомер формулы 1.1 или Rp-стереоизомер формулы 1.2), их изотопно-обогащенный аналог, кристаллическая и поликристаллическая форма в качестве лекарственного препарата для лечения гепатита С у человека или теплокровного животного, нуждающегося в этом.
Предпочтительным пролекарством является циклобутил (S)-2-{(S)-[(2R,3R,4R,5R)-5-(3,4-дигидро-2,4-диоксо-2H-пиримидин-1-ил)-3-гидрокси-4-метил-4-фтор-тетрагидрофуран-2-илметокси]-фенокси-фосфориламино}-пропаноат (1.1), его изотопно-обогащенный аналог, кристаллическая и поликристаллическая форма.
Неожиданно новое пролекарство общей формулы 1, его фосфорные стереоизомеры, их изотопно-обогащенные аналоги, кристаллические и поликристаллические формы оказались более эффективным пролекарством ингибитором NS5B HCV, чем известные пролекарства ингибиторы NS5B HCV, в том числе более эффективным, чем Sovaldi® и циклогексиловый эфир формулы А1.
Действительно, Sovaldi® по отношению к генотипу 1b (gT1b) HCV имеет ЕС50=0.045-0.170 μМ [http://www.hcvdruginfo.ca/downloads/HCV_Sofosbuvir.pdf] и ЕС90=0.59 μМ, а новое пролекарство формулы 1.1 имеет ЕС50=15.0-27.0 нМ и ЕС90=128.0 нМ (Таблица 1а), т.е. новое пролекарство формулы 1.1 более чем в три раза активнее, чем Sovaldi®. Время полураспада пролекарства формулы 1.1 в S9 фракции микросом печени человека составляет T1/2hS9=0,05 ч, а у Sovaldi® соответственно T1/2hS9=0.54 ч (Таблица 2), т.е. новое пролекарство формулы 1.1 в 11 раз быстрее метаболизирует в S9 фракции микросом печени человека, чем Sovaldi®. Кроме того, концентрация и AUC24 ч трифосфата PSI-7409, образующегося при метаболизме пролекарства формулы 1.1 в печени крыс, составляют Cmax=3,224.0 нг/г и AUC24 ч=30,487.0 нг ч/г, в то время как при аналогичном метаболизме Sovaldi® имеет Cmax=1,934.0 нг/г и AUC24 ч=16,796.0 нг.ч/г (Таблица 3). Это свидетельствует о том, что новое пролекарство формулы 1.1 почти в 2 раза более эффективно метаболизирует в печени в нужный трифосфат PSI-7409 (лекарство).
Еще большую эффективность новое пролекарство формулы 1.1 имеет по сравнению с известным циклогексиловым эфиром формулы А1, поскольку известно [М.J. Sofia et al. J. Med. Chem. 2010, 53, 7202-7218], что он имеет следующие параметры: ЕС90=250.0 нМ, T1/2hS9=1,4 ч, Cmax=557 нг/г и AUC24 ч=6,484.0 нг.ч/г.
Полученные результаты (эффект) являются неожиданными, поскольку пролекарство формулы 1.1, представляющее собой циклобутиловый эфир, который не только значительно эффективнее своего аналога - циклогексилового эфира формулы А1, но и активнее другого аналога - циклопропилового эфира формулы А2 (ЕС90=73.0 нМ, ЕС90=410.0 нМ в Таблице 1а), который был специально получен изобретателями для большей наглядности неожиданного эффекта,
Неожиданность состоит в том, что в ряду циклоалкиловых эфиров наиболее эффективным оказался циклобутиловый эфир формулы 1.1 с промежуточным размером циклоалкила, а менее эффективными оказались эфиры с большим размером циклоалкила (известный циклогексиловый эфир формулы А1) и меньшим размером циклоалкила (специально полученный изобретателями циклопропиловый эфир формулы А2).
Приведенные выше данные убедительно подтверждают новизну изобретения и его изобретательский уровень (эффективность).
Предметом настоящего изобретения является лекарственный препарат, обладающий свойствами ингибитора NS5B HCV полимеразы, представляющий собой соединение общей формулы 1, его стереоизомер, изотопно-обогащенный аналог, кристаллическая и поликристаллическая форма, в терапевтически эффективном количестве, для лечения гепатита С у человека или теплокровного животного, нуждающегося в этом.
Предметом настоящего изобретения является фармацевтическая композиция в терапевтически эффективном количестве для лечения вируса гепатита С у млекопитающих, содержащая пролекарство общей формулы 1, его стереоизомер, изотопно-обогащенный аналог, кристаллическая или поликристаллическая форма, необязательно в комбинации с фармацевтически приемлемым наполнителем, носителем, добавкой, разбавителем.
Пролекарство общей формулы 1, его стереоизомер, изотопно-обогащенный аналог, кристаллическая или поликристаллическая форма могут быть приготовлены в виде самых разнообразных перорально вводимых лекарственных форм и носителей, пероральное введение может быть в форме таблеток, таблеток с покрытием, твердых и мягких желатиновых капсул, растворов, эмульсий, сиропа или суспензии. Соединения по настоящему изобретению являются эффективными при введении в виде суппозитория. Наиболее удобным способом введения обычно является пероральный с использованием обычной суточной схемы приема лекарственных доз, который можно регулировать в зависимости от тяжести заболевания и реакции пациента на противовирусное и противоопухолевое лекарство.
Пролекарство общей формулы 1, его стереоизомер, изотопно-обогащенный аналог, кристаллическая или поликристаллическая форма вместе с одним или несколькими обычными эксципиентами, носителями или разбавителями могут быть представлены в форме фармацевтических композиций и их единичных доз. Фармацевтические композиции и стандартные лекарственные формы могут состоять из обычных ингредиентов в обычных пропорциях с или без дополнительных активных соединений и лекарственных форм. Фармацевтическая композиция может содержать любое соответствующее эффективное количество активного ингредиента, соразмерное с назначенной суточной дозой. Фармацевтические композиции могут быть использованы в виде твердых веществ, таких как таблетки или заполненные капсулы, в виде полутвердых порошков, препаратов с замедленным высвобождением или жидкостей, таких как суспензии, эмульсии или заполненные капсулы для перорального применения; или в форме суппозиториев для ректального или вагинального введения. Типичный препарат будет содержать примерно от 5% вес. до 95% вес. активного соединения или соединения. Термин «препарат» или «лекарственная форма» предназначен для включения как твердых, так и жидких композиций активного соединения, и специалисту в данной области техники будет понятно, что активный ингредиент может существовать в виде различных препаратов в зависимости от требуемой дозы и фармакокинетических параметров.
Препараты в твердой форме включают порошки, таблетки, пилюли, капсулы, суппозитории и диспергируемые гранулы. Твердый носитель может представлять собой одно или несколько веществ, которые могут также действовать как разбавители, корригенты, солюбилизаторы, смазывающие вещества, суспендирующие агенты, связующие вещества, консерванты, дезинтегрирующие таблетки агенты или инкапсулирующий материал. В порошках носитель обычно представляет собой тонкоизмельченное твердое вещество, которое представляет собой смесь с тонкоизмельченным активным компонентом. В таблетках активный компонент обычно смешивают с носителем, имеющим необходимую связывающую способность, в подходящих пропорциях и спрессовывают в желаемую форму желаемого размера. Подходящие носители включают, но не ограничиваются ими, карбонат магния, стеарат магния, тальк, сахар, лактозу, пектин, декстрин, крахмал, желатин, трагакант, метилцеллюлозу, натрийкарбоксиметилцеллюлозу, легкоплавкий воск, масло какао и тому подобное. Препараты в твердой форме могут содержать в дополнение к активному компоненту красители, ароматизаторы, стабилизаторы, буферы, искусственные и природные подсластители, диспергаторы, загустители, солюбилизирующие агенты и тому подобное.
Жидкие составы также пригодны для перорального введения. Жидкие лекарственные формы представляют собой эмульсии, сиропы, эликсиры и водные суспензии. Они включают твердые формы препаратов, которые предназначены для превращения в жидкие препараты непосредственно перед использованием. Эмульсии могут быть приготовлены в растворах, например, в водных растворах пропиленгликоля или могут содержать эмульгаторы, такие как лецитин, моноолеат сорбита или гуммиарабик. Водные суспензии могут быть приготовлены диспергированием тонкоизмельченного активного компонента в воде с вязкими материалами, такими как природные или синтетические камеди, смолы, метилцеллюлоза, натрийкарбоксиметилцеллюлоза и другими хорошо известными суспендирующими агентами.
Пролекарство общей формулы 1, его стереоизомер, изотопно-обогащенный аналог, кристаллическая или поликристаллическая форма могут быть приготовлены для введения в виде суппозиториев. Низкоплавкий воск, такой как смесь глицеридов жирных кислот или масло какао, сначала расплавляют и активный компонент гомогенно диспергируют, например, перемешиванием. Расплавленную гомогенную смесь затем выливают в формы удобного размера, дают остыть и затвердеть.
Пролекарство общей формулы 1, его стереоизомер, изотопно-обогащенный аналог, кристаллическая или поликристаллическая форма могут быть приготовлены для вагинального введения. Применение суппозиториев, тампонов, кремов, гелей, паст, пен или спреев, содержащих в дополнение к активному ингредиенту такие носители, которые известны в данной области техники, будет уместно.
Предметом настоящего изобретения является использование пролекарства общей формулы 1, его стереоизомера, изотопно-обогащенного аналога, кристаллической или поликристаллической формы в производстве лекарственного средства для лечения вируса гепатита С. Предполагается, что пролекарство, представленное общей формулой 1, его стереоизомер, изотопно-обогащенный аналог, кристаллическая или поликристаллическая форма, используемые в производстве лекарственного средства для лечения любого противовирусного заболевания, описанного здесь, могут представлять собой любое из соединений общей формулы 1, выбранное из:
циклобутил (S)-2-{[(2R,3R,4R,5R)-5-(3,4-дигидро-2,4-диоксо-2H-пиримидин-1-ил)-3-гидрокси-4-метил-4-фтор-тетрагидрофуран-2-илметокси]-фенокси-фосфориламино}-пропаноата (1),
циклобутил (S)-2-{(S)-[(2R,3R,4R,5R)-5-(3,4-дигидро-2,4-диоксо-2H-пиримидин-1-ил)-3-гидрокси-4-метил-4-фтор-тетрагидрофуран-2-илметокси]-фенокси-фосфориламино}-пропаноата (1.1),
и циклобутил (S)-2-{(R)-[(2R,3R,4R,5R)-5-(3,4-дигидро-2,4-диоксо-2H-пиримидин-1-ил)-3-гидрокси-4-метил-4-фтор-тетрагидрофуран-2-илметокси]-фенокси-фосфориламино}-пропаноата (1.2),
их изотопно-обогащенного аналога, кристаллической или поликристаллической формы либо по отдельности, либо в сочетании с другим соединением по настоящему изобретению.
Предметом настоящего изобретения является способ комбинированного лечения и/или профилактики субъекта, нуждающегося в этом, причем указанный способ включает введение субъекту терапевтически эффективного количества пролекарства, представленного общей формулой 1, его стереоизомера, изотопно-обогащенного аналога, кристаллической или поликристаллической формы и терапевтически эффективного количества другого противовирусного или противоракового агента; в котором используют параллельное или альтернативное введение агентов. Понятно, что время между последовательным введением агентов может находиться в диапазоне между 1-24 ч, который включает в себя любой поддиапазон между ними.
Примеры «других противовирусных агентов» включают в себя, но не ограничиваются ими: ингибиторы HCV NS3 протеазы [US 20140296136, US 8,987,195, US 7973040, US 2012214783], ингибиторы NS4 HCV [EP 1497282], ингибиторы NS3/NS4 HCV [ЕР 2364984], ингибиторы NS5A HCV [С. Wang et al. Hepatitis С virus RNA elimination and development of resistance in replicon cells treated with BMS-790052. Antimicrob. Agents Chemother. 2012, 56, 1350-1358. https://en.wikipedia.org/wiki/Daclatasvir; A.V. Ivachtchenko et al. Discovery of Novel Highly Potent Hepatitis С Virus NS5A Inhibitor (AV4025). J. Med. Chem. 2014, 57, 7716-7730; Pat. Appl. US 14/845,333); агонисты Толл-подобных рецепторов (WO 2015023958, WO 2012097012); и другие ингибиторы (WO 2014106019, WO 2014033176, WO 2014033170, WO 2014033167, WO 2013006394, US 20090163545].
Более предпочтительной является фармацевтическая противовирусная композиция, которая вместе с новым пролекарством общей формулы 1 или его стереоизомером формулы 1.1, изотопно-обогащенным аналогом, кристаллической или поликристаллической формой дополнительно включает в себя антивирусное или противораковое лекарственное средство в терапевтически эффективном количестве.
Более предпочтительной является фармацевтическая противовирусная композиция, которая вместе с новым пролекарством общей формулы 1 или его стереоизомером формулы 1.1, изотопно-обогащенным аналогом, кристаллической или поликристаллической формой дополнительно содержит терапевтически эффективное количество ингибитора NS5A HCV, выбранного из группы, включающей:
Даклатасвир (Daclatasvir) (Daklinza, BMS790052) [Belema, М. et al. Discovery and Development of Hepatitis С Virus NS5A Replication Complex Inhibitors. J. Med. Chem. 2014, 57, 1643-1672. Bachand, C. et al. Hepatitis С virus inhibitors. Patent WO 2008/021927, 2008. Bachand, C. et al. Hepatitis с virus inhibitors. Patent WO 2008/021928, 2008. Bachand, C. et al. Hepatitis С virus inhibitors. Patent WO 2008/021936, 2008.
http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_Public_assessment report/human/003768/ WC500172849.pdf.]
Гепавивир (Hepavivir) (AV-4025) [Ivachtchenko, A.V. et al. Discovery of Novel Highly Potent Hepatitis С Virus NS5A Inhibitor (AV4025). J. Med. Chem. 2014, 57, 7716-7730. Patent WO 2012/074437, 2012. Patent US 9428491, 2016.]
AV-4056 и AV-4058 [US 9428491.]
AV-4067 и AV-4084 [Pat. Appl. US 14/845,333.]
Омбитасвир (Ombitasvir) (АВТ-267) [Gardelli, С. et al. Phosphoramidate Prodrugs of 20-C-Methylcytidine for Therapy of Hepatitis С Virus Infection. J. Med. Chem. 2014, 57, 2047-2057. Patent WO 2010/144646, 2010.]
Элбасвир (Elbasvir) (MK-8742), [Coburn, C.A. et al. ChemMedChem. 2013, 8, 1930-1940. Patent WO 2012/040923, 2012. Patent WO 2012/041014, 2012]
Велпатасвир (Velpatasvir) (VEL, GS-5816), [Patent WO 2015/110048, 2015. http://www.accessdata.fda.gov/ drugsatfdadocs/ nda/2016/2083410 rigls000PharmR.pdf]. http://www.gilead.com/~/media/files/pdfs/ medicines/liver-disease/epclusa/epclusa_pi.pdf]
Ингибитор неструктурированного белка 3 ВГС (NS3 HCV) Нарлапревир (Narlaprevir, SCH 900518) [Arasappan A. et al. Discovery of Narlaprevir (SCH 900518): A Potent, Second Generation HCV NS3 Serine Protease Inhibitor. ACS Med. Chem. Lett., 2010, 1 (2), 64-69]
и ингибитор неструктурированного белка NS3/NS4 ВГС (NS3/4A HCV) Симепревир (Simeprevir, Olysio) [https://www.tga.gov.au/sites/default/files/auspar-simeprevir-141027-pi.docx]
Предметом настоящего изобретения является способ комбинированного лечения вирусных и раковых заболеваний у субъекта, нуждающегося в этом, причем указанный способ включает в себя последовательное или одновременное введение терапевтически эффективного количества пролекарства, представленного общей формулой 1, его стереоизомера, изотопно-обогащенного аналога, кристаллической или поликристаллической формы и другого антивирусного или противоракового средства. Понятно, что время между раздельным введением препаратов может находиться в любом диапазоне.
Предполагается, что другой антивирусный агент представляет собой, но не ограничивается: интерферон-альфа, интерферон-бета, пегилированный интерферон-альфа, рибавирин, левовирин, вирамидин, другой нуклеозидный HCV полимеразный ингибитор, ненуклеозидный HCV полимеразный ингибитор, HCV протеазный ингибитор, HCV хеликазный ингибитор или HCV ингибитор слияния, ингибитор полимеразы ДНК HBV и ингибитор ВИЧ-1 обратной транскриптазы (RT). Когда пролекарство или его производное или соль вводят в комбинации с другим антивирусным или противораковым агентом, активность может быть увеличена по сравнению с исходным пролекарством. Когда лечение комбинированное, то введение препаратов может быть одновременным или последовательным по отношению к пролекарству, представленному общей формулой 1. Понятие «одновременное введение», используемое здесь, таким образом, включает в себя введение агентов в то же время или в разное время. Прием двух или более агентов в то же время может быть достигнут с помощью одной препаративной формы, содержащей два или более активных ингредиентов, или, по существу, одновременного введения двух или более лекарственных форм с одним активным агентом. Следует понимать, что ссылки здесь на лечение распространяются и на профилактику. Кроме того, термин «лечение» вирусной инфекции, как он использован здесь, включает также лечение или профилактику заболевания или состояния, связанного с опосредованной вирусной инфекцией, или их клинических симптомов.
Настоящее изобретение представляет собой способ получения пролекарства общей формулы 1, его стереоизомера, изотопно-обогащенного аналога, кристаллической или поликристаллической формы, включающий использование неизвестного ранее циклобутил (S)-2-(пентафторфенилокси-фенокси-фосфориламино)-пропионата формулы 2 или его стереоизомеров циклобутил (S)-2-((5)-пентафторфенилокси-фенокси-фосфориламино)-пропионата формулы 2.1 и циклобутил (S)-2-((R)-пентафторфенилокси-фенокси-фосфориламино)-пропионата формулы 2.2, которые также являются предметом данного изобретения,
Авторы неожиданно обнаружили, что новое пролекарство общей формулы 1 и его фосфорные стереоизомеры (Sp-стереоизомер формулы 1.1 и Rp-стереоизомер формулы 1.2) являются более эффективными пролекарствами ингибиторами NS5B HCV, в том числе более эффективными, чем известные Sovaldi® и циклогексиловый эфир формулы А1, а также неизвестный ранее циклопропиловый эфир (препарат сравнения) формулы А2.
Действительно, Sovaldi® по отношению к генотипу 1b (gT1b) HCV имеет ЕС50=45-170 нМ и ЕС90=590 нМ, циклогексиловый эфир формулы А1 имеет ЕС90=250.0 нМ, а циклопропиловый эфир формулы А2 имеет ЕС90=73.0 нМ и ЕС90=410.0 нМ (Таблица 1). Новое пролекарство формулы 1.1 имеет ЕС50=15.0-27.0 нМ и ЕС90=128.0 нМ (Таблица 1а), т.е. новое пролекарство формулы 1.1 более чем в три раза активнее, чем Sovaldi®, в два раза активнее, чем соединение формулы А1, и более чем в три раза активнее, чем соединение формулы А2.
Время полураспада пролекарства формулы 1.1 в S9 фракции микросом печени человека составляет T1/2hS9=0,05 ч, у Sovaldi® соответственно T1/2hS9=0.54 ч, а у циклогексилового эфира формулы A1 T1/2hS9=1,4 ч, (Таблица 2), т.е. новое пролекарство формулы 1.1 в 11 раз быстрее метаболизирует в S9 фракции микросом печени человека, чем Sovaldi® и в 28 раз быстрее, чем циклогексиловый эфир формулы А1. Кроме того, концентрация и AUC24 ч трифосфата PSI-7409, образующегося при метаболизме пролекарства формулы 1.1 в печени крыс, составляют Cmax=3,224.0 нг/г и AUC24 ч=30,487.0 нг.ч/г, в то время как при аналогичном метаболизме Sovaldi® имеет Cmax=1,934.0 нг/г и AUC24 ч=16,796.0 нг.ч/г, а циклогексиловый эфир формулы А1 имеет Cmax=557 нг/г и AUC24 ч=6,484.0 нг.ч/_(Таблица 3). Это свидетельствует о том, что новое пролекарство формулы 1.1 почти в 2 раза более эффективно метаболизирует в печени в нужный трифосфат PSI-7409 (лекарство), чем Sovaldi®, и в 4,7 раза более эффективно метаболизирует, чем циклогексиловый эфир формулы А1.
Полученные результаты (эффект) являются неожиданными, поскольку пролекарство формулы 1.1, представляющее собой циклобутиловый эфир, который не только значительно эффективнее своего аналога - циклогексилового эфира формулы А1, но и еще активнее другого аналога - циклопропилового эфира формулы А2 (ЕС90=73.0 нМ, ЕС90=410.0 нМ в Таблице 1a), который был специально получен изобретателями для большей наглядности неожиданного эффекта.
Настоящее изобретение далее будет описано в связи с определенными вариантами осуществления, которые не предназначены для ограничения его объема. Напротив, настоящее изобретение охватывает все альтернативы, модификации и эквиваленты, которые могут быть включены в объем формулы изобретения. Таким образом, следующие примеры, которые включают в себя конкретные варианты, иллюстрируют, но не ограничивают настоящее изобретение.
Пример 1. Протокол синтеза пролекарства циклобутил (S)-2-{[(2R,3R,4R,5R)-5-(3,4-дигидро-2,4-диоксо-2H-пиримидин-1-ил)-3-гидрокси-4-метил-4-фтор-тетрагидрофуран-2-илметокси]-фенокси-фосфориламино}-пропаноата общей формулы 1 и его стереоизомеров формул 1.1 и 1.2 (Схема 1).
Схема 1
К раствору N-Boc-L-аланина (4: 15,5 г, 81,9 ммоль) в 300 мл дихлорметана при 0°С добавляют DCC (16,9 г, 81,9 ммоль) и через 5 мин циклобутанол (3: 5,6 г, 78,0 ммоль) и DMAP (2,0 г, 16,4 ммоль). Смесь оставляют перемешиваться на ночь при комнатной температуре, упаривают в вакууме и остаток обрабатывают 300 мл этилацетата. Осадок отфильтровывают и промывают этилацетатом. Фильтрат промывают 5% раствором лимонной кислоты (2×100 мл), насыщенным раствором NaHCO3 (2×100 мл), рассолом, сушат над Na2SO4 и упаривают в вакууме. Получают 19,6 г (98%) (S)-циклобутил 2-(трет-бутоксикарбониламино)-пропаноат (5) в виде белого порошка. 1Н ЯМР (400 МГц, ДМСО-d6) δ 7.22 (d, J=7.2 Hz, 0.85Н), 6.87 (m, 0.15H), 4.89 (p, J=7.2 Hz, 1H), 3.94 (m, 1H), 2.26 (m, 2H), 1.98 (m, 2H), 1.74 (m, 1H), 1.59 (m, 1H), 1.38 (s, 7.5H), 1.34 (brs, 1.5H), 1.22 (d, J=7.2Hz, 3H).
К раствору соединения формулы 5 (19,6 г, 80,6 ммоль) в 50 мл диоксана добавляют 230 мл 3М HCl в диоксане, смесь оставляют перемешиваться на ночь и затем упаривают в вакууме. Остаток обрабатывают 400 мл эфира и оставляют перемешиваться на ночь. Осадок отфильтровывают, промывают эфиром и сушат в вакууме. Получают 14,1 г (97%) (S)-циклобутил 2-амино-пропаноат гидрохлорид (6) в виде белого порошка. 1Н ЯМР (400 МГц, ДМСО-d6) δ 8.56 (brs, 3Н), 5.00 (р, J=7.6 Hz, 1H), 4.02 (q, J=7.2 Hz, 1H), 2.31 (m, 2H), 2.07 (m, 2H), 1.78 (m, 1H), 1.62 (m, 1H), 1.41 (d, J=7.2 Hz, 3H).
К раствору соединения формулы 6 (14,4 г, 80,2 ммоль) в 214 мл дихлорметана добавляют фенилдихлорфосфат (16,9 г, 80,2 ммоль). Смесь охлаждают до -75-70°С и по каплям добавляют раствор триэтиламина (16,2 г, 160,4 ммоль) в 16 мл дихлорметана, поддерживая температуру -75-70°С. Смесь перемешивают при -70°С в течение 30 мин и затем нагревают до -20°С. Добавляют раствор пентафторфенола (14,6 г, 79,4 ммоль) в 105 мл дихлорметана при -20-10°С, затем по каплям раствор триэтиламина (8,1 г, 80,2 ммоль) в 8 мл дихлорметана и смесь оставляют перемешиваться на ночь при комнатной температуре. Смесь упаривают в вакууме, добавляют 500 мл этилацетата и 500 мл воды, органический слой отделяют, промывают 5% раствором NaHCO3, рассолом, сушат над Na2SO4 и упаривают в вакууме. К остатку добавляют 200 мл смеси гексан/этилацетат 6:1 и оставляют перемешиваться на ночь. Образовавшийся осадок отфильтровывают, промывают 50 мл смеси гексан/этилацетат 6:1 и сушат на воздухе. Получают 16,7 г циклобутил (S)-2-((перфторфенокси)(фенокси)фосфориламино)-пропаноат (2).
Полученный продукт формулы 2 перекристаллизовывают из 500 мл смеси гексан/этилацетат 4:1 и получают 13,8 г (37%) циклобутил (S)-2-((S)-(перфторфенокси)-(фенокси)-фосфориламино)пропаноат (2.1) в виде белого рыхлого порошка. 1Н ЯМР (300 МГц, ДМСО-d6) δ 7.42 (m, 2Н), 7.24 (m, 3Н), 6.87 (dd, J1=14.1 Hz, J2=10.2 Hz, 1H), 4.87 (p, J=7.5 Hz, 1H), 3.94 (m, 1H), 2.23 (m, 2H), 1.94 (m, 2H), 1.71 (m, 1H), 1.58 (m, 1H), 1.27 (d, J=7.2 Hz, 3Н). Маточный раствор от промывки смесью гексан/этилацетат 6:1 при перекристаллизации соединения формулы 2.1 упаривают в вакууме и трижды перекристаллизовывают из гексана. Получают циклобутил (S)-2-((R)-(перфторфенокси)-(фенокси)-фосфориламино)-пропаноат (2.2) в виде белого рыхлого порошка. 1Н ЯМР (300 МГц, ДМСО-d6) δ 7.42 (m, 2Н), 7.26 (m, 3Н), 6.85 (dd, J1=13.8 Hz, J2=10.2 Hz, 1H), 4.88 (p, J=7.5 Hz, 1H), 3.95 (m, 1H), 2.24 (m, 2H), 1.93 (m, 2H), 1.72 (m, 1H), 1.59 (m, 1H), 1.28 (d, J=6.9 Hz, 3H).
К раствору трет-бутил (2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-(гидроксиметил)-4-метил-4-фтор-тетрагидрофуран-3-ил карбоната (7:5 г, 13,9 ммоль) в 165 мл ТГФ добавляют 1М раствор трет-бутилмагния хлорида в ТГФ (31,3 мл, 31,3 ммоль) под аргоном при 0°С и смесь перемешивают в течение 30 мин при комнатной температуре. Затем при помощи шприца добавляют раствор соединения формулы 2.1 (7,8 г, 16,7 ммоль) в 30 мл ТГФ при 0-5°С и смесь перемешивают под аргоном в течение суток. К смеси добавляют 10 мл метанола и упаривают в вакууме. Остаток растворяют в 500 мл этилацетата, промывают 5% раствором лимонной кислоты, 5% раствором NaHCO3, сушат над Na2SO4 и упаривают в вакууме. Остаток хроматографируют на силикагеле (элюент гексан/этилацетат 1:2). Получают 5,89 г (66%) циклобутил (S)-2-((S)-(((2R,3R,4R,5R)-3-(трет-бутоксикарбонилокси)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-метил-4-фтор-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноат (8.1) в виде бесцветной застывшей пены. LC-MS (ESI) 642 (М+Н)+.
Аналогично получают циклобутил (S)-2-((((2R,3R,4R,5R)-3-(трет-бутоксикарбонилокси)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-метил-4-фтор-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноат (8). Выход 52%. LC-MS (ESI) 642 (М+Н)+, исходя из полупродуктов формул 7 и 2, и циклобутил (S)-2-((R)-(((2R,3R,4R,5R)-3-(трет-бутоксикарбонилокси)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-метил-4-фтор-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноат (8.2). Выход 59%. LC-M