Химические соединения
Иллюстрации
Показать всеИзобретение относится к соединению формулы (I)
в которой R1 представляет собой метил или этил и R2 представляет собой (С2-3)алкил, замещенный группой гидрокси; или его фармацевтически приемлемой соли. Также изобретение относится к соединению, представляющему собой 1-[4-[5-[5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил]-1-этил-1,2,4-триазол-3-ил]-1-пиперидил]-3-гидроксипропан-1-он, к комбинации, подходящей для применения в лечении рака, опосредованного PI3K-α или PI3K-δ, к фармацевтической композиции, к способу отбора пациента для лечения рака и к способу лечения пациента, страдающего раком. Технический результат: получены новые соединения, обладающие свойствами ингибитора киназы PI3K-α или PI3K-δ, которые могут быть полезны при лечении рака. 6 н. и 11 з.п. ф-лы, 13 ил., 9 табл., 11 пр.
Реферат
Изобретение относится к некоторым новым производным аминопиразина или их фармацевтически приемлемым солям, которые обладают противораковой активностью и, соответственно, являются полезными в способах лечения человека или животного. Изобретение также относится к способам получения указанных производных аминопиразина, фармацевтических композиций, содержащих такие производные, и их применению в терапевтических способах, например, при изготовлении лекарственных средств для применения в предупреждении или лечении злокачественных новообразований у теплокровного животного, например, человека, включая применение в предупреждении или лечении рака.
Настоящее изобретение также относится к производным аминопиразина, которые являются селективными ингибиторами ферментов PI3-киназного семейства (альтернативно известного как фосфатидилинозитол-3-киназное семейство или PI3K-семейство), в частности, изоформ PI3K-α и PI3K-δ, и полезны, например, для противоопухолевой терапии.
В области онкологии в последние годы было обнаружено, что клетка может стать раковой в силу превращения части ее ДНК в онкоген, представляющий собой ген, который при активации приводит к образованию злокачественных опухолевых клеток (Bradshaw, Mutagenesis, 1986, 1, 91). Некоторые такие онкогены вызывают выработку пептидов, представляющих собой киназы, класс ферментов, которые способны фосфорилировать свои белковые или липидные субстраты. Существует несколько классов киназ.
Во-первых, тирозинкиназы, которые могут представлять собой рецепторные тирозинкиназы или нерецепторные тирозинкиназы. Известны различные классы рецепторных тирозинкиназ (Wilks, Advances in Cancer Research, 1993, 60, 43-73), соотнесенных с семействами факторов роста, которые могут связываться с внеклеточным доменом разных рецепторных тирозинкиназ; в качестве примера классификация включает рецепторные тирозинкиназы класса I, содержащего EGF(эпидермальный фактор роста)-семейство рецепторных тирозинкиназ. Нерецепторные тирозинкиназы располагаются внутри клетки; известны различные классы нерецепторных тирозинкиназ, включая Src-семейство киназ, таких как тирозинкиназы Src, Lyn, Fyn и Yes.
Во-вторых, некоторые киназы принадлежат к классу серин/треониновых киназ, которые также располагаются внутри клетки. Сигнальные пути с участием серин/треониновых киназ включают каскад Raf(киназа, индуцирующая быстро прогрессирующую фибросаркому)-MEK(киназа митоген-активируемой протеинкиназы)-ERK(внеклеточная сигнал-регулируемая киназа) и ферменты, расположенные в каскаде ниже PI3-киназы, такие как PDK-1 (PI3K-зависимая киназа-1), АКТ (протеинкиназа В) и mTOR (мишень рапамицина у млекопитающих) (Blume-Jensen and Hunter, Nature, 2001, 411, 355).
Также известно, что некоторые другие киназы принадлежат к классу липидных киназ, которые располагаются внутри клетки и, как и в случае вышеупомянутых киназ, вовлечены в передачу биохимических сигналов, таких как те, которые влияют на рост и инвазивность опухолевых клеток. Известны различные классы липидных киназ, включая вышеупомянутое семейство PI3-киназ.
В настоящее время хорошо известно, что дерегуляция онкогенов и генов-супрессоров опухолей способствует образованию злокачественных опухолей, например, путем усиления пролиферации клеток или повышения жизнеспособности клеток. Также в настоящее время известно, что сигнальные пути, опосредованные семейством PI3-киназ, играют центральную роль во многих клеточных процессах, включая пролиферацию и выживаемость, и дерегуляция этих путей является причинным фактором образования широкого спектра раковых и других заболеваний у человека (Katso et al., Annual Rev. Cell Dev. Biol., 2001, 17: 615-617 и Foster et al., J. Cell Science. 2003, 116: 3037-3040).
PI3-киназное семейство липидных киназ представляет собой группу ферментов, которые фосфорилируют 3-е положение кольца инозита фосфатидилинозита (PI). Известны три главные группы PI3-киназных ферментов, которые классифицируются в соответствии с их физиологической субстратной специфичностью (Vanhaesebroeck et al., Trends in Biol. Sci., 1997, 22, 267; Engleman et al., Nature Review Genetics. 2006, 7, 607). PI3-киназные ферменты класса III фосфорилируют исключительно PI. В отличие от них PI3-киназные ферменты класса II фосфорилируют и PI, и PI-4-фосфат (сокращенный ниже как PI(4)P). PI3-киназные ферменты класса I фосфорилируют PI, PI(4)P и PI-4,5-бифосфат (сокращенный ниже как PI(4,5)P2), несмотря на то, что только PI(4,5)P2, как полагают, является физиологическим клеточным субстратом. В результате фосфорилирования PI(4,5)P2 образуется липидный вторичный мессенджер PI-3,4,5-трифосфат (сокращенный ниже как PI(3,4,5)P3). Более отдаленно связанными членами этого суперсемейства являются киназы класса IV, такие как mTOR и ДНК-зависимая протеинкиназа, которые фосфорилируют остатки серина/треонина в белковых субстратах. Наиболее изученными и понятными из этих липидных киназ являются PI3-киназные ферменты класса I.
PI3-киназы класса I являются гетеродимерами, состоящими из каталитической субъединицы p110 и регуляторной субъединицы, и семейство далее разделено на ферменты класса Ia и класса Ib по признаку регуляторных партнеров и механизма регулирования (Engleman et al., Nature Review Genetics, 2006, 7, 607). Ферменты класса Ia содержат три разные каталитические субъединицы (p110α, p110β и p110δ; по номенклатуре изоформу PI3-киназы определяют как α, β или δ, соответственно), которые димеризуются с пятью разными регуляторными субъединицами (р85α, р55α, р50α, р85β и р55γ), причем все каталитические субъединицы способны вступать во взаимодействие со всеми регуляторными субъединицами с образованием разнообразных гетеродимеров. PI3-киназные ферменты класса Ia, как правило, активируются в ответ на стимуляцию рецепторных тирозинкиназ фактором роста, через взаимодействие SH2-доменов регуляторной субъединицы со специфическими фосфотирозиновыми остатками активированных рецепторных или адаптерных белов, таких как IRS-1. И p110α, и p110β широко экспрессируются во всех типах клеток и во всех тканях, тогда как экспрессия p110δ более ограничена популяциями лейкоцитов и некоторыми эпителиальными клетками. В противоположность этому, единственный фермент класса Ib состоит из каталитической субъединицы р110γ, которая взаимодействует с регуляторной субъединицей p101. Кроме того, этот фермент класса Ib активируется в ответ на системы G-белок-связанного рецептора (GPCR), так же как и механизмами, описанными выше.
В настоящее время имеется большое число данных, указывающих на то, что PI3-киназные ферменты класса Ia участвуют в онкогенезе широкого спектра раковых опухолей у человека, либо напрямую, либо опосредованно (Vivanco and Sawyers, Nature Reviews Cancer, 2002, 2, 489-501). В частности, ген PIK3CA, кодирующий каталитическую субъединицу p110α PI3-киназы, широко вовлечен в онкогенез. Активирующие точечные мутации, наиболее часто обнаруживаемые в спиральных или каталитических доменах p110α, повышают PI3-киназную активность холофермента и могут приводить к трансформации клеток. В частности, согласно опубликованным данным они представляют собой мутации в соматических клетках, возникающие с очень высокой частотой в широком диапазоне типов опухолей (Samuels et al., Science, 2004, 304, 554; Samuels et al., Cancer Cell, 2005, 7, 561; Engleman et al., Nature Review Genetics, 2006, 7, 607; Zhao L and Vogt PK, Oncogene, 2008, 27, 5486). Опухоль-ассоциированные мутации в p85α также были идентифицированы при таких видах рака, как рак яичника и толстой кишки (Philp et al., Cancer Research, 2001, 61, 7426-7429). Кроме того, субъединица p110α амплифицируется в некоторых опухолях, таких как опухоли яичника (Shayesteh et al., Nature Genetics, 1999, 21, 99-102) и шейки матки (Ma et al., Oncogene, 2000, 19, 2739-2744).
Полагают, что помимо прямого влияния активация PI3-киназы класса Ia вносит вклад в приводящие к образованию опухолей события, которые происходят выше в сигнальных путях, например, посредством лиганд-зависимой или лиганд-независимой активации рецепторных тирозинкиназ, GPCR систем или интегринов (Vara et al., Cancer Treatment Reviews, 2004, 30, 193-204). Примеры таких расположенных выше в сигнальных путях событий включают сверхэкспрессию рецепторной тирозинкиназы Erb2 в ряде опухолей, что приводит к активации PI3-киназа-опосредованных путей (Harari et al., Oncogene, 2000, 19, 6102-6114) и сверхэкспрессии онкогена Ras (Kauffmann-Zeh et al., Nature, 1997, 385, 544-548). Помимо этого, PI3-киназы класса Ia могут участвовать в онкогенезе, вызываемом различными событиями, расположенными ниже по пути передачи сигнала. Например, ослабление действия опухоль-супрессорной фосфатазы PTEN (гомолог фосфатазы и тензина с делецией по 10-й хромосоме), которая катализирует превращение PI(3,4,5)P3 обратно в PI(4,5)P2, связано с очень широким диапазоном опухолей через дерегуляцию PI3-киназа-опосредованного образования PI(3,4,5)P3 (Simpson and Parsons, Exp. Cell Res., 2001, 264, 29-41). Кроме того, считается, что усиление действия других PI3-киназа-опосредованных событий передачи сигнала, способствует возникновению многих раковых заболеваний, например, путем активации Akt (Nicholson and Anderson, CelluIar Signaling, 2002, 14, 381-395).
В связи с этим, общая дерегуляция PI3-киназы вместе с киназами, расположенными выше и ниже в сигнальных путях, в совокупности делают этот путь одним из наиболее часто разрегулированных путей при раковом заболевании у человека (Hennessey et al., Nature Reviews Drug Discovery, 2005, 4, 988).
Помимо участия в опосредовании передачи сигналов, касающихся пролиферации и жизнеспособности, в опухолевых клетках также имеются убедительные доказательства того, что PI3-киназные ферменты класса Ia также будут принимать участие в онкогенезе в результате их функционирования в опухоле-ассоциированных стромальных клетках. Например, известно, что ассоциированная с PI3-киназами передача сигнала играет важную роль в опосредовании ангиогенных событий в эндотелиальных клетках в ответ на проангиогенные факторы, такие как сосудистый эндотелиальный фактор роста (VEGF) (Abid et al., Arterioscler. Thromb. Vasc. Biol., 2004, 24, 294-300). Поскольку PI3-киназные ферменты класса I также вовлечены в подвижность и миграцию (Sawyer, Expert Opinion Investig, Drugs. 2004, 13, 1-19), ингибиторы PI3-киназ должны обеспечить терапевтическую пользу путем ингибирования инвазии опухолевых клеток и метастазирования.
Кроме того, PI3-киназные ферменты класса I играют важную роль в регуляции иммунных клеток с PI3-киназной активностью, способствуя проонкогенному действию воспалительных клеток (Coussens and Werb, Nature, 2002, 420, 860-867). В действительности, PI3-киназный фермент класса Ia, в частности, PI3-киназа 5, вовлечен в онкогенез при гематологических злокачественных новообразованиях, таких как хронический лимфолейкоз (CLL), острый лимфобластный лейкоз (ALL) и лимфома из клеток мантийной зоны (MCL). Сообщается об усилении передачи сигнала через PI3K (главным образом, p110δ) в целом ряде злокачественных лимфоидных клеток (Herman et al., Blood, 2010, 116, 2078; Ikeda et al., Blood, 2010, 116, 1460; Uddin et al., Blood, 2006, 108, 4178; Rudelius et al., Blood, 2006, 108, 1668; Garcia-Martinez., Br. J. Cancer, 2011, 104, 1116; Renne et al., Leukemia. 2007, 2, 780). Это стимулировало разработку агентов, направленно воздействующих на PI3-киназу δ, с многообещающими первоначальными клиническими результатами при гематологических злокачественных новообразованиях (Castillo et al., Expert Opinion on Investigational Drugs, 2012, 21, 15).
Эти данные наводят на мысль, что фармакологические ингибиторы PI3-киназных ферментов класса I должны обладать терапевтической ценностью для лечения различных форм заболевания раком, включающих солидные опухоли, такие как карциномы и саркомы, и лейкозы и лимфолейкозы.
В более ранних исследованиях, как доклинических, так и клинических, в которых изучали физиологическую и патологическую роли PI3-киназного фермента, были в основном использованы агенты с ограниченной селективностью в отношении ингибирования киназ, выбранных либо среди всех киназных семейств, либо среди PI3-киназного семейства, либо среди семейства PI3-киназ класса I. В связи с этим существует потребность в более селективных фармацевтических ингибиторах PI3-киназы класса I для получения полезных терапевтических агентов с возможностью достижения улучшенной широты терапевтического действия по сравнению с первоначальными агентами, которые уже введены в клиническую практику.
Как правило, соединения по настоящему изобретению обладают сильной ингибирующей активностью в отношении подгруппы PI3-киназных ферментов класса I, в частности, α- и δ-изоформ PI3-киназ класса Ia при относительном снижении в отношении γ- и, в особенности, β-изоформы. Данные соединения также селективны в отношении всего PI3-киназного семейства и кинома в целом. Такие соединения обладают достаточной эффективностью в отношении PI3-киназных ферментов класса I, так что их можно применять в количестве, достаточном для ингибирования подгруппы изоформ PI3-киназ класса I, в частности, для ингибирования α- и δ-изоформ PI3-киназных ферментов класса Ia, одновременно демонстрируя незначительную активность в отношении других киназ.
Понимание дерегуляции PI3-киназа-опосредованной передачи сигнала при раковых и других заболеваниях у человека открывает перспективу для направленного воздействия на подгруппу пациентов с наибольшей вероятностью получения пользы в результате лечения агентами, описанными в этой заявке, с использованием способа, известного как персонализированная медицинская помощь (РНС) или персонализированная медицина. Что касается этих агентов, то пациенты, заболевание у которых зависит от усиленной или иным образом измененной передачи сигнала посредством PI3K-α и/или передачи сигнала посредством PI3K-δ, могут, в частности, получить пользу в результате лечения. В данной области техники хорошо известно, что с целью получения показания для дающего предсказательный ответ биомаркера можно использовать диагностику. С помощью такой диагностики можно измерить одно или более показаний дерегуляции пути, таких как, но не ограничиваясь этим, мутация в генах PIK3CA, PTEN или р85 (PIK3R), амплификация или увеличение числа копий гена PIK3CA, сверхэкспрессия или повышение активности изоформы PI3K-α и/или -δ, либо использовать показание для фосфо-биомаркера данного пути, такого как фосфо-RTK (рецепторная тирозинкиназа) или фосфо-АКТ. Кроме того, определение мутационного статуса или активационного статуса дополнительных генов, таких как K-ras, потенциальный маркер устойчивости в опухолях с аберрантной или разрегулированной PIK3CA или PI3K-α (Engelman et al., Nature Medicine, 2008, 14, p. 1351-1355; Ihle et al., Cancer Research, 2009, 69, p. 143-160; Janku et al., MolecuIar Cancer Therapeutics, 2011, 10, p. 558-564), может помочь в повышении предсказательной способности персонализированного подхода в медицине. Альтернативно, в другом подходе с направленным действием, но с меньшей специфичностью, лечение может быть сфокусировано на разновидностях заболеваний, при которых, как известно, наиболее распространена дерегуляция релевантных изоформ PI3K.
Описанные соединения могут быть использованы для направленного воздействия на заболевание либо по отдельности, либо в комбинации с другим(ими) фармацевтическим(ими) агентом или агентами. Комбинируя ингибиторы PI3-киназ с другими терапиями, можно улучшить эффективность посредством преодоления механизмов устойчивости, или врожденной, или индуцированной в ответ на направленный на PI3-киназу агент. Имеются убедительные доклинические данные, подтверждающие такой подход (Courtney et al., J. Clin. Oncol., 2010, 28, 1075; Engleman et al., Nature Review Genetics, 2006, 7, 607). Один подход относится к комбинациям «внутри одного пути» ("intra-pathway") с агентами, модулирующими другие оси в PI3-киназа-опосредованных сигнальных путях (например, mTOR, АКТ, RTK, с другим направленным на PI3-киназу агентом). Второй подход относится к комбинациям с агентами «другого пути» ("inter-pathway"), при этом ингибирование более чем одного сигнального пути может быть полезно по сравнению с ингибированием одного пути (например, при комбинировании с ингибиторами MEK, ингибиторами Raf, модуляторами Bcl-семейства, ингибиторами RTK или модуляторами передачи сигнала при повреждении ДНК, такими как ингибиторы поли(АДФ-рибоза)-полимеразы (PARP). Другие подходы включают подходы, при которых ингибитор PI3-киназ объединяют с агентами или схемами лечения, уже принятыми в клинической практике, так называемые стандартные подходы к лечению (SoC), или включают комбинации с агентами, направленными на механизмы, не связанные с опухолевыми клетками, такими как стромальная клетка опухоли, или действующие посредством иммунной системы.
Помимо онкогенеза, имеются доказательства того, что PI3-киназные ферменты класса I играют роль в других заболеваниях (Wymann et al., Trends in Pharmacological Science, 2003, 24, 366-376). И PI3-киназные ферменты класса Ia, в частности, PI3K-δ, и единственный фермент класса Ib (PI3K-γ) играют важную роль в клетках иммунной системы (Koyasu, Nature Immunology, 2003, 4, 313-319), и таким образом они представляют собой терапевтические мишени в случае воспалительных и аллергических показаний. Ингибирование PI3-киназы, как описано ранее, также полезно для лечения сердечно-сосудистого заболевания благодаря противовоспалительному действию или непосредственному воздействию на кардиомиоциты (Prasad et al., Trends in CardiovascuIar Medicine, 2003, 13, 206-212). Таким образом, ингибиторы PI3-киназных ферментов класса I могут быть полезны в предупреждении и лечении целого ряда заболеваний, помимо рака.
Было установлено, что соединения по изобретению, т.е. производные аминопиразина, обладают сильной противоопухолевой активностью, являясь полезными для ингибирования неконтролируемой клеточной пролиферации, которая является результатом злокачественного заболевания. Не желая дать основания полагать, что соединения, описанные в настоящем изобретении, обладают фармакологической активностью только в силу воздействия на единственный биологический процесс, считают, что соединения обеспечивают противоопухолевое действие путем ингибирования PI3-киназных ферментов класса I, в частности путем ингибирования PI3-киназных ферментов класса Ia, более конкретно путем ингибирования α- и δ-изоформ PI3K.
Соединения по настоящему изобретению также могут быть полезны для ингибирования неконтролируемой клеточной пролиферации, которая является результатом различных незлокачественных заболеваний, таких как воспалительные заболевания (например, ревматоидный артрит и воспалительное заболевание кишечника), фибротические заболевания (например, цирроз печени и фиброз легких), гломерулонефрит, рассеянный склероз, псориаз, доброкачественная гипертрофия предстательной железы (BPH), реакции гиперчувствительности кожи, заболевания кровеносных сосудов (например, атеросклероз и рестеноз), аллергическая астма, инсулинозависимый диабет, диабетическая ретинопатия и диабетическая нефропатия.
Пролинамиды раскрыты в качестве селективных в отношении PI3K-α агентов в международных патентных заявках WO 2009/080705, WO 2010/029082 и WO 2011/000905 (Novartis). В WO 2011/143426 и WO 2010/071837 (Vertex) раскрыты аминопиразин-содержащие ингибиторы ATR(атаксия-телеангиэктазия+Rad3-родственной)-киназы.
Согласно одному из аспектов изобретения предложено соединение формулы (I)
,
где:
R1 представляет собой метил или этил; и
R2 представляет собой (C2-3)алкил, замещенный гидроксилом;
или его фармацевтически приемлемая соль.
Согласно другому аспекту изобретения предложено соединение формулы (I), которое определено выше.
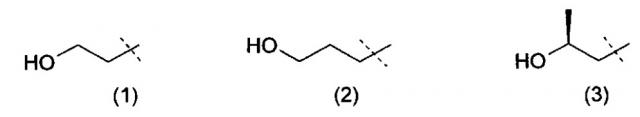
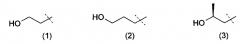
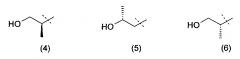
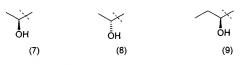
Очевидно, что термин «(C2-3)алкил, замещенный группой гидрокси» включает в себя алкильные группы как с прямой цепью, так и разветвленной цепью, например такие, которые приведены ниже как группы от (1) до (11):
Следует понимать, что, поскольку некоторые из определенных выше соединений формулы (I) могут существовать в оптически активных или рацемических формах в силу наличия одного или более асимметрических атомов углерода, данное изобретение включает в своем определении любую такую оптически активную или рацемическую форму, которая обладает ингибирующей активностью в отношении PI3K-α и -δ. Синтез оптически активных форм может быть проведен с использованием стандартных методов органической химии, хорошо известных в данной области техники, например, путем синтеза из оптически активных исходных веществ или путем выделения из рацемической формы. Аналогично, вышеупомянутая активность может быть оценена с использованием стандартных лабораторных методов.
Конкретный энантиомер соединения, описанного в данной заявке, может быть более активным, чем другие энантиомеры того же соединения.
Согласно другому аспекту изобретения предложены соединение формулы (I) или его фармацевтически приемлемая соль, которое(ая) является отдельным энантиомером, находящимся в энантиомерном избытке (% ее), составляющим не менее 95, не менее 98% или не менее 99%. Подходящим образом отдельный энантиомер присутствует в энантиомерном избытке (% ее) не менее 99%.
Согласно другому аспекту изобретения предложена фармацевтическая композиция, содержащая соединение формулы (I), которое является отдельным энантиомером, находящимся в энантиомерном избытке (% ее) не менее 95, не менее 98% или не менее 99%, или его фармацевтически приемлемую соль вместе с фармацевтически приемлемым разбавителем или носителем. Подходящим образом отдельный энантиомер присутствует в энантиомерном избытке (% ее) не менее 99%.
Некоторые соединения формулы (I) могут быть кристаллическими и могут существовать более чем в одной кристаллической форме. Следует понимать, что настоящее изобретение охватывает любую кристаллическую либо аморфную форму или их смеси, при этом форма обладает свойствами, полезными в ингибировании активности PI3K-α и -δ, причем в данной области техники хорошо известно, как определить эффективность кристаллической или аморфной формы в отношении ингибирования активности PI3K-α и/или -δ, используя стандартные тесты, описанные далее.
Общеизвестно, что анализ кристаллических веществ можно провести, используя традиционные методы, такие как анализ с применением дифракции рентгеновских лучей на порошке (далее XRPD), дифференциальная сканирующая калориметрия (далее DSC), термогравиметрический анализ (далее TGA), инфракрасная спектроскопия диффузного отражения с преобразованием Фурье (DRIFT), спектроскопия в ближней инфракрасной области (NIR), спектроскопия ядерного магнитного резонанса в растворе и/или твердом состоянии. Содержание воды в таких кристаллических веществах можно определить посредством анализа по методу Карла Фишера.
В качестве примера, соединение из примера 1 демонстрирует кристалличность, и была идентифицирована одна его кристаллическая форма.
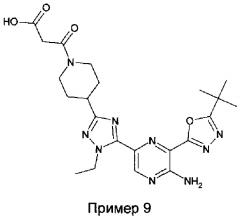
Соответственно, дополнительный аспект изобретения относится к Форме A 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-метил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она.
Согласно дополнительному аспекту настоящего изобретения предложена кристаллическая форма, Форма А 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-метил-1Н-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характерным пиком при 2-тета, приблизительно составляющем 5,1°.
Согласно дополнительному аспекту настоящего изобретения предложена кристаллическая форма, Форма А 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-метил-1Н-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характерным пиком при 2-тета, приблизительно составляющем 18,0°.
Согласно дополнительному аспекту настоящего изобретения предложена кристаллическая форма, Форма А 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-метил-1Н-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характерными пиками при 2-тета, приблизительно составляющих 5,1 и 18,0°.
Согласно дополнительному аспекту настоящего изобретения предложена кристаллическая форма, Форма А 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-метил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке с характерными пиками при 2-тета, приблизительно составляющих 5,1; 18,0; 10,2; 11,7; 19,4; 18,5; 14,8; 26,7; 26,6; 17,8°.
Согласно настоящему изобретению предложена кристаллическая форма, Форма A, которая имеет картину дифракции рентгеновских лучей на порошке по существу аналогичную картине дифракции рентгеновских лучей на порошке, показанной на Фиг. 1.
Согласно дополнительному аспекту настоящего изобретения предложена кристаллическая форма, Форма А 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-метил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характерным пиком при 2-тета, приблизительно составляющем 5,1°±0,2° 2-тета.
Согласно дополнительному аспекту настоящего изобретения предложена кристаллическая форма, Форма А 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-метил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характерным пиком при 2-тета, приблизительно составляющем 18,0°±0,2° 2-тета.
Согласно дополнительному аспекту настоящего изобретения предложена кристаллическая форма, Форма A 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-метил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характерными пиками при 2-тета, приблизительно составляющих 5,1 и 18,0°±0,2° 2-тета.
Согласно дополнительному аспекту настоящего изобретения предложена кристаллическая форма, Форма А 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-метил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке с характерными пиками при 2-тета, приблизительно составляющих 5,1; 18,0; 10,2; 11,7; 19,4; 18,5; 14,8; 26,7; 26,6; 17,8°±0,2° 2-тета.
Соединение из примера 3 также является кристаллическим, и в данном изобретении описаны три формы (A, B и C).
Согласно настоящему изобретению предложена кристаллическая форма, Форма А 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характерным пиком при 2-тета, приблизительно составляющем 4,8°.
Согласно настоящему изобретению предложена кристаллическая форма, Форма А 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1Н-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характерным пиком при 2-тета, приблизительно составляющем 10,0°.
Согласно настоящему изобретению предложена кристаллическая форма, Форма А 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характерными пиками при 2-тета, приблизительно составляющих 4,8° и 10,0°.
Согласно настоящему изобретению предложена кристаллическая форма, Форма А 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке с характерными пиками при 2-тета, приблизительно составляющих 4,8; 10,0; 14,6; 5,2; 19,9; 10,4; 25,4; 23,6; 24,4; 16,2°.
Согласно настоящему изобретению предложена кристаллическая форма, Форма А 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по существу аналогичную картине дифракции рентгеновских лучей на порошке, показанной на Фиг. 3.
Согласно настоящему изобретению предложена кристаллическая форма, Форма А 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характерным пиком при 2-тета, составляющем 4,8° ± 0,2° 2-тета.
Согласно настоящему изобретению предложена кристаллическая форма, Форма А 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характерным пиком при 2-тета, составляющем 10,0° ± 0,2° 2-тета.
Согласно настоящему изобретению предложена кристаллическая форма, Форма А 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характерными пиками при 2-тета, составляющих 4,8° и 10,0°, где указанные значения могут отклоняться на величину ± 0,2° 2-тета.
Согласно настоящему изобретению предложена кристаллическая форма, Форма А 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке с характерными пиками при 2-тета, составляющих 4,8; 10,0; 14,6; 5,2; 19,9; 10,4; 25,4; 23,6; 24,4; 16,2°, где указанные значения могут отклоняться на величину ± 0,2° 2-тета.
Согласно настоящему изобретению предложена кристаллическая форма, Форма В 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характерным пиком при 2-тета, приблизительно составляющем 5,8°.
Согласно настоящему изобретению предложена кристаллическая форма, Форма В 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характерным пиком при 2-тета, приблизительно составляющем 10,9°.
Согласно настоящему изобретению предложена кристаллическая форма, Форма В 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характерными пиками при 2-тета, приблизительно составляющих 5,8 и 10,9°.
Согласно настоящему изобретению предложена кристаллическая форма, Форма В 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке с характерными пиками при 2-тета, приблизительно составляющих 5,8; 10,9; 11,5; 25,9; 17,3; 24,0; 19,1; 12,9; 24,7; 27,2°.
Согласно настоящему изобретению предложена кристаллическая форма, Форма В 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по существу аналогичную картине дифракции рентгеновских лучей на порошке, показанной на Фиг. 5.
Согласно настоящему изобретению предложена кристаллическая форма, Форма В 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характерным пиком при 2-тета, составляющем 5,8° ± 0,2° 2-тета.
Согласно настоящему изобретению предложена кристаллическая форма, Форма В 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характерным пиком при 2-тета, составляющем 10,9° ± 0,2° 2-тета.
Согласно настоящему изобретению предложена кристаллическая форма, Форма В 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характерными пиками при 2-тета, составляющих 5,8° и 10,9°, где указанные значения могут отклоняться на величину ± 0,2° 2-тета.
Согласно настоящему изобретению предложена кристаллическая форма, Форма В 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке с характерными пиками при 2-тета, составляющих 5,8; 10,9; 11,5; 25,9; 17,3; 24,0; 19,1; 12,9; 24,7; 27,2°, где указанные значения могут отклоняться на величину ± 0,2° 2-тета.
Согласно настоящему изобретению предложена кристаллическая форма, Форма С 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характерным пиком при 2-тета, приблизительно составляющем 6,9°.
Согласно настоящему изобретению предложена кристаллическая форма, Форма С 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1Н-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характерным пиком при 2-тета, приблизительно составляющем 12,3°.
Согласно настоящему изобретению предложена кристаллическая форма, Форма С 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характерными пиками при 2-тета, приблизительно составляющих 6,9 и 12,3°.
Согласно настоящему изобретению предложена кристаллическая форма, Форма С 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с характерными пиками при 2-тета, приблизительно составляющих 6,9; 12,3; 10,5; 21,0; 24,6; 13,6; 16,4; 19,6; 20,2; 22,5°.
Согласно настоящему изобретению предложена кристаллическая форма, Форма С 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1Н-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по существу аналогичную картине дифракции рентгеновских лучей на порошке, показанной на Фиг. 7.
Согласно настоящему изобретению предложена кристаллическая форма, Форма С 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характерным пиком при 2-тета, составляющем 6,9° ± 0,2° 2-тета.
Согласно настоящему изобретению предложена кристаллическая форма, Форма С 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характерным пиком при 2-тета, составляющем 12,3° ± 0,2° 2-тета.
Согласно настоящему изобретению предложена кристаллическая форма, Форма С 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характерными пиками при 2-тета, составляющих 6,9° и 12,3°, где указанные значения могут отклоняться на величину ± 0,2° 2-тета.
Согласно настоящему изобретению предложена кристаллическая форма, Форма С 1-(4-(5-(5-амино-6-(5-трет-бутил-1,3,4-оксадиазол-2-ил)пиразин-2-ил)-1-этил-1H-1,2,4-триазол-3-ил)пиперидин-1-ил)-3-гидроксипропан-1-она, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с характерными пиками при 2-тета, составляющих 6,9; 12,3; 10,5; 21,0; 24,6; 13,6; 16,4; 19,6; 20,2; 22,5°, где указанные значения могут отклоняться на величину ± 0,2° 2-тета.
Когда указано, что настоящее изобретение относится к к