Производные имидазопиридина, стимулирующие нейрогенез
Иллюстрации
Показать всеИзобретение относится к области органической химии, а именно к новым производным имидазопиридина формулы I или к его фармацевтически приемлемой кислотно-аддитивной соли или его рацемической смеси, Ar представляет собой фенил или пиридинил; X1 представляет собой N или СН; X2 представляет собой N или СН, при условии, что только один из X1 или X2 представляет собой N, а другой представляет собой СН; R1 представляет собой водород, галоген, низший алкокси, низший алкил, замещенный галогеном, циано или S(O)2-низший алкил; R2 представляет собой водород, галоген, низший алкил, низший алкокси, низший алкил, замещенный галогеном; n представляет собой 1 или 2. Также изобретение относится к фармацевтической композиции на основе соединения формулы I и его применению. Технический результат: получены новые производные имидазопиридина, стимулирующие нейрогенез. 4 н. и 9 з.п. ф-лы, 1 табл., 24 пр.
I
Реферат
Настоящее изобретение относится к соединениям общей формулы
где
Ar представляет собой фенил или пиридинил;
X1 представляет собой N или СН,
X2 представляет собой N или СН,
при условии, что только один из X1 или X2 представляет собой N, а другой представляет собой СН;
R1 представляет собой водород, галоген, низший алкил, низший алкокси, низший алкил, замещенный галогеном, циано или S(O)2-низший алкил;
R2 представляет собой водород, галоген, низший алкил, низший алкокси, низший алкил, замещенный галогеном или циано;
n представляет собой 1 или 2;
или к фармацевтически приемлемой кислотно-аддитивной соли, к рацемической смеси или ее соответствующему энантиомеру и/или их оптическим изомерам.
Было показано, что соединения по настоящему изобретению стимулирует нейрогенез из нервных стволовых клеток (НСК). Нейрогенез наблюдается как в развивающемся, так и во взрослом мозге. Концептуально, данный процесс нейрогенеза можно разделить на четыре стадии: (I) пролиферации НСК; (II) определение нейронального предназначения НСК; (III) выживание и созревание новых нейронов; и (IV) функциональная интеграция новых нейронов в нейронную сеть.
Нейрогенез у взрослых - это процесс развития, который происходит на протяжении жизни во взрослом мозге, в результате чего образуются новые функциональные нейроны из взрослых нервных стволовых клеток. Конститутивный взрослый нейрогенез в физиологических условиях наблюдается в основном в двух "нейрогенных" областях мозга, 1) в субгранулярной зоне (SGZ) в зубчатой извилине гиппокампа, где образуются новые зубчатые зернистые клетки, 2) в субвентрикулярной зоне (SVZ) боковых желудочков, где новые нейроны образуются и затем мигрируют через ростральный миграционный тракт (RMS) в обонятельную луковицу, чтобы стать интернейронами.
Многочисленные свидетельства предполагают, что нейрогенез гиппокампа у взрослых играет важную роль в когнитивных и эмоциональных состояниях, хотя его точная функция остается неясной. Было высказано мнение, что относительно небольшое число новообразованных зернистых нейронов может повлиять на общую функцию мозга вследствие того, что они иннервируют много интернейронов в зубчатой извилине, каждый из которых ингибирует сотни зрелых зернистых клеток, приводящих к нейрогенез-зависимому ингибированию обратной связи. В сочетании с низким порогом возбуждения новообразованные нейроны вызывают ответы на очень тонкие изменения в окружении. Нарушения в этом процессе поведенчески могут проявляться в дефиците разделения паттернов, связанных с психическими заболеваниями. Например, нейрогенез взрослого гиппокампа коррелирует с познавательной и эмоциональной способностью, например, физические упражнения, контакт с обогащенной средой и типичные антидепрессанты одновременно способствуют нейрогенезу взрослого гиппокампа и познанию и/или эмоциональному состоянию, в то время как хронический стресс, депрессия, лишение сна и старение снижают нейрогенез и ассоциируются с когнитивными и/или эмоциональными состояниями (Neuron 70, May 26, 2011, рр 582-588 and рр 687-702; WO 2008/046072). Интересно, что антидепрессанты способствуют нейрогенезу гиппокампа и для их влияния на определенное поведение требуется стимуляция нейрогенеза. Нейрогенез в других взрослых регионах ЦНС, как правило, считается очень ограниченным в нормальных физиологических условиях, но может быть вызван после травмы, такой как инсульт, и повреждения центрального и периферического отделов головного мозга.
Таким образом, считается, что стимуляция взрослого нейрогенеза представляет собой нейрорегенеративную терапевтическую мишень при обычном старении и, в частности, при различных нейродегенеративных и психоневрологических заболеваниях, в том числе шизофрении, обсессивно-компульсивного расстройства личности, большой депрессии, биполярных расстройств, тревожных расстройств, обычного старения, эпилепсии, дегенерации сетчатки, черепно-мозговой травмы, повреждения спинного мозга, посттравматического стресса, панического расстройства, болезни Паркинсона, деменции, болезни Альцгеймера, умеренных когнитивных нарушений, вызванной химиотерапией когнитивной дисфункции («химический мозг"), синдрома Дауна, нарушений аутистического спектра, потери слуха (Neuroscience, 167 (2010) 1216-1226; Nature Medicine, Vol. 11, number 3, (2005), 271-276) шума в ушах, спиноцеребеллярной атаксии, латерального амиотрофического склероза, рассеянного склероза, болезни Хантингтона, инсульта и повреждений в результате лучевой терапии, хронического стресса, или злоупотребления нейроактивными препаратами, такого как употребление алкоголя, опиатов, метамфетамина, фенциклидина и кокаина (US 2012/0022096).
Таким образом, химическое стимулирование взрослого нейрогенеза предлагает новые регенеративные пути и возможности для разработки новых препаратов для лечения неврологических заболеваний и нервно-психических расстройств.
Соответственно, целью настоящего изобретения являлась идентификация соединений, которые модулируют нейрогенез. Было обнаружено, что соединения формулы I являются активными в этой области, и, таким образом, они могут быть использованы для лечения шизофрении, обсессивно-компульсивного расстройства личности, большой депрессии, биполярных расстройств, тревожных расстройств, обычного старения, эпилепсии, дегенерации сетчатки, черепно-мозговой травмы, повреждения спинного мозга, посттравматического стресса, панического расстройства, болезни Паркинсона, деменции, болезни Альцгеймера, умеренных когнитивных нарушений, вызванной химиотерапией когнитивной дисфункции («химический мозг"), синдрома Дауна, заболеваний аутистического спектра, потери слуха, шума в ушах, спиноцеребеллярной атаксии, латерального амиотрофического склероза, рассеянного склероза, болезни Хантингтона, инсульта и повреждений в результате лучевой терапии, хронического стресса или злоупотребления нейроактивными препаратами, такого как употребление алкоголя, опиатов, метамфетамина, фенциклидина и кокаина.
Наиболее предпочтительными показаниями для соединений формулы I являются болезнь Альцгеймера, депрессия, тревожные расстройства и инсульт.
Настоящее изобретение относится к соединениям формулы I и их фармацевтически приемлемым солям, в случаях, когда это необходимо, к смесям энантиомеров или диастереомеров или их энантиомерно или диастереомерно чистых форм, к этим соединениям в качестве фармацевтически активных веществ, а также к применению при лечении или профилактике нарушений, связанных с нейрогенезом, шизофрении, обсессивно-компульсивного расстройства личности, большой депрессии, биполярных расстройств, тревожных расстройств, обычного старения, эпилепсии, дегенерации сетчатки, черепно-мозговой травмы, повреждения спинного мозга, посттравматического стресса, панического расстройства, болезни Паркинсона, деменции, болезни Альцгеймера, умеренных когнитивных нарушений, вызванной химиотерапией когнитивной дисфункции («химический мозг"), синдрома Дауна, заболеваний аутистического спектра, потери слуха, шума в ушах, спиноцеребеллярной атаксии, латерального амиотрофического склероза, рассеянного склероза, болезни Хантингтона, инсульта и повреждений в результате лучевой терапии, хронического стресса или злоупотребления нейроактивными препаратами, такого как употребление алкоголя, опиатов, метамфетамина, фенциклидина и кокаина, и к фармацевтическим композициям, содержащим соединения формулы I.
Следующие определения общих терминов, упомянутых в настоящем описании, используются независимо от того, употребляются ли указанные термины самостоятельно или в комбинации.
Как здесь используется, термин "низший алкил" означает насыщенную, т.е. алифатическую углеводородную группу, включающую линейную или разветвленную углеродную цепочку с 1-4 атомами углерода. Примерами для "алкила" являются метил, этил, н-пропил и изопропил.
Термин "низший алкокси" означает группу О-R', где R' представляет собой низший алкил, как определено выше.
Термин "низший алкил, замещенный галогеном" обозначает низшую алкильную группу, как определено выше, где по меньшей мере один атом водорода заменен галогеном.
Термин "галоген" означает хлор, бром, фтор или йод.
Термин "фармацевтически приемлемая соль" или "фармацевтически приемлемая кислотно-аддитивная соль" охватывает соли с неорганическими или органическими кислотами, такие как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и т.д.
Одним воплощением настоящего изобретения являются соединения формулы
где
R1 представляет собой водород, галоген, низший алкил, низший алкокси, низший алкил, замещенный галогеном, циано или S(O)2-низший алкил;
R2 представляет собой водород, галоген, низший алкил, низший алкокси, низший алкил, замещенный галогеном или циано;
n представляет собой 1 или 2;
или их фармацевтически приемлемая кислотно-аддитивная соль, рацемическая смесь или ее соответствующий энантиомер и/или их оптические изомеры, например, следующие соединения
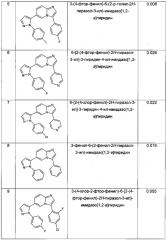
3-(4-фтор-фенил)-6-[2-(4-фтор-фенил)-2H-пиразол-3-ил]-имидазо[1,2-a]пиридин
3-(4-хлор-фенил)-6-[2-(4-хлор-фенил)-2Н-пиразол-3-ил]-имидазо[1,2-а]пиридин
6-[2-(4-хлор-фенил)-2Н-пиразол-3-ил]-3-(4-фтор-фенил)-имидазо[1,2-а]пиридин
3-(4-хлор-фенил)-6-[2-(4-фтор-фенил)-2Н-пиразол-3-ил]-имидазо[1,2-а]пиридин
3-(4-фтор-фенил)-6-(2-р-толил-2H-пиразол-3-ил)-имидазо[1,2-а]пиридин
3-фенил-6-(2-фенил-2Н-пиразол-3-ил)-имидазо[1,2-а]пиридин
3-(4-хлор-2-фтор-фенил)-6-[2-(4-фтор-фенил)-2Н-пиразол-3-ил]-имидазо[1,2-а]пиридин
3-фенил-6-(2-р-толил-2H-пиразол-3-ил)-имидазо[1,2-а]пиридин
3-(4-хлор-2-фтор-фенил)-6-[2-(4-хлор-фенил)-2H-пиразол-3-ил]-имидазо[1,2-а]пиридин
6-[2-(4-хлор-фенил)-2H-пиразол-3-ил]-3-(4-метокси-фенил)-имидазо[1,2-а]пиридин
6-[2-(4-фтор-фенил)-2Н-пиразол-3-ил]-3-(4-метокси-фенил)-имидазо[1,2-а]пиридин
3-(2,4-дифтор-фенил)-6-[2-(4-фтор-фенил)-2Н-пиразол-3-ил]-имидазо[1,2-а]пиридин
6-[2-(4-хлор-фенил)-2Н-пиразол-3-ил]-3-(2,4-дифтор-фенил)-имидазо[1,2-а]пиридин
6-[2-(4-хлор-фенил)-2Н-пиразол-3-ил]-3-(4-трифторметил-фенил)-имидазо[1,2-а]пиридин
6-[2-(4-фтор-фенил)-2Н-пиразол-3-ил]-3-(4-трифторметил-фенил)-имидазо[1,2-а]пиридин
4-{6-[2-(4-фтор-фенил)-2Н-пиразол-3-ил]-имидазо[1,2-а]пиридин-3-ил}-бензонитрил
4-{6-[2-(4-хлор-фенил)-2H-пиразол-3-ил]-имидазо[1,2-а]пиридин-3-ил}-бензонитрил
6-[2-(4-хлор-фенил)-2H-пиразол-3-ил]-3-(4-метансульфонил-фенил)-имидазо[1,2-а]пиридин
6-[2-(4-фтор-фенил)-2Н-пиразол-3-ил]-3-(4-метансульфонил-фенил)-имидазо[1,2-а]пиридин
3-(4-фтор-фенил)-6-[2-(4-трифторметил-фенил)-2Н-пиразол-3-ил]-имидазо[1,2-а]пиридин или
4-{6-[2-(4-трифторметил-фенил)-2Н-пиразол-3-ил]-имидазо[1,2-а]пиридин-3-ил}-бензонитрил.
Одним дополнительным воплощением настоящего изобретения являются соединения формулы
где
представляет собой пиридиновую группу, где N-атом может быть в 2, 3 или 4 положении;
R1 представляет собой водород, галоген, низший алкил, низший алкокси, низший алкил, замещенный галогеном, циано или S(O)2-низший алкил;
R2 представляет собой водород, галоген, низший алкил, низший алкокси, низший алкил, замещенный галогеном или циано;
n представляет собой 1 или 2;
или их фармацевтически приемлемая кислотно-аддитивная соль, рацемическая смесь или ее соответствующий энантиомер и/или их оптические изомеры, например, следующие соединения
6-[2-(4-фтор-фенил)-2Н-пиразол-3-ил]-3-пиридин-4-ил-имидазо[1,2-а]пиридин или
6-[2-(4-хлор-фенил)-2H-пиразол-3-ил]-3-пиридин-4-ил-имидазо[1,2-а]пиридин.
Одним дополнительным воплощением настоящего изобретения являются соединения формулы
где
Ar представляет собой фенил или пиридинил;
R1 представляет собой водород, галоген, низший алкил, низший алкокси, низший алкил, замещенный галогеном, циано или S(O)2-низший алкил;
R2 представляет собой водород, галоген, низший алкил, низший алкокси, низший алкил, замещенный галогеном или циано;
n представляет собой 1 или 2;
или их фармацевтически приемлемая кислотно-аддитивная соль, рацемическая смесь или ее соответствующий энантиомер и/или их оптические изомеры, например, следующее соединение
3-(4-фтор-фенил)-6-[3-(4-фтор-фенил)-3Н-имидазол-4-ил]-имидазол[1,2-а]пиридин.
Соединения по настоящему изобретению формулы I и их фармацевтически приемлемые соли могут быть получены способами, известными в уровне техники, например, способами, описанными ниже, способом, который содержит
а) взаимодействие соединения формулы
с соединением формулы
с получением соединения формулы
и, если необходимо, превращение полученных соединений в фармацевтически приемлемые кислотно-аддитивные соли.
b) взаимодействие соединения формулы
с соединением формулы
с получением соединения формулы
и, если необходимо, превращение полученных соединений в фармацевтически приемлемые кислотно-аддитивные соли.
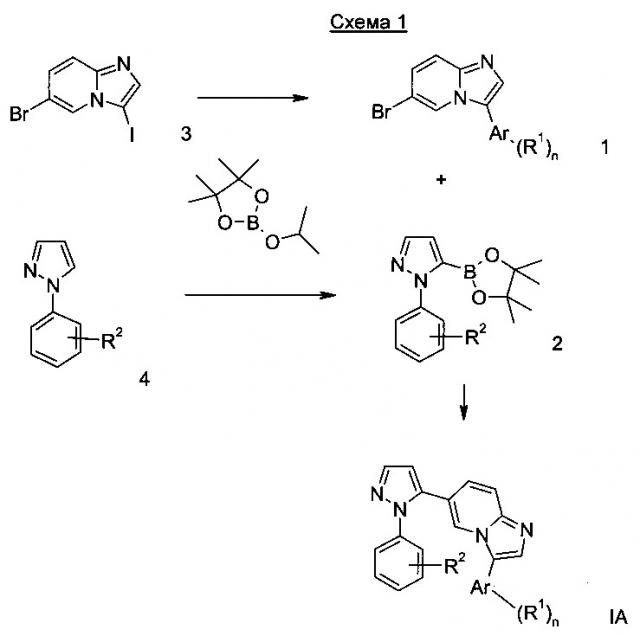
Получение соединений формулы I согласно настоящему изобретению может проводиться в соответствии с последовательными или конвергентными путями синтеза. Синтез соединений согласно настоящему изобретению показан на следующей схеме 1. Навыки, необходимые для осуществления реакций и очистки полученных соединений известны квалифицированным специалистам. Заместители и индикаторы, используемые в данных ниже описаниях способов получения, прежде всего, имеют значения данные здесь, если не указано иного.
Более детально, соединения формулы I могут быть получены способами, описанными ниже, способами, приведенными в примерах или аналогичными способами. Подходящие реакционные условия для индивидуальных реакций известны квалифицированным специалистам. Последовательности реакций не ограничены показанными на схеме 1, однако, в зависимости от исходного материала и его соответствующей химической активности последовательности реакционных стадий может быть изменена без ограничений. Исходные материалы являются как коммерчески доступными, так и могут быть получены согласно способам, аналогичным описанным здесь, способами, описанными в примерах или способами известными в уровне техники.
К перемешанному раствору коммерчески доступного соединения формулы 4 в растворителе, например ТГФ, добавили по каплям при -78°С в атмосфере аргона н-бутиллитий, например, в гексане. Реакционную смесь перемешивали в течение 1 ч при -78°С. Затем коммерческий доступный 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолан добавили по каплям при -78°С и смесь перемешивали в течение 1.5 ч при -78°С. Смеси дали достичь комнатной температуры в течение 1 ч и добавили уксусную кислоту. Смесь очистили обычным способом с получением соединения формулы 2.
К смеси соединения формулы 1 и соединения формулы 2 в 1,2-диметоксиэтане добавили Na2CO3 и реакционную смесь продули аргоном в течение 10 мин в ультразвуковой ванне. После этого добавили тетракис(трифенилфосфин)палладий(0) и перемешанную реакционную смесь нагрели с получением соединения формулы IA.
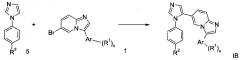
Схема 2
В высушенную на огнем реакционную колбу добавили при комнатной температуре и в атмосфере аргона коммерчески доступный имидазол формулы 5, ацетат палладия (II), фторид цезия, трифениларсин и соединение формулы 1. После этого добавили ДМФ последовательно с помощью шприца при комнатной температуре и в потоке аргона. Получившуюся смесь оставили перемешиваться при 140°С в атмосфере аргона в течение 24 ч. Реакционную смесь охладили до комнатной температуры с получением соединения формулы IB.
Выделение и очистка соединений
Выделение и очистка соединений и промежуточных соединений, описанных здесь, может быть осуществлена, если необходимо, с помощью любых подходящих способов разделения или очистки, таких как, например, фильтрация, экстракция, кристаллизация, колоночная хроматография, тонкослойная хроматография, хроматография в толстом слое, препаративная жидкостная хроматография низкого или высокого давления или комбинация этих способов. Конкретные иллюстрации подходящих методик разделения и выделения могут быть даны со ссылкой на способы и примеры, изложенные ниже. Тем не менее, другие эквивалентные процедуры разделения или выделения, конечно, также могут быть использованы. Рацемические смеси хиральных соединений формулы I могут быть разделены с использованием хиральной ВЭЖХ.
Соли соединений формулы I
Соединения формулы I являются основными и могут быть превращены в соответствующие кислотно-аддитивные соли. Превращение осуществляют путем обработки по меньшей мере стехиометрическим количеством соответствующей кислоты, такой как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., и органической кислоты, такой как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и т.п.. Как правило, свободное основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ, этанол или метанол и т.п., и добавляют кислоту в аналогичном растворителе. Температуру поддерживают в пределах от 0°С до 50°С. Полученная соль выпадает в осадок самопроизвольно или может быть выделена из раствора с помощью менее полярного растворителя.
Кислотно-аддитивные соли основных соединений формулы I могут быть превращены в соответствующие свободные основания обработкой по меньшей мере стехиометрическим эквивалентом подходящего основания, такого как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммиак, и т.д.
Соединения формулы I и их фармацевтически приемлемые аддитивные соли обладают ценными фармакологическими свойствами. В частности, было обнаружено, что соединения настоящего изобретения обладают активностью в качестве нейрогенных агентов.
Соединения были исследованы в соответствии с тестом, приведенным далее.
Анализ нейрогенеза
Анализ пролиферации нервных стволовых клеток
Нейрогенные свойства малых молекул определяли на основе пролиферации нервных стволовых клеток (НСК), полученных из эмбриональных стволовых клеток человека, которые получили посредством ингибирования сигнального пути SMAD, как ранее было описано (Chambers, S.M., et al., Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling, Nature biotechnology, 2009. 27(3): p. 275-80.)
Ответ соединений измеряют посредством увеличения в клетках на основании уровней АТФ (Promega:CellTiterGlo®) после периода инкубирования в течение 4 дней.
НСК оттаивали и увеличивали их количество за 3 пассажа. На 14-й день НСК посеяли в покрытые полиорнитином/ламинином 384 луночные планшеты при плотности клеток 21'000 клетка/см2 в 38 мкл среды.
Через 4 часа после посева, добавили растворы соединений в объеме 2 мкл. Стоковые растворы соединений (вода, 5% ДМСО) разбавили для получения кривой доза-ответ (11 точек, коэффициент разбавления 2), в диапазоне от 8 мкМ до 8 нМ. Контроли использовали для достоверного определения нейрогенных свойств клеток:
Отрицательный контроль (нейтральный) представлял собой среду для культивирования клеток (конечная концентрация ДМСО: 0.25%).
Положительными контролями являлись:
1. среда для культивирования клеток + 100 нг/мл FGF2 (конечная концентрация ДМСО: 0.1%)
2. среда для культивирования клеток + 20 нг/мл EGF (конечная концентрация ДМСО: 0.1%)
3. среда для культивирования клеток + 100 нг/мл Wnt3a (конечная концентрация ДМСО: 0.1%)
Через 4 дня инкубации при 37°С, 5% CO2, подсчитывали количество АТФ в каждой лунке. Концентрация АТФ пропорциональна количеству клеток. АТФ подсчитывали с помощью набора Promega CellTiterGlo®. Реагенты CellTiterGlo® содержат буфер для клеточного лизиса, термостабильную люциферазу (рекомбинантная люцифераза UltraGlo™), магний и люциферин. Люциферин взаимодействует с АТФ с получением оксилюциферина, АМФ и света. Люминесцентный сигнал пропорционален содержанию АТФ.
Значение отрицательного (нейтрального) контроля определялись для каждого тестируемого планшета с использованием среднего для 16 лунок с отрицательным контролем. Нейрогенный ответ соединений рассчитывался для каждого соединения как (соединение/отрицательный контроль)*100.
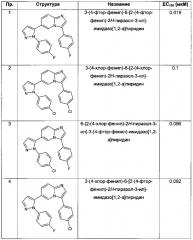
Значения ЕС150 из кривой доза-ответ определялись для каждого тестируемого соединения. Значение ЕС150 представляет собой концентрацию соединения при котором достигается 150% активность по сравнению с контролем (100%).
Предпочтительные соединения показали значения ЕС150 (мкМ) в диапазоне <2.8 мкМ, как показано в следующей Таблице.
Список примеров и данных EC150
Промежуточные соединения
Промежуточное соединение А: 1-(4-фтор-фенил)-5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-1Н-пиразол
К перемешанному раствору коммерчески доступного 1-(4-фторфенил)-1Н-пиразола [CAS No 81329-32-0] (2.27 г, 14.0 ммоль) в ТГФ (100 мл) добавили по каплям при -78°С в атмосфере аргона н-бутиллитий (1.6 н в гексане, 10.5 мл, 16.8 ммоль. Реакционную смесь оставили перемешиваться в течение 1 ч при -78°С. Затем коммерчески доступный 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолан (2.84 г, 3.12 мл, 15.0 ммоль) добавили по каплям при -78°С, и смесь перемешивали в течение 1.5 ч при -78°С. Смеси дали достичь комнатной температуры в течение 1 ч, и добавили уксусную кислоту (0.925 г, 881 мкл, 15.4 ммоль) добавили. Смесь отфильтровали с помощью слоя целита, который промыли этилацетатом, и фильтрат эвапорировали досуха. Неочищенный продукт (4.36 г, светло-коричневый осадок) очистили с помощью флеш-хроматографии на силикагеле (гептан/этилацетат, 10-50%) с получением соединения, указанного в заголовке, в виде серо-белого осадка (2.04 г, 51%), MS (ISP) m/z=289.5 [(М+Н)+], Тпл 133°С.
Промежуточное соединение В: 1-(4-хлор-фенил)-5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-1Н-пиразол
Соединение, указанное в заголовке, светло-коричневый осадок (1.27 г, 45%), MS (ISP) m/z=305.4 [(М+Н)+], Тпл 170°С, получили в соответствии с общим способом для промежуточного соединения А из коммерчески доступного 1-(4-хлорфенил)-1Н-пиразола [CAS No. 25419-86-7] (1.66 г, 9.29 ммоль) и коммерчески доступного 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолана.
Промежуточное соединение С: 5-(4,4,5,5-Тетраметил-[1,3,2]диоксаборолан-2-ил)-1-р-толил-1Н-пиразол
Соединение, указанное в заголовке, светло-коричневый осадок (2.31 г, 85%), MS (ISP) m/z=285.6 [(М+Н)+], Тпл 127°С, получили в соответствии с общим способом для промежуточного соединения А из коммерчески доступного 1-(п-толил)-1Н-пиразола [CAS No. 20518-17-6] (1.51 г, 9.54 ммоль) и коммерчески доступного 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолана.
Промежуточное соединение D: 1-фенил-5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-1Н-пиразол
Соединение, указанное в заголовке, коричневый осадок (2.0 г, 76%), MS (ISP) m/z=271.6 [(М+Н)+], Тпл 132°С, получили в соответствии с общим способом для промежуточного соединения А из коммерчески доступного 1-фенил-1Н-пиразола (1.40 г, 9.71 ммоль) и коммерчески доступного 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолана.
Промежуточное соединение Е: 6-бромо-3-(4-фтор-фенил)-имидазо[1,2-а]пиридин
К смеси коммерчески доступного 6-бромо-3-йодимидазо[1,2-а]пиридина (0.7 г, 2.17 ммоль) и коммерчески доступного 4-фтор-фенилбороновой кислоты (0.3 г, 2.17 ммоль) в 1,2-диметоксиэтане (14 мл), добавили 2М раствор карбоната натрия (2.71 мл, 5.42 ммоль) и реакционную смесь продули аргоном в течение 5 мин в ультразвуковой ванне. После этого добавили тетракис(трифенилфосфин)палладий(0) (125 мг, 108 мкмоль) и перемешанную реакционную смесь нагревали при кипении с обратным холодильником в течение 17 ч. Реакционную смесь охладили до комнатной температуры, влили в воду (30 мл) и экстрагировали этилацетатом (2×40 мл). Объединенные органические слои промыли солевым раствором (30 мл), высушили (MgSO4) и эвапорировали. Неочищенное вещество (0.74 г) дополнительно очистили с помощью флеш-хроматографии на силикагеле (дихлорметан/МеОН 98:2) и тритурировали (диэтиловый эфир) с получением соединения, указанного в заголовке, в виде светло-желтого осадка (0.3 г, 48%), MS (ISP) m/z=291.3 [(М+Н)+], Тпл 102°С.
Промежуточное соединение F: 6-бромо-3-(4-хлор-фенил)-имидазо[1,2-а]пиридин
Соединение, указанное в заголовке, светло-желтый осадок (0.28 г, 42%), MS (ISP) m/z=307.3 [(М+Н)+], Тпл 157°С, получили в соответствии с общим способом для промежуточного соединения Е из коммерчески доступного 6-бромо-3-йодимидазо[1,2-а]пиридина (0.7 г, 2.17 ммоль) и коммерчески доступной 4-хлор-фенилбороновой кислоты (0.34 г, 2.17 ммоль).
Промежуточное соединение G: 6-бромо-3-фенил-имидазо[1,2-а]пиридин
Соединение, указанное в заголовке, серо-белый осадок (0.4 г, 68%), MS (ISP) m/z=273.4 [(М+Н)+], Тпл 77°С, получили в соответствии с общим способом для промежуточного соединения Е из коммерчески доступного 6-бромо-3-йодимидазо[1,2-а]пиридина (0.7 г, 2.17 ммоль) и коммерчески доступной фенилбороновой кислоты (0.29 г, 2.38 ммоль).
Промежуточное соединение Н: 6-бромо-3-пиридин-4-ил-имидазо[1,2-а]пиридин
Соединение, указанное в заголовке, серо-белый осадок (0.27 г, 45%), MS (ISP) m/z=274.4 [(М+Н)+], Тпл 134°С, получили в соответствии с общим способом для промежуточного соединения Е из коммерчески доступного 6-бромо-3-йодимидазо[1,2-а]пиридина (0.7 г, 2.17 ммоль) и коммерчески доступной пиридин-4-илбороновой кислоты (0.27 г, 2.17 ммоль).
Промежуточное соединение I: 6-бромо-3-(4-хлор-2-фтор-фенил)-имидазо[1,2-а]пиридин
Соединение, указанное в заголовке, светло-коричневый осадок (0.54 г, 76%), MS (ISP) m/z=327.3 [(М+Н)+], Тпл 159°С, получили в соответствии с общим способом для промежуточного соединения Е из коммерчески доступного 6-бромо-3-йодимидазо[1,2-а]пиридина (0.7 г, 2.17 ммоль) и коммерчески доступной 4-хлор-2-фтор-фенилбороновой кислоты (0.42 г, 2.38 ммоль).
Промежуточное соединение K: 6-бромо-3-(2,4-дифтор-фенил)-имидазо[1,2-а]пиридин
Соединение, указанное в заголовке, серо-белый осадок (0.33 г, 49%), MS (ISP) m/z=309.4 [(М+Н)+], Тпл 137.5°С, получили в соответствии с общим способом для промежуточного соединения Е из коммерчески доступного 6-бромо-3-йодимидазо[1,2-а]пиридина (0.7 г, 2.17 ммоль) и коммерчески доступной 2,4-дифтор-фенилбороновой кислоты (0.38 г, 2.38 ммоль).
Промежуточное соединение L: 6-бромо-3-(4-метокси-фенил)-имидазо[1,2-а]пиридин
Соединение, указанное в заголовке, коричневое масло (0.47 г, 72%), MS (ISP) m/z=303.4 [(М+Н)+], получили в соответствии с общим способом для промежуточного соединения Е из коммерчески доступного 6-бромо-3-йодимидазо[1,2-а]пиридина (0.7 г, 2.17 ммоль) и коммерчески доступной 4-метокси-фенилбороновой кислоты (0.36 г, 2.38 ммоль).
Промежуточное соединение М: 6-бромо-3-(4-трифторметил-фенил)-имидазо[1,2-а]пиридин
Соединение, указанное в заголовке, светло-коричневый осадок (0.3 г, 40%), MS (ISP) m/z=341.4 [(М+Н)+], Тпл 151°С, получили в соответствии с общим способом для промежуточного соединения Е из коммерчески доступного 6-бромо-3-йодимидазо[1,2-а]пиридина (0.7 г, 2.17 ммоль) и коммерчески доступной 4-трифторметил-фенилбороновой кислоты (0.45 г, 2.38 ммоль).
Промежуточное соединение N: 4-(6-бромо-имидазо[1,2-а]пиридин-3-ил)-бензонитрил
Соединение, указанное в заголовке, светло-коричневый осадок (0.47 г, 73%), MS (ISP) m/z=298.4 [(М+Н)+], Тпл 176°С, получили в соответствии с общим способом для промежуточного соединения Е из коммерчески доступного 6-бромо-3-йодимидазо[1,2-а]пиридина (0.7 г, 2.17 ммоль) и коммерчески доступной 4-циано-фенилбороновой кислоты (0.36 г, 2.38 ммоль).
Промежуточное соединение О: 6-бромо-3-(4-метансульфонил-фенил)-имидазо[1,2-а]пиридин
Соединение, указанное в заголовке, коричневый осадок (0.53 г, 69%), MS (ISP) m/z=353.4 [(М+Н)+], Тпл 194°С, получили в соответствии с общим способом для промежуточного соединения Е из коммерчески доступного 6-бромо-3-йодимидазо[1,2-а]пиридина (0.7 г, 2.17 ммоль) и коммерчески доступной 4-метансульфонил-фенилбороновой кислоты (0.48 г, 2.38 ммоль).
Промежуточное соединение Р: 5-(4,4,5,5-Тетраметил-[1,3,2]диоксаборолан-2-ил)-1-(4-трифторметил-фенил)-1Н-пиразол
Соединение, указанное в заголовке, светло-желтый осадок (2.21 г, 69%), MS (ISN) m/z=338.6 [(М-Н)+], Тпл 153°С, получили в соответствии с общим способом для промежуточного соединения А из коммерчески доступного 1-(4-(трифторметил)-фенил)-1Н-пиразола [CAS No. 207797-05-5] (2 г, 9.43 ммоль) и коммерчески доступного 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолана.
Пример 1
3-(4-фтор-фенил)-6-[2-(4-фтор-фенил)-2Н-пиразол-3-ил]-имидазо[1,2-а]пиридин
К смеси 6-бромо-3-(4-фторфенил)-имидазо[1,2-а]пиридина (промежуточное соединение Е) (100 мг, 344 мкмоль) и 1-(4-фтор-фенил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-пиразола (промежуточное соединение А) (119 мг, 412 мкмоль) в 1,2-диметоксиэтане (2 мл), добавили 1М Na2CO3 (859 мкл, 859 мкмоль) и реакционную смесь продули аргоном в течение 10 мин в ультразвуковой ванне. После этого тетракис(трифенилфосфин)палладий(0) (39.7 мг, 34.4 мкмоль) добавили и перемешанную реакционную смесь нагревали при кипении с обратным холодильником в течение 17 ч. Реакционную смесь охладили до комнатной температуры, влили в воду (20 мл) и экстрагировали этилацетатом (2×20 мл). Объединенные органические слои промыли солевым раствором (20 мл), высушили (MgSO4) и эвапорировали. Неочищенное вещество (190 мг) дополнительно очистили с помощью флеш-хроматографии на силикагеле (дихлорметан/МеОН, 0-20%) и тритурировали (диэтиловый эфир) с получением соединения, указанного в заголовке, в виде серо-белого осадка (40 мг, 31%), MS (ISP) m/z=373.4 [(М+Н)+], Тпл 172°С.
Пример 2
3-(4-хлор-фенил)-6-[2-(4-хлор-фенил)-2Н-пиразол-3-ил]-имидазо[1,2-а]пиридин
Соединение, указанное в заголовке, серо-белый осадок (41 мг, 31%), MS (ISP) m/z=405.3 [(М+Н)+], Тпл 172.5°С, получили в соответствии с общим способом примера 1 из 6-бромо-3-(4-хлор-фенил)-имидазо[1,2-а]пиридина (промежуточное соединение F) (0.1 г, 0.325 ммоль) и 1-(4-хлор-фенил)-5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-1Н-пиразола (промежуточное соединение В) (0.12 г, 0.39 ммоль).
Пример 3
6-[2-(4-хлор-фенил)-2Н-пиразол-3-ил]-3-(4-фтор-фенил)-имидазо[1,2-а]пиридин
Соединение, указанное в заголовке, белый осадок (27 мг, 20%), MS (ISP) m/z=389.4 [(М+Н)+], Тпл 147°С, получили в соответствии с общим способом примера 1 из 6-бромо-3-(4-фтор-фенил)-имидазо[1,2-а]пиридина (промежуточное соединение Е) (0.1 мг, 0.34 ммоль) и 1-(4-хлор-фенил)-5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-1Н-пиразола (промежуточное соединение В) (0.13 г, 0.41 ммоль).
Пример 4
3-(4-хлор-фенил)-6-[2-(4-фтор-фенил)-2Н-пиразол-3-ил]-имидазо[1,2-а]пиридин
Соединение, указанное в заголовке, серо-белый осадок (43 мг, 34%), MS (ISP) m/z=389.4 [(М+Н)+], Тпл 171°С, получили в соответствии с общим способом примера 1 из 6-бромо-3-(4-хлор-фенил)-имидазо[1,2-а]пиридина (промежуточное соединение F) (0.1 г, 0.325 ммоль) и 1-(4-фторфенил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-пиразола (промежуточное соединение А) (0.11 мг, 0.38 ммоль).
Пример 5
3-(4-фтор-фенил)-6-(2-р-толил-2Н-пиразол-3-ил)-имидазо[1,2-а]пиридин
Соединение, указанное в заголовке, белый осадок (14 мг, 11%), MS (ISP) m/z=369.5 [(М+Н)+], Тпл 141°С, получили в соответствии с общим способом примера 1 из 6-бромо-3-(4-фтор-фенил)-имидазо[1,2-а]пиридина (промежуточное соединение Е) (0.1 мг, 0.34 ммоль) и 5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-1-р-толил-1Н-пиразола (промежуточное соединение С) (0.083 г, 0.41 ммоль).
Пример 6
6-[2-(4-фтор-фенил)-2Н-пиразол-3-ил]-3-пиридин-4-ил-имидазо[1,2-а]пиридин
Соединение, указанное в заголовке, серо-белый осадок (49 мг, 38%), MS (ISP) m/z=356.6 [(М+Н)+], Тпл 201°С, получили в соответствии с общим способом примера 1 из 6-бромо-3-пиридин-4-ил-имидазо[1,2-а]пиридина (промежуточное соединение F) (0.1 г, 0.365 ммоль) и 1-(4-фтор-фенил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-пиразола (промежуточное соединение А) (0.13 мг, 0.44 ммоль).
Пример 7
6-[2-(4-хлор-фенил)-2Н-пиразол-3-ил]-3-пиридин-4-ил-имидазо[1,2-а]пиридин
Соединение, указанное в заголовке, серо-белый осадок (37 мг, 27%), MS (ISP) m/z=372.5 [(М+Н)+], Тпл 186°С, получили в соответствии с общим способом примера 1 6-бромо-3-пиридин-4-ил-имидазо[1,2-а]пиридина (промежуточное соединение F) (0.1 г, 0.365 ммоль) и 1-(4-хлор-фенил)-5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-1Н-пиразола (промежуточное соединение В) (0.13 г, 0.44 ммоль).
Пример 8
3-фенил-6-(2-фенил-2H-пиразол-3-ил)-имидазо[1,2-а]пиридин
Соединение, указанное в заголовке, серо-белый осадок (48 мг, 39%), MS (ISP) m/z=337.5 [(М+Н)+], Тпл 139°С, получили в соответствии с общим способом примера 1 из 6-бромо-3-фенил-имидазо[1,2-а]пиридина (промежуточное соединение G) (0.1 г, 0.366 ммоль) и 1-фенил-5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-1Н-пиразола (промежуточное соединение D) (0.12 г, 0.44 ммоль).
Пример 9
3-(4-хлор-2-фтор-фенил)-6-[2-(4-фтор-фенил)-2Н-пиразол-3-ил]-имидазо[1,2-а]пиридин
Соединение, указанное в заголовке, белый осадок (53 мг, 42%), MS (ISP) m/z=407.5 [(М+Н)+], Тпл 187°С, получили в соответствии с общим способом примера 1 из 6-бромо-3-(4-хлор-2-фтор-фенил)-имидазо[1,2-а]пиридина (промежуточное соединение I) (0.1 г, 0.31 ммоль) и 1-(4-фтор-фенил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-пиразола (промежуточное соединение А) (0.12 мг, 0.39 ммоль).
Пример 10
3-фенил-6-(2-р-толил-2Н-пиразол-3-ил)-имидазо[1,2-а]пиридин
Соединение, указанное в заголовке, серо-белый осадок (53 мг, 41%), MS (ISP) m/z=351.5 [(М+Н)+], Тпл 107°С, получили в соответствии с общим способом примера 1 из 6-бромо-3-фенил-имидазо[1,2-а]пиридина (промежуточное соединение G) (0.1 г, 0.366 ммоль) и 5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-1-р-толил-1Н-пиразола (промежуточное соединение С) (0.125 г, 0.44 ммоль).
Пример 11
3-(4-хлор-2-фтор-фенил)-6-[2-(4-хлор-фенил)-2Н-пиразол-3-ил]-имидазо[1,2-а]пиридин
Соединение, указанное в заголовке, белый осадок (46 мг, 46%), MS (ISP) m/z=423.5 [(М+Н)+], Тпл 1