Анти-gitr-антитела
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к выделенному антителу или его антигенсвязывающему фрагменту, которые специфически связываются с белком GITR человека. Также раскрыты фармацевтическая композиция, содержащая указанное антитело или его фрагмент, нуклеиновая кислота, кодирующая указанное антитело или его фрагмент, экспрессирующий вектор, содержащий указанную нуклеиновую кислоту, клетка-хозяин, содержащая указанный вектор. Раскрыты способ получение указанного антитела или его антигенсвязывающего фрагмента, а также способ усиления иммунного ответа у человека, при введении указанного антитела или его антигенсвязывающего фрагмента. Изобретение обладает способностью специфически связываться с белком GITR, что позволяет усиливать иммунный ответ у человека. 10 н. и 16 з.п. ф-лы, 8 пр., 9 табл., 2 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение, в общем, относится к антителам, специфичным для индуцируемого глюкокортикоидами рецептора TNF (GITR), и их применениям. Более конкретно изобретение относится к гуманизированным антителам, которые узнают GITR человека и модулируют его активность, особенно при иммунных и пролиферативных нарушениях.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Индуцированный глюкокортикоидами TNFR-родственный белок (GITR), представитель надсемейства TNFR, экспрессируется во многих компонентах врожденной и адаптивной иммунной системы (смотри, например, Hanabuchi et al. (2006) Blood 107: 3617-3623; и Nocentim and Riccardi (2005) Eur. J. Immunol. 2005. 35: 1016-1022). Его экспрессия в мембране возрастает после активации T-клеток (Hanabuchi, выше; и Nocentini and Riccardi, выше); ее усиление коактивирует эффекторные T-лимфоциты и модулирует активность регуляторных T-клеток (Treg) (смотри, например, McHugh et al. (2002) Immunity 2002. 16: 311-323; Shimizu et al. (2002) Nat. Immunol. 3: 135-142; Ronchetti et al. (2004) Eur. J. Immunol. 34: 613-622; и Tone et al. (2003) Proc. Natl. Acad. Sci. USA 100: 15059-15064.
GITR активируется лигандом GITR (GITRL), который экспрессируется, главным образом, на АПК и, как предполагалось, доставляет сигналы благодаря своему цитоплазматическому домену, хотя необходимы дополнительные исследования для определения передачи биохимических сигналов (Nocentini, выше; Ronchetti, выше; Suvas et al. (2005) J. Virol. 79: 11935-11942; и Shin et al. (2002) Cytokine 19: 187-192).
Активация GITR повышает устойчивость к опухолям и вирусным инфекциям, вовлечена в аутоиммунные/воспалительные процессы и регулирует просачивание лейкоцитов (Nocentini, выше; Cuzzocrea et al. (2004) J. Leukoc. Biol. 76: 933-940; Shevach et al. (2006) Nat. Rev. Immunol. 6: 613-618; Cuzzocrea et al. (2006) J. Immunol. 177: 631-641; и Cuzzocrea et al. (2007) FASEB J. 21: 117-129).
Существует потребность в улучшенных способах и композициях для лечения иммунных и пролиферативных нарушений, например, опухолей и злокачественных опухолей с использованием средств, которые модулируют активность GITR. Предпочтительно такие агонисты обладают высокой аффинностью по отношению к молекуле-мишени и способны стимулировать передачу сигнала GITR в относительно низких дозах. Предпочтительно, такие способы и композиции являются высокоспецифичными для GITR и не мешают активности других рецепторов. Предпочтительно, в таких способах и композициях применяют агонисты, подходящие для модификации доставки цитотоксических нагрузок к клеткам-мишеням, но также подходящие для нетоксических применений. Предпочтительно, в таких способах и композициях применяют антитела, модифицированные с целью ограничения их антигенности при введении субъекту, нуждающемуся в таком введении.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 показано синергетическое влияние комбинированного лечения с использованием DTA-1 (специфичного для mGITR; смотри, например, Shimizu et al. (2002) Nature Immunol. 3: 135-142) и местного облучения. «CR» означает полную регрессию.
На фигуре 2 показаны модули GITR, которые определены способом, описанным в публикации Naismith and Sprang (1998) Trends Biochem. Sci. 23: 74-79. Изображенными жирным шрифтом остатками указан конформационный DTA-1-подобный эпитоп, который определен ниже.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение отвечает указанным и другим потребности в данной области благодаря получению агонистов GITR, например, гуманизированных анти-GITR-антител.
В одном аспекте изобретение относится к связывающим соединениям, таким как антитела или их фрагменты, включая гуманизированные или химерные рекомбинантные антитела, которые связывают GITR человека, содержащие вариабельный домен легкой цепи антитела или его антигенсвязывающий фрагмент, имеющий по меньшей мере одну или несколько CDR, выбранных из группы, состоящей из последовательностей SEQ ID NO: 56-88, и вариабельный домен тяжелой цепи, имеющий по меньшей мере одну или несколько CDR, выбранных из группы, состоящей из последовательностей SEQ ID NO: 23-55.
В других вариантах осуществления связывающее соединение согласно настоящему изобретению содержит вариабельный домен легкой цепи и вариабельный домен тяжелой цепи или их антигенсвязывающие фрагменты, описанные в предшествующих двух абзацах.
В некоторых вариантах осуществления связывающее соединение содержит каркасную область, при этом аминокислотная последовательность каркасной области вся или по существу вся состоит из аминокислотной последовательности иммуноглобулина человека.
В некоторых вариантах осуществления вариабельный домен легкой цепи содержит последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 12-22 или их вариантов. В некоторых вариантах вариабельный домен тяжелой цепи содержит последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 1-11. В следующем варианте связывающее соединение содержит вариабельный домен легкой цепи и вариабельный домен тяжелой цепи или их антигенсвязывающие фрагменты, описанные в данном абзаце.
В других вариантах осуществления связывающее соединение согласно настоящему изобретению содержит вариабельный домен легкой цепи или его антигенсвязывающий фрагмент, по существу состоящий из последовательности, выбранной из группы, состоящей из SEQ ID NO: 91, 93, 95, 97, 99, 101, 103, 105, 107, 109, 111, и/или вариабельный домен тяжелой цепи или его антигенсвязывающий фрагмент, по существу состоящий из последовательности, выбранной из группы, состоящей из SEQ ID NO: 90, 92, 94, 96, 98, 100, 102, 104, 106, 108, 110.
В одном варианте осуществления изобретение относится к антителам, которые способны блокировать связывание связывающего соединения согласно настоящему изобретению с GITR человека в анализе перекрестного блокирования. В различных вариантах антитело способно блокировать связывание GITR человека с антителом, содержащим последовательности CDR антител 36E5, 3D6, 61G6, 6H6, 61F6, 1D8, 17F10, 35D8, 49A1, 9E5 или 31H6, которые описаны в настоящей публикации. В другом варианте изобретение относится к связывающим соединениям, которые способны блокировать GITR-опосредованную активность, такие активности включают без ограничения костимуляцию наивных T-клеток CD4+ в анализе пролиферации.
В некоторых вариантах осуществления связывающее соединение согласно настоящему изобретению дополнительно содержит константную область тяжелой цепи, при этом константная область тяжелой цепи содержит константную область тяжелой цепи γ1, γ2, γ3 или γ4 человека или ее вариант. В различных вариантах константная область легкой цепи содержит константную область легкой цепи лямбда или каппа человека.
В различных вариантах осуществления связывающие соединения согласно настоящему изобретению являются поликлональными, моноклональными, химерными, гуманизированными или полностью человеческими антителами или их фрагментами. Настоящее изобретение также предполагает, что антигенсвязывающим фрагментом является фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, Fab’-SH, Fv, scFv, F(ab’)2 и диантитела.
Настоящее изобретение охватывает способ усиления иммунного ответа у человека, включающий введение субъекту, нуждающемуся в этом, антитела (или его антигенсвязывающего фрагмента), специфичного для GITR, в количестве, эффективном для стимуляции передачи сигнала GITR. В некоторых вариантах осуществления антитело, специфичное для GITR, является гуманизированным или химерным антителом. В следующих вариантах осуществления иммунный ответ представляет собой противоинфекционный или противовирусный ответ. В некоторых вариантах осуществления GITR-антитело или его антигенсвязывающий фрагмент применяют совместно с TGFβ-антителом или местным облучением.
Настоящее изобретение относится к изолированной нуклеиновой кислоте, кодирующей полипептидную последовательность варианта связывающего соединения в виде антитела согласно настоящему изобретению. Нуклеиновая кислота может находиться в экспрессирующем векторе, функционально связанном с регуляторными последовательностями, узнаваемыми клеткой-хозяином, трансфицированной вектором. Также предлагается клетка-хозяин, содержащая вектор, и способ получения полипептида, включающий культивирование клетки-хозяина в условиях, в которых экспрессируется последовательность нуклеиновой кислоты, с получением таким образом полипептида, и извлечение полипептида из клетки-хозяина или среды.
Настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, полученному с использованием гидридомы, депонированной в Американской коллекции типовых культур (ATCC), при этом гибридома выбрана из группы, состоящей из PTA-9889, PTA-9890, PTA-9891, PTA-9892, PTA-9893, PTA-10286, PTA-10287, PTA-10288, PTA-10289, PTA-10290 и PTA-10291.
Настоящее изобретение относится к антителу или антигенсвязывающему фрагменту, который связывается с белком GITR человека, при этом антитело или антигенсвязывающий фрагмент узнает эпитоп, охватывающий модуль 3 и модуль 4 белка GITR человека (SEQ ID NO: 89). В некоторых вариантах осуществления эпитоп содержит Gly57, Arg65, His67, Lys80, Phe81, Ser82 и Gln86. В других вариантах осуществления антитело перекрестно блокирует по меньшей мере одно из антител или фрагментов антител, полученных с использованием гибридом, выбранных из группы, состоящей из PTA-9889, PTA-9890, PTA-9891, PTA-9892, PTA-9893, PTA-10286, PTA-10287, PTA-10288, PTA-10289, PTA-10290 и PTA-10291.
ПОДРОБНОЕ ОПИСАНИЕ
При использовании в настоящем описании, включая прилагаемую формулу изобретения, формы слов единственного числа включают соответствующие им значения множественного числа, если контекст ясно не диктует иное. В таблице 15, ниже, приведен список идентификационных номеров последовательностей, используемых в настоящей заявке. Все публикации, цитированные в настоящем описании, включены путем ссылки в такой же степени, как в случае, когда специально и по отдельности указано, что каждая отдельная публикация, доступ в базу данных (например, доступы в базы последовательностей Genbank или GeneID), заявка на выдачу патента или патент включены путем ссылки. Цитирование публикаций в настоящем описании не предназначено в качестве признания того, что любая из указанных выше публикаций представляет предшествующий уровень техники, а также признания в таком качестве содержания или данных, приведенных в таких публикациях или документах.
I. Определения
Термины «GITR», «индуцируемый глюкокортикоидами TNFR-родственный белок», «индуцируемый при активации рецептор семейства TNFR», «AITR», «представитель 18 надсемейства рецепторов фактора некроза опухолей» и «TNFSF18» хорошо известны в данной области. Нуклеотидные и полипептидные последовательности GITR человека и мыши описаны в WO 98/06842. Также доступны депозиты в GenBank® аминокислотной последовательности GITR человека (Q9Y5U5) и нуклеотидной и аминокислотной последовательностей GITR мыши (AF109216).
Термин «пролиферативная активность» включает активность, которая стимулирует, которая необходима или которая специфично ассоциирована, например, с нормальным делением клеток, а также со злокачественными опухолями, опухолями, дисплазией, трансформацией клеток, метастазами и ангиогенезом.
«Введение» и «лечение» в применении к животному, человеку, объекту эксперимента, клетке, ткани, органу или биологической жидкости относится к контакту с экзогенным фармацевтическим, терапевтическим, диагностическим средством или композицией животного, человека, субъекта, клетки, ткани, органа или биологической жидкости. «Введение» и «лечение» («обработка») может относиться, например, к терапевтическим, фармакокинетическим, диагностическим, исследовательским и экспериментальным способам. Обработка клетки включает контакт реагента с клеткой, а также контакт реагента с жидкостью, когда жидкость находится в контакте с клеткой. «Введение» и «лечение» также означает обработки in vitro и ex vivo, например, клетки, реагентом, диагностическим средством, связывающей композицией или другой клеткой. Термин «лечение», который применяют по отношению к человеку, объекту ветеринарии или исследования, относится к терапевтическому лечению, профилактическим или превентивным мерам, к исследовательским и диагностическим применениям. Термин «лечение» в применении к человеку, объекту ветеринарии или исследования или к клетке, ткани или органу охватывает контакт животного, клетки, ткани, физиологического отдела или физиологической жидкости со средством. «Обработка клетки» также охватывает ситуации, когда средство контактирует с GITR, например, в жидкой фазе или коллоидной фазе, а также ситуации, когда агонист или антагонист не контактирует с клеткой или рецептором.
При использовании в настоящем описании термин «антитело» относится к любой форме антитела, которая проявляет требуемую биологическую активность. Таким образом, термин используют в наиболее широком смысле, и он, как правило, охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, полиспецифичные антитела (например, биспецифичные антитела), химерные антитела, гуманизированные антитела, полностью человеческие антитела и т.д., при условии, что они проявляют требуемую биологическую активность.
При использовании в настоящем описании термины «GITR-связывающий фрагмент», «его связывающий фрагмент» или «его антигенсвязывающий фрагмент» охватывают фрагмент или производное антитела, которые в значительной степени сохраняют свою биологическую активность в индукции передачи сигнала GITR, называемую в настоящем описании «GITR-индуцирующей активностью». Термин «фрагмент антитела» или GITR-связывающий фрагмент относится к части полноразмерного антитела, обычно его антигенсвязывающей или вариабельной части. Примеры фрагментов антител включают Fab, Fab’, F(ab’)2 и Fv-фрагмент; диантитела; линейные антитела; одноцепочечные молекулы антител, например, sc-Fv; и полиспецифичные антитела, образованные из фрагментов антител. Обычно связывающий фрагмент или производное сохраняет по меньшей мере 10% от активности агониста GITR. Предпочтительно связывающий фрагмент или производное сохраняет по меньшей мере 25%, 50%, 60%, 70%, 80%, 90%, 95%, 99% или 100% (или больше) активности агониста GITR, хотя может быть применим любой связывающий фрагмент с аффинностью, достаточной для проявления требуемого биологического эффекта. Также предполагается, что GITR-связывающий фрагмент может включать варианты, имеющие консервативные аминокислотные замены, которые по существу не меняют его биологическую активность.
Термин «моноклональное антитело» при использовании в настоящем описании относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела являются высокоспецифичными, будучи направленными против одного антигенного эпитопа. Напротив, обычные препараты (поликлональных) антител обычно содержат множество антител, направленных против (или специфичных для) разных эпитопов. Определение «моноклональное» указывает на природу антитела, как антитела, полученного по существу из гомогенной популяции антител, и его не следует рассматривать как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, применяемые согласно настоящему изобретению, могут быть получены способом на основе гибридом, впервые описанным Kohler с соавторами ((1975) Nature 256: 495) или могут быть получены способами на основе рекомбинантной ДНК (смотри, например, патент США № 4816567). «Моноклональные антитела» также могут быть выделены из фаговых библиотек антител с использованием способов, описанных, например, Clackson с соавторами (1991) (Nature 352: 624-628) и Marks с соавторами (1991) (J. Mol. Biol. 222: 581-597).
Моноклональные антитела согласно изобретению, в частности, включают «химерные» антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных от конкретного вида или относящихся к конкретному классу или подклассу антител, при этом остальная часть цепи (цепей) идентична или гомологична соответствующим последовательностям в антителах, полученных от другого вида или относящихся к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют требуемую биологическую активность (патент США № 4816567; Morrison et al. (1984) Proc. Natl. Acad. Sci. USA 81: 6851-6855).
«Доменное антитело» представляет собой иммунологически функциональный фрагмент иммуноглобулина, содержащий только вариабельную область тяжелой цепи или вариабельную область легкой цепи. В некоторых случаях две или больше области VH ковалентно связаны пептидным линкером с образованием бивалентного доменного антитела. Две области VH бивалентного доменного антитела могут быть нацелены на одни и те же или разные антигены.
«Бивалентное антитело» содержит два антигенсвязывающих участка. В некоторых случаях два связывающих участка имеют одинаковые антигенные специфичности. Однако бивалентные антитела могут быть биспецифичными (смотри ниже).
При использовании в настоящем описании термин «одноцепочечное Fv» или «scFv» антитело относится к фрагментам антител, содержащим домены VH и VL антитела, при этом указанные домены присутствуют в одной полипептидной цепи. В общем, полипептид Fv дополнительно содержит полипептидный линкер между доменами VH и VL, который позволяет scFv образовывать требуемую структуру для связывания антигена. Обзор scFv смотри в Pluckthun (1994), Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315.
Моноклональные антитела в настоящем описании также включают камелизированные однодоменные антитела. Смотри, например, Muyldermans et al. (2001) Trends Biochem. Sci. 26: 230; Reichmann et al. (1999) J. Immunol. Methods 231: 25; WO 94/04678; WO 94/25591; патент США № 6005079. В одном варианте осуществления настоящее изобретение относится к однодоменным антителам, содержащим два домена VH с модификациями, так что образуются однодоменные антитела.
При использовании в настоящем описании термин «диантитела» относится к небольшим фрагментам антител с двумя антигенсвязывающими участками, и такие фрагменты содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в одной и той же полипептидной цепи (VH-VL или VL-VH). При использовании линкера, который является слишком коротким, чтобы обеспечить спаривание между двумя доменами на одной и той же цепи, домены вынуждены образовывать пару с комплементарными доменами другой цепи и создавать два антигенсвязывающих участка. Диантитела более полно описаны, например, в EP 404097; WO 93/11161; и Hollinger et al., (1993) Proc. Natl. Acad. Sci. USA, 90: 6444-6448. Обзор сконструированных вариантов антител, в общем, приведен в Holliger and Hudson (2005) Nat. Biotechnol. 23: 1126-1136.
При использовании в настоящем описании термин «гуманизированное антитело» относится к формам антител, которые содержат последовательности антител животных, отличных от человека (например, мыши), а также антител человека. Такие антитела содержат минимальную последовательность, полученную из иммуноглобулина животного, отличного от человека. В общем, гуманизированное антитело будет содержать в основном целиком по меньшей мере один и обычно два вариабельных домена, в которых все или по существу все гипервариабельные петли соответствуют петлям иммуноглобулина животного, отличного от человека, и все или по существу все области FR являются областями FR из последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также будет содержать по меньшей мере часть константной области иммуноглобулина (Fc), обычно константной области иммуноглобулина человека. Приставку «hum», «hu» или «h» добавляют к обозначению клона антитела, когда необходимо отличить гуманизированные антитела от исходных антител грызунов. Гуманизированные формы антител грызунов обычно будут содержать те же самые последовательности CDR исходных антител грызунов, хотя могут быть введены некоторые аминокислотные замены, чтобы повысить аффинность, повысить стабильность гуманизированного антитела или по другим причинам.
Антитела согласно настоящему изобретению также включают антитела с модифицированными (или блокированными) областями Fc, чтобы обеспечить измененные эффекторные функции. Смотри, например, патент США №№ 5624821, WO2003/086310, WO2005/120571, WO2006/0057702, Presta (2006) Adv. Drug Delivery Rev. 58: 640-656. Такая модификация может быть использована для усиления или подавления различных реакций иммунной системы с возможными полезными эффектами для диагностики и терапии. Изменения Fc-области включают изменения аминокислот (замены, делеции и инсерции), гликозилирование или дегликозилирование и добавление нескольких Fc. Изменения Fc также могут изменять время полужизни антител в случае терапевтических антител, и более длительное время полужизни может обеспечивать менее частое введение доз с сопутствующим более удобным применением и использованием меньшего количества материала. Смотри Presta (2005) J. Allergy Clin. Immunol. 116: 731, 734-35.
Антитела согласно настоящему изобретению также включают антитела с интактными областями Fc, которые обеспечивают полные эффекторные функции, например, антитела изотипа IgG1, которые индуцируют зависимую от комплемента цитотоксичность (CDC) или зависимую от антител клеточную цитотоксичность (ADCC) в клетках-мишенях.
Антитела согласно настоящему изобретению также включают антитела, конъюгированные с цитотоксической нагрузкой, такой как цитотоксические средства или радионуклиды. Такие конъюгаты антител можно использовать в иммунотерапии в сочетании с анти-GITR-обработкой, чтобы избирательно направить к цели и убить клетки, экспрессирующие определенные антигены на своей поверхности. Примеры цитотоксических средств включают рицин, алкалоид барвинка, метотрексат, экзотоксин Psuedomonas, сапонин, дифтерийный токсин, цисплатин, доксорубицин, токсин абрин, гелонин и антивирусный белок лаконоса. Примерами радионуклидов для применения в иммунотерапии с использованием антител согласно настоящему изобретению являются 125I, 131I, 90Y, 67Cu, 211At, 177Lu, 143Pr и 213Bi. Смотри, например, публикацию заявки на выдачу патента № 2006/0014225.
Термин «полностью человеческое антитело» относится к антителу, которое содержит только последовательности белка иммуноглобулина человека. Полностью человеческое антитело может содержать мышиные углеводные цепи, если они продуцируются в организме мыши, в мышиной клетке или в гибридоме, полученной из мышиной клетки. Подобным образом, термины «мышиное антитело» или «антитело крысы» относятся к антителу, которое содержит только последовательности иммуноглобулина мыши или крысы, соответственно. Полностью человеческое антитело может быть образовано в организме человека, в трансгенном животном, имеющем последовательности зародышевой линии иммуноглобулина человека, с помощью фагового дисплея или других молекулярно-биологических способов.
При использовании в настоящем описании термин «гипервариабельная область» относится к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Гипервариабельная область содержит аминокислотные остатки из «области, определяющей комплементарность» или «CDR» (например, остатки 24-34 (CDRL1), 50-56 (CDRL2) и 89-97 (CDRL3) в вариабельном домене легкой цепи и остатки 31-35 (CDRH1), 50-65 (CDRH2) и 95-102 (CDRH3) в вариабельном домене тяжелой цепи (Kabat et al.(1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md.)) и/или остатки из «гипервариабельной петли» (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (H1), 53-55 (H2) и 96-101 (H3) в вариабельном домене тяжелой цепи (Chothia and Lesk (1987) J. Mol. Biol. 196: 901-917)). При использовании в настоящем описании остатки «каркаса» или «FR» представляют собой другие остатки вариабельного домена, отличные от остатков гипервариабельной области, которые определены в данном описании как остатки CDR. Нумерация остатков, указанная выше, относится к системе нумерации по Кабату и необязательно должна в точности соответствовать нумерации последовательностей, приведенных в прилагаемом списке последовательностей.
«Связывающее соединение» относится к молекуле, малой молекуле, макромолекуле, полипептиду, антителу или его фрагменту или аналогу или растворимому рецептору, способному связываться с мишенью. «Связывающее соединение» также может относиться к комплексу молекул, например, нековалентному комплексу, к ионизированной молекуле и к ковалентно или нековалентно модифицированной молекуле, например, модифицированной фосфорилированием, ацилированием, поперечным связыванием, циклизацией или ограниченным расщеплением, которая способна связываться с мишенью. При использовании в отношении антител термин «связывающее соединение» относится как к антителам, так и их антигенсвязывающим фрагментам. «Связывание» относится к ассоциации связывающей композиции с мишенью, при этом ассоциация приводит к уменьшению нормального броуновского движения связывающей композиции в случаях, когда связывающая композиция может быть растворена или суспендирована в растворе. «Связывающая композиция» относится к молекуле, например, связывающему соединению, в сочетании со стабилизатором, эксципиентом, солью, буфером, растворителем или добавкой, способной к связыванию с мишенью.
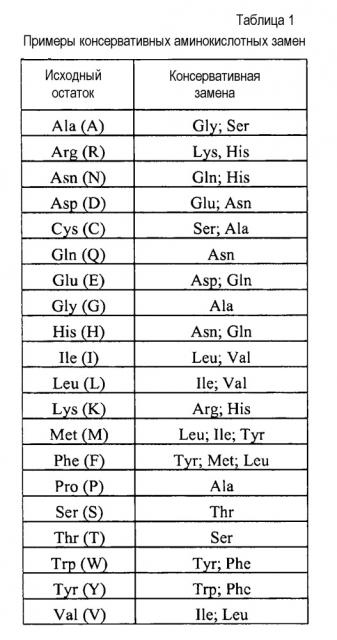
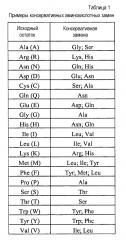
Термины «консервативно модифицированные варианты» или «консервативная замена» относятся к заменам аминокислот, известным специалистам в данной области, и часто могут быть осуществлены даже в важных областях полипептида без изменения биологической активности полученной в результате молекулы. Такие примерные замены предпочтительно осуществляют в соответствии с заменами, указанными в приведенной ниже таблице 1:
Специалистам в данной области понятно, что, в общем, одиночные аминокислотные замены в несущественных областях полипептида могут незначительно изменять биологическую активность. Смотри, например, Watson et al. (1987) Molecular Biology of the Gene, The Benjamin/Cummings Pub. Co., p. 224 (4th Edition).
Фраза «по существу состоит из» или варианты, такие как «по существу состоят из» или «по существу состоящий из», которые использованы на протяжении описания и формулы изобретения, указывают на включение любого из перечисленных элементов или группы элементов и необязательно включение других элементов, сходных или отличающихся по своей природе от перечисленных элементов, которые фактически не изменяют основные или новые свойства указанной схемы дозирования, способа или композиции. В качестве неограничивающего примера связывающее соединение, которое по существу состоит из указанной аминокислотной последовательности, также может содержать одну или несколько аминокислот, включая замены одного или нескольких аминокислотных остатков, которые фактически не влияют на свойства связывающего соединения.
«Эффективное количество» охватывает количество, достаточное для ослабления или предотвращения симптома или признака патологического состояния. Эффективное количество также означает количество, достаточное для обеспечения возможности или облегчения диагностики. Эффективное количество для конкретного пациента или объекта ветеринарии может варьировать в зависимости от таких факторов, как состояние, подвергаемое лечению, общее состояние здоровья пациента, способ, путь и доза введения и тяжесть побочных эффектов. Смотри, например, патент США № 5888530. Эффективное количество может соответствовать максимальной дозе или протоколу дозирования, которые позволяют избегать значимых побочных эффектов или токсических эффектов. Эффект будет приводить к улучшению диагностического показателя или параметра по меньшей мере на 5%, обычно по меньшей мере на 10%, более обычно по меньшей мере на 20%, чаще всего по меньшей мере на 30%, предпочтительно по меньшей мере на 40%, более предпочтительно по меньшей мере на 50%, наиболее предпочтительно по меньшей мере на 60%, в оптимальном варианте по меньшей мере на 70%, более оптимально по меньшей мере на 80% и наиболее оптимально по меньшей мере на 90%, при этом 100% определяют в качестве диагностического параметра, наблюдаемого у здорового субъекта. Смотри, например, Maynard et al. (1996) A Handbook of SOPs or Good Clinical Practice, Interpharm Press, Boca Raton, FL; Dent (2001) Good Laboratory and Good Clinical Practice, Urch Publ., London, UK.
«Связанное с иммунной системой состояние» или «иммунное нарушение» охватывает, например, патологическое воспаление, воспалительное нарушение и аутоиммунное нарушение или заболевание. «Связанное с иммунной системой состояние» также относится к инфекциям, хроническим инфекциям и пролиферативным состояниям, таким как злокачественная опухоль, опухоли и ангиогенез, включая инфекции, опухоли и злокачественные опухоли, которые резистентны к подавлению иммунной системой. «Злокачественное состояние» включает, например, рак, злокачественные клетки, опухоли, ангиогенез и предзлокачественные состояния, такие как дисплазия.
Термин «иммунное заболевание» означает заболевание, при котором компонент иммунной системы млекопитающего вызывает, опосредует или иным образом вносит вклад в заболеваемость млекопитающих. Термин также включает заболевания, при которых стимуляция или препятствование иммунному ответу оказывает ослабляющее влияние на прогрессирование заболевания. В данный термин включены аутоиммунные заболевания, опосредованные иммунной системой воспалительные заболевания, не опосредованные иммунной системой воспалительные заболевания, инфекционные болезни и иммунодефицитные заболевания. Примеры иммунных и воспалительных заболеваний, некоторые из которых опосредованы иммунной системой или T-клетками, которые можно лечить согласно изобретению, включают системную красную волчанку, ревматоидный артрит, ювенильный хронический артрит, спондилоартропатии, системный склероз (склеродермию), идиопатические воспалительные миопатии (дерматомиозит, полимиозит), синдром Шегрена, системный васкулит, саркоидоз, аутоиммунную гемолитическую анемию (иммунную панцитопению, пароксизмальную ночную гемоглобинурию), аутоиммунную тромбоцитопению (идиопатическую тромбоцитопеническую пурпуру, опосредованную иммунной системой тромбоцитопению), тиреоидит (диффузный токсический зоб, тиреоидит Хашимото, ювенильный лимфоцитарный тиреоидит, атрофический тиреоидит), сахарный диабет, опосредованное иммунной системой заболевание почек (гломерулонефрит, тубулярно-интерстициальный нефрит), демиелинизирующие заболевания центральной и периферической нервной системы, такие как рассеянный склероз, идиопатическая димиелинизирующая полинейропатия или синдром Гийена-Барре и хроническая воспалительная демиелинизирующая полинейропатия, гепатобилиарные заболевания, такие как инфекционный гепатит (гепатит A, B, C, D, E и другие негепатотропные вирусы), аутоиммунный хронический активный гепатит, первичный билиарный цирроз, гранулематозный гепатит и склерозирующий холангит, воспалительное и фиброзные заболевания легких, воспалительное заболевание кишечника (язвенный колит, болезнь Крона), глутен-чувствительную энтеропатию и болезнь Уиппла, аутоиммунные или опосредованные иммунной системой заболевании кожи, включая буллезные заболевания кожи, экссудативную многоформную эритему и контактный дерматит, псориаз, аллергические болезни, такие как астма, аллергический ринит, атопический дерматит, гиперчувствительность к пищевым продуктам и крапивница, иммунологические заболевания легких, такие как эозинофильная пневмония, идиопатический легочный фиброз и гиперчувствительный пневмонит, заболевания, связанные с трансплантацией, включая отторжение трансплантата и болезнь трансплантат против хозяина. Инфекционные болезни включают СПИД (ВИЧ-инфекцию), гепатит A, B, C, D и E, бактериальные инфекции, грибковые инфекции, протозойные инфекции и паразитарные инфекции.
Термины «злокачественная опухоль», «опухоль» и «злокачественный» относятся или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым клеточным ростом. Примеры злокачественной опухоли включают без ограничения карциному, включая аденокарциному, лимфому, бластому, меланому, саркому и лейкоз. Более конкретные примеры таких злокачественных опухолей включают плоскоклеточный рак, мелкоклеточный рак легкого, немелкоклеточный рак легкого, рак желудочно-кишечного тракта, лимфому Ходжкина и неходжкинскую лимфому, рак поджелудочной железы, глиобластому, глиому, рак шейки матки, рак яичника, рак печени, такой как карцинома печени и гепатома, рак мочевого пузыря, рак молочной железы, рак ободочной кишки, рак ободочной и прямой кишки, эндометриальную карциному, миелому (такую как множественная миелома), карциному слюнных желез, рак почек, такой как почечноклеточная карцинома и опухоли Вильмса, карциному базальных клеток, меланому, рак простаты, рак вульвы, рак щитовидной железы, рак семенников, рак пищевода и различные типы рака головы и шеи.
По мере того, как злокачественные клетки растут и размножаются, они образуют массу злокачественной ткани, которая представляет собой опухоль, которая внедряется и нарушает нормальные близлежащие ткани. Злокачественные новообразования представляют собой злокачественную опухоль. Злокачественные опухоли обычно можно удалить, но они могут вырасти вновь. Клетки из злокачественных опухолей могут проникать и повреждать близлежащие ткани и органы. Также злокачественные клетки могут отрываться от злокачественной опухоли и поступать в кровоток или лимфатическую систему, и таким путем злокачественные клетки распространяются от первичной опухоли (т.е. исходной злокачественной опухоли), образуя новые опухоли в других органах. Распространение злокачественной опухоли в организме называют метастазированием (What You Need to Know About Cancer - an Overview, NIH Publication No. 00-1566; posted Sept. 26, 2000, updated Sept. 16, 2002 (2002)).
При использовании в настоящем описании термин «солидная опухоль» относится к аномальному росту или аномальной массе ткани, которая обычно не содержит пузырей или областей, заполненных жидкостью. Солидные опухоли могут быть доброкачественными (незлокачественными) или злокачественными. Разные типы солидных опухолей называют по типу клеток, которые их образуют. Примерами солидных опухолей являются саркомы, карциномы и лимфомы. Лейкозы (рак крови) обычно не образуют солидных опухолей (National Cancer Institute, Dictionary of Cancer Terms).
При использовании в настоящем описании термин «первичная злокачественная опухоль» относится к исходной опухоли или первой опухоли. Злокачественная опухоль может возникать в любом органе или ткани организма. Ее обычно называют по части тела или по типу клеток, в которых она возникает (Metastatic Cancer: Questions and Answers, Cancer Facts 6.20, National Cancer Institute, reviewed Sept. 1, 2004 (2004)).
При использовании в настоящем описании термин «карцинома in situ» относится к злокачественным клеткам, которые еще находятся в ткани, в которой начали расти и еще не стали инвазивными или не распространились на другие части тела.
При использовании в настоящем описании термин «карциномы» относится к злокачественным опухолям эпителиальных клеток, которые представляют собой клетки, которые покрывают поверхность тела, продуцируют гормоны и образуют гланды. Примерами карцином являются злокачественные опухоли кожи, легкого, ободочной кишки, желудка, молочной железы, простаты и тиреоидной железы.
При использовании в настоящем описании термин «изолированная молекула нуклеиновой кислоты» относится к молекуле нуклеиновой кислоты, которую идентифицируют и отделяют по меньшей мере от одной примесной молекулы нуклеиновой кислоты, с которой она обычно ассоциирована в природном источнике нуклеиновой кислоты. Изолированная молекула нуклеиновой кислоты имеет другую форму или окружение, отличные от той формы и окружения, в которых она встречается в природе. Поэтому изолированные молекулы нуклеиновой кислоты отличаются от молекулы нуклеиновой кислоты, в виде которой она существует в природных клетках. Однако изолированная молекула нуклеиновой кислоты включает молекулы нуклеиновой кислоты, которые содержатся в клетках, которые обычно экспрессируют антитело, при этом молекула нуклеиновой кислоты находится, например, в положении хромосомы, отличном от поло