Способ определения содержания свободной абсцизовой кислоты в вегетативных органах растений методом капиллярного электрофореза
Иллюстрации
Показать всеИзобретение относится к аналитической химии и может быть использовано при определении содержания свободной абсцизовой кислоты в вегетативных органах растений. Для этого проводят экстракцию свободной абсцизовой кислоты из биологического материала с использованием диэтилового эфира, упариванием эфирного экстракта досуха и последующим разстворением остатка в 60%-ном водном растворе ацетона. Определение содержания свободной абсцизовой кислоты проводят методом капиллярного электрофореза в кварцевом капилляре с эффективной длиной 0,5 м и внутренним диаметром 75 мкм. Анализ проводят в водном ведущем электролите, содержащем 0,33 мас.% борной кислоты, 0,05 мас.% тетрабората натрия и 0,5 об.% изопропанола при положительной полярности напряжения. Длина волны детектирования - 254 нм. Изобретение обеспечивает упрощение процедуры пробоподготовки при количественном определении свободной абсцизовой кислоты. 1 табл., 2 ил., 4 пр.
Реферат
Изобретение относится к аналитической химии изопреноидов, в частности к способу определения содержания свободной абсцизовой кислоты (АБК) в вегетативных органах растений.
Абсцизовая кислота индуцирует состояние покоя, играет основную роль при регуляции водного баланса и участвует в регуляции экспрессии генов стрессового ответа у растений [Г.-В. Хелдт, Биохимия растений. - М.: БИНОМ, 2011. - 471 с.].
Известно, что для выделения и изучения абсцизовой кислоты используют различные методы, в том числе хроматографию, метод биотестов.
Метод биологических проб (биотестов) применяют для определения активности эндогенных биологически активных веществ. Метод основан на подсчете числа проросших семян горчицы в опытных вариантах к числу проросших семян в контрольном варианте. Уровень ингибирования прорастания семян характеризует содержание АБК в исследуемом материале [Методические рекомендации по определению фитогормонов. Киев: Институт ботаники АН УССР, 1988. - 78 с.]. Недостатками этого метода являются длительность его проведения (не менее 2 суток), относительные показатели содержания абсцизовой кислоты в исследуемом материале и отсутствие требуемой точности количественного анализа.
Известен способ определения содержания фитогормонов с использованием системы капиллярного электрофореза в кварцевом капилляре эффективной длиной 0,5 м, внутренним диаметром 75 мкм, проводимого в боратном буфере pH 10. Для анализа используют метанольные растворы фитогормонов, абсцизовой кислоты, гибберелловой кислоты, индолилуксусной кислоты и ее химических аналогов (нафтилуксусной кислоты и 2,4 дихлорфеноксиуксусной кислоты), а также салициловой и жасмоновой кислот, которые разделяли в градиенте pH между тремя жидкими фазами. Для определения их содержания используют UV-Visible детектор при длинах волн: для гибберелловой кислоты, жасмоновой кислоты, 2,4-дихлорфеноксиуксусной кислоты и салициловой кислоты - 200 нм; индолилуксусной и 2,4-дихлорфеноксиуксусной кислоты - 220 нм; для салициловой кислоты также 254 нм. (Linfang, Man Не, Biebie Cen, Bin Hu Membren-supported liquid-liquid-liquid microextraction combined with anion-selective axhaustive injection capillary electrophoresis-ultraviolet detection for sensitive analysis of phytohormones // Journal of Cromatography A, Volume 1343, 23 May 2014, pp. 10-17, D1). Недостаток этого способа в том, что он очень длительный. Этот способ включает в себя выделение и разделение большого количества биологически активных веществ, для экстракции которых используется метанол, смесь фенетола и 1-октанола в соотношении 6:4, извлекающие из растений на только свободную, но и связанные формы этих веществ, с последующим разделением их в градиенте pH трех не смешивающихся жидкостей, с последующим использованием капиллярного электрофореза с ультрафиолетовым детектором. Применение токсичного метанола загрязняет окружающую среду. При анализе сложных по составу биологических проб происходит быстрое загрязнение разделяющего капилляра. Кроме того, искомой биологической активностью обладает свободная форма абсцизовой кислоты.
Наиболее близким к заявляемому способу техническим решением является способ количественного определения содержания абсцизовой кислоты методом высокоэффективной жидкостной хроматографии с УФ-детектором в очищенных экстрактах.
Предварительная пробоподготовка заключается в выделении анализируемого объекта 80%-ным этанолом, удалении пигментов и белков из водной фазы подкислением 10%-ной серной кислотой до pH 2,0-3,0, замораживании жидким азотом с последующим оттаиванием при комнатной температуре и центрифугировании в течение 20 минут при 15-16 тыс. об/мин на центрифуге. Дальнейшую очистку экстракта проводят перераспределением в системах двух несмешивающихся фаз.
Анализ содержания абсцизовой кислоты в супернатанте выполняют методом высокоэффективной жидкостной хроматографии на колонке с привитой фазой Partisil 10 ODS, 5 мкм, с использованием подвижной фазы - 40%-ного водного раствора метилового спирта, температура +40°C, давление 75 бар. Идентификацию и количественный анализ осуществляют на основе времени удерживания стандартного вещества и метода добавки [Методические рекомендации по определению фитогормонов. - Киев: Институт ботаники АН УССР, 1988. - 78 с.].
Недостатки способа в том, что этанол экстрагирует суммарную абсцизовую кислоту (свободную и связанную), применение жидкого азота существенно увеличивает стоимость анализа и его опасность, последующая утилизация использованной подвижной фазы, содержащей метанол, приводит к загрязнению окружающей среды. При анализе сложных по составу биологических проб происходит быстрое загрязнение разделяющего капилляра. Кроме того, искомой биологической активностью обладает свободная форма абсцизовой кислоты.
Задачей изобретения является извлечение, эффективное разделение и определение свободной абсцизовой кислоты методом высокоэффективного капиллярного электрофореза, обеспечение экспрессных и достоверных количественных результатов при минимальных затратах на пробоподготовку и выполнение анализа.
Техническим результатом при использовании предлагаемого изобретения является экспрессность и достоверность количественного определения свободной абсцизовой кислоты методом капиллярного электрофореза с применением нетоксичных и доступных реактивов для проведения анализа.
Технический результат достигают за счет того, что способ определения содержания свободной абсцизовой кислоты в вегетативных органах растений включает экстракцию свободной абсцизовой кислоты диэтиловым эфиром, упаривание экстракта до сухого остатка с последующим разведением его в 60%-ном водном растворе ацетона и выполнение анализа на системе капиллярного электрофореза в кварцевом капилляре, эффективной длиной 0,5 м, внутренним диаметром 75 мкм, с использованием для анализа водного ведущего электролита содержащего 0,33% масс. борной кислоты, 0,05% масс. тетрабората натрия, 0,5% об. изопропанола, pH 9,3, при положительной полярности напряжения и длине волны детектирования - 254 нм.
Способ экспрессного и достоверного определения содержания свободной абсцизовой кислоты в вегетативных органах растений на системе капиллярного электрофореза в кварцевом капилляре, эффективной длиной 0,5 м, внутренним диаметром 75 мкм, с использованием для анализа водного ведущего электролита, содержащего 0,33% масс. борной кислоты, 0,05% масс. тетрабората натрия и 0,5% об. изопропанола, pH 9,3 при положительной полярности напряжения и длине волны детектирования - 254 нм, отличается тем, что подготовка пробы для определения содержания свободной абсцизовой кислоты в вегетативных органах растений включает экстракцию свободной абсцизовой кислоты из биологического материала с использованием диэтилового эфира, упаривание эфирного экстракта до сухого остатка и разведением его в 60%-ном водном растворе ацетона.
Поставленная задача решается за счет того, что для экстракции свободной абсцизовой кислоты используется диэтиловый эфир, а при проведении капиллярного электрофореза свойства ведущего электролита позволяют исключить из процесса анализа многостадийную пробоподготовку и обеспечить эффективное разделение анализируемого компонента.
В результате проведенных исследований и сравнения с аналогом установлено, что предлагаемый способ определения содержания свободной абсцизовой кислоты в вегетативных органах растений, включающий экстракцию свободной абсцизовой кислоты диэтиловым эфиром, упаривание экстракта до сухого остатка с последующим разведением его в 60%-ном водном растворе ацетона, выполнение анализа на системе капиллярного электрофореза в кварцевом капилляре, эффективной длиной 0,5 м, внутренним диаметром 75 мкм, с использованием для анализа водного ведущего электролита, содержащего 0,33% масс. борной кислоты, 0,05% масс. тетрабората натрия и 0,5% об. изопропанола, pH 9,3 при положительной полярности напряжения и длине волны детектирования - 254 нм, позволяет достичь объективного, экспрессного определения массового содержания свободной абсцизовой кислоты как в градуировочных растворах, так и в биологических пробах.
Преимущества заявляемого способа заключаются в использовании нетоксичных и доступных реактивов при осуществлении экстракции свободной абсцизовой кислоты из биологического материала с использованием диэтилового эфира, упаривание экстракта до сухого остатка с последующим разведением его в 60%-ном водном растворе ацетона и выполнение анализа на системах капиллярного электрофореза, например, серии «Капель», обеспечении объективности и достоверности анализа реальных проб, стабильности во времени ведущего электролита, позволяющего исключить из процесса анализа многостадийную пробоподготовку и обеспечить эффективное разделение анализируемого компонента.
Контролем служило определение абсцизовой кислоты в этой же пробе согласно способа-прототипа.
Изобретение иллюстрируется следующими примерами.
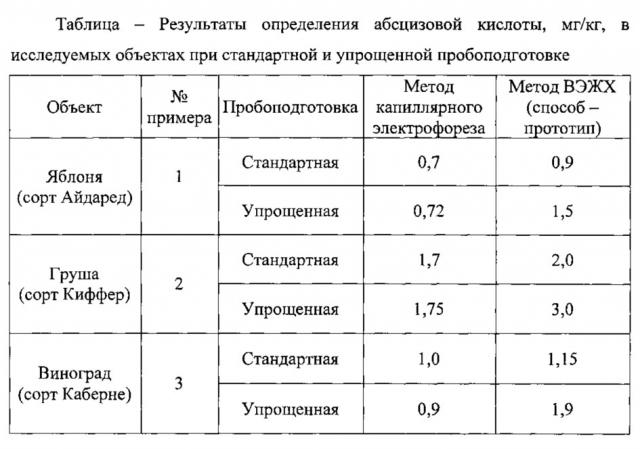
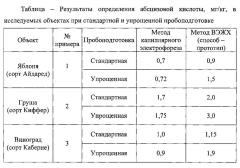
Пример 1. Определение содержания свободной абсцизовой кислоты методом капиллярного электрофореза в листьях яблони при стандартной и упрощенной пробоподготовке.
При стандартной подготовке пробу листьев яблони сорта Айдаред массой 1,00 г фиксируют в жидком азоте, затем гомогенизировали с 80%-ным этанолом в соотношении 1:10 и оставляли для экстракции при температуре +2…+4°C в течение 22-24 часов. Операцию повторяют трижды. Все порции экстрагента объединяли и упаривали при 40°C до водной фазы.
Для удаления пигментов и белков водную фазу подкисляли 10%-ной серной кислотой до pH 2,0-3,0, замораживали с последующим оттаиванием при комнатной температуре. После этого содержимое из пробирки количественно переносили в центрифужные пробирки (объем 5 см3), центрифугировали при 15-16 тыс. об/мин в течение 20 минут. Подкисленный водный остаток переносили в мерные цилиндры с притертой пробкой и проводили экстракцию очищенным от перекисей серным эфиром (соотношение объемов эфира и водной фазы 1:1). После разделения фаз эфирную фракцию переносили в ротационный испаритель и упаривали при температуре не выше 40°C, который переносили в делительную воронку и трехкратно экстрагировали 5%-ным водным раствором натрия гидрокарбоната (15-20 см3). Водные фракции объединяли, подкисляли 10%-ной серной кислотой до pH 7,0 и трижды экстрагировали в делительной воронке диэтиловым эфиром (соотношение объемов 1:1). Эфирные фракции отбрасывали, pH водного раствора доводили до 2,0-3,0 и трижды экстрагировали диэтиловым эфиром (соотношение объемов 1:1). Эфирную фракцию концентрировали и упаривали до сухого остатка.
Количественно определяли содержание свободной абсцизовой кислоты методом капиллярного электрофореза. Для этого полученный сухой остаток растворяли в 1 см3 40%-ного водного метанола и помещали в систему капиллярного электрофореза. Анализ осуществляли в следующих условиях. Система капиллярного электрофореза с источником питания положительной полярности, например, серии «Капель», оборудованная фотометрическим детектором с установленной длиной волны 254 нм, кварцевым капилляром внутренним диаметром 75 мкм, эффективной длиной 0,5 м; положительное напряжение на капилляре 16 кВ; рекомендуется термостатирование капилляра при +25°C; ввод пробы - пневматический - 30 мБар в течение 10 секунд; время анализа - 10 мин. Для проведения анализа используют водный раствор ведущего электролита следующего состава: 0,33% масс, борной кислоты, 0,05% масс, тетрабората натрия, 0,5% об. изопропанола, pH 9,3. Срок хранения ведущего электролита не более 14 суток.
Осуществляли подготовку упрощенным способом. Пробу листьев яблони сорта Айдаред массой 1,00 г заливали серным эфиром, очищенным по известной технологии от перекисей, в соотношении 1:10 и растирали в смеси с кварцевым песком, фильтровали через стеклянный фильтр. Эфирный экстракт переносили в стаканы и выпаривали досуха в токе сухого воздуха. Полученный сухой остаток, содержащий анализируемое вещество, растворяли в 2 см3 60%-ного ацетона, центрифугировали и переносили для анализа в систему капиллярного электрофореза. Анализ осуществляли согласно описанным выше параметрам.
Контролем служило определение абсцизовой кислоты в этой же пробе, согласно способу-прототипу методом ВЭЖХ.
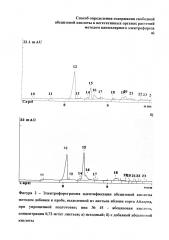
Полученные результаты приведены в таблице. Электрофореграмма определения абсцизовой кислоты в экстракте листьев яблони при стандартной пробоподготовке методом капиллярного электрофореза приведена на фигуре 1; в экстракте листьев яблони при упрощенной пробоподготовке методом капиллярного электрофореза - на фигуре 2а.
Пример идентификации абсцизовой кислоты при упрощенной пробоподготовке методом добавки стандартного раствора абсцизовой кислоты показан на фигуре 2б.
Пример 2. Определение содержания абсцизовой кислоты методом капиллярного электрофореза в листьях груши при стандартной и упрощенной пробоподготовке
Аналогично примеру 1, кроме того, что пробоподготовке подвергали листья груши сорта Киффер. Полученные результаты приведены в таблице.
Пример 3. Определение содержания абсцизовой кислоты методом капиллярного электрофореза в листьях винограда при стандартной и упрощенной пробоподготовке
Аналогично примеру 1, кроме того, что пробоподготовке подвергали листья винограда сорта Каберне. Полученные результаты приведены в таблице.
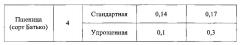
Пример 4. Определение содержания абсцизовой кислоты методом капиллярного электрофореза в листьях пшеницы при стандартной и упрощенной пробоподготовке.
Аналогично примеру 1, кроме того, что пробоподготовке подвергали листья пшеницы сорта Батько. Полученные результаты приведены в таблице.
Анализ полученных результатов показал, что:
В случае анализа листьев яблони, груши завышение результатов определения абсцизовой кислоты, выделенной по стандартной процедуре подготовки пробы, согласно прототипу, составило 20-30% (примеры 1-2) в сравнении с результатами предлагаемого способа.
Применение упрощенной процедуры подготовки пробы (примеры 1-4), дающей возможность ускорить анализ в несколько раз, оказалось неприемлемым для способа-прототипа, так как результат искажался в 1,5-3 раза, что связано с быстрым загрязнением разделяющей колонки и, соответственно, ухудшением качества разделения компонентов.
Применение заявляемого способа позволило получить воспроизводимый результат в случае упрощенной подготовки пробы для объектов примеров 1-4.
Для проверки надежности метода упрощенной подготовки пробы, реализованного в примере №1, использовали метод добавки свободной абсцизовой кислоты в пробу биологического материала и проводили экстракционную подготовку.
Установлено, что степень извлечения абсцизовой кислоты для анализируемого образца составила 102-104%.
Эти данные свидетельствуют о возможности корректного определения свободной абсцизовой кислоты согласно примера №1 (упрощенная пробоподготовка).
Предлагаемый способ практически лишен таких недостатков, как необходимость дополнительного разбавления проб для корректного анализа, влияние мешающих веществ биологической пробы - фенольных соединений, аминокислот, анионов, органических кислот, фитогормона в связанной форме, водный раствор ведущего электролита стабилен во времени и не загрязняет внутреннюю поверхность капилляра. При анализе сложных по составу биологических проб происходит быстрое загрязнение разделяющей колонки хроматографа, что снижает точность определения
При реализации способа получены количественные результаты определения массовой концентрации свободной абсцизовой кислоты, превосходящие по своему качеству прототип.
Способ определения содержания свободной абсцизовой кислоты в вегетативных органах растений на системе капиллярного электрофореза в кварцевом капилляре, эффективной длиной 0,5 м, внутренним диаметром 75 мкм, с использованием для анализа водного ведущего электролита, содержащего 0,33% масс. борной кислоты, 0,05% масс. тетрабората натрия и 0,5% об. изопропанола при положительной полярности напряжения и длине волны детектирования - 254 нм, отличающийся тем, что подготовка пробы для определения содержания свободной абсцизовой кислоты в вегетативных органах растений включает экстракцию свободной абсцизовой кислоты из биологического материала с использованием диэтилового эфира, упаривание эфирного экстракта до сухого остатка и разведением его в 60%-ном водном растворе ацетона.