Химерный улучшенный рекомбинантный фактор viii
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению нового рекомбинантного фактора свертывания крови, представляющего собой химерный белок с увеличенным временем полужизни в плазме, состоящий из фактора III человека и мутантного Fc-фрагмента IgG человека, что может быть использовано в медицине. Полученные химерные белки используют в составе фармацевтической композиции для терапии гемостатических нарушений, в том числе для лечения гемофилии А. Изобретение позволяет осуществлять эффективную терапию гемофилии А за счет повышенного времени полужизни полученного фактора свертывания в плазме. 6 н. и 9 з.п. ф-лы, 4 ил., 5 табл., 8 пр.
Реферат
Область применения
Настоящее изобретение относится в основном к области терапии гемостатических нарушений, а именно к новым рекомбинантным факторам свертывания крови, использующимся для лечения гемофилии А.
Уровень техники
Свертывание является сложным процессом образования кровью тромбов. Важной частью гемостаза является прекращение тока крови из поврежденного сосуда, при котором стенка поврежденного сосуда покрывается бляшками и содержащими фибрин тромбами для того, чтобы остановить кровотечение и начать восстановление поврежденного сосуда. Нарушения свертываемости крови могут привести к повышенному риску возникновения кровотечений (геморрагии) или образованию закупоривающих тромбов (тромбозу).
Свертывание начинается практически сразу после того, как при повреждении кровеносного сосуда была повреждена эндотелиальная выстилка сосуда. Воздействие на кровь таких белков, как тканевой фактор, инициирует изменения в тромбоцитах и плазменном белке фибриногене - факторе свертывания крови. Тромбоциты мгновенно образуют пробку в месте повреждения; это называется первичным гемостазом. Одновременно происходит вторичный гемостаз: белки, находящиеся в плазме крови, которые называются факторами коагуляции или факторами свертывания крови, откликаются сложным каскадом реакций, образуя фибриновые нити, которые укрепляют тромбоцитарную пробку. Неограничивающие факторы коагуляции включают, но не ограничиваются этим, фактор I (фибриноген), фактор II (протромбин), тканевый фактор, фактор V (проакцелерин, лабильный фактор), фактор VII (стабильный фактор, проконвертин), фактор VIII (антигемофильный глобулин А), фактор IX (антигемофильный глобулин В или кристмас-фактор), фактор X (фактор Стюарта-Прауэра), фактор XI (плазменный предшественник тромбопластина), фактор XII (фактор Хагемана), фактор XIII (фибринстабилизирующий фактор), ФВ, прекалликреин (фактор Флетчера), высокомолекулярный кининоген (ВМК) (фактор Фитцджеральда), фибронектин, антитромбин III, кофактор гепарина II, протеин С, протеин S, протеин Z, плазминоген, альфа 2-антиплазмин, тканевой активатор плазминогена (ТАЛ), урокиназа, ингибитор активатора плазминогена-1 (ИАП-1) ингибитор активатора плазминогена-2 (ИАП-2).
Гемофилия А является нарушением свертываемости крови, возникающим из-за дефектов в гене, кодирующем фактор коагуляции VIII(FVIII), и проявляющимся у 1-2 из 10,000 младенцев мужского пола. Grawetal., Nat. Rev. Genet. 6(6): 488-501 (2005). Данное заболевание характеризуется спонтанным кровоизлиянием и избыточным кровотечением после травмы. С течением времени повторяющееся кровоизлияние в мышцы и суставы, которое часто начинается в раннем детстве, приводит к гемофилической артропатии и необратимому повреждению суставов. Это повреждение прогрессирует и может привести к существенному ограничению подвижности суставов, мышечной атрофии и хронической боли (Rodriguez-Merchan, Е.С., Semin. Thromb. Hemost. 29:87-96 (2003), содержание которой специально целиком включено сюда в качестве ссылки).
По некоторым оценкам, сегодня количество больных гемофилией А в мире составляет 400 тыс. человек (один из 10 тысяч мужчин). По данным Всемирной организации здравоохранения, на территории России проживает около 15 тысяч больных гемофилией, из них дети составляют около 6 тысяч человек. При этом каждый год еще у 50 тыс. людей выявляют нарушения, связанные с дефицитом и выработкой фактора свертывания VIII в организме. Таким образом, в мире и в России в частности существует значимая потребность в доступном и эффективном лечении гемофилии А.
Пациентов, страдающих гемофилией А можно лечить путем вливаний очищенного или полученного с помощью рекомбинантных технологий FVIII. При этом все коммерчески доступные продукты, содержащие FVIII, как известно, имеют время полужизни, составляющее 8-12 часов, и требуют частых внутривенных введений пациентам, практически каждый день, что создает ощутимые неудобства, как для пациента, так и для клинических врачей. При этом нередко возникновение дозозависимых побочных эффектов и аллергических реакций. В связи с чем, разработка фактора свертывания VIII нового поколения, лишенного этих недостатков, позволит сделать лечение гемофилических заболеваний доступнее и эффективнее. Смотрите Weiner М.А. and Cairo, M.S., Pediatric Hematology Secrets, Lee, M.T., 12. Disorders of Coagulation, Elsevier Health Sciences, 2001; Lillicrap, D. Thromb. Res. 122 Suppl 4:S2-8 (2008). Ввиду чего было предпринято большое количество попыток с целью продлить время полужизни FVIII.
В настоящее время известные формы рекомбинантного фактора свертывания VIII, сшитого с константным доменом иммуноглобулина G, содержат нативную форму Fc-фрагмента (Powell et al., 2012), что позволяет продлить время циркуляции в крови по сравнению с немодицифированными формами фактора свертывания крови VIII в 1,7 раз.
Из уровня техники известен физиологически активный полипептид (RU 2352583), находящийся в конъюгации с Fc-фрагментом посредством полиэтиленгликоля. Данный полипептид может являться фактором свертывания крови, в частности фактором VIII. В результате такой конъюгации достигается увеличение продолжительности действия физиологически активного пептида in vivo, а также увеличение относительной активности конъюгатов с белками в сравнении с нативными белками. Константный домен может быть агликолизированным, иметь шарнирную область и может происходить от различных видов иммуноглобулина (IgG, IgA, IgD, IgE, IgM).
Известен конъюгат физиологически активного полипептида (RU 2356909), связанного с Fc-фрагментом посредством полиэтиленгликолевого линкера, при этом Fc-фрагмент может быть от иммуноглобулинов IgG, IgA, IgD, IgE, IgM, быть негликолизированным и содержать шарнирную область. Кроме того, раскрыт способ получения данного конъюгата. При этом биологические исследования показали, что конъюгаты согласно изобретению обладают более высокой внутриклеточной активностью (более чем на 28%) и более длительным временем полужизни в сыворотке (примерно в 2 раза) по сравнению с нативными белкам.
В патенте ЕА 12566 описаны химерные белки, содержащие биологически активную молекулу, которой может быть фактор свертывания крови, связанный через линкер с Fc-фрагментом иммунноглобулина в месте связывания с FcRn - рецептором. При этом описанные белки представляют собой гибриды ''мономер-димером''. Данная модификация фактора свертывания крови имеет активность примерно в 3 раза более высокую по сравнению с только димерными формами фактора свертывания, что, в свою очередь, позволяет снизить дозу вводимого препарата или частоту введения.
В заявке на патент ЕА 201290443 описываются химерные полипептиды, содержащие фактор VIII и Fc-фрагмент, при этом Fc-фрагмент содержит делецию В-домена. Заявленные полипептиды обладают улучшенной эффективностью: более продолжительным временем полужизни и активностью примерно в 2 раза по сравнению с немодифицированными рекомбинатными факторами свертывания VIII. Описанные полипептиды позволяют снизить частоту введения препарата фактора VIII до 1 раза в неделю, что представляет удобство для пациентов.
Техническим результатом данного изобретение является получение рекомбинантного фактора свертывания крови, обладающего повышенным временем полужизни и улучшенным сродством к FcRn.
Описание чертежей
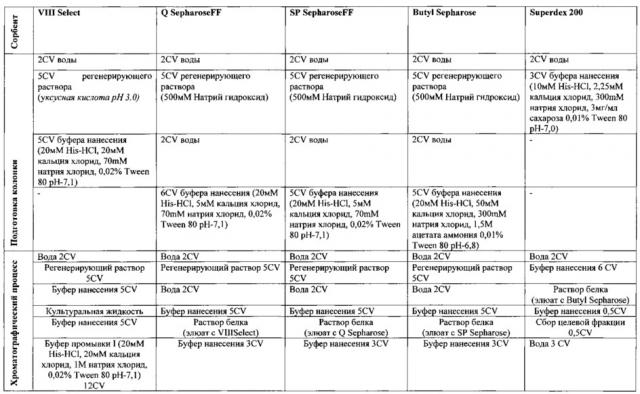
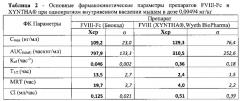
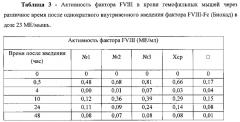
Фиг 1. Анализ HPLC рекомбинантного мономерно-димерного FVIII-Fc по сравнению с препаратом Xyntha.
Фиг 2. SDS-PAGE рекомбинантного мономерно-димерного FVIII-Fc.
Фиг 3. Усредненные кривые изменения концентрации FVIII во времени после однократного внутривенного введения мышам препаратов FVIII-Fc и FVIII (XYNTHA®) в дозе 0,00494 мг/кг.
Фиг. 4 - Активность фактора FVIII в сыворотке мышей после однократного внутривенного введения фактора FVIII-Fc (Биокад) в дозе 23 МЕ/мышь (черная кривая-животное №1; Красная кривая - животное №2; - Зеленая кривая - животное №3).
Определения
Термин ''полинуклеотид'' или ''нуклеотид'' включает в себя как одиночную нуклеиновую кислоту, так и множественные нуклеиновые кислоты, и относится к выделенной молекуле или конструкции нуклеиновой кислоты, например, информационной РНК (иРНК) или плазмидной ДНК (пДНК). В определенных вариантах реализации изобретения полинуклеотид содержит обычную фосфодиэфирную связь или альтернативную связь (например, амидную связь, которую можно обнаружить в пептидных нуклеиновых кислотах (ПНК)). Термин ''нуклеиновая кислота'' к какому-либо одному или более сегментам нуклеиновой кислоты, например, фрагментам ДНК или РНК, присутствующим в полинуклеотиде. Под ''выделенными'' нуклеиновой кислотой или полинуклеотидом подразумевается молекула нуклеиновой кислоты, ДНК или РНК, которая была удалена из своей естественной среды. Например, рекомбинантный полинуклеотид, кодирующий полипептид фактора VIII, содержащийся в векторе, считается выделенным в контексте настоящего изобретения. Дополнительные примеры выделенного полинуклеотида включают рекомбинантные полинуклеотиды, содержащиеся в гетерологичной клетке-хозяине или очищенные (частично или в значительной степени) от других полинуклеотидов в растворе. Выделенные молекулы РНК включают in vivo или in vitro РНК транскрипты полинуклеотидов, являющихся объектами настоящего изобретения. Выделенные полинуклеотиды или нуклеиновые кислоты согласно настоящему изобретению дополнительно включают такие молекулы, полученные синтетическим способом. Вдобавок полинуклеотид или нуклеиновая кислота может содержать регуляторные элементы, такие как промоторы, энхансеры, участки связывания рибосом или сигналы терминации транскрипции.
При употреблении в данном тексте ''кодирующая область'' или ''кодирующая последовательность'' представляют собой фрагмент полинуклеотида, который состоит из кодонов, которые могут транслироваться в аминокислоты. Хотя ''стоп-кодон'' (TAG, TGA или ТАЛ) обычно не транслируется в аминокислоту, он может считаться частью кодирующей области, но любые фланкирующие последовательности, например, промоторы, участки связывания рибосом, терминаторы транскрипции, нитроны и тому подобные элементы не являются частью кодирующей области. Границы кодирующей области обычно определяются стартовым кодоном на 5'-конце, кодирующем амино конец результирующего полипептида, и трансляционным стоп-кодоном на 3'-конце, кодирующем карбоксильный конец результирующего полипептида. Две или более кодирующих областей согласно настоящему изобретению могут присутствовать в одиночной полинуклеотидной конструкции, например, в одиночном векторе, или в отдельных полинуклеотидных конструкциях, например, в отдельных (различных) векторах. Следовательно, отсюда вытекает, что одиночный вектор может содержать только одиночную кодирующую область или содержать две или более кодирующих областей, например, одиночный вектор может отдельно кодировать связывающий домен-А и связывающий домен-В. Вдобавок вектор, полинуклеотид или нуклеиновая кислота, являющиеся объектами данного изобретения, могут кодировать гетерологичные кодирующие области, как сшитые, так и несшитые с нуклеиновой кислотой, кодирующей связывающий домен согласно изобретению. Гетерологичные кодирующие области без ограничений включают специализированные элементы или мотивы, такие как секреторный сигнальный пептид или гетерологичный функциональный домен.
Определенные белки, секретируемые клетками млекопитающих, связаны с секреторным сигнальным пептидом, который отщепляется от зрелого белка, как только инициируется экспорт растущей белковой цепи через шероховатый эндоплазматический ретикулум. Специалистам в данной области техники известно, что сигнальные пептиды в общем случае сшиты с N-концом полипептида для того, чтобы вырабатывать секретируемую или ''зрелую'' форму полипептида. В определенных вариантах реализации изобретения применяется нативный сигнальный пептид, например, сигнальный пептид тяжелой цепи или легкой цепи иммуноглобулина, либо функциональное производное такой последовательности, которое сохраняет способность управлять секрецией функционально связанного с ней полипептида. В альтернативном варианте может применяться гетерологичный сигнальный пептид млекопитающего, например, человеческий тканевой активатор плазминогена (ТАП) или мышиный сигнальный пептид Р-глюкуронидазы, либо его функциональное производное.
Термин ''нижележащая'' относится к нуклеотидной последовательности, которая расположена в направлении 3' от основной нуклеотидной последовательности. В определенных вариантах реализации изобретения нижележащие нуклеотидные последовательности относятся к последовательностям, которые следуют за точкой старта транскрипции. Например, ко дон инициации трансляции гена расположен ниже сайта старта транскрипции.
Термин ''вышележащая'' относится к нуклеотидной последовательности, которая расположена в направлении 5' от основной нуклеотидной последовательности. В определенных вариантах реализации изобретения Вышележащие нуклеотидные последовательности относятся к последовательностям, которые расположены на 5' стороне кодирующей области или точки старта транскрипции. Например, большинство промоторов располагаются выше сайта старта транскрипции.
При употреблении в данном тексте ''регуляторная область'' относится к нуклеотидным последовательностям, расположенным выше (в направлении 5' некодирующих последовательностей), в рамках или ниже (в направлении 3' некодирующих последовательностей) кодирующей области, и которые оказывают влияние на транскрипцию, процессинг РНК, стабильность или трансляцию связанной с ней кодирующей области. Регуляторные области могут включать промоторы, трансляционные лидерные последовательности, нитроны, последовательности распознавания полиаденилирования, участки процессинга РНК, участки связывания эффекторов и структуры типа ''стебель - петля''. Если кодирующая область предназначена для экспрессии в эукариотической клетке, сигнальная последовательность полиаденилирования и последовательность терминации транскрипции обычно расположены в направлении 3' относительно кодирующей последовательности.
Полинуклеотид, который кодирует генный продукт, например, полипептид, может включать промотор и/или другие транскрипционные или трансляционные контрольные элементы, функционально связанные с одной или более кодирующими областями. Находящаяся в функциональной связи кодирующая область для генного продукта, например, полипептида, связана с одной или более регуляторными областями таким образом, чтобы экспрессия генного продукта оказалась под влиянием или контролем регуляторной области (областей). Например, кодирующая область и промотор являются функционально связанными, если индукция действия промотора приводит к транскрипции иРНК, кодирующей генный продукт, кодируемый кодирующей областью, и если природа связи между промотором и кодирующей областью не препятствует возможности промотора управлять экспрессией генного продукта или не препятствует возможности транскрибирования ДНК-матрицы. Другие транскрипционные контрольные элементы, кроме промотора, например, энхансеры, операторы, репрессоры и сигналы терминации транскрипции, также могут быть функционально связанными с кодирующей областью для того, чтобы управлять экспрессией генного продукта.
Специалистам в данной области техники известно множество транскрипционных контрольных областей. Они включают без ограничения транскрипционные контрольные области, которые функционируют в клетках позвоночных, такие как промоторные и энхансерные сегменты цитомегаловирусов (предранний промотор в сочетании с интроном-А), вирус обезьян 40 (ранний промотор) и ретровирусы (такие как вирус саркомы Рауса). Другие транскрипционные контрольные области включают те, которые получены из генов позвоночных, такие как актин, белок теплового шока, бычий гормон роста и кроличий Р-глобин, а также другие последовательности, способные контролировать генную экспрессию в эукариотических клетках. Дополнительные подходящие транскрипционные контрольные области включают тканеспецифические промоторы и энхансеры, а также лимфокин-индуцибельные промоторы (например, индуцибельные интерферонами или интерлейкинами промоторы).
Аналогично, специалистам в данной области техники известно множество трансляционных контрольных элементов. Они включают без ограничения участки связывания рибосом, кодоны инициации и терминации трансляции и элементы, полученные из пикорнавирусов (в частности, участок внутренней посадки рибосомы или УВПР, также называемый CITE-последовательностью).
Употребляемый в данном тексте термин ''экспрессия'' относится к процессу, посредством которого полинуклеотид продуцирует генный продукт, например, РНК или полипептид. Он включает без ограничения транскрипцию полинуклеотида в информационную РНК (иРНК), транспортную РНК (тРНК), малую шпилечную РНК (мшРНК), малую интерферирующую РНК (миРНК) или любой другой РНК-продукт, и трансляцию иРНК в полипептид. При помощи экспрессии получают ''генный продукт''. При употреблении в данном тексте генный продукт может представлять нуклеиновую кислоту, например, информационную РНК, полученную посредством транскрипции гена, или полипептид, который был транслирован с транскрипта. Описанные в данном тексте генные продукты дополнительно включают нуклеиновые кислоты, прошедшие посттранскрипционные модификации, например, полиаденилирование или сплайсинг, или полипептиды, прошедшие пост-транскрипционные модификации, например, метилирование, гликозилирование, добавление липидов, объединение с другими белковыми субъединицами или протеолитическое расщепление.
''Вектор'' относится к любому средству для клонирования и/или переноса нуклеиновой кислоты в клетку-хозяина. Вектор может являться репликоном, к которому может быть присоединен сегмент другой нуклеиновой кислоты таким образом, чтобы привести к репликации присоединенного сегмента. ''Репликон'' относится к любому генетическому элементу (например, плазмиде, фагу, космиде, хромосоме, вирусу), который функционирует как автономная единица репликации in vivo, т.е., способен к самостоятельно управляемой репликации. Термин ''вектор'' включает как вирусной, так и невирусной природы средства для внесения нуклеиновой кислоты в клетку in vitro, ex vivo или in vivo. В данной области техники известно и применяется большое количество векторов, включая, например, плазмиды, модифицированные эукариотические вирусы или модифицированные бактериальные вирусы. Вставку полинуклеотида в подходящий вектор можно осуществить путем лигирования соответствующих фрагментов полинуклеотида в выбранный вектор, который имеет комплементарные липкие концы.
Векторы могут быть сконструированы таким образом, чтобы кодировать селектируемые маркеры или репортеры, которые обеспечивают отбор или идентификацию клеток, в которые был инкорпорирован вектор. Экспрессия селектируемых маркеров или репортеров позволяет осуществлять идентификацию и/или отбор клеток-хозяев, которые инкорпорируют и экспрессируют другие кодирующие области, содержащиеся в векторе. Примеры известных и применяемых в данной области техники генов селектируемых маркеров включают: гены, обеспечивающие устойчивость к ампициллину, стрептомицину, гентамицину, канамицину, гигромицину, гербициду биалафос, сульфонамиду и тому подобным веществам; и гены, которые применяются в качестве фенотипических маркеров, т.е., регуляторные гены антоцианов, ген изопентенил трансферазы и тому подобные. Примеры известных и применяемых в данной области техники репортеров включают: люциферазу, зеленый флуоресцентный белок, хлорамфеникол-ацетилтрансферазу и тому подобные вещества. Селектируемые маркеры также могут считаться репортерами.
Термин ''плазмида'' относится к внехромосомному элементу, часто несущему ген, который не является частью центрального метаболизма клетки, и обычно находящемуся в форме кольцевых двухцепочечных молекул ДНК. Такие элементы могут являться автономно реплицирующимися последовательностями, интергирующимися в геном последовательностями, фагом или нуклеотидными последовательностями, линейными, кольцевыми или сверхспиральными одно- или двухцепочечных ДНК или РНК, полученными из произвольного источника, в которых определенное число нуклеотидных последовательностей было соединено или рекомбинировано в уникальную конструкцию, которая способна внести в клетку фрагмент промотора и последовательность ДНК для выбранного генного продукта вместе с соответствующей 3' нетранслируемой последовательностью.
Эукариотические вирусные векторы, которые могут применяться, включают, но не ограничиваются этим, аденовирусные векторы, ретровирусные векторы, адено-ассоциированные вирусные векторы, поксвирус, например, векторы на основе вируса осповакцины, векторы на основе бакуловирусов или векторы на основе вируса герпеса. Невирусные векторы включают плазмиды, липосомы, электрически заряженные липиды (цитофектины), ДНК-белковый комплексы и биополимеры.
''Клонирующий вектор'' относится к ''репликону'', который является единицей длины нуклеиновой кислоты, которая последовательно реплицируется и которая содержит точку начала репликации, такую как плазмида, фаг или космида, к которой может быть присоединен сегмент другой нуклеиновой кислоты таким образом, чтобы привести к репликации присоединенного сегмента. Определенные клонирующие векторы способны к репликации в одном типе клеток, например, в бактериальных клетках, и экспрессии в другом, например, в эукариотических клетках. Клонирующие векторы обычно содержат одну или более последовательностей, которые могут применяться для отбора клеток, содержащих вектор, и/или один или более множественных клонирующих участков для вставки представляющих интерес нуклеотидных последовательностей.
Термин ''экспрессионный вектор'' относится к элементу, сконструированному для того, чтобы сделать возможной экспрессию вставленной нуклеотидной последовательности после внесение в клетку-хозяина. Вставленная нуклеотидная последовательность размещается в функциональной связи с регуляторными областями, как описано выше.
Векторы вносят в клетки-хозяев способами, хорошо известными в данной области техники, например, путем трансфекции, электропорации, микроинъекции, трансдукции, клеточного слияния, при помощи диэтиламиноэтилдекстрана, осаждения фосфата кальция, липофекции (слияния лизосом), применения генной пушки или транспортера ДНК-вектора.
При употреблении в данном тексте ''культивировать'', ''культивирование'' и ''культивация'' обозначают инкубацию клеток в таких in vitro условиях, которые способствуют росту клеток или делению, или поддержанию клеток в живом состоянии. При употреблении в данном тексте ''культивированные клетки'' обозначают клетки, которые были размножены in vitro.
При употреблении в данном тексте термин ''полипептид'' включает в себя как одиночный ''полипептид'', так и множественные ''полипептиды'', и относится к молекуле, состоящей из мономеров (аминокислот), линейно связанных амидными связями (также известными как пептидные связи). Термин ''полипептид'' относится к любой цепи или цепям двух или более аминокислот и не относится к специфичной длине продукта. Таким образом, пептиды, дипептиды, трипептиды, олигопептиды, ''белок'', ''аминокислотная цепь'' либо любой другой термин, применяемый для обозначения цепи или цепей двух или более аминокислот, включены в определение ''полипептида'', а термин ''полипептид'' может применяться вместо либо взаимозаменяемо с любым из этих терминов. Термин ''полипептид'' также относится к продуктам пост-экспрессионной модификации полипептида, включая без ограничений гликозилирование, ацетилирование, фосфорилирование, амидирование, дериватизацию известными защитными/блокирующими группами, протеолитическое расщепление или модификацию аминокислотами неприродного происхождения. Полипептид может быть получен из природного биологического ресурса или при помощи рекомбинатной технологии, но не обязательно являться транслированным из определенной нуклеотидной последовательности. Он может быть получен любым способом, включая химический синтез.
''Выделенный'' полипептид или его фрагмент, вариант или производное обозначает полипептид, который не находится в своем естественном окружении. Никакой конкретный уровень очистки не требуется. Например, выделенный полипептид может быть просто удален из своего природного или естественного окружения. Полученные при помощи рекомбинантных технологий полипептиды и белки, экспрессируемые в клетках-хозяевах, считаются выделенными в контексте данного изобретения, как и нативные или рекомбинантные полипептиды, которые были отделены, фракционированы либо частично или в значительной степени очищены любым подходящим способом.
Также в настоящее изобретение включены фрагменты или варианты полипептидов и любые их комбинации. Термин ''фрагмент'' или ''вариант'' в отношении связывающих доменов полипептидов или связывающих молекул, являющихся объектами настоящего изобретения, включают любые полипептиды, которые сохраняют по меньшей мере некоторые свойства (например, аффинность связывания с FcRn в случае FcRn-связывающего домена или Fc-варианта, активность коагуляции в случае ФУШ-варианта) основного полипептида. Фрагменты полипептидов включают протеолитические фрагменты, а также делеционные фрагменты дополнительно к специфическим фрагментам антител, обсуждаемым в другом месте данного текста, но не включают полноразмерный полипептид природного происхождения (или зрелый полипептид). Варианты связывающих доменов полипептидов или связывающих молекул, являющихся объектами настоящего изобретения, включают фрагменты, как описано выше, а также полипептиды с аминокислотными последовательностями, измененными вследствие аминокислотных замен, делеций или инсерций. Варианты могут быть природного и неприродного происхождения. Варианты неприродного происхождения могут быть получены путем известных в данной области техники методов мутагенеза. Вариантные полипептиды могут содержать консервативные или неконсервативные аминокислотные замены, делеций или добавки.
Употребляемый в данном тексте термин ''фактор, ограничивающий время полужизни'' или ''фактор, ограничивающий время полужизни FVIII'' определяет фактор, который предупреждает продление времени полужизни белка FVIII более чем в 1,5 раз или 2 раза по сравнению с FVIII дикого типа (например, ADVATE® или REFACTO®).
Как известно в данной области техники ''идентичность последовательностей'' между двумя полипептидами определяется путем сравнения аминокислотной последовательности одного полипептида с последовательностью второго полипептида. При обсуждении в данном тексте определение того, является ли любой конкретный полипептид идентичным по меньшей мере на около 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 99% или 100% другому полипептиду, осуществляется при помощи известных в данной области техники методов и компьютерных программ/программного обеспечения, включающих, но не ограничивающихся этим, программу BESTFIT (WisconsinSequenceAnalysisPackage, Версия 8 для Unix, GeneticsComputerGroup, UniversityResearchPark, 575 ScienceDrive, Madison, WI 53711). BESTFIT использует алгоритм локальной гомологии Смита и Уотермана, AdvancesinAppliedMathematics 2: 482-489 (1981), для того, чтобы найти сегмент наибольшей гомологии между двумя последовательностями. При применении BESTFIT или любой другой программы для выравнивания последовательностей для определения того, является ли конкретная последовательность, например, на 95% идентичной основной последовательности согласно настоящему изобретению, параметры устанавливают, конечно, таким образом, что процент идентичности рассчитывается относительно полной длины основной полипептидной последовательности и допускаются расхождения в гомологии до 5% относительно общего числа аминокислот в основной последовательности.
Употребляемый в данном тексте термин ''время полужизни'' относится к биологическому времени полужизни конкретного полипептида in vivo. Время полужизни может обозначать время, необходимое для того, чтобы половина количества введенного испытуемому объекту препарата была выведена из кровообращения и/или других тканей животного. При построении кривой выведения данного полипептида как функции времени кривая обычно является двухфазной с быстрой а-фазой и более длинной Р-фазой. а-фаза обычно отображает равновесное распределение введенного Fc полипептида между внутрисосудистым и внесосудистым пространством и частично определяется размером полипептида. Р-фаза обычно отображает катаболизм полипептида во внутрисосудистом пространстве. В некоторых вариантах реализации изобретения ФУШ и содержащие ФУШхимерные белки являются монофазными и, таким образом, не имеют альфа-фазы, а только бета-фазу. Следовательно, в определенных вариантах реализации изобретения употребляемый в данном тексте термин время полужизни относится ко времени полужизни полипептида в Р-фазе. Обычное время полужизни Р-фазы человеческого антитела у человека составляет 21 день.
Употребляемый в данном тексте термин ''связанный'' относится к первой аминокислотной последовательности или нуклеотидной последовательности, ковалентно или нековалентно соединенной со второй аминокислотной последовательностью или нуклеотидной последовательностью соответственно. Термин ''ковалентно связанный'' или ''ковалентная связь'' относится к ковалентной связи, например, дисульфидной связи, пептидной связи или одной или более аминокислотам, например, линкеру, между двумя связанными между собой компонентами. Первая аминокислотная или нуклеотидная последовательность может быть прямым образом связана или соединена со второй аминокислотной или нуклеотидной последовательностью, или в другом варианте промежуточная последовательность может ковалентно связывать первую последовательность со второй последовательностью. Термин ''связанный'' обозначает не только сшивание первой аминокислотной последовательности со второй аминокислотной последовательностью в области С-конца или N-конца, но также включает вставку полной первой аминокислотной последовательности (или второй аминокислотной последовательности) между любыми двумя аминокислотами второй аминокислотной последовательности (или первой аминокислотной последовательности соответственно). В одном варианте реализации изобретения первая аминокислотная последовательность может быть соединена со второй аминокислотной последовательностью посредством пептидной связи или линкера. Первая аминокислотная последовательность может быть соединена со второй аминокислотной последовательностью посредством фосфодиэфирной связи или линкера. Линкер может представлять собой пептид или полипептид (для полипептидных цепей) или нуклеотид или нуклеотидную цепь (для нуклеотидных цепей) либо любое химическое соединение (как для полипептидных, так и для полинуклеотидных цепей). Ковалентную связь иногда обозначают как (-) или дефис.
Употребляемый в данном тексте термин ''связанный с'' относится к ковалентной или нековалентной связи, образованной между первой аминокислотной цепью и второй аминокислотной цепью. В одном варианте реализации изобретения термин ''связанный с'' обозначает ковалентную, непептидную связь или нековалентную связь. В некоторых вариантах реализации изобретения такую связь обозначают двоеточием, т.е., (:). В другом варианте реализации изобретения он обозначает ковалентную связь за исключением пептидной связи. В других вариантах реализации изобретения употребляемый в данном тексте термин ''ковалентно связанный'' обозначает связь между двумя компонентами посредством ковалентной связи, например, дисульфидной связи, пептидной связи или одной или более аминокислот (например, линкера). Например, аминокислота цистеин содержит тиольную группу, которая может образовывать дисульфидную связь или мостик с тиольной группой второго остатка цистеина. В большинстве молекул IgG природного происхождения области СН1 и CL связаны дисульфидной связью, а две тяжелые цепи связаны двумя дисульфидными связями в позициях, соответствующих 239 и 242 согласно системе нумерации Кабата (позиции 226 и 229 в Европейской системе нумерации). Примеры ковалентных связей включают, но не ограничиваются этим, пептидную связь, металлическую связь, водородную связь, дисульфидную связь, сигма-связь, пи-связь, дельта-связь, гликозидную связь, агностическую связь, изогнутую связь, диполярную связь, пи-обратную связь, двойную связь, тройную связь, четвертную связь, пятерную связь, шестерную связь, конъюгацию, гиперконъюгацию, ароматичность, гаптичность или антисвязывание. Неограничивающие примеры нековалентной связи включают ионную связь (например, катионную пи-связь или соляную связь), металлическую связь, водородную связь (например, диводородную связь, диводородный комплекс, низкобарьерную водородную связь или симметричную водородную связь), Ван-дер-Ваальсовы силы, лондоновские дисперсионные силы, механическую связь, галогенную связь, аурофильность, интеркаляцию, стэкинг, энтропийные силы или химическую полярность.
Употребляемый в данном тексте термин ''мономерно-димерный гибрид'' относится к химерному белку, содержащему первую полипептидную цепь и вторую полипептидную цепь, которые связаны друг с другом дисульфидной связью, при этом первая цепь содержит фактор свертывания крови, например, фактор VIII, и Fc-область, а вторая цепь содержит, состоит преимущественно из или состоит из Fc-области без фактора свертывания крови. Мономерно-димерная гибридная конструкция, таким образом, является гибридом, содержащим мономерную часть, содержащую только один фактор свертывания крови, и димерную часть, содержащую две Fc-области.
При употреблении в данном тексте гемостатическое нарушение означает генетически унаследованное или приобретенное заболевание, которое характеризуется склонностью к кровоизлияниям, как к спонтанным, так и в результате травмы, из-за нарушения способности или неспособности образовывать фибриновые сгустки. Примеры таких нарушений включают разные виды гемофилии. Тремя основными формами являются гемофилия А (дефицит фактора VIII), гемофилия В (дефицит фактора IX или ''болезнь Кристмаса'') и гемофилия С (дефицит фактора XI, склонность к умеренным кровотечениям). Другие гемостатические нарушения включают, например, болезнь Виллебранда, дефицит фактора XI (дефицит ПТП), дефицит фактора XII, дефицит или структурные аномалии фибриногена, протромбина, фактора V, фактора VII, фактора X или фактора XIII, синдром Бернара-Сулье, который является дефектом или дефицитом GPIb. GPIb - рецептор для ФВ - может быть дефективным и приводить к недостатку первичного тромбообразования (первичного гемостаза) и повышенной склонности к кровотечениям, и тромбастении Гланцманна и Негели (тромбастении Гланцманна). При печеночной недостаточности (острой и хронической формах) наблюдается недостаточная выработка факторов свертывания крови печенью, что может привести к повышенному риску кровотечений.
Химерные молекулы, являющиеся объектом данного изобретения, можно применять в профилактических целях. Употребляемый в данном тексте термин ''профилактическое лечение'' относится к применению данной молекулы до случая кровотечения. В одном варианте реализации изобретения пациенту, нуждающемуся в общем гемостатическом средстве, проводят или собираются проводить хирургическую операцию. Химерный белок, являющийся объектом данного изобретения, можно применять до или после хирургической операции в качестве профилактики. Химерный белок, являющийся объектом данного изобретения, можно применять во время или после хирургической операции для контролирования острых случаев кровотечения. Хирургическая операция может включать, но не ограничивается этим, трансплантацию печение, резекцию печени, стоматологические процедуры или трансплантацию стволовых клеток.
Химерный белок, являющийся объектом данного изобретения, также применяется для лечения по требованию (также называемому ''эпизодическим''). Термин ''лечение по требованию'' или ''эпизодическое лечение'' относится к применению химерной молекулы в ответ на проявление симптомов случая кровотечения или перед де