Основанное на иммуноферментном анализе определение кинетики связывания в растворе
Иллюстрации
Показать всеИзобретение касается способа определения аффинности связывания лекарственного средства с его мишенью, включающий следующие стадии: определение доли свободного лекарственного средства или свободной мишени в образце, содержащем лекарственное средство, мишень и нековалентные комплексы лекарственное средство-мишень в интервале концентраций лекарственного средства при постоянной концентрации мишени, где доля свободного лекарственного средства остается постоянной, посредством определения на основе результата иммуноанализа доли свободного лекарственного средства в образце, содержащем лекарственное средство, мишень и комплексы лекарственное средство-мишень, по меньшей мере для двух разных отношений лекарственное средство : мишень в образце и, если определенная доля свободного лекарственного средства не сравнима для всех использованных отношений лекарственное средство : мишень, тогда отношение лекарственное средство : мишень в образце уменьшают, и образец подвергают повторному анализу посредством такого же иммуноанализа, или определения на основе результата иммуноанализа доли свободной мишени в образце, содержащем лекарственное средство, мишень и комплексы лекарственное средство-мишень, по меньшей мере для двух разных отношений лекарственное средство : мишень в образце, и, если определенная доля свободной мишени не сравнима для всех использованных отношений лекарственное средство : мишень, тогда отношение лекарственное средство : мишень в образце увеличивают и образец подвергают повторному анализу посредством такого же иммуноанализа, и проведение расчета на основе доли свободного лекарственного средства или проведение расчета на основе доли свободной мишени, определенных на предыдущей стадии, аффинности связывания лекарственного средства с его мишенью, где «сравнимый» означает относительное различие (% Разл.) двух определенных значений менее чем 100%, а «несравнимый» означает относительное различие (% Разл.) двух определенных значений больше чем 100%, где % Разл., рассчитанное согласно следующей формулы % Разл. = [(наибольшее значение) - (наименьшее значение)] / (среднее арифметическое значений), где для расчета значения аффинности связывания (KD) применяют следующее уравнение: KD = (доля свободного лекарственного средства) * (концентрация мишени [нМ] / (1 - доля свободного лекарственного средства). Технический результата изобретения заключается в том, что определение аффинности связывающего агента и его лиганда в образцах можно осуществлять с использованием очень ограниченного (малого) числа измерений (образцов), что снижает трудоемкость способа и повышает его точность. 11 з.п. ф-лы, 6 пр., 11 ил.
Реферат
Здесь описано основанное на иммуноферментном анализе определение кинетики связывания в растворе в образцах буфера или сыворотки/плазмы.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Фармакологический эффект лекарственного средства, действующего системно, является функцией не только собственной активности лекарственного средства, но также и его поглощения, распределения, метаболизма и выведения в человеческом организме. Данные характеристики объединены под термином «фармакокинетика». Фармакокинетикой обычно называют исследование развития во времени (т.е. кинетики), ассоциированного с динамическими процессами поглощения, распределения, метаболизма и выведения лекарственного средства и/или его метаболитов в живом организме, и она тесно взаимосвязана с областями биофармацевтики, фармакологии и терапевтических средств.
Поскольку организм задерживает транспорт молекул лекарственных средств через мембраны, разбавляет их в разных компартментах, в которых они распределяются, превращает их в метаболиты и, в конечном счете, выводит их, часто сложно предсказывать фармакологический эффект лекарственного средства in vivo. Однако исследователи обычно используют фармакокинетические исследования в качестве одного способа предсказания эффективности лекарственного средства в месте действия в организме.
Традиционно исследователи, участвующие в доклинических исследованиях поглощения, распределения, метаболизма и выведения, используют фармакокинетические/математические модели в сочетании с данными по реальной концентрации лекарственного средства в крови (или сыворотке, или плазме) и/или моче, а также данными по концентрации в разных тканях для характеризации свойств и пути лекарственного средства в живых организмах.
Имея под рукой фармакокинетическую информацию, можно увидеть (1) плохо ли поглощалось лекарственное средство с тем, чтобы давать субтерапевтические уровни в системе кровообращения, или (2) подвергалось ли лекарственное средство пресистемному метаболизму до неактивного метаболита. Такая информация также может давать руководство для последующих решений, таких как (1) следует ли улучшать поглощение лекарственного средства путем изменения солевой формы или композиции, (2) следует ли исследовать возможность получения пролекарств или (3) следует ли рассматривать другой путь введения.
Помимо вышеуказанного, фармакокинетические/математические модели также обычно считаются полезными, среди прочего, для следующего: (1) предсказание уровней лекарственного средства в плазме, ткани и моче при использовании любой схемы дозировки; (2) расчет оптимальной схемы дозировки для индивидуального пациента; (3) оценка возможного накопления лекарственных средств и/или метаболитов; (4) коррелирование концентраций лекарственного средства с фармакологической и токсикологической активностью (т.е. фармакодинамика); (5) оценка различий между композициями в коэффициенте или степени доступности (т.е. биоэквивалентность); (6) описание того, как изменения физиологии или заболевание влияют на поглощение, распределение и/или устранение лекарственного средства и (7) объяснение взаимодействий лекарственное средство-лекарственное средство или пища-лекарственное средство.
Фармакокинетические данные по поглощению, распределению, метаболизму и выведению также стали интегральной частью процесса фармакологической характеризации многообещающих новых потенциальных лекарственных средств.
Таким образом, существенной частью процесса разработки лекарственного средства является характеризация фармакокинетики (РК) и токсикокинетики (ТК) лекарственного средства и установление понимания связи между фармакокинетическими и фармакодинамическими (PD) эффектами (PK/PD). Предпосылкой оценки РК/ТК является доступность надежных биоаналитических методов. В отличие от низкомолекулярных лекарственных средств, которые обычно количественно измеряют с использованием методов на основе жидкостной хроматографии-масс-спектрометрии (ЖХ-МС), золотым стандартом биоаналитической методики для терапевтических белков является анализ связывания с лигандом (LBA). Помимо высокой чувствительности и высокой производительности, главным преимуществом LBA является возможность анализировать либо общие концентрации лекарственного средства, либо конкретно только молекул лекарственного средства, компетентных к связыванию с лигандом («свободное лекарственное средство»).
Ясное понимание возможностей и ограничений биоаналитического анализа, используемого для количественного измерения лекарственного средства, является важным для обеспечения правдоподобной интерпретации данных. Предпосылкой для определения концентрации свободного лекарственного средства является применение LBA, который делает возможным анализ молекул лекарственного средства, компетнтных к связыванию с лигандом, в сложном матриксе, например, посредством применения анализов захвата мишени. Однако один лишь выбор подходящего формата анализа не обязательно является достаточным для точного определения концентрации свободного лекарственного средства. Лекарственное средство и мишень взаимодействуют обратимым, нековалентным способом, управляемым законом действующих масс. Кроме того, LBA равным образом основаны на обратимом нековалентном взаимодействии между лекарственным средством/аналитом и реактивами для анализа. Следовательно, результаты анализа легко искажаются любым вмешательством в равновесие между партнерами по связыванию. Такие мешающие воздействия для анализа рассматривались в современной литературе, но еще не обсуждались подробно (см., например, Lee, J.W., et al., AAPS.J. 13 (2011) 99-110, Kuang, В., et al., Bioanal. 2 (2010) 1125-1140).
Стандартной методикой для биоанализа терапевтических белков являются анализы связывания с лигадом (LBA). Главным преимуществом LBA является возможность различать между общей концентрацией лекарственного средства и концентрацией лекарственного средства, компетентного к связыванию мишени. Однако один лишь выбор подходящего формата анализа не обязательно является достаточным для точного определения концентрации свободного лекарственного средства. Лекарственное средство, мишень и реактивы для анализа взаимодействуют обратимым, нековалентным способом, управляемым законом действующих масс. Следовательно, результаты анализа легко искажаются любым вмешательством в равновесие между партнерами по связыванию. Ясное понимание возможностей и ограничений анализа, однако, является существенным для обеспечения правдоподобной интерпретации данных (см., например, Staack, G., et al., Bioanalysis 4 (2012) 381-395).
В WO 2008/005674 описаны способы проведения анализа взаимодействий, приводящих к связыванию. Способы получения и применения комплекса кумасси бриллиантовый синий/белок описаны в US 6057160. Azimzahdeh, А. и Van Regenmortel, M.H.V. приводят измерение аффинности вирусных моноклональных антител посредством титрования ELISA (твердофазный иммуноферментный анализ) свободного антитела в равновесных смесях (J. Immunol. Meth. 141 (1991) 199-208). Lee, J.W., et al. (AAPS J. 13 (2011) 99-110) приводят биоаналитические подходы для количественного измерения «общих» и «свободных» терапевтических антител и их мишеней. Математическое моделирование разработки биоаналитического анализа приведено Staack, R.F., et al. (Bioanalysis 4 (2012) 381-395). В WO 2011/094445 описаны полипептидные агенты, полученные посредством генной инженерии, для направленной нейтрализации широкого спектра вирусов гриппа.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Существует потребность в определении свободного лекарственного средства/связывающего агента в образце, содержащем смесь свободного лекарственного средства/связывающего агента, комплексов мишень-лекарственное средство/лиганд-лекарственное средство и свободной мишени/лиганда.
Обнаружили, что определение аффинности и кинетики связывания (KD, константы скорости ассоциации и диссоциации) связывающего агента и его лиганда в образцах буфера или сыворотки/плазмы может осуществляться с использованием очень ограниченного/малого числа измерений/образцов, т.е. одного или двух (и обеспечивая подходящую калибровку). Данный способ основан на открытии того, что определение свободного связывающего агента или свободного лиганда возможно, если определение осуществляется в пределах линейного интервала/постоянного плато кривой (при низкой концентрации связывающего агента/высокой концентрации лиганда нет изменений доли свободного связывающего агента, или, подобным образом, при высокой концентрации связывающего агента/низкой концентрации лиганда нет изменений доли свободного лиганда).
Обнаружили, что определение единичного (одного) значения (т.е., например, одного значения для количества свободного связывающего агента) является достаточным для определения аффинности. При определении дополнительного второго значения, что является опцией, данный способ также включает внутренний контроль качества определенного результата. Таким образом, при использовании описанного здесь способа, не требуется получать и анализировать сложный график точек данных. Даже не является необходимым получение кривой наилучшего соответствия для определенных точек данных.
Определение кинетики связывания возможно с определением одного значения, если известна аффинность.
Обнаружили, что измерение следует проводить с использованием образцов с избытком одного партнера (избытком связывающего агента по сравнению с лигандом (высокое отношение связывающий агент:лиганд) или с избытком лиганда по сравнению со связывающим агентом (высокое отношение лиганд:связывающий агент)).
В одном воплощении избыток одного партнера составляет по меньшей мере 10 раз. В одном воплощении избыток одного партнера составляет по меньшей мере 40 раз. В одном воплощении избыток одного партнера составляет по меньшей мере 100 раз.
Обнаружили, что описанный здесь способ можно использовать с образцом, содержащим сыворотку или плазму.
В описанном здесь способе концентрация лиганда или связывающего агента поддерживается на постоянном уровне, тогда как концентрация соответствующего другого партнера (т.е. связывающего агента или лиганда) изменяется.
В одном воплощении описанного здесь способа концентрация связывающего агента поддерживается на постоянном уровне, тогда как концентрация лиганда изменяется.
Обнаружили, что при низком отношении связывающий агент:лиганд (т.е. меньше 1) можно наблюдать плато свободного связывающего агента, которое является специфичным по отношению к концентрации лиганда и KD, таким образом, при низких отношениях связывающий агент:лиганд получается постоянное значение для доли свободного связывающего агента. Подобным образом, при высоком отношении связывающий агент:лиганд (т.е. больше 1) можно наблюдать плато свободного лиганда, которое является специфичным по отношению к концентрации связывающего агента и KD, таким образом, при высоких отношениях связывающий агент:лиганд получается постоянное значение для доли свободного лиганда.
Одним аспектом, как здесь описано, является способ определения аффинности связывания (значения KD) связывающего агента с его лигандом, включающий следующие стадии:
- определение доли свободного (т.е. не образующего комплекс) связывающего агента, который специфично связывается с лигандом, в образце, содержащем связывающий агент, лиганд и нековалентные комплексы связывающий агент-лиганд, на плато свободного связывающего агента и
- проведение расчета на основе доли свободного (не образующего комплекс) связывающего агента, определенной на предыдущей стадии, аффинности связывания (значение KD) связывающего агента с его лигандом.
Одним аспектом, как здесь описано, является способ определения аффинности связывания (значения KD) связывающего агента с его лигандом, включающий следующие стадии:
- определение доли свободного (т.е. не образующего комплекс) лиганда, который специфично связывается со связывающим агентом, в образце, содержащем связывающий агент, лиганд и нековалентные комплексы связывающий агент-лиганд, на плато свободного лиганда и
- проведение расчета на основе доли свободного (не образующего комплекс) лиганда, определенной на предыдущей стадии, аффинности связывания (значение KD) лиганда с его связывающим агентом.
Одним аспектом, как здесь описано, является способ определения аффинности связывания (значения KD) связывающего агента с его лигандом, включающий следующие стадии:
- определение доли комплексов связывающий агент-лиганд в образце, содержащем связывающий агент, лиганд и нековалентные комплексы связывающий агент-лиганд, на плато свободного связывающего агента или на плато свободного лиганда,
- проведение расчета доли свободного (не образующего комплекс) связывающего агента или лиганда на основе определенных комплексов связывающий агент-лиганд и
- проведение расчета на основе доли свободного (не образующего комплекс) связывающего агента или лиганда, рассчитанной на предыдущей стадии, аффинности связывания (значение KD) лиганда с его связывающим агентом.
Одним аспектом, как здесь описано, является способ определения аффинности связывания (значения KD) связывающего агента с его лигандом, включающий следующие стадии:
- определение доли свободного (т.е. не образующего комплекс) связывающего агента, который специфично связывается с лигандом, в образце, содержащем связывающий агент, лиганд и нековалентные комплексы связывающий агент-лиганд по меньшей мере для двух разных отношений связывающий агент:лиганд в образце и, если определенная доля свободного (не образующего комплекс) связывающего агента не сравнима для всех использованных отношений связывающий агент:лиганд, тогда отношение связывающий агент:лиганд в образце уменьшают (т.е. количество связывающего агента уменьшают при постоянном количестве лиганда), и образец подвергают повторному анализу,
или
определение доли свободного (т.е. не образующего комплекс) лиганда в образце, содержащем связывающий агент, который специфично связывается с лигандом, лиганд и нековалентные комплексы связывающий агент-лиганд по меньшей мере для двух разных отношений связывающий агент:лиганд в образце и, если определенная доля свободного (не образующего комплекс) лиганда не сравнима для всех использованных отношений связывающий агент:лиганд, тогда отношение связывающий агент:лиганд в образце увеличивают (т.е. количество лиганда уменьшают при постоянном количестве связывающего агента), и образец подвергают повторному анализу и
- проведение расчета на основе доли свободного (не образующего комплекс) связывающего агента или проведение расчета на основе доли свободного (не образующего комплекс) лиганда, определенных на предыдущей стадии, аффинности связывания (значения KD) связывающего агента с его лигандом.
В одном воплощении данным способом не является анализ по Скэтчарду.
В одном воплощении данный способ не требует линеаризации точек данных.
В одном воплощении данный способ не требует расчета значений ЕС50 (полумаксимальная эффективная концентрация) или IC50 (полумаксимальная ингибирующая концентрация).
В одном воплощении используют два или три разных отношения связывающий агент:лиганд.
Одним аспектом, как здесь описано, является способ определения аффинности связывания (значения KD) связывающего агента с его лигандом, включающий следующие стадии:
- определение доли свободного (не образующего комплекс) связывающего агента в образце, содержащем связывающий агент, лиганд и комплексы связывающий агент-лиганд, для первого отношения связывающий агент:лиганд в образце,
при этом отношение связывающий агент:лиганд равно или меньше, чем отношение связывающий агент:лиганд, для которого определенная доля свободного (не образующего комплекс) связывающего агента сравнима по меньшей мере для двух разных отношений связывающий агент:лиганд,
- определение доли свободного (не образующего комплекс) связывающего агента в образце, содержащем связывающий агент, лиганд и комплексы связывающий агент-лиганд, для по меньшей мере второго отношения связывающий агент:лиганд в образце,
при этом второе отношение связывающий агентлиганд отличается от первого отношения связывающий агент:лиганд путем увеличения или уменьшения количества лиганда в образце и путем сохранения количества связывающего агента в образце,
при этом доля свободного (не образующего комплекс) связывающего агента сравнима для отношения связывающий агент:лиганд с повышенным или пониженным количеством лиганда в образце для повышенного или пониженного количества связывающего агента в образце,
- проведение расчета на основе доли свободного (не образующего комплекс) связывающего агента, определенной на предыдущей стадии, аффинности связывания (значения KD) связывающего агента с его лигандом.
Одним аспектом, как здесь описано, является способ определения аффинности связывания (значения KD) связывающего агента с его лигандом, включающий следующие стадии:
- определение доли свободного (не образующего комплекс) лиганда в образце, содержащем связывающий агент, лиганд и комплексы связывающий агент-лиганд, для первого отношения связывающий агент:лиганд в образце,
при этом отношение связывающий агент:лиганд является равным или большим, чем отношение связывающий агент:лиганд, для которого определенная доля свободного (не образующего комплекс) лиганда сравнима для по меньшей мере двух разных отношений связывающий агент:лиганд,
- определение доли свободного (не образующего комплекс) лиганда в образце, содержащем связывающий агент, лиганд и комплексы связывающий агент-лиганд, для по меньшей мере второго отношения связывающий агент:лиганд в образце,
при этом второе отношение связывающий агент:лиганд является отличным от первого отношения связывающий агент:лиганд путем увеличения или уменьшения количества связывающего агента в образце и путем поддержания количества лиганда в образце,
при этом доля свободного (не образующего комплекс) лиганда сравнима для отношения связывающий агент:лиганд с повышенным или пониженным количеством связывающего агента в образце для повышенного или пониженного количества лиганда в образце,
- проведение расчета на основе доли свободного (не образующего комплекс) лиганда, определенной на предыдущей стадии, аффинности связывания (значения KD) связывающего агента с его лигандом.
Одним аспектом, как здесь описано, является способ определения аффинности связывания (значения KD) связывающего агента с его лигандом, включающий следующие стадии:
- определение доли свободного (не образующего комплекс) связывающего агента в образце, содержащем связывающий агент, лиганд и комплексы связывающий агент-лиганд, для первого отношения связывающий агент:лиганд в образце,
при этом отношение связывающий агент:лиганд является равным или большим, чем отношение связывающий агент:лиганд, для которого определенная доля свободного (не образующего комплекс) лиганда сравнима для по меньшей мере двух разных отношений связывающий агент:лиганд,
- определение доли свободного (не образующего комплекс) связывающего агента в образце, содержащем связывающий агент, лиганд и комплексы связывающий агент-лиганд, для по меньшей мере второго отношения связывающий агент:лиганд в образце,
при этом второе отношение связывающий агент:лиганд является отличным от первого отношения связывающий агент:лиганд посредством увеличения или уменьшения количества связывающего агента в образце и посредством поддержания количества лиганда в образце,
при этом доля свободного (не образующего комплекс) связывающего агента сравнима для отношения связывающий агент:лиганд с повышенным или пониженным количеством связывающего агента в образце для повышенного или пониженного количества лиганда в образце,
- проведение расчета на основе доли свободного (не образующего комплекс) связывающего агента, определенной на предыдущей стадии, аффинности связывания (значения KD) связывающего агента с его лигандом.
Одним аспектом, как здесь описано, является способ определения аффинности связывания (значения KD) связывающего агента с его лигандом, включающий следующие стадии:
- определение доли комплекса связывающий агент-лиганд в образце, содержащем связывающий агент, лиганд и комплексы связывающий агент-лиганд, для первого отношения связывающий агент:лиганд в образце,
при этом отношение связывающий агент:лиганд является равным или большим, чем отношение связывающий агент:лиганд, для которого определенная доля комплекса связывающий агент-лиганд сравнима для по меньшей мере двух разных отношений связывающий агент:лиганд,
- определение доли комплекса связывающий агент-лиганд в образце, содержащем связывающий агент, лиганд и комплексы связывающий агент-лиганд, для по меньшей мере второго отношения связывающий агент:лиганд в образце,
при этом второе отношение связывающий агент:лиганд является отличным от первого отношения связывающий агент:лиганд посредством увеличения или уменьшения количества связывающего агента в образце и посредством поддержания количества лиганда в образце,
при этом доля комплекса связывающий агент-лиганд сравнима для отношения связывающий агент:лиганд с повышенным или пониженным количеством связывающего агента в образце для повышенного или пониженного количества лиганда в образце,
- проведение расчета на основе доли комплекса связывающий агент-лиганд, определенной на предыдущей стадии, аффинности связывания (значения KD) связывающего агента с его лигандом.
Одним аспектом, как здесь описано, является способ определения аффинности связывания (значения KD) связывающего агента с его лигандом, включающий следующие стадии:
- определение доли свободного связывающего агента в по меньшей мере двух образцах с разными отношениями связывающий агент:лиганд,
при этом в по меньшей мере двух образцах количество связывающего агента поддерживается постоянным (таким же), и количество лиганда в каждом образце отличается, при условии, что образец содержит избыток лиганда по сравнению со связывающим агентом,
или
- определение доли свободного лиганда в по меньшей мере двух образцах с разными отношениями связывающий агент:лиганд,
при этом в по меньшей мере двух образцах количество лиганда поддерживается постоянным (таким же), и количество связывающего агента в каждом образце отличается, при условии, что образец содержит избыток связывающего агента по сравнению с лигандом,
- проведение расчета на основе доли свободного (не образующего комплекс) связывающего агента или проведение расчета на основе доли свободного (не образующей комплекс) лиганда, определенных на предыдущей стадии, аффинности связывания (значения KD) связывающего агента с его лигандом для каждого образца,
при этом аффинность связывания была определена, если по меньшей мере три значения KD являются сравнимыми,
при этом, если по меньшей мере два значения KD не являются сравнимыми, данный способ повторяют с использованием образцов, в которых либо
1) количество лиганда снижено при постоянном количестве связывающего агента, либо
2) количество связывающего агента снижено при постоянном количестве лиганда,
по сравнению с образцами, использованными в предыдущем определении.
В одном воплощении всех аспектов, как здесь описано, связывающий агент/лиганд выбран из группы, включающей антиген/антитело, клетку/метку, лекарственное средство/мишень, рецептор/лиганд рецептора, фермент/субстрат фермента и комплексант/ион металла.
В одном воплощении всех аспектов, как здесь описано, связывающий агент выбран из группы, включающей низкомолекулярное лекарственное средство, биологически активный полипептид и антитело.
В одном воплощении всех аспектов, как здесь описано, антитело выбрано из группы, включающей полноразмерное антитело, фрагмент антитела и конъюгат антитела.
В одном воплощении всех аспектов, как здесь описано, антитело выбрано из группы, включающей моноспецифичное антитело, биспецифичное антитело, триспецифичное антитело, тетраспецифичное антитело и гексаспецифичное антитело.
В одном воплощении всех аспектов, как здесь описано, антитело выбрано из двухвалентного антитела, трехвалентного антитела, четырехвалентного антитела и шестивалентного антитела.
В одном воплощении всех аспектов, как здесь описано, образец содержит сыворотку или плазму.
В одном воплощении всех аспектов, как здесь описано, определение осуществляется посредством иммуноанализа. В одном воплощении повторное проведение анализа осуществляется таким же иммуноанализом. В одном воплощении иммуноанализ представляет собой гетерогенный анализ.
В одном воплощении всех аспектов, как здесь описано, лекарственное средство/связывающий агент представляет собой антитело, и мишень/лиганд представляет собой антиген, который специфично связывается антителом.
В одном воплощении всех аспектов, как здесь описано, связывающий агент или лиганд иммобилизован на твердой фазе.
В одном воплощении всех аспектов, как здесь описано, для расчета значения KD используют следующее уравнение:
KD = (доля свободного лекарственного средства/связывающего агента) * (концентрация мишени/лиганда [нМ]) / (1 - доля свободного лекарственного средства/связывающего агента).
Одним аспектом, как здесь описано, является применение одной точки данных (определенной с использованием подходящей калибровки), определенной на плато свободного связывающего агента, для определения аффинности в растворе (KD).
Одним аспектом, как здесь описано, является применение способа, как здесь описано, для определения KD для определения кинетики связывания/констант скорости (kon и koff) путем определения концентраций свободного связывающего агента или лиганда в фазе ассоциации или диссоциации связывающего агента и лиганда, индуцированной разведением образца.
Одним аспектом, как здесь описано, является применение способа, как здесь описано, для определения кинетики связывания/констант скорости в растворе (kon и koff).
Одним аспектом, как здесь описано, является применение способа, как здесь описано, для определения значений kon в растворе. В данном случае значение KD известно.
Одним аспектом, как здесь описано, является применение способа, как здесь описано, для определения значений koff в растворе.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1. Зависимость доли свободного лекарственного средства/связывающего агента от изменяющихся концентраций лекарственного средства/связывающего агента и мишени/лиганда, предполагая обычно встречающиеся аффинности (KD - фиксированная (0,1 нМ (1×10-10 М)), мишень/лиганд - изменяющаяся, лекарственное средство/связывающий агент - изменяющаяся).
Фиг. 2. Схематическое описание методики анализа ELISA (1).
Фиг. 3. Схематическое описание методики анализа ELISA (2).
Фиг. 4. Калибровочная кривая анализа.
Фиг. 5. Типичная концентрационная кривая свободного лекарственного средства/связывающего агента, демонстрирующая зависимость доли свободного лекарственного средства/связывающего агента от изменяющейся общей концентрации лекарственного средства/связывающего агента.
Фиг. 6. Зависимость доли свободного лекарственного средства/связывающего агента от времени и после разведения буфера после достижения равновесия.
Фиг. 7. Взаимная зависимость между концентрацией лекарственного средства/связывающего агента, концентрацией мишени/лиганда и аффинностью/KD.
Фиг. 8. Доля свободного лекарственного средства/связывающего агента в зависимости от концентрации лекарственного средства/связывающего агента при постоянной концентрации мишени/лиганда, определенная для антитела против VEGF (фактор роста эндотелия сосудов) в качестве лекарственного средства/связывающего агента и VEGF в качестве мишени/лиганда.
Фиг. 9. KD является постоянной, независимо от концентрации лекарственного средства/связывающего агента в пределах плато свободного лекарственного средства/связывающего агента.
Фиг. 10. KD является постоянной, независимо от концентрации мишени/лиганда в пределах плато свободного лекарственного средства/связывающего агента.
Фиг. 11. Схематическое описание определения кинетики связывания на основе иммуноанализа.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Обнаружили, что определение аффинности и кинетики связывания (KD, константы скорости ассоциации и диссоциации) связывающего агента с его лигандом в образцах буфера или сыворотки/плазмы можно осуществлять с использованием малого числа образцов на основе определения свободного связывающего агента или свободного лиганда, при этом определение следует проводить в пределах линейного интервала/постоянного плато кривой, т.е. при низкой концентрации связывающего агента/лиганда, когда не происходит изменений доли свободного связывающего агента, или, подобным образом, при высокой концентрации связывающего агента/лиганда, когда не происходит изменений доли свободного лиганда.
Обнаружили, что при низком отношении связывающий агент:лиганд можно наблюдать плато свободного связывающего агента, которое является специфичным для концентрации лиганда и KD, таким образом, при низких отношениях связывающий агент:лиганд получается постоянное значение доли свободного связывающего агента. Подобным образом, при высоком отношении связывающий агент:лиганд можно наблюдать плато свободного лиганда, которое является специфичным для концентрации связывающего агента и KD, таким образом, при высоких отношениях связывающий агент:лиганд получается постоянное значение доли свободного лиганда.
Термин «плато свободного связывающего агента» обозначает интервал концентрации связывающего агента при постоянной концентрации лиганда в образцах, содержащих разные концентрации связывающего агента, постоянные концентрации лиганда и соответствующие нековалентные комплексы связывающий агент-лиганд, где доля свободного связывающего агента остается постоянной (см., например, Фиг. 5).
Термин «плато свободного лиганда» обозначает интервал концентрации лиганда при постоянной концентрации связывающего агента в образцах, содержащих разные концентрации лиганда, постоянные концентрации связывающего агента и соответствующие нековалентные комплексы связывающий агент-лиганд, где доля свободного лиганда остается постоянной.
Термин «сравнимый» обозначает то, что относительное различие (% Разл.) двух определенных значений меньше, чем 100%. В одном воплощении различие меньше, чем 50%. В одном воплощении различие меньше, чем 30%. Различие (% Разл.) рассчитывается с использованием следующей формулы:
% Разл. = [(наибольшее значение)-(наименьшее значение)]/(среднее арифметическое значений).
Например, при первом определении было определено 10% свободного связывающего агента, и при втором определении было определено 13% свободного связывающего агента. Согласно приведенной выше формуле это приводит к различию 26% (13-10)/((13+10)/2)=26%).
Термин «несравнимый» обозначает то, что относительное различие (% Разл.) двух определенных значений больше, чем 100%. В одном воплощении различие больше, чем 50%. В одном воплощении различие больше, чем 30%. Различие (% Разл.) рассчитывается с использованием следующей формулы:
% Разл. = [(наибольшее значение)-(наименьшее значение)]/(среднее арифметическое значений).
Далее настоящее изобретение проиллюстрировано примерами с использованием лекарственного средства в качестве примера связывающего агента и мишени - в качестве примера лиганда. Лекарственное средство специфично взаимодействует с мишенью.
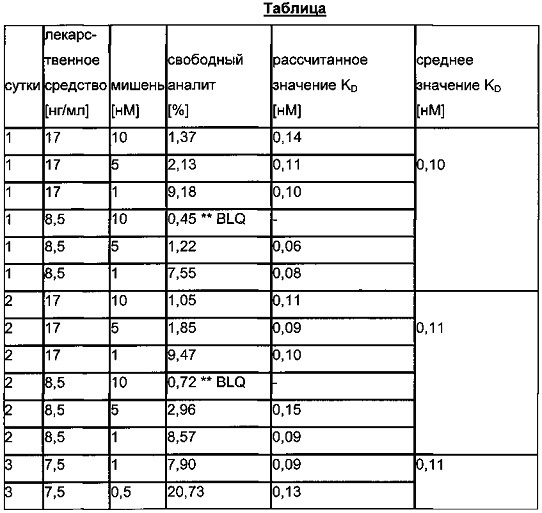
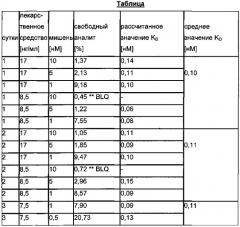
Как показано на Фиг. 7, существует взаимная зависимость между концентрацией лекарственного средства, концентрацией мишени и аффинностью (KD).
При низком отношении лекарственное средство:мишень можно наблюдать плато свободного лекарственного средства, которое является специфичным в отношении концентрации мишени и KD. Экспериментально определенная доля свободного лекарственного средства, зависящая от концентрации лекарственного средства при постоянной концентрации мишени, показана на Фиг. 8. Можно видеть, что при низких отношениях лекарственное средство:мишень получается постоянное значение для доли свободного лекарственного средства.
Подобным образом, при высоких отношениях лекарственное средство:мишень можно наблюдать аналогичное плато. Данное плато также можно использовать для определения значения KD. Следовательно, все аспекты и воплощение, которые направлены на низкое отношение лекарственное средство:мишень (избыток мишени) также можно осуществлять при высоком отношении лекарственное средство:мишень (избыток лекарственного средства).
Подобным образом, данный способ можно изменять путем определения концентрации свободной мишени при использовании избытка лекарственного средства. Следовательно, все аспекты и воплощения, которые направлены на лекарственное средство, также можно осуществлять при направлении на мишень.
Обнаружили, что доля свободного лекарственного средства и, соответственно, значение KD, являются постоянными, независимо от концентрации лекарственного средства в пределах плато свободного лекарственного средства (см. Фиг. 9).
Обнаружили, что значение KD является постоянным, независимо от концентрации мишени в пределах плато свободного лекарственного средства (см. Фиг. 10).
Для определения аффинности лекарственное средство-мишень и кинетики связывания (KD) константа скорости для ассоциации и диссоциации) в образцах буфера или сыворотки/плазмы получали образцы с различной ожидаемой концентрацией свободного лекарственного средства/аналита (для оценки KD должно достигаться равновесие). Доля свободного лекарственного средства/аналита должна находиться в линейном интервале/постоянном плато кривой (низкая концентрация лекарственного средства/аналита, нет изменений доли свободного лекарственного средства). Для первой оценки доли свободного лекарственного средства/аналита на Фиг. 1 приведены соответствующие концентрации. Анализировали реальные доли свободного лекарственного средства/аналита. Рассчитывали аффинность (KD) и константы скорости (kon, koff) с использованием определенной доли свободного лекарственного средства.
Таким образом, в способе, как здесь описано, можно использовать любой способ, который подходит для определения доли свободного лекарственного средства.
В качестве альтернативы, долю свободного лекарственного средства можно определять опосредованно с использованием установки для анализа для определения образованного комплекса.
Например, для определения концентрации свободного лекарственного средства/аналита в образцах буфера или сыворотки/плазмы можно использовать два серийных многослойных твердофазных иммуноферментных анализа (ELISA).
На Фиг. 2 и 3 показаны разные стадии методики анализа на основе ELISA.
Более подробно, на планшет для микротитрования (МТР), покрытый стрептавидином (SA), последовательно добавляют биотинилированный захватывающий белок (мишень-Bi), лекарственное средство/аналит, mAb(моноклональное антитело) <лекарственное средство/аналит> - Dig (дигоксигенин) и антитело против дигоксигенина-POD (перксидаза) с инкубацией каждого реактива в течение 1 часа на шейкере для МТР. Для ускорения анализа, в качестве альтернативы, можно использовать mAb <лекарственное средство/аналит> - POD вместо комбинации mAb <лекарственное средство/аналит> - Dig и антитело против дигоксигенина-POD.
Для точной картины концентрации свободного лекарственного средства/аналита в растворе лекарственное средство/аналит инкубируют в течение примерно 5 мин (компромисс между получением сигнала и минимальным мешающим влиянием равновесия).
После каждой стадии МТР промывают три раза, и остаточные жидк