Способы повышения эффективности этапов очистки белка, находящихся ниже по потоку, с использованием мембранной ионообменной хроматографии
Иллюстрации
Показать всеИзобретение относится к способу усиления эффективности этапов хроматографии для очистки антител ниже по потоку, включающему: а) пропускание композиции, содержащей представляющее интерес антитело и загрязняющий ионный полимер сквозь ионообменную мембрану, отличающееся тем, что антитело и мембрана имеют противоположный заряд, при рабочих условиях, которые состоят из буфера, имеющего рН, достаточно отличающийся от pI антитела с целью повышения заряда антитела, и низкой ионной силы, эффективной для предотвращения экранирования зарядов буферных ионов, которые приводят к тому, что мембрана связывает антитело и по крайней мере один загрязняющий ионный полимер; b) перегрузку ионообменной мембраны до плотности нагрузки 1000-5000 г/л таким образом, что по меньшей мере один указанный загрязняющий ионный полимер остается связанным с мембраной, тогда как представляющее интерес антитело находится, главным образом, в элюате; c) улавливание элюата из ионообменной мембраны, который содержит представляющее интерес антитело; d) этап ионообменной хроматографии, которая имеет аналогичный предыдущей мембране заряд, которому подвергают элюат мембраны, содержащий представляющее интерес антитело, и e) извлечение очищенного антитела из элюата этапа ионообменной хроматографии. Способ позволяет улучшить очистку белков и удалять примеси ионного полимера, например, такого как полиэтиленимин. 3 н. и 24 з.п. ф-лы, 16 ил., 2 табл., 1 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение в целом относится к очистке белка. В частности, настоящее изобретение относится к способам повышения эффективности находящихся ниже по потоку этапов очистки с целью удаления примесей посредством использования находящейся выше по потоку мембранной ионообменной хроматографии.
УРОВЕНЬ ТЕХНИКИ
Масштабная, экономичная очистка белков становится все более важной проблемой для биотехнологической промышленности. Как правило, белки получают путем культивирования клеток, с использованием либо эукариотических или прокариотических клеточных линий разработанных для получения интересующего белка путем введения рекомбинантной плазмиды, содержащей ген этого белка. Эти клетки должны подаваться со сложной средой роста, содержащей сахара, аминокислоты и факторы роста, обычно поставляемые из препаратов сыворотки животных. Разделение желаемого белка в смеси соединений, подаваемых к клеткам, и побочных продуктов самих клеток с чистотой, достаточной для использования в качестве терапевтических доз для человека, представляет собой сложную задачу.
Методики очистки белков от остатков клеток изначально зависят от механизма экспрессии данного белка. Некоторые белки могут быть секретированы непосредственно из клетки в окружающую питательную среду; другие созданы внутри клетки. Для последних белков, первый этап способа очистки содержит лизис клетки, что может осуществляться различными способами, в том числе механического разрезания, осмотического удара или ферментативных способов обработки. Такое разрушение высвобождает все содержимое ячейки в гомогенат, и, кроме того, производит субклеточные фрагменты, которые трудно удалить из-за их небольшого размера. Как правило, их удаляют дифференциальным центрифугированием или фильтрацией. Та же проблема возникает, хотя и в меньшем масштабе, с непосредственно секретируемыми белками за счет естественной смерти клеток и высвобождения внутриклеточных белков клетки-хозяина в ходе получения белка.
После того, как был получен представляющий интерес осветленный раствор, содержащий белок, без больших компонентов дебриса, его отделение от остальных других белков, продуцируемых клеткой, как правило, осуществляют с использованием комбинации различных способов хроматографии. Эти способы разделяют смеси белков и других примесей на основе их заряда, степени гидрофобности или размера. Для каждого из этих способов доступны несколько различных хроматографических смол, что позволяет осуществить правильную адаптацию схемы очистки вовлеченного, в частности, белка. Сущностью каждого из этих способов разделения является то, что белки подвергают либо движению с разной скоростью по длинной колонке, достигая физического разделения, которое увеличивается, когда они проходят далее вниз по колонке, или селективному присоединению к разделяющей среды, будучи затем дифференциально элюированными или перемещенными с помощью различных растворителей или заместителей. В некоторых случаях желаемый белок отделяют от примесей, причем примеси специфически прилипают к колонке, а представляющий интерес белок нет, то есть интересующий белок присутствует в "элюате". Публикации, касающиеся очистка белка, включают Fahrner и соавт., Biotechnol Genet Eng Rev. 2001; 18:301-27.
Типичный масштабный процесс очистки антител часто построен вокруг применения иммобилизованного протеина А в качестве основного этапа захвата и очистки, в сочетании с другими операциями в колонке. Протеин А представляет собой белок клеточной стенки Staphylococcus aureas со сродством к области Fc IgG. По этой причине он широко используется для очистки IgG. Операции с протеином А в колонке в целом предоставляют чистоту продукта более 98%, с большинством технологических примесей, вымываемых фракцией элюата. Тем не менее, существуют многочисленные недостатки использования хроматографии с протеином А. Во-первых, связывание обычно осуществляют при рН от нейтрального до слабощелочного и, как правило, элюирование обычно осуществляют при кислом значении рН. Одной из потенциальных проблем является то, что низкий рН может денатурировать или частично денатурировать IgG. Из-за этого и высокой чистоты продукта, необходимой для клинического применения, для разделения изомеров, связанных с продуктами, являются необходимыми дополнительные этапы концентрации, очистки и удаления оставшихся количеств белков/ДНК клетки-хозяина, культивирования клеток примесей, выщелоченного протеина А и вирусов. Усугубляется проблема тем, что многие из этих примесей могут помешать эффективности функциональных блоков технологического способа выделения очищенных антител ниже по потоку. Другой основной проблемой является цена - колонки с протеином А являются более дорогими, чем обычные ионообменные колонки. Наконец, существуют многочисленные сценарии, в которых хроматография с протеином А или не является подходящей, или стоимость является слишком высокой, например, с очисткой полипептидов, подобных антителам молекул, фрагментов антител и/или всех антител, выделенных из определенных клеточных систем.
Природа настоящего изобретения решает вышеобозначенные проблемы, и в вариантах его осуществления демонстрируют способ очистки, альтернативный доступным в настоящее время в данной области с использованием этапа очистки с протеином А антитела, фрагмента антитела и полипептида.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам повышения эффективности последующих этапов хроматографии для очистки белков, которые содержат (а) пропускание композиции, содержащей представляющий интерес полипептид и различные загрязняющие вещества сквозь ионообменную мембрану, отличающуюся тем, что полипептид и мембрана имеют противоположный заряд, при рабочих условиях, состоящих из буфера, имеющего рН, достаточно отличающийся от pi полипептида для повышения заряда полипептида, и низкой ионной силы, эффективно предотвращающей экранирование зарядов буферными ионами, которое приводит к связыванию с мембраной молекул полипептида и по меньшей мере одного загрязняющего вещества, (b) улавливание фракции из ионообменной мембране, содержащей представляющий интерес полипептид; (с) дополнительный один или более этап(ы) очистки, которому подвергают композицию, содержащую полипептид, и (d) извлечение очищенного полипептида из элюата.
В одном альтернативном варианте осуществления настоящее изобретение относится к способу повышения эффективности последующих этапов хроматографии для очистки белков, содержащих (а) пропускание композиции, содержащей представляющий интерес полипептид, и различных загрязняющих веществ через катионообменную мембрану, где этот полипептид и мембрана имеют противоположный заряд, при рабочих условиях, состоящих из буфера с рН от около 1 до около 5 единиц рН ниже pI полипептида и проводимости ≤ около 40 мСм/см, которая приводит к связыванию с мембраной полипептид и по меньшей мере одно загрязняющее вещество, и (b) выделение фракции на ионообменной мембране, содержащей представляющий интерес полипептид; (с) дополнительный один или более этап(ы) очистки, которому подвергают композицию, содержащую полипептид, и (d) извлечение очищенного полипептида из элюата.
В одном альтернативном варианте осуществления настоящее изобретение относится к способу повышения эффективности последующих этапов хроматографии для очистки белков, содержащих (а) пропускание композиции, содержащей представляющий интерес полипептид, и различных загрязняющих веществ через анионообменную мембрану, где этот полипептид и мембрана имеют противоположный заряд, при рабочих условиях, состоящих из буфера с рН от около 1 до около 5 единиц рН выше pI полипептида и проводимости ≤ около 40 мСм/см, которая приводит к связыванию с мембраной полипептид и по меньшей мере одно загрязняющее веществе, и (b) выделение фракции на ионообменной мембране, содержащей представляющий интерес полипептид; (с) дополнительный один или более этап(ы) очистки, которому подвергают композицию, содержащую полипептид, и (d) выделение очищенного полипептида из элюата.
В одном аспекте загрязняющее вещество представляет собой белок яичника китайского хомячка (CHOP). В другом аспекте загрязняющее вещество представляет собой белок Е. coli (ЕСР). В другом аспекте загрязняющее вещество представляет собой гентамицин. В еще одном аспекте загрязняющее вещество представляет собой полиэтиленимин (PEI).
В отдельном аспекте полипептид содержит область СН2/СН3. В другом аспекте полипептид представляет собой антитело. В еще одном дополнительном аспекте антитело представляет собой моноклональное антитело.
В других аспектах способы дополнительно включают воздействие на композицию, содержащую полипептид, на дальнейшем одном или более этапе(ах) очистки до, во время или после стадии а на протяжении стадии b, описанной выше, стадия очистки в одном альтернативном варианте осуществления представляет собой Fc-связывающую аффинную хроматографию (напр., хроматографию с протеином А) и, в другом альтернативном варианте осуществления, ионообменную хроматографию, которая использует колонку или мембрану, действующую в режиме связывания/вымывания, промывания или перемещения. В еще одном аспекте ионообменную мембрану заменяют на монолит или объемный фильтр.
Кроме того, настоящее изобретение обеспечивает получение фармацевтической композиции путем объединения очищенного полипептида с фармацевтически приемлемым носителем.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
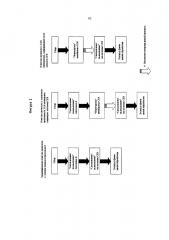
Фигура 1. Схема очистки антител с использованием мембраны СЕХ для защиты колонки СЕХ с, или без, исходной колонки с протеином А.
Фигура 2. Схема очистки не-антител с использованием мембраны СЕХ для защиты колонки СЕХ в качестве начального этапа.
Фигура 3. Выход в случае анионообменной емкости mAb 1 при рН 5,5 и 6,4 мСм/см и при рН 8,0 и 5,0 мСм/см, Mustang™ S (малогабаритная, минутный объем 0,18 мл, 667 MV/час).
Фигура 4. Выход в случае анионообменной емкости mAb 2 при рН рН 8,0, Mustang™ Q (малогабаритная, минутный объем 0,35 мл, 600 MV/час).
Фигура 5. Клиренс CHOP в случае емкости с протеином A mAb 3 при рН 5,5, 3,2 мСм/см, Mustang™ S (малогабаритная, минутный объем 0,18 мл, 1333 MV/час).
Фигура 6. Клиренс примесей после перегрузки с мембранами СЕХ.
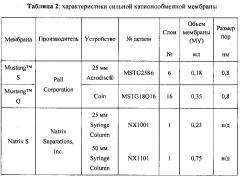
Фигура 7. Сила связывания Mustang S различных видов, которая определяется градиентом элюирования, и нормализация высокой концентрации видов в каждой фракции.
Фигура 8. Общую связанную массу различных видов на Mustang S рассчитывают с помощью суммирования всех масс фракций градиентного элюирования и при сравнении с разными плотностями нагрузки мембран и нормализацией к максимальной массе.
Фигура 9. Мембрану Mustang S загружают белком, промывают 20 мМ ацетатного буфера, пока УФ-поглощение не достигнет исходного уровня, а затем элюируют 20 мМ ацетат/гентамициновым буфером, чтобы продемонстрировать перемещение антитела относительно гентамицина.
Фигура 10. Схема, изображающая протокол для определения способности к динамическому связыванию (DBC) антител на колонке СЕХ (Fractogel SE Hicap) с, или без, использованием мембраны СЕХ на различных концентрациях гентамицина.
Фигура 11. Влияние концентрации гентамицина на DBC антитела Fractogel SE
Hicap.
Фигура 12. Сравнение DBC гентамицина на двух мембранах СЕХ (Mustang S и Natrix S).
Фигура 13. DBC антитела Fractogel SE Hicap с перегруженной Natrix S емкостью, которая демонстрирует 30% повышение DBC.
Фигура 14. Влияние % PEI, используемое в способе экстракции на SP Sepharose Fast Flow (SPSFF), на DBC белка демонстрирует повышение на от 36 до 51 г/л, при том, что используют меньше PEL
Фигура 15. Влияние % PEI, используемое в способе экстракции, на SPSFF, демонстрирует сниженный выход на этапе и повышенные примеси в емкости, при том, что используют больше PEI.
Фигура 16. DBC протеина на Natrix S, ЕСР и PEI демонстрируют прорыв PEI при 330 мг/мл мембраны, по сравнению с прорывом белка и ЕСР при 123 мг/мл мембраны.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО ВАРИАНТА РЕАЛИЗАЦИИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Определения:
В данном документе численные диапазоны или количества, которым предшествует термином "около", полностью содержит точный диапазон или точное численное количество.
"Композиция", которая должна быть очищена по данному документу, содержит представляющий интерес полипептид и одно или более загрязняющее вещество. Композиция может быть "частично очищенный" (напр., такой, которая была подвергнута одному или нескольким этапам очистки, таким как хроматография с протеином А) или может быть получена непосредственно из клетки-хозяина или организма, продуцирующего полипептид (напр., композиция может содержать собранную культуральную жидкость).
Как используется в данном документе, "полипептид" в целом относится к пептидам и белкам, имеющим более чем около десяти аминокислот. Предпочтительно полипептид представляет собой белок млекопитающего, примеры которого содержат: ренин; гормон роста, в том числе гормона роста человека и бычий гормон роста; фактор высвобождения гормона роста; паратгормон; тиреотропный гормон; липопротеины; альфа-1-антитрипсин; А-цепь инсулина; В-цепь инсулина; проинсулин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы свертывания, такие как фактор VIIIC, фактор IX, тканевой фактор, и фактор фон Виллебранда; противосвертывающие факторы, такие как протеин С; предсердный натрийуретический фактор; сурфактант легких; активатор плазминогена, такой как урокиназа или моча человека, или тканевой активатор плазминогена (t-PA); бомбезин; тромбин; гемопоэтический фактор роста; альфа и -бета фактор некроза опухолей; энкефалиназа; RANTES (регулируют обычно по активации экспрессированных и секретированных Т-клеток); макрофагальный белок воспаления человека (MIP-1 -альфа); сывороточный альбумин, такой как человеческий сывороточный альбумин; мюллерова ингибирующая субстанция; А-цепь релаксина; В-цепь релаксина; прорелаксин; гонадотропин-ассоциированный пептид мыши; микробный белок, такой как бета-лактамаза; ДНКаза; IgE; антиген цитотоксических Т-лимфоцитов (CTLA), таких как CTLA-4; ингибин; активин; фактор роста эндотелия сосудов (VEGF); рецепторы гормонов или факторов роста; протеин А или D; ревматоидные факторы; нейротрофический фактор, такой как костный нейротрофический фактор (BDNF), нейротрофин-3, -4, -5, -6 (или NT-3, NT-4, NT-5 или NT-6) или фактор роста нервной ткани, такой как NGF-β; тромбоцитарный фактор роста (PDGF); фактор роста фибробластов, такой как aFGF и bFGF; эпидермальный фактор роста (EGF); трансформирующий фактор роста (TGF), такой как TGF-альфа и TGF-бета, в том числе TGF-β1, TGF-β2, TGF-β3, TGF-β4, или TGF-β5; инсулиноподобный фактор роста-I и II (IGF-I и IGF-II); дез(1-3)-IGF-1 (IGF-I мозга), белки, связывающие инсулиноподобный фактор роста (IGFBP); белки CD, такие как CD3, CD4, CD8, CD 19 и CD20; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; костный морфогенетический белок (BMP); интерферон, такой как интерферон-альфа, -бета и -гамма; колониестимулирующие факторы (CSF), напр., M-CSF, GM-CSF и G-CSF; интерлейкины (ILS), напр., от IL-1 до IL-10; супероксиддисмутазы; Т-клеточные рецепторы; белки поверхности мембраны; стимулятор гемолиза; вирусный антиген, такой как, например, часть оболочки СПИДа; транспортные белки; "хоуминг"-рецептор; аддрессины; регуляторные белки; интегрины, такие как CD11a, CD11b, CD11c, CD18, ICAM, VLA-4 и VCAM; опухолеспецифический антиген, такой как рецептора HER2, HER3 или HER4; и фрагменты и/или варианты любого из вышеперечисленных полипептидов, а также антител, в том числе фрагменты антител, связывающихся с любым из вышеперечисленных полипептидов.
"Загрязняющее вещество" представляет собой материал, который отличается от желаемого полипептидного продукта. Загрязняющее вещество содержит, без ограничения ими, материалы клетки-хозяина, такие как белки яичника китайского хомячка (CHOP) или белки Е. coli (ЕСР); выщелоченный белок А; нуклеиновую кислоту; вариант, фрагмент, агрегат, изомер или производное желаемого полипептида; другой полипептид; эндотоксин; вирусное загрязняющее вещество; компоненты аминогликозидньгх антибиотиков (напр., гентамицин, стрептомицин, неомицин, канамицин); или ионный полимер, добавленный в процессе очистки (напр., полиэтиленимин (PEI), поливиниламин, полиаргинин, поливинилсульфоновая кислота, полиакриловая кислота) и т.д.
Используемый в данном документе термин "область CH2/CH3" относится к аминокислотным остаткам в области Fc молекулы иммуноглобулина. В предпочтительных вариантах область область CH2/CH3 содержит в себе неповрежденную область CH2 после интактной области CH3, и наиболее предпочтительно Fc-область иммуноглобулина. Примеры полипептидов, содержащих область CH2/CH3, содержат антитела, иммуноадгезины и слитые белки, содержащие представляющий интерес полипептид, слитый с, или сопряженный с, областью CH2/CH3.
В предпочтительных вариантах реализации настоящего изобретения антитело, которое очищают по данному документу, представляет собой рекомбинантное антитело. "Рекомбинантное антитело" представляет собой таковое, полученное в клетке-хозяине, которая была трансформирована или, трансфицирована с, кодирующей антитело нуклеиновой кислотой, или получает антитело в результате гомологичной рекомбинации. "Трансформацию" и "трансфекцию" используют взаимозаменяемо для обозначения процесса введения нуклеиновой кислоты в клетку. После трансформации или трансфекции нуклеиновая кислота может интегрироваться в геном клетки-хозяина или может существовать как внехромосомный элемент."Клетка-хозяин" содержит в себе клетку в клеточной культуре in vitro, а также в клетке животного-хозяина. Например, способы рекомбинантного получения полипептидов, описанные в патенте США №5534615, специально содержатся в данном документе в виде ссылки.
Термин "антитело" используется в широком смысле и конкретно охватывает моноклональные антитела (в том числе непроцессированный моноклональные антитела), поликлональные антитела, мульти специфические антитела (напр., биспецифичные антитела) и фрагменты антител, пока они сохраняют, или изменены, чтобы содержать, область CH2/CH3 так, как они определены в данном документе.
Антитело по настоящему изобретению направлено против "антигена", представляющего интерес. Предпочтительно антиген представляет собой биологически важный полипептид и введение антитела млекопитающему, страдающему от заболевания или расстройства, которое может привести к терапевтическому действию для этого млекопитающего. Тем не менее, также рассматриваются антитела, направленные против не-полипептидных антигенов (таких, как ассоциированные с опухолью гликолипидные антигены, смотри патент США 5091178). Если антиген представляет собой полипептид, то он может быть трансмембранной молекулой (напр., рецептором) или лигандом, таким как фактор роста. Примерные антигены содержат полипептиды, описанные выше. Предпочтительные молекулярные мишени для антител, охватываемых настоящим изобретением, содержат CD полипептиды, такие как CD3, CD4, CD8, CD 19, CD20 и CD34; члены семейства рецепторов HER, такие как рецептор EGF (HER1), HER2, HER3 или рецептор HER4; молекулы клеточной адгезии, такие как LFA-1, Mac1, р150,95, VLA-4, ICAM-1, VCAM и интегрин av/b3, которые содержат их субъединицы А или В (напр., антитела анти-CD11a, анти-CD18 или анти-CD11b); факторы роста, такие как VEGF; IgE; антигены группы крови; рецептор flk2/flt3; рецептор ожирения (ОВ); рецептор mpI; CTLA-4; полипептид С и т.д. Растворимые антигены или их фрагменты, необязательно конъюгированные с другими молекулами, могут быть использованы в качестве иммуногенов для получения антител. Для трансмембранных молекул, таких как рецепторы, в качестве иммуногена могут быть использованы их фрагменты (напр., внеклеточный домен рецептора). С другой стороны, в качестве иммуногена могут быть использованы клетки, экспрессирующие трансмембранную молекулу. Такие клетки могут быть получены из природного источника (напр., линии раковых клеток) или могут быть клетками, которые были трансформированы рекомбинантными способами для экспрессирования трансмембранной молекулы.
Примеры антител, которые должны быть очищены по данному документу, содержат, но без ограничения ими: антитела HER2, содержащие трастузумаб (в том числе HERCEPTIN®) (Carter и соавт., Proc. Natl. Acad. Sci. USA, 89:4285-4289 (1992), патент США №5725856) и пертузумаб (OMNITARG™) (SEQ CHAPTER \h \r 1WO01/00245); антитела CD20 (см. ниже); антитела IL-8 (St John и соавт., Chest, 103:932 (1993), и международная заявка WO 95/23865); антитела рецептора VEGF или VEGF, в том числе гуманизированные антитело и/или антитело VEGF с созревшей аффинностью, такие как гуманизированное антитело VEGF huA4.6.1 бевацизумаба (AVASTIN®) и ранибизумаба (Lucentis®) (Ким и соавт., Growth Factors, 7:53-64 (1992), международные заявки WO 96/30046 и WO 98/45331, опубликованные 15 октября 1998); антитела PSCA (WO 01/40309); антитела CD11а, которые содержат эфализумаб (RAPTIVA®) (патент США №5622700, WO 98/23761, Steppe и соавт., Transplant Intl. 4:3-7 (1991), и Hourmant и соавт, Transplantation 58:377-380 (1994)).; антитела, которые связывают IgE, в том числе омализумаб (XOLAIR®) (Presta и соавт., J. Immunol. 151:2623-2632 (1993), и международная заявка WO 95/19181; патент США №5714338, выданный 3 февраля 1998 или патент США №5091313, выданный 25 февраля 1992, WO 93/04173, опубликованный 4 марта 1993, или международная заявка PCT/US98/13410, поданная 30 июня 1998, патент США №5714338); антитела CD18 (патент США №5622700, выданный 22 апреля 1997, или как в WO 97/26912, опубликованной 31 июля 1997); антитела рецептора антитела Аро-2 (WO 98/51793, опубликованный 19 ноября 1998); антитела тканевого фактора (TF) (Европейский патент №0 420 937 В1, выданный 9 ноября 1994); α4-α7 интегриновые или антитела (WO 98/06248, опубликованный 19 февраля 1998); антитела EGFR (напр., химерное или гуманизированными антитела 225, цетуксимаб, ERBUTIX®, как в WO 96/40210, опубликованном 19 Декабрь 1996); антитела CD3, такие как ОКТЗ (патент США №4515893, выданный 7 мая 1985); антитела CD25 или Тас, такие как CHI-621 (SIMULECT®) и ZENAPAX® (смотри патент США №5693762, выданный 2 декабря 1997); антитела CD4, такие как антитела сМ-7412 (Choy и соавт., Arthritis Rheum 39(1):52-56 (1996)); антитела CD52, такие как САМРАТН-1Н (ILEX/Berlex) (Riechmann и соавт., Nature 332:323-337 (1988)); антитела рецепторов Fc, такие как антитела М22, направленные против Fc(RI, такие как в Graziano и соавт., J. Immunol. 155(10):4996-5002 (1995)); антитела карциноэмбрионального антигена (СБА), такие как hMN-14 (Sharkey и соавт., Cancer Res. 55(23 Suppl): 5935s-5945s (1995)); антитела, направленные против эпителиальных клеток молочной железы, в том числе huBrE-3, hu-Mc 3 и CHL6 (Ceriani и соавт., Cancer Res. 55(23): 5852s-5856s (1995); и Richman и соавт., Cancer Res. 55(23 Supp): 5916s-5920s (1995)); антитела, которые связываются с клетками карциномы толстой кишки, такие как С242 (Litton и соавт., EurJ. Immunol. 26(1): 1-9 (1996)); антитела CD38, напр., AT 13/5 (Ellis и соавт., J. Immunol. 155(2):925-937 (1995)); антитела CD33, такие как Ни Ml95 (Jurcic и соавт., Cancer Res 55(23 Suppl): 5908s-5910s (1995)) и СМА-676 или CDP771; антитела ЕрСАМ, такие как 17-1A (PANOREX®); антитела GpIIb/IIIa, такие как абциксимаб или с7Е3 Fab (REOPRO®); антитела RSV, такие как MEDI-493 (SYNAGIS®); антитела CMV, такие как PROTOVIR®; антитела HIV, такие как PR0542; антитела к гепатиту, такие как антитело к Hep В OSTAVIR®; антитело СА 125 OvaRex; идиотипическое антитело ВЕС2 к антигену GD3; антитело αvβ3 (напр., VITAXIN®; Medimmune); антитело к почечно-клеточному раку человека, такое как ch-G250; ING-1; антитело к клеткам человека 17-1 An (3622W94); колоректальное опухолевое антитело к клеткам человека (А33); антитело к клеткам меланомы человека R24, направленное против ганглиозида GD3; плоскоклеточный рак к клеткам человека (SF-25); антитело лейкоцитарного антигена человека (HLA), такое как Smart ID 10 и анти-HLA натитело DR Oncolym (Lym-1); антитело CD37, такое как TRU 016 (Trubion); антитело IL-21 (Zymogenetics/Novo Nordisk); антитела против В-клетки (Impheron); В-клетка, специфическая к MAb (Immunogen/Aventis); 1D09C3 (Morphosys/GPC); LymphoRad 131 (HGS); антитело Lym-1, такое как Lym-1 Y-90 (USC) или анти-Lym-l Oncolym (USC/Peregrine); LIF 226 (Enhanced Lifesci.); антитело BAFF (напр., WO 03/33658); антитело к рецептору BAFF (смотри, напр., WO 02/24909); BR3 антитело; антитело Blys, такое как белимумаб; LYMPHOSTAT -В™; ISF 154 (UCSD/Roche/Tragen); гомиликсима (Idee 152; Biogen Idee); антитело к рецептору IL-6, такое как атлизумаб (ACTEMRA™; Chugai/Roche); антитело IL-15, такое как HuMax-Il-15 (Genmab/Amgen); антитело к хемокиновому рецептору, такое как антитело CCR2 (напр., MLN1202; Millieneum); антикомплементное антитело, такое как антитело С5 (напр., экулизумаб, 5G1.1; Alexion); пероральный состав иммуноглобулина человека (напр., IgPO; Protein Therapeutics); антитело, IL-12, такое как АВТ-874 (CAT/Abbott); Teneliximab (BMS-224818; BMS); антитела CD40, которые содержат S2C6 и их гуманизированные варианты (WO 00/75348) и TNX 100 (Chiron/Tanox); антитела TNF-α, которые содержат сА2 или инфликсимаб (REMICADE®), CDP571, МАК-195, адалимумаб (HUMIRA™), фрагмент пегилированного антитела TNF-α, такого как CDP-870 (Celltech), D2E7 (Knoll), анти-TNF-α поликлональное антитело (напр., PassTNF; Verigen); антитела CD22, такие как LL2 или эпратузумаб (LYMPHOCIDE®; Immunomedics), которые содержат эпратузумаб Y-90 и эпратзумаб 1-131, антитело CD22 от Abiogen (Abiogen, Italy), CMC 544 (Wyeth/Celltech), комботокс (UT Soutwestern), BL22 (NIH) и LympoScan Tc99 (Immunomedics).
Примеры антител CD20 содержат: "C2B8", который теперь называется "ритуксимаб" ("RITUXAN®") (патент США №5736137); мышиное антитело 2 В8, помеченное иттрий-[90], обозначаемое "Y2B8" или "Ibritumomab Tiuxetan" (ZEVALIN®), коммерчески доступное от IDEC Pharmaceuticals, Inc. (патент США №5736137;. 2В8 хранят с АТСС под добавлении № НВ11388, 22 июня 1993); мышиный IgG2a "В1," также называемый "Tositumomab", необязательно помеченный 131I, для получения "131I-B1" или антитела "йод 1131 тозитумомаб" (Bexxar™), коммерчески доступного от Corixa (см. также патент США №5595721); мышиное моноклональное антитело "1F5" (Press и соавт., Blood 69(2):584-591 (1987)) и их варианты, которые содержат "измененный каркас" или гуманизированный 1F5 (WO 2003/002607, Leung, S.; АТСС комплекс НВ-96450); мышиное антитело 2Н7 и химерное антитело 2Н7 (патент США №5677180); гуманизированное 2Н7 (WO 2004/056312, Lowman и соавт.,); 2F2 (HuMax-CD20), полностью человеческое высокоаффинное антитело, направленное на молекулу CD20 в клеточной мембране В-клеток (Genmab, Дания; смотри, например, Glennie и van de Winkel, Drug Discovery Today 8: 503-510 (2003) и Cragg и соавт., Blood 101: 1045-1052 (2003); WO 2004/035607; US 2004/0167319); человеческие моноклональные антитела, описанные в WO 2004/035607 и US 2004/0167319 (Teeling и соавт.,); антитела, имеющие сложные N-гликозид-связанные сахарные цепи, присоединенные к области Fc, описанные в US 2004/0093621 (Shitara и соавт.); моноклональные антитела и антигенсвязывающие фрагменты, связанные с CD20 (WO 2005/000901, Tedder и соавт.,), такие как НВ20-3, НВ20-4, НВ20-25 и МВ20-11; молекулы, связывающие CD20, такие как серии антител АМЕ, напр., антитела АМЕ 33, как описано в WO 2004/103404 и US 2005/0025764 (Watkins и соавт., Eli Lilly/Applied Molecular Evolution, АМЕ); молекулы, связывающие CD20, такие как описаны в US 2005/0025764 (Watkins и соавт.); А20 антитело или его варианты, такое как химерное или гуманизированное антитело А20 (сА20, hA20, соответственно) или IMMU-106 (US 2003/0219433, Immunomedics); антитела, связывающие CD20, в том числе бес-антигенные Leu-16, 1Н4 или 2 В8, необязательно сопряженные с IL-2, как в US 2005/0069545А1 и WO 2005/16969 (Carr и соавт.,); биспецифическое антитело, которое связывает CD22 и CD20, например, hLL2×hA20 (WO 2005/14618, Chang и соавт.,); моноклональные антитела L27, G28-2, 93-1В3, В-С1 или NU-B2, доступные от International Leukocyte Typing Workshop (Valentine и соавт., In: Leukocyte Typing III (McMichael, Ed., p.440, Oxford University Press (1987)); 1H4 (Haisma и соавт., Blood 92:184 (1998)); анти-СD20 конъюгат ауристатина Е (Seattle Genetics); анти-CD20-IL2 (EMD/Biovation/City of Hope); анти-CD20 терапия MAb (EpiCyte); анти-СD20 антитело TRU015 (Trubion).
Термин "моноклональное антитело", используемый в данном документе, относится к антителу, полученному из популяции по существу гомогенных антител, напр., индивидуальные антитела, содержащие популяцию, являются идентичными за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высоко специфичными, направленными против одного иммунодоминантного сайта. Кроме того, в отличие от обычных (поликлональных) препаратов антител, которые обычно содержат различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты антигена. Определение "моноклональное" указывает на характер антитела, полученного из, по существу, гомогенной популяции антител, и не должно быть истолковано как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, которые будут использоваться в соответствии с настоящим изобретением, могут быть изготовлены гибридомным способом, впервые описанным Kohler и соавт., Nature 256:495 (1975), или могут быть получены способами рекомбинантных ДНК (см., напр., патент США №4816567). В дополнительном варианте, "моноклональные антитела" могут быть выделены из фаговых библиотек антител, полученных с использованием способов, описанных в McCafferty и соавт., Nature, 348:552-554 (1990). Clackson и соавт., Nature, 352:624-628 (1991) и Marks и соавт., J. Mol. Biol, 222:581-597 (1991) описывают выделение мышиных и человеческих антител, соответственно, с использованием фаговых библиотек. В последующих публикациях описано производство с высоким сродством (диапазон нМ) человеческого антитела по перестановки цепей (Marks и соавт., Bio/Technology, 10:779-783 (1992)), а также комбинаторной инфекции и in vivo рекомбинации в качестве стратегии конструирования очень больших фаговых библиотек (Waterhouse и соавт., Nuc. Acids. Res., 21:2265-2266 (1993)). Таким образом, эти способы являются приемлемой альтернативой традиционным гибридомным способам для выделения моноклональных антител. Кроме того, в настоящее время возможно получать трансгенных животных (напр., мыши), которые способны после иммунизации продуцировать полный репертуар антител человека при отсутствии продуцирования эндогенных иммуноглобулинов. Например, было описано, что гомозиготная делеция тяжелой цепи антитела области присоединения (JH) гена у химерных и мутантных по зародышевой линии мышей приводит к полному ингибированию продуцирования эндогенного антитела. Передача ряда генов иммуноглобулина зародышевой линии человека зародышевой линии таких мутантных мышей приведет к производству человеческого антитела при антигенной стимуляции. Смотри, напр., Jakobovits и соавт., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits и соавт., Nature, 362:255-258 (1993); Bruggermann и соавт., Year in Immuno., 7:33 (1993); и Duchosal и соавт., Nature 355:258 (1992).
Моноклональные антитела в данном документе специально содержат "химерные" антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из отдельных видов или принадлежащих к конкретному классу или подклассу антител, в то время как остальная часть цепи (цепей) идентична или гомологична соответствующим последовательностям в антителах, полученных из другого вида или принадлежащих к другому классу или подклассу антител, а также фрагментам таких антител, при условии, что они проявляют желаемую биологическую активность (патент США №4816567; и Morrison и соавт., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)).
Термин "гипервариабельная область" при использовании в данном документе относится к аминокислотным остаткам антитела, которые ответственны за связывание антигена. Гипервариабельная область содержит аминокислотные остатки из "области, определяющей комплементарность" или "CDR" (напр., остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (H1), 50-65 (Н2) и 95-102 (Н3) в тяжелой цепи вариабельного домена; Kabat и соавт., Sequences of Polypeptides of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)) и/или остатки из "гипервариабельной петли" (напр., остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в легкой цепи вариабельного домена и 26-32 (H1), 53-55 (Н2) и 96-101 (Н3) в тяжелой цепи вариабельного домена; Chothia и Lesk J. Mol. Biol. 196:901-917 (1987)). "Каркас" или остатки "FR", как определено здесь, представляют собой остатки гипервариабельной области, отличные от остатков вариабельного домена.
"Гуманизированные" формы не принадлежащих к человеческому роду (напр., мышиные) антител представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из иммуноглобулина, не принадлежащего к человеческому роду. По большей части, гуманизированные антитела представляют собой иммуноглобулины человека (антитело реципиента), в которых остатки из гипервариабельной области реципиента заменены остатками из гипервариабельной области, не относящихся к человеку видов (антитело донора), таких как мышь, крыса, кролик или примат, имеющих желаемую специфичность, аффинность и способность. В некоторых случаях остатки области каркаса Fv (FR) иммуноглобулина человека заменены соответствующими остатками, не принадлежащими к человеческому роду. Кроме того, гуманизированные антитела могут содержать остатки, которые не встречаются в антителе реципиента или в антителе донора. Эти изменения сделаны для улучшения производительности антител в дальнейшем. В общем, гуманизированное антитело содержит по существу все из по меньшей мере одного, а обычно двух вариабельных доменов, в которых все, или по существу все, гипервариабельные петли соответствуют таковым из иммуноглобулина, не принадлежащего к человеческому роду, и всем, или по существу всем, областям FR из последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также содержит, по меньшей мере часть константной области иммуноглобулина (Fc), обычно, человеческого иммуноглобулина.
Выбор вариабельных доменов человека как легкого, так и тяжелого, которые используют для получения гуманизированных антител, очень важен для снижения антигенности. В соответствии со способом так называемого "максимального соответствия", осуществляют скрининг последовательности вариабельного домена антитела грызуна по всей библиотеке известных последовательностей вариабельных доменов человека. Последовательность человека, которая является наиболее близкой последовательности грызуна, в случае гуманизированного антитела затем, принимается как человеческий каркас (FR) (Sims и соавт., J. Immunol, 151:2296 (1993); Chothia и соавт., J. Mol Biol, 196:901 (1987)).
Другой способ использует определенный каркас, полученный из консенсусной последовательности всех антител человека конкретной подгруппы легких или тяжелых цепей. И тот же каркас можно использовать для нескольких различных гуманизированных антител (Carter и соавт., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); Presta и соавт., J. Immnol, 151:2623 (1993)).
Кроме того, важно, чтобы антитела были гуманизированы с сохранением высокой аффинности по отношению к антигену и другим благоприятным биологическим свойствам. Для достижения этой цели, в соответствии с предпочтительным способом, гуманизированные антитела получают с помощью процесса анализа исходных последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов являются доступными и известны специалистам в данной области. Доступны компьютерные программы, которые иллюстрируют и отображают возможные трехмерные конформационные структуры выбранных потенциальных последовательностей иммуноглобулина. Исследование этих изображений позволяет проанализировать вероятную роль остатков в функционировании потенциальных последовательностей иммуноглобулина, напр., анализ остатков, которые влияют на способность потенциального иммуноглобулина связываться с его антигеном. Таким образом, остатки FR могут быть выбраны и объединены с реципиентом и вводимыми последовательностями таким образом, чтобы достигнуть требуемую характеристику антитела, такую как повышенная аффинность по отношению к антигену-мишени(ям). В общем, на связывание антигена остатки CDR влияют непосредственно и в наибольшей степени.
"Фрагменты антитела" содержат часть полноразмерного антитела, как правило, их область связывания антигена или вариабельную область. Примеры фрагментов антител содержат фрагменты Fab, Fab', F(ab')2 и Fv; диатела; линейные антитела; молекулы одноцепочечных антител; и мультиспецифические антитела, образованные из фрагментов антител. Для получения фрагментов антител были разработаны различные способы. Традиционно эти фрагменты получали путем протеолитического расщепления интактных антител (смотри, напр., Morimoto и соавт., Journal of Biochemical and Biophysical Methods 24:107-117 (1992) и Brennan и соавт., Science, 229:81 (1985)). Однако эти фрагменты могут быть получены непосредственно с помощью рекомбинантных клеток-хозяев. Например, фрагменты антител могут быть выделены из фаговых библиотек антител, обсуждаемых выше. Альтернативно, фрагменты Fab'-SH могут быть выделены непосредственно из Е. coli и химически связаны с образованием фрагментов F(ab')2 (Carter и соавт., Bio/Technology 10:163-167 (1992)). В другом варианте реализации настоящего изобретения F(ab')2 формируется с помощью лейциновой застежки GCN4 для содействия сборке молекулы F(ab')2. Согласно другому подходу, фрагменты F(ab')2 могут быть выделены непосредственно из культуры рекомбинантных