Бивалентные ингибиторы ингибиторов белков апоптоза и терапевтические способы их применения
Иллюстрации
Показать всеИзобретение относится к соединениям структуры
, а также к их фармацевтически приемлемым солям. Технический результат: получены новые соединения, являющиеся ингибиторами IAP-белков, а также фармацевтические композиции на их основе, пригодные для лечения заболеваний и состояний, при которых ингибирование IAP-белков обеспечивает положительный эффект, таких, как рак. 3 н. и 11 з.п. ф-лы, 1 ил., 1 табл., 50 пр.
Реферат
Правительственное финансирование
Данное изобретение было выполнено при государственной финансовой поддержке грантов СА 127551 и СА 109025, предоставленных Национальным институтом здравоохранения. Государство имеет определенные права на данное изобретение.
Область техники
Настоящее изобретение относится к бивалентным ингибиторам белков-ингибиторов апоптоза (IAP) и к терапевтическим способам лечения состояний и заболеваний, при которых ингибирование IAP-белков оказывает положительное действие. Ингибиторы согласно настоящему изобретению связываются с очень высокой аффинностью с IAP-белками, включающими cIAP1, cIAP2, и XIAP, запуская апоптоз линии опухолевых клеток человека и усиливая противоопухолевую активность других противоопухолевых лекарственных препаратов.
Уровень техники изобретения
Апоптоз или программируемая клеточная гибель представляет собой клеточный процесс крайне важный для гомеостаза, нормального развития, иммунной защиты организма и подавления онкогенеза. Нарушение регуляции апоптоза приводит к различным заболеваниям у людей, 1 включая рак, 1,3 и на сегодняшний день признается, что резистентность к апоптозу является отличительным признаком рака. Следовательно, воздействие на ключевые регуляторы апоптоза представляет собой перспективную стратегию в разработке новых подходов к лечению рака у человека.1
Большинство нынешних способов лечения рака, включая химиопрепараты, радиационные способы и иммунотерапию, опосредованно запускают апоптоз раковых клеток. Неспособность раковых клеток исполнять апоптическую программу из-за поврежденности нормального апоптического механизма, таким образом, часто связано с повышением резистентности к вызывающим апоптоз химиотерапии, радиационным способам лечения или иммунотерапии. Данная первичная или приобретенная резистентность рака человека к существующей терапии вследствие повреждения механизма апоптоза является основной проблемой используемых в настоящее время способов лечения рака.
С целью повышения выживаемости и улучшения качества жизни больных раком, настоящие и последующие усилия по разработке и созданию новых молекулярных препаратов и способов лечения направленного (или таргетного) действия включают разработку таких подходов, основное действие которых нацелено на резистентность раковых клеток к апоптозу. В связи с этим, воздействие на негативные регуляторы, которые играют центральную роль в прямом ингибировании апоптоза в раковых клетках, представляет собой очень перспективную стратегию в разработке новых противораковых препаратов.
Одним из классов основных негативных регуляторов апоптоза являются белки-ингибиторы апоптоза (IAP). Данный класс содержит такие белки, как XIAP, cIAP1, cIAP2, ML-IAP, HIAP, KIAP, TSIAP, NAIP, survivin (сурвивин), livin (ливин), ILP-2, apollon, и BRUCE. IAP-белки эффективно подавляют апоптоз раковой клетки, индуцируемый различными стимуляторами апоптоза, включая химиотерапевтические агенты, радиацию и иммунотерапию.
Хотя роль данных белков не ограничивается только регуляцией апоптоза,7,8 IAP-белки являются классом ключевых регуляторов апоптоза и характеризуются присутствием одного или нескольких BIR (Baculoviral IAP Repeat) доменов.5-6 Среди IAP-белков, клеточные IAP1 (cIAP1) и cIAP2 играют ключевую роль в регуляции апоптоза, опосредованного рецепторами-смерти, тогда как связанный с X-хромосомой IAP (XIAP) ингибирует как апоптоз, опосредуемый рецепторами-смерти, так и апоптоз, опосредуемый митохондриями, за счет связывания и ингибирования каспазы-3/7 и каспазы-9, трех цистеиновых протеаз, критически важных при реализации механизма апоптоза.5 Данные IAP-белки в высокой степени сверхэкспрессируются как в линии раковых клеток, так и опухолевых тканях человека, и имеют низкую экспрессию в нормальных клетках и тканях.9 Обширные исследования продемонстрировали, что сверхэкспрессия IAP-белков делает раковые клетки резистентными к индукции апоптоза посредством разнообразных противоопухолевых лекарственных препаратов.10-12 Подробное описание IAP-белков и их роли в развитии рака и механизме апоптоза изложены в патенте США No. 7960372, включенного в настоящий документ в качестве ссылки. Таким образом, направленное воздействие на один или несколько IAP-белков является перспективной терапевтической стратегией в лечении рака у человека.10-12
Исследования показали, что ингибиторы на основе пептидов являются полезным инструментом для изучения анти-апоптической функции IAP-белков и их роли в формировании ответа раковых клеток на воздействие химиотерапевтических агентов. Вместе с тем, ингибиторы на основе пептидов имеют внутренние ограничения для использования их в качестве лекарственных препаратов, включая низкую клеточную проницаемость и низкую стабильность in vivo. Согласно опубликованным данным исследований, использовавших Smac-ингибиторы на основе пептидов, пептиды должны сшиваться с пептидами-переносчиками для того, чтобы они обладали относительной клеточной проницаемостью.
Известны также низкомолекулярные ингибиторы IAP-белков. Например, в опубликованной патентной заявке США No. 2005/0197403 и патенте США No. 7960372 заявлены димерные Smac-миметические соединения, каждый из документов включен в настоящую заявку в виде ссылки в полном объеме.
Несмотря на открытие низкомолекулярных ингибиторов IAP-белков, разработка эффективных непептидных ингибиторов IAP-белков остается серьезной задачей в современном поиске новых лекарственных средств. Соответственно, в данной области техники по-прежнему существует необходимость в разработке ингибиторов IAP-белков, имеющих физические и фармакологические свойства, позволяющие использовать данные ингибиторы в терапевтических целях. В настоящем изобретении предложены соединения, предназначенные для связывания IAP-белков и ингибирования активности IAP-белков.
Сущность изобретения
Общепризнанным является тот факт, что неспособность раковых клеток или поддерживающих их клеток подвергаться апоптозу в ответ на генетические изменения или воздействие индукторов апоптоза (таких, например, как химиотерапевтические агенты или радиация) представляет собой главный фактор возникновения и развития рака. Индукция апоптоза в раковых клетках или в поддерживающих их клетках (например, неоваскулярные клетки в сосудистой опухоли) рассматривается как универсальный механизм действия для практически всех эффективных лекарственных препаратов раковых заболеваний и радиационной терапии, применяемых сегодня. Одной из причин неспособности клеток подвергаться апоптозу является повышенная экспрессия и накопление IAP-белков. Настоящее изобретение относится к ингибиторам IAP-белков, смесям, содержащим данные ингибиторы, и способам использования ингибиторов в терапевтическом лечении состояний и заболеваний, при которых ингибирование активности IAP-белков обеспечивает положительный эффект. Соединения согласно настоящему изобретению являются эффективными ингибиторами активности IAP-белков, и индуцируют апоптоз раковых клеток.
Краткое описание графических материалов
Фигура 1 представляет график зависимости среднего объема опухоли (мм3) от количества дней после имплантации, демонстрируя противоопухолевую активность образцов 2 и 24 в MDA-MB-231 ксенографтной модели у безтимусных мышей.
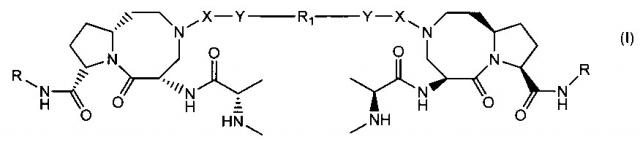
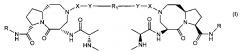
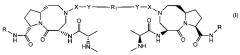
В частности изобретение относится к соединениям, имеющим структурную формулу (I):
где X выбирается из группы, состоящей из и -SO2-;
Y выбирается из группы, состоящей из -NH-, -O-, -S-, или отсутствует;
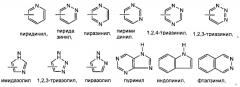
R выбирается из группы, состоящей из , , при этом кольцо А является С4-8 алифатическим кольцом, , и , при этом кольцо В является арильным или азот-содержащим гетероарильным, также В кольца являются необязательно замещенными; и R1 представляет собой группу, состоящую из -(CH2)4-10-, , , , , , где Z является О, S, или NH, и , при этом n равно 0, 1 или 2, и при этом кольцо В является арильным или азот-содержащим гетероарильным, также кольца являются необязательно замещенными;
или его фармацевтически приемлемая соль, гидрат, сольват или пролекарство.
В конкретном исполнении, настоящее изобретение предлагает соединения, которые ингибируют активность IAP-белков и повышают чувствительность клеток к индукторам апоптоза, таким, как например, химиотерапевтические средства или радиационная терапия.
В другом конкретном исполнении, соединения согласно изобретению используются в способах индуцирования апоптоза в клетках и повышения чувствительности клеток к индукторам апоптоза.
В еще одном конкретном исполнении, настоящее изобретение обеспечивает способ лечения состояния или заболевания путем введения терапевтически эффективного количества соединения со структурной формулой (I) нуждающемуся в этом субъекту. Представляющими интерес заболевания или состояния являются заболевания или состояния, поддающиеся лечению за счет ингибирования IAP-белков, к примеру, рак. Соединения согласно настоящему изобретению, следовательно, находят себе применение для лечения или уменьшения интенсивности нарушений, ответственных за индукцию смерти апоптических клеток, например, нарушения, характеризующиеся дисрегуляцией апоптоза, включая гиперпролиферативные заболевания, такие, как рак. В конкретных исполнениях, данные соединения могут использоваться для лечения или уменьшения интенсивности рака, который характеризуется резистентностью к терапии рака (например, хемостойкий, устойчивый к радиационному облучению, гормонорезистентный и т.п.). В других конкретных исполнениях соединения согласно настоящему изобретению могут использоваться для лечения гиперпролиферативных заболеваний, характеризующиеся сверхэкспрессией IAP-белков.
В другом конкретном исполнении настоящего изобретения представлена смесь, содержащая (а) ингибитор IAP-белка со структурной формулой (I) и (b) эксцепиент и/или фармацевтически приемлемый носитель, пригодный для лечения заболеваний или состояний, при которых ингибирование IAP-белков обеспечивает положительный эффект.
В другом конкретном осуществлении настоящего изобретения используется композиция, содержащая соединение со структурной формулой (I) и второй терапевтически активный агент, в способе лечения индивидуума от заболевания или состояния, при которых IAP-белков обеспечивает положительный эффект.
В другом конкретном исполнении, настоящее изобретение предусматривает возможность использования смеси, содержащей ингибитор IAP-белка со структурной формулой (I) и, опционально, второй терапевтический агент для производства медикаментов для лечения представляющих интерес заболеваний или состояний, например, рака.
Еще одно конкретное исполнение настоящего изобретения представляет набор фармацевтического назначения для человека, содержащий (а) контейнер, (b1) упакованную смесь, содержащую ингибитор IAP-белка со структурной формулой (I), и, опционально, (b2) упакованную смесь, содержащую второй терапевтический агент, используемый для лечения представляющих интерес заболеваний или состояний, и (с) листовку-вкладыш, содержащую инструкцию по применению смеси или смесей, вводимых одновременно или последовательно, для лечения заболевания или состояния.
Ингибитор IAP-белка со структурной формулой (I) и второй терапевтический агент могут вводиться вместе, как единичная стандартная доза или раздельно, как многократная стандартная доза, при этом ингибитор IAP-белка со структурной формулой (I) вводится прежде второго терапевтического агента или наоборот. Предусматривается, что может быть введена одна или несколько доз ингибитора IAP-белка со структурной формулой (I) и/или одна или несколько доз второго терапевтического агента.
В одном конкретном исполнении ингибитор IAP-белка со структурной формулой (I) и второй терапевтический агент вводятся одновременно. В близких вариантах исполнения, ингибитор IAP-белка со структурной формулой (I) и второй терапевтический агент вводятся в составе единой смеси или раздельными смесями. В других исполнениях, ингибитор IAP-белка со структурной формулой (I) и второй терапевтический агент вводятся последовательно один за другим. Ингибитор IAP-белка со структурной формулой (I), при использовании согласно настоящему изобретению, может вводиться в количестве приблизительно от 0,005 до приблизительно 500 миллиграммов в расчете на одну дозу, приблизительно от 0,05 до приблизительно 250 миллиграммов в расчете на одну дозу, или приблизительно от 0,5 до приблизительно 100 миллиграммов в расчете на одну дозу.
Подробное описание предпочтительных вариантов осуществления изобретения
Настоящее изобретение описывается вместе с предпочтительными вариантами осуществления изобретения. Тем не менее, следует учитывать, что настоящее изобретение не ограничивается объявленными вариантами осуществления. Следует понимать, что рассматриваемое описание осуществлений изобретения, раскрываемого в настоящем документе, предполагает различные модификации, которые могут быть выполнены специалистами в данной области техники. Такие модификации включаются в объем приводимой ниже формулы изобретения.
Smac/DIABLO (вторичный митохондриальный активатор каспазы или прямой IAP-связывающий белок с низким pI) представляет собой белок, высвобождающийся в митохондриях в ответ на апоптический стимул и функционирующий в качестве эндогенного ингибитора cIAP1, cIAP2 и XIAP.14,15 Взаимодействие между Smac и IAP-белками опосредуется N-терминальным фрагментом AVPI тетрапептида в Smac и одним или несколькими BIR-доменами в данных IAP-белках.16,17 Smac представляет собой гомодимер, который связывается и с BIR2, и с BIR3-доменами в XIAP и является антагонистом ингибирования XIAP каспазами-3/-7 и каспазой-9.18 Для сравнения, Smac связывается только с BIR3-доменом в cIAP1 и cIAP219 и индуцирует быстрое разрушение белка в клетке.20 За счет использования двух различных механизмов, Smac представляет собой более эффективный антагонист для данных трех IAP-белков.
Кристаллографические и ЯМР исследования структур XIAP BIR3, связанных с белком Smac или пептидом Smac, показывают, что фрагмент AVPI тетрапептида в Smac соединяется с хорошо различимой бороздой на поверхности XIAP и данное взаимодействие представляется перспективным для создания низкомолекулярных ингибиторов XIAP.16-18 Посредством использования AVPI тетрапептида в качестве основной структуры, было разработано несколько классов низкомолекулярных Smac-миметиков, выполняющих роль антагонистов XIAP и cIAP1/2.21-38 Разработано два типа Smac-миметиков.21-23 Первый тип, выполненный с возможностью имитировать одиночный связывающий фрагмент AVPI, называется моновалентным Smac-миметиком.21-23 Второй тип, бивалентный Smac-миметик, состоит из двух AVPI миметиков, связанных посредством мостика, и имитирует димерную форму Smac-белков.21-23
Одним из преимуществ моновалентных Smac-миметиков в качестве потенциальных лекарственных препаратов является их биодоступность при пероральном введении препарата, но недостатком является их незначительная эффективность в качестве антагониста по всей длине XIAP согласно функциональным биологическим испытаниям. Основным преимуществом бивалентных Smac-миметиков является то, что они представляют собой значительно более эффективные антагонисты XIAP по сравнению с моновалентными Smac-миметиками за счет одновременного воздействия и на BIR2, и на BIR3 домены в XIAP. 30 Бивалентные Smac-миметики, как правило, на 2-3 порядка более эффективны по сравнению с их моновалентными аналогами Smac-миметков в индукции апоптоза в раковых клетках. На настоящий момент, три моновалентных и два бивалентных Smac-миметкиа успешно прошли клинические испытания в отношении лечения рака у человека.21
Вследствие того, что бивалентные Smac-миметики значительно эффективнее, чем моновалентные Smac-миметики в таргетировании XIAP и cIAP1/2, в индукции апоптоза раковых клеток in vitro и in vivo и в ингибировании роста опухоли, бивалентные соединения настоящего изобретения были разработаны для применения лечения рака и лечения других заболеваний и состояний, опосредованных активностью IAP-белка.
Термин "IAP-белки" в контексте настоящего изобретения относится к любым известным представителям семейства ингибиторов белков апоптоза, включая, но не ограничиваясь: XIAP, cIAP-1, cIAP-2, ML-IAP, HIAP, TSIAP, KIAP, NAIP, survivin, livin, ILP-2, apollon, и BRUCE.
Термин «сверхэкпрессия IAP-белков" в контексте настоящего изобретения относится к повышенному уровню (например, абберантный уровень) м-РНК, кодирующей IAP-белок(ки), и/или к повышенным уровням IAP-белка(ов) в клетках по сравнению с соответствующими аналогичными непатологическими клетками, представляющих базовый уровень м-РНК, кодирующих IAP-белки и имеющих базовый уровень IAP-белков. Способы определения уровня м-РНК, кодирующей IAP-белки, или уровня IAP-белков в клетке включают, но не ограничиваются: вестерн-блоттинг с использованием антител к IAP-белкам, иммуногистохимические способы, и способы амплификации нуклеиновой кислоты или прямое определение РНК. Не менее важен, чем абсолютный уровень IAP-белков в клетках, устанавливающий, что клетки сверхэксперссируют IAP-белки, также и относительный уровень IAP-белков по отношению к прочим про-апоптозным сигнальным молекулам (например, про-апоптозные белки семейства Bcl-2) внутри данной клетки. Если баланс двух данных факторов таков, что, если бы не данные уровни IAP-белков, уровень про-апоптозных сигнальных молекул был бы достаточен, чтобы заставить клетку запустить программу апоптоза и погибнуть, то IAP-белки будут оказывать воздействие на выживаемость указанных клеток. В таких клетках воздействие ингибирующего эффективного количества ингибитора IAP-белка будет достаточно для того, чтобы заставить клетку запустить программу апоптоза и погибнуть. Таким образом, термин «сверхэксперссия IAP-белка" также относится к клеткам, которые благодаря относительным уровням про-апоптозных сигналов и анти-апоптозных сигналов, подвергаются апоптозу в ответ на ингибирующее эффективное количество соединений, которые ингибируют функцию IAP-белков.
Термин «заболевание или состояние, при котором ингибирование IAP-белков обеспечивает положительный эффект» относится к состоянию, при котором IAP-белок и/или действие IAP-белка, является важным или необходимым, например, для возникновения, прогрессирования, выраженности данного заболевания или состояния, или же заболевание или состояние, насколько известно, лечатся посредством ингибиторов IAP-белка. Пример такого состояния включает, но не ограничивается раком. Специалист в данной области техники с легкостью сможет установить, оказывает ли соединение лечебный эффект на заболевание или состояние, опосредованное IAP-белком для данного типа клеток, например, посредством биологических испытаний, которые приемлемы для использования с целью оценки активности конкретных соединений.
Термин «второй терапевтический агент» относится к терапевтическому агенту, который отличается от ингибитора IAP-белка со структурной формулой (I) и который, как известно, оказывает воздействие на представляющее интерес заболевание или состояние. Например, если интересующее заболевание является раком, то второй терапевтический агент может быть известным химиотерапевтическим лекарственным препаратом, таким как таксол, или, например, радиацией.
Термин «заболевание» или «состояние» означает нарушение и/или отклонение от нормы, которое, как правило, считается патологическим состоянием или функцией, и которое может проявляться в форме конкретного признака, симптома и/или дисфункции. Как будет показано дальше, соединение со структурной формулой (I) является эффективным ингибитором IAP-белков и может использоваться для лечения заболеваний и состояний, при которых ингибирование IAP-белков обеспечивает положительный эффект.
В контексте настоящего изобретения термины «лечить», «оказывать лечебное воздействие», «лечение» и тому подобные относятся к подавлению, ослаблению или облегчению заболевания или состояния и/или симптомов, связанных с ними. Не требуется, хотя и не исключается, что при лечении заболевания или состояния, данное заболевание, состояние или связанные с ними симптомы были полностью подавлены. В контексте настоящего изобретения термины «лечить», «оказывать лечебное воздействие», «лечение» и тому подобные могут включать «профилактическое лечение», которое относится к снижению вероятности повторного появления заболевания или состояния, или рецидива ранее контролируемого заболевания или состояния у субъектов, которые не имеют заболевания или состояния, но находятся в группе риска или предрасположены к повторному появлению заболевания или состояния или рецидиву заболевания или состояния. Термин «лечить» или его синонимы предполагают введение терапевтически эффективного количества соединения согласно настоящему изобретению индивидууму, для которого имеются показания для данного лечения.
В понимании настоящего изобретения «лечение» также включает повторение профилактики или фазы профилактики наряду с лечением острых или хронических признаков, симптомов и/или дисфункций. Может быть выбрано симптоматическое лечение, например, направленное на подавление симптомов. Лечение может быть эффективно в краткосрочном периоде, может быть ориентировано на среднесрочный период и может быть долгосрочным лечением, например, в рамках поддерживающего лечения.
Термины «сенсибилизировать (повышать чувствительность)» или «сензибилизирующий (повышающий чувствительность)» в контексте настоящего изобретения относятся к формированию благодаря введению первого агента (например, соединения со структурной формулой I) у животного организма или у клетки внутри животного организма большей восприимчивости или отзывчивости к биологическому действию (например, активизация или задержка различных аспектов клеточного функционирования, включая, но не ограничиваясь делением клетки, ростом клетки, пролиферацией, инвазией, регенерацией или апоптозом) второго агента. Эффект сенсибилизации первого агента на таргетную клетку может измеряться как различие предполагаемого биологического эффекта (например, активизация или задержка различных аспектов клеточного функционирования, включая, но не ограничиваясь делением клетки, ростом клетки, пролиферацией, инвазией, регенерацией или апоптозом), наблюдаемого после введения второго агента при введении или отсутствии введения первого агента. Чувствительность сенсибилизированной клетки может возрастать, как минимум, на 10%, как минимум, на 20%, как минимум, на 30%, как минимум, на 40%, как минимум, на 50%, как минимум, на 60%, как минимум, на 70%, как минимум, на 80%, как минимум, на 90%, как минимум, на 100%, как минимум, на 150%, как минимум, на 200%, как минимум, на 250%, как минимум, на 300%, как минимум, на 350%, как минимум, на 400%, как минимум, на 450%, или как минимум, на 500% по сравнению с чувствительностью при отсутствии первого агента.
Термин «гиперпролиферативное заболевание» в контексте настоящего изобретения относится к любому состоянию, при котором локализованная популяция пролиферативных клеток в животном организме не подчиняется обычным регуляторам нормального роста. Примеры гиперпролиферативных заболеваний включают, но не ограничиваются опухолями, новообразованиями, лимфомами и тому подобным. Новообразование считается доброкачественным, если оно не осуществляет инвазию или метастазирование, и считается злокачественным, если осуществляет одно из этих действий. «Метастатическая» клетка означает, что клетка способна вторгаться и разрушать соседние соматические структуры. Гиперплазия является формой клеточной пролиферации, включающей рост количества клеток в ткани или органе без существенного изменения структуры и функциональности. Метаплазия является формой контролируемого клеточного роста, при котором дифференцированные клетки одного типа замещаются дифференцированными клетками другого типа.
Патологическое увеличение активированных лимфоцитов часто приводит к аутоиммунным расстройствам или к хроническим воспалительным состояниям. В контексте настоящего изобретения термин «аутоиммунные расстройства» относится к любому состоянию, при котором организм вырабатывает антитела или иммуноциты, которые распознают молекулы, клетки или ткани собственного организма. Неограничивающие примеры аутоиммунных заболеваний включают аутоиммунную гемолитическую анемию, аутоиммунный гепатит, болезнь Бергера или первичную нефропатию lgA-типа, спру-целиакию, синдром хронической усталости, болезнь Крона, дерматомиозит, фибромиалгию, болезнь «трансплантат против хозяина», базедову болезнь, тиреоидит Хашимото, идиопатическую тромбоцитопеническую пурпуру, красный плоский лишай, рассеянный склероз, тяжелую псевдопаралитическую миастению, псориаз, острую ревматическую лихорадку, ревматоидный артрит, склеродермию, синдром Шегрена, системную красную волчанку, сахарный диабет первого типа, неспецифический язвенный колит, витилиго и тому подобное.
Термин «неопластическое заболевание (новообразование)» в контексте настоящего изобретения относится к любому абнормальному росту клеток, который является доброкачественным (не раковым) или злокачественным (раковым).
Термин «противоопухолевый агент» в контексте настоящего изобретения относится к любому соединению, которое замедляет пролиферацию, рост или распространение таргетного (например, злокачественного) новообразования.
Термин «апоптоз-регулирующие агенты» в контексте настоящего изобретения относится к агентам, которые вовлечены в регуляцию (например, ингибирование, снижение, возрастание, промотирование) апоптоза. Примеры апоптоз-регулирующих агентов включают белки, которые содержат домены смерти, такие как, без ограничений, Fas/CD95, TRAMP, TNF RI, DR1, DR2, DR3, DR4, DR5, DR6, FADD, и RIP. Другие примеры апоптоз-регулирующих агентов включают, но не ограничиваются: TNFα, Fas лиганд, антитела к Fas/CD95 и другие рецепторы семейства TNF, TRAIL (также известный как Аро2 лиганд или Apo2L/TRAIL), агонисты (например, моноклональные или поликлональные антитела-агонисты) TRAIL-R1 или TRAIL-R2, Bcl-2, р53, ΒΑΧ, BAD, Akt, CAD, PI3 киназы, PP1, и белки каспазы. Регулирующие агенты в широком смысле включают агонисты или антагонисты рецепторов семейства TNF и лигандов TNF семейства. Апоптоз-регулирующие агенты могут быть растворимыми или мембраносвязанными (например, лиганд или рецептор). Предпочтительные апоптоз-регулирующие агенты являются индукторами апоптоза, например, TNF и TNF-связанный лиганд, в частности, TRAMP лиганд, Fas/CD95 лиганд, TNFR-1 лиганд или TRAIL.
Термин «дисрегуляция или нарушение апоптоза» в контексте настоящего изобретения относится к любым нарушениям способности (например, предрасположенности) клетки подвергаться клеточной смерти посредством апоптоза. Нарушение апоптоза связано с различными состояниями или вызывается различными состояниями, включая, например, аутоиммунные заболевания (к примеру, системная красная волчанка, ревматоидный артрит, болезнь «трансплантат против хозяина», тяжелая псевдопаралитическая миастения или синдром Шегрена), хронические воспалительные состояния (к примеру, псориаз, астма или болезнь Крона), гиперпролиферативные нарушения (к примеру, опухоли, Т-клеточная лимфома, или В-клеточная лимфома), вирусные инфекции (к примеру, герпес, папиллома или HIV), и другие состояния, такие как остеоартрит и атеросклероз. Следует отметить, что, если дисрегуляция индуцирована или связана с вирусной инфекцией, то вирусная инфекция может или не может быть обнаружена во время возникновения дисрегуляции или ее наблюдения. Иными словами, дисрегуляция, вызванная вирусной инфекции, может случиться даже после исчезновения симптомов вирусной инфекций.
Термин «терапевтически эффективное количество» или «эффективная доза» в контексте настоящего изобретения относится к количеству активного(ных) ингредиента(ов), которое достаточно, при условии его введения согласно способу настоящего изобретения, чтобы эффективно доставить активный(ные) ингредиент(ы) для лечения интересующего состояния или заболевания индивидууму, который в этом нуждается. В случае рака или других пролиферативных нарушений терапевтически эффективное количество агента может понижать (например, замедлять в некоторой степени и предпочтительно останавливать) нежелательную клеточную пролиферацию; уменьшать количество раковых клеток; уменьшать размер опухоли; ингибировать (к примеру, замедлять в некоторой степени и предпочтительно останавливать) инфильтрацию раковых клеток в периферические органы; ингибировать (к примеру, замедлять в некоторой степени и предпочтительно останавливать) метастазирование опухоли; ингибировать до некоторой степени рост опухоли; снижать активацию сигнала IAP-белка в таргетных клетках; увеличивать время жизни; и/или облегчать до некоторой степени один или несколько симптомов, связанных с раком, на, как минимум, 5%, предпочтительно, не менее 10%, не менее 15%, не менее 20%, не менее 25%, не менее 30%, не менее 35%, не менее 40%, не менее 45%, не менее 50%, не менее 55%, не менее 60%, не менее 65%, не менее 70%, не менее 75%, не менее 80%, не менее 85%, не менее 90%, не менее 95%, или 100%. Для того, чтобы объем вводимого соединения или смеси предотвращал рост и/или вызывал гибель существующих раковых клеток, возможно использование цитостатиков или цитотоксических препаратов.
Термин «контейнер» означает любую емкость и закупоривающую крышку к ней, пригодные для хранения, доставки, дозирования и/или обращения с фармацевтическим продуктом.
Термин «листовка-вкладыш» означает информацию, прилагаемую к фармацевтическому продукту и предоставляющую описание того, как вводить продукт, также наряду с данными о безопасности и эффективности, необходимыми, чтобы дать возможность врачу, фармацевту или пациенту принять информированное решение относительно использования данного продукта. Инструкция по применению препарата, как правило, рассматривается в качестве идентификатора или этикетки фармацевтического продукта.
«Совместное введение», «введение в сочетании», «одновременное введение» и подобные фразы означают, что два или более агентов вводятся совместно субъекту, получающему лечение. Определение «совместно» означает, что каждый агент вводится либо в один момент времени, либо последовательно в любом порядке в разные моменты времени. Если же введение не одновременное, это означает, что агенты вводятся субъекту последовательно и достаточно близко по времени, с тем, чтобы обеспечить желаемый терапевтический эффект и возможность действовать сообща. Например, ингибитор IAP-белка со структурной формулой (I) может быть введен одновременно или последовательно в любом порядке в разные моменты времени со вторым терапевтическим агентом. Ингибитор IAP-белка согласно настоящему изобретению и второй терапевтический агент могут вводиться раздельно, в любом приемлемом виде или любым пригодным способом. Если ингибитор IAP-белка согласно настоящему изобретению и второй терапевтический агент не вводятся совместно, следует понимать, что они могут вводиться в любой последовательности субъекту, нуждающемуся в этом. К примеру, ингибитор IAP-белка согласно настоящему изобретению может вводиться до (например, за 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часа, 48 часов, 72 часа, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель или за 12 недель прежде), одновременно, или после (например, через 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часа, 48 часов, 72 часа, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель или за 12 недель после) введения второго терапевтического агента данного способа лечения (например, радиационная терапия) индивидууму, нуждающемуся в этом. В различных вариантах осуществления изобретения ингибитор IAP-белка со структурной формулой (I) и второй терапевтический агент вводятся с разницей в 1 минуту, с разницей в 10 минут, с разницей в 30 минут, с разницей менее, чем 1 час, с разницей в 1 час, с разницей от 1 до 2 часов, с разницей от 2 до 3 часов, с разницей от 3 до 4 часов, с разницей от 4 до 5 часов, с разницей от 5 до 6 часов, с разницей от 6 до 7 часов, с разницей от 7 до 8 часов, с разницей от 8 до 9 часов, с разницей от 9 до 10 часов, с разницей от 10 до 11 часов, с разницей от 11 до 12 часов, с разницей не более, чем 24 часа или не более, чем 48 часов. В одном из исполнений, компоненты комбинированной терапии вводятся с разницей от 1 минуты до 24 часов.
Употребление артиклей "a", "an", "the", и схожих объектов в контексте описываемого изобретения (в особенности, в контексте формулы изобретения) следует понимать, как распространяющееся и на единичный объект, и на несколько объектов, если не указано противоположное. Перечисление диапазонов значений в настоящем документе сделано только с целью сокращения записи упоминаемых индивидуальных значений каждой отдельной величины, попадающей внутрь данного диапазона, если в документе не указано противоположное, и каждое конкретно взятое значение включено в описание, как если бы оно заявлялось в настоящем документе отдельно. Использование какого-либо одного или всех примеров, или приводимых в настоящем документе в качестве примера формулировок/или типовых оборотов (к примеру, «такие, как») имеет своей целью полнее и нагляднее отобразить изобретение и не ограничивает объем изобретения, если не заявлено противоположное. Отсутствие формулировки в спецификации должно рассматриваться как обозначение любого незаявленного элемента существенным для практического использования данного изобретения.
Настоящее изобретение относится к соединениям со структурной формулой (I), которые представляют собой Smac-миметики и функционируют в качестве ингибиторов IAP-белков. Соединения согласно настоящему изобретению повышают чувствительность клеток к индукторам апоптоза и, в некоторых случаях, сами индуцируют апоптоз за счет ингибирования IAP-белков. Следовательно, изобретение относится к методам повышения чувствительности клеток к индукторам апоптоза, и к методам индуцирования апоптоза в клетках, включая контакт клетки с соединением со структурной формулой (I) отдельно или в комбинации с индуктором апоптоза. Изобретение также относится к способам лечения или облегчения нарушений в животном организме, которые реагируют на индукцию апоптоза, включая введение в животный организм соединения со структурной формулой (I) и индуктора апоптоза. Такие нарушения включают в себя те нарушения, которые характеризуются дисрегуляцией апоптоза, и те нарушения, которые характеризуются сверхэксперссией IAP-белков.
Настоящее изобретение относится к эффективным ингибиторам IAP-белков. Ингибиторы IAP-белка согласно настоящему изобретению представляют собой непептидные, бивалентные Smac-миметики, которые связываются с XIAP, cIAP1, и cIAP2 с аффинностью от низкой до субнаномолярной и являются крайне эффективными антагонистами XIAP согласно бесклеточным функциональным биологическим испытаниям. Соединения согласно настоящему изобретению индуцируют деградацию cIAP1 и cIAP2 в раковых клетках при низкой концентрации, активируют каспазу-3 и -8, и расщепляют PARP. Соединения согласно настоящему изобретению имеют низкое значение IC50 (или ИК50 _ половина концентрации ингибирования) в ингибировании роста клеток как в iMDA-MB-231, так и в SK-OV-3 клеточных линиях.
Ингибиторы IAP-белка согласно настоящему изобретению, исходя из установленного выше, пригодны для лечения клеток с нежелательной пролиферативной активностью, включая р