Формы и составы пиримидинилциклопентанового соединения, композиции и способы, относящиеся к ним
Иллюстрации
Показать всеИзобретение относится к аморфному (S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она моногидрохлориду. Технический результат: получен новый аморфный (S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она моногидрохлорид, а также фармацевтические составы на его основе, обладающие AKT протеинкиназной ингибирующей активностью и могут быть использованы для лечения рака. 5 н. и 24 з.п. ф-лы, 6 табл., 11 пр., 58 ил.
Реферат
ПРИОРИТЕТ ИЗОБРЕТЕНИЯ
[0001] Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США №61/648536, поданной 17 мая 2012 г. Полное содержание указанной предварительной заявки тем самым включено в настоящее описание посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] В настоящем изобретении предложены формы и составы пиримидинилциклопентанового соединения, обладающего терапевтической активностью в отношении заболеваний, таких как рак, и способы их получения.
УРОВЕНЬ ТЕХНИКИ
[0003] Ферменты протеинкиназа B/Akt представляют собой группу серин/треонинкиназ, которые сверхэкспрессируются в некоторых опухолях у человека. В публикации международной заявки на патент № WO 2008/006040 и в патенте США №8063050 обсуждается ряд ингибиторов АКТ, в том числе соединение (S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-он (GDC-0068), для которого были проведены клинические исследования в отношении лечения различных видов рака. Свободное основание и форма гидрохлоридной соли соединения GDC-0068, выделенные в примере 14 патента США №8063050, были гигроскопичными, и было сложно получить из них твердую лекарственную форму. Необходимы формы и составы GDC-0068 и его солей, обладающие улучшенными фармацевтическими свойствами.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0004] Один из аспектов настоящего изобретения включает аморфный (S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она моногидрохлорид (соединение формулы I), содержащие его фармацевтические композиции, составы и способы их получения.
[0005] Другой аспект включает мезоморфную форму (S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)-пропан-1-она моногидрохлорида, содержащие ее фармацевтические композиции, составы и способы их получения.
[0006] Другой аспект включает конформационно-разупорядоченную (condis) кристаллическую форму (S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она моногидрохлорида, содержащие ее фармацевтические композиции, составы и способы их получения.
[0007] Другой аспект включает кристаллические формы (S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она моногидрохлорида, содержащие их фармацевтические композиции, составы и способы их получения.
[0008] Другой аспект включает композиции, содержащие (S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)-пропан-1-она моногидрохлорид и растворитель, фармацевтические композиции, составы и способы их получения. В некоторых вариантах реализации настоящего изобретения композиция представляет собой твердую композицию.
[0009] Другой аспект включает композиции, содержащие сольваты (S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она моногидрохлорида, содержащие их фармацевтические композиции, составы и способы их получения.
[0010] Другой аспект включает способ получения аморфного (S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5Н-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она моногидрохлорида, включающий распылительную сушку смеси, содержащей (S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5Н-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она моногидрохлорид, или его сольват, и растворитель.
[0011] Другой аспект включает способ получения аморфного (S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5Н-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она моногидрохлорида, включающий приведение смеси, содержащей (S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5Н-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она моногидрохлорид или его сольват в контакт с газом, например азотом и водой.
[0012] Другой аспект включает таблетку для пероральной доставки, содержащую аморфный (S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5Н-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она моногидрохлорид.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0013] На фигурах 1A-B представлена физическая характеристика аморфной формы соединения формулы I. На фигуре 1A представлена дифрактограмма рентгеновской порошковой дифрактометрии (XRPD) для диффузного гало, типичного для аморфного материала. На фигуре 1B представлено изображение, полученное методом поляризационной микроскопии. Двойного лучепреломления обнаружено не было.
[0014] На фигуре 2 представлен профиль термогравиметрического анализа (ТГА) аморфного соединения формулы I, показывающий потерю массы (вследствие присутствия растворителя: воды и этанола) вплоть до 150°C.
[0015] На фигуре 3 представлен профиль дифференциальной сканирующей калориметрии (ДСК) аморфного соединения формулы I, из которого очевидно стеклование во втором цикле нагревания после удаления растворителя в первом цикле нагревания. Температура начала стеклования образца составляет 114°C.
[0016] На фигуре 4 представлен спектр комбинационного рассеяния с преобразованием Фурье для аморфного соединения формулы I.
[0017] На фигуре 5 представлена дифрактограмма XRPD продукта согласно примеру 1, на которой показаны дифракционные пики и аморфное гало, обнаруженные посредством XRPD.
[0018] На фигуре 6 представлено изображение, полученное методом поляризационной световой микроскопии для продукта согласно примеру 1, где обнаружено двойное лучепреломление.
[0019] На фигуре 7 представлен анализ сорбции воды продукта согласно Примеру 1 с непрерывным профилем сорбции воды при 25°C и относительной влажности (ОВ) от 0 до 90% (точка растворения под действием влаги из воздуха находится при ~75% ОВ).
[0020] На фигуре 8 представлен спектр комбинационного рассеяния с преобразованием Фурье для продукта согласно Примеру 1, наложенный на спектр аморфной формы соединения формулы I.
[0021] На фигуре 9 представлен профиль ДСК для продукта согласно примеру 1. Первая эндотерма показывает потерю растворителя (воды и этанола). Вторая эндотерма с острым пиком перекрывается с произошедшим «шаговым изменением» (изменением базовой линии). Для разделения данных двух событий использовали изменение температуры (±0,5°C за 80 сек), и было обнаружено, что эндотерма (со связанным изменением энтальпии 7-11 Дж/г) перекрывается с температурой стеклования (начало при ~130°C).
[0022] На фигуре 10 представлен измененный профиль ДСК второй эндотермы с фигуры 9.
[0023] На фигуре 11 представлены различные дифрактограммы XRPD в зависимости от температуры. Нагревание продукта согласно примеру 1 приводит к потере структуры (дифракционные пики начинают исчезать при температуре в диапазоне 100-160°C), и твердая форма становится аморфной.
[0024] На фигуре 12 представлены различные дифрактограммы XRPD в зависимости от действия водяного пара (относительной влажности, или ОВ) для продукта согласно примеру 1. При воздействии водяного пара при комнатной температуре (различные условия по ОВ/относительной влажности, созданные путем применения различных растворов солей) в течение 5-7 дней, исходный материал теряет кристалличность, что предполагается по уменьшению интенсивности дифракционного пика в зависимости от увеличивающейся ОВ. При сушке образец подвергали действию условий: 60% ОВ в течение 4 часов при пониженном давлении (самая верхняя дифрактограмма XRPD), кристалличность не восстанавливалась.
[0025] На фигуре 13 представлены иллюстративные дифрактограммы XRPD продукта согласно примеру 1 (внизу) по сравнению с гранулами аморфной формы соединения формулы I (полученной согласно способам, описанным в настоящем документе), которые хранили согласно руководству Международной конференции по гармонизации (ICH) в течение 12 недель. Дифракционные пики кристаллических областей не присутствуют на дифрактограммах гранул аморфной формы формулы I в составах, описанных в настоящем документе.
[0026] На фигуре 14 представлены профили ДСК для составов, содержащих аморфное соединение формулы I, полученное согласно описанию, приведенному в настоящем документе. Данные профили демонстрируют соответствующую Tg, составляющую 124-130°C (начало) в течение 12 недель выдерживания состава. Содержание воды в гранулах сохраняется в диапазоне 3,5-4,5% (содержание воды при T0=3,5-4%).
[0027] На фигуре 15 представлены профили XRPD двух сольватов соединения формулы I (в глицерилкаприле - сверху, в глицериллаурате - снизу).
[0028] На фигуре 16 представлены дифрактограммы XRPD глицерилкаприлата (сольват в Каприоле 90 (Capryol 90™)) соединения формулы I при различных температурах.
[0029] На фигуре 17 представлены дифрактограммы XRPD глицериллаурата (сольват в Лаурилгликоле 90 (Laurylglycol 90™)) соединения формулы I при различных температурах.
[0030] На фигуре 18 представлен анализ сорбции воды глицерилкаприлата соединения формулы I при 25°C.
[0031] На фигуре 19 представлен анализ сорбции воды глицериллауратным сольватом соединения формулы I при 25°C.
[0032] На фигуре 20 представлен профиль XRPD сольвата соединения формулы I в метил-трет-бутиловом эфире (МТБЭ), полученного путем осаждения сольвата из МТБЭ или смеси МТБЭ с растворителем, например, хлороформом.
[0033] На фигуре 21 представлен профиль XRPD метилэтилкетонового (МЭК) сольвата соединения формулы I, полученного путем осаждения сольвата из МЭК или смеси МЭК с растворителем.
[0034] На фигуре 22 представлен профиль XRPD метилизобутилкетонового (МИБК) сольвата соединения формулы I, полученного путем осаждения сольвата из МИБК или смеси МИБК с растворителем.
[0035] На фигуре 23 представлен профиль XRPD толуольного сольвата соединения формулы I, полученного путем осаждения из толуола с растворителем.
[0036] На фигуре 24 представлены результаты XRPD партий соединения формулы I до измельчения и после измельчения, полученных путем прямого влажного гранулирования композиции, содержащей частично кристаллическое соединение формулы I. Превращение частично кристаллической формы в аморфную форму при лекарственной нагрузке 33%, а также при лекарственной нагрузке 43%, происходит без опосредованного раствором осаждения.
[0037] На фигуре 25 представлена изотерма сорбции влаги из партии соединения формулы I после измельчения, полученной путем прямого влажного гранулирования композиции, содержащей частично кристаллическое соединение формулы I при лекарственной нагрузке 43%, на которой показано, что гигроскопичность соединения минимизируется путем применения аморфного/коллоидного диоксида кремния в качестве внутреннего осушителя, и то, как происходит сорбция влаги, сравнимо с сорбцией влаги из гранул, полученных при опосредованном раствором осаждении соединения формулы I.
[0038] На фигуре 26 представлена программа динамической сорбции пара (ДСП) для продукта согласно примеру 10.
[0039] На фигуре 27 представлен профиль XRPD для продукта согласно примеру 10.
[0040] На фигуре 28 представлен профиль ДСК для продукта согласно примеру 10.
[0041] На фигуре 29 представлена монокристаллическая структура кристаллической решетки продукта согласно примеру 11.
[0042] На фигурах 30A-B представлены профили XRPD для продуктов согласно примеру 11.
[0043] На фигурах 31A-C представлены профили XRPD для продуктов согласно примеру 12 (подвергнутого распылительной сушке аморфного соединения формулы I).
[0044] На фигуре 32 представлен профиль XRPD этилацетатного сольвата соединения формулы I.
[0045] На фигуре 33 представлены профили XRPD этилацетатного сольвата соединения формулы I при изменяющихся условиях сушки. Профиль 1 относится к сольвату, анализ которого проводили в полугерметичном держателе образцов; профиль 2 относится к сольвату, анализ которого проводили в держателе, открытом для доступа воздуха; профиль 3 относится к сольвату, анализ которого проводили после нагревания до 75°C в вакуумной печи в течение 1 часа; и профиль 4 относится к сольвату, нагретому до 75°C в вакуумной печи в течение 5 часов.
[0046] На фигуре 34A представлена монокристаллическая структура в этилацетатного сольвата соединения формулы I, а на фигуре 34B представлен расчетный профиль рентгеновской дифракции монокристалла.
[0047] На фигуре 35 представлен профиль XRPD этилбензольного сольвата соединения формулы I.
[0048] На фигуре 36 представлен профиль XRPD орто-ксилольного сольвата соединения формулы I.
[0049] На фигуре 37 представлен профиль XRPD мета-ксилольного сольвата соединения формулы I.
[0050] На фигуре 38 представлен профиль XRPD пара-ксилольного сольвата соединения формулы I.
[0051] На фигуре 39 представлен профиль XRPD кумольного сольвата соединения формулы I.
[0052] На фигуре 40 представлен профиль XRPD тетралинового сольвата соединения формулы I.
[0053] На фигуре 41 представлен профиль XRPD МЭК-сольвата соединения формулы I.
[0054] На фигуре 42 представлен профиль XRPD МИБК-сольвата соединения формулы I.
[0055] На фигуре 43 представлен профиль XRPD метилбутилкетонового (МБК) сольвата соединения формулы I.
[0056] На фигуре 44 представлен профиль XRPD диизобутилкетонового сольвата соединения формулы I.
[0057] На фигуре 45 представлен профиль XRPD метилацетатного сольвата соединения формулы I.
[0058] На фигуре 46 представлен профиль XRPD пропилацетатного сольвата соединения формулы I.
[0059] На фигуре 47 представлен профиль XRPD изопропилацетатного сольвата соединения формулы I.
[0060] На фигуре 48 представлен профиль XRPD изобутилацетатного сольвата соединения формулы I.
[0061] На фигуре 49 представлен профиль XRPD трет-бутилацетатного сольвата соединения формулы I.
[0062] На фигуре 50 представлен профиль XRPD сольвата соединения формулы I в простом этиловом эфире.
[0063] На фигуре 51 представлен профиль XRPD амилацетатного сольвата соединения формулы I.
[0064] На фигуре 52 представлен профиль XRPD глицерилтриацетатного сольвата соединения формулы I.
[0065] На фигуре 53 представлен профиль XRPD гидрата сольвата соединения формулы I в простом этиловом эфире этанола.
[0066] На фигуре 54 представлен профиль XRPD сольвата соединения формулы I в метил-трет-бутиловом эфире.
[0067] На фигуре 55 представлен профиль XRPD диметоксиэтанового сольвата соединения формулы I.
[0068] На фигуре 56 представлен профиль XRPD диэтоксиэтанового сольвата соединения формулы I.
[0069] На фигуре 57 представлен профиль XRPD диметоксипропанового сольвата соединения формулы I.
[0070] На фигуре 58 представлен профиль XRPD 2-метилтетрагидрофуранового сольвата соединения формулы I.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0071] Термины в единственном числе означают «один или более».
[0072] Указание «примерно», относящееся к значению или параметру, в настоящем описании включает (и описывает) варианты реализации, которые относятся к самому указанному значению или параметру, и в одном из вариантов реализации - плюс или минус 20% от заданного значения. Например, описание, относящееся к «примерно X», включает описание «X».
[0073] «Фармацевтически приемлемые соли» включают как кислотно-, так и основно-аддитивные соли. Примеры солей включают, но не ограничиваются ими, сульфатные, цитратные, ацетатные, оксалатные, хлоридные, бромидные, иодидные, нитратные, бисульфатные, фосфатные, кислые фосфатные, изоникотинатные, лактатные, салицилатные, кислые цитратные, тартратные, олеатные, таннатные, пантотенатные, битартратные, аскорбатные, сукцинатные, малеатные, гентизинатные, фумаратные, глюконатные, глюкуронатные, сахаратные, формиатные, бензоатные, глутаматные, метансульфонатные, этансульфонатные, бензолсульфонатные, п-толуолсульфонатные и памоатные (то есть 1,1'-метилен-бис-(2-гидрокси-3-нафтоатные)) соли. В фармацевтически приемлемых солях может быть задействовано включение другой молекулы, такой как ацетат-ион, сукцинат-ион или другой противоион. Указанный противоион может представлять собой любой органический или неорганический фрагмент, который стабилизирует заряд на исходном соединении.
[0074] Термин «фармацевтически приемлемые кислотно-аддитивные соли» относится к солям, которые сохраняют биологическую эффективность и свойства свободных оснований и которые не являются биологически или иным образом нежелательными, указанные соли образованы с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, угольная кислота, фосфорная кислота и т.п., и органическими кислотами, которые могут быть выбраны из классов алифатических, циклоалифатических, ароматических, аралифатических, гетероциклических, карбоновых и сульфоновых органических кислот, таких как муравьиная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, глюконовая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, аспарагиновая кислота, аскорбиновая кислота, глутаминовая кислота, антраниловая кислота, бензойная кислота, коричная кислота, миндальная кислота, эмбоновая кислота, фенилуксусная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфокислота, салициловая кислота и т.п.
[0075] «Фармацевтически приемлемые основно-аддитивные соли» включают соли, полученные из неорганических оснований, такие как соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и т.п. В частности, основно-аддитивные соли представляют собой соли аммония, калия, натрия, кальция и магния. Соли, полученные из фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклические амины и основные ионообменные смолы, такие как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, 2-диэтиламиноэтанол, трометамин, дициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин, этилендиамин, глюкозамин, метилглюкамин, теобромин, пурины, пиперизин, пиперидин, N-этилпиперидин, полиаминовые смолы и т.п. В частности, органические нетоксичные основания представляют собой изопропиламин, диэтиламин, этаноламин, трометамин, дициклогексиламин, холин и кофеин.
[0076] Соединения согласно настоящему изобретению, если не указано иное, включают соединения, которые отличаются только наличием одного или более изотопно-обогащенных атомов. Например, соединения согласно настоящему изобретению, в которых один или более атомов водорода заменены на дейтерий или тритий, или один или более атомов углерода заменены на атом углерода 13C или 14C, или один или более атомов азота заменены на атом азота 15N, или один или более атомов серы заменены на атом серы 33S, 34S или 36S, или один или более атомов кислорода заменены на атом кислорода 17O или 18O, входят в объем настоящего изобретения.
[0077] Было неожиданно обнаружено, что выделение (S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она моногидрохлорида (соединения формулы I) из конкретных растворителей позволяет получить различные физические формы данного соединения, и что указанные различные формы имеют различные фармацевтические свойства. Было обнаружено, что некоторые формы обладают улучшенными свойствами, подходящими для приготовления указанного соединения в виде стабильных лекарственных форм для лечения заболеваний, таких как рак.
[0078] Один из аспектов настоящего изобретения включает твердую композицию, содержащую соединение формулы I и растворитель. Другой аспект включает кристаллическую твердую композицию, содержащую соединение формулы I и растворитель. Примеры растворителей для указанной твердой композиции включают каприолгликоль, лаурилгликоль, МЭК, МИБК, МТБК, хлороформ, дихлорметан, этилацетат, толуол, хлорбензол, этилбензол, ТГФ, 2-метил-ТГФ, 1,2-дихлорэтан, орто-ксилол, мета-ксилол, пара-ксилол, анизол, метилацетат, кумол, тетралин, пропилацетат, изопропилацетат, диизобутилкетон, изобутилацетат, трет-бутилацетат, амилацетат, триацетат глицерина, 1,2-диметоксиэтан, 1,2-диэтоксиэтан, 2,2-диметоксипропан, простой этиловый эфир, метил-трет-бутиловый эфир, воду и их смеси (включая смесь эфира и этанола). В некоторых вариантах реализации настоящего изобретения твердая композиция содержит различное количество растворителя. В некоторых вариантах твердая композиция содержит растворитель, в котором сольватировано соединение формулы I. Примеры сольватов для твердой композиции включают канальные или слоистые сольваты. В один из примеров твердая композиция содержит соединение формулы I, полностью замещенное растворителем, такое как сольват с молярным отношением 1:1. В другом примере твердая композиция содержит соединение формулы I, частично замещенное растворителем, например, при отношении масс./масс. % (растворитель : соединение формулы I) в диапазоне от примерно 0,1% до примерно 20%, в альтернативном варианте от примерно 1% до примерно 15%. В одном конкретном примере твердая композиция содержит соединение формулы I и этилацетат в отношении от примерно 16% до примерно 1% этилацетата.
[0079] Другой аспект включает мезоморфную форму соединения формулы I, имеющую промежуточный порядок, которая получена в результате кристаллизации соединения формулы I из смеси растворителей, содержащей антирастворитель.
[0080] Другой аспект включает конформационно-разупорядоченную кристаллическую форму соединения формулы I, имеющую промежуточный порядок, которая получена в результате кристаллизации из смеси растворителей, содержащей антирастворитель.
[0081] Другой аспект включает аморфную форму соединения формулы I, которая получена в результате выделения из растворителя. Данная аморфная форма обладает некоторыми улучшенными фармацевтическими свойствами и может быть приготовлена в виде стабильных лекарственных форм для лечения заболеваний, таких как рак.
[0082] Таким образом, один из аспектов включает аморфный (S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5Н-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она моногидрохлорид (соединение формулы I).
[0083] Другой аспект включает заключенный в капсулу жидкий состав соединения формулы I, содержащий соединение формулы I и жидкий растворитель-заполнитель. Жидкие растворители-заполнители для применения в жидких заключаемых в капсулу составах включают растворители, которые содержат липидную (например, C3-20алкильную) группу и гидроксильную группу. В одном из примеров, жидкие растворители-заполнители представляют собой сложные моноэфиры, сложные диэфиры и сложные триэфиры жирных кислот (C3-20алкильных или C8-18алкильных) и глицерина, этиленгликоля, пропиленгликоля или полиэтиленгликоля. Примеры включают липиды, такие как глицерилстеараты, например сложные эфиры природных жирных, стеариновой и пальмитиновой кислот с глицерином, и алкилгликолькаприлаты и т.п. Другие примеры включают монокаприлат пропиленгликоля типа II (Капроил 90 (Capryol 90™)), ПЭГ-32-глицериллаурат (Гелуцир (Gelucire®) 44/14), монокаприлат полипропиленгликоля типа I (Имвитор 792 (Imwitor 792)), ПЭГ-6-глицерилолеат (Лабрафил (Labrafil®) М 1944CS), ПЭГ-6-глицериллинолеат (Лабрафил (Labrafil®) М 2125 CS), монолаурат пропиленгликоля типа II (Лаурогликоль 90 (Лаурилгликоль 90)), Полоксамер 188 (Лутрол F68NF (Lutrol F68NF)), Полоксамер 407 (Лутрол F127 NF (Лутрол F127 NF)), полиэтиленгликоль (ПЭГ) 1500, пропиленгликоль, глицерол (глицерин), d-альфа-токоферил-ПЭГ-1000-сукцинат (витамин E-TPGS), ПЭГ-8-каприловые/каприновые глицериды (Лабразол (Labrasol®)) и сложные эфиры каприловой или каприновой жирных кислот и глицерина или пропиленгликоля (например, Миглиол 81 ON (Miglyol 810N) или Миглиол 812N (Miglyol 812N)).
[0084] В другом примере жидкие растворители-заполнители представляют собой растворители, для которых значения критической концентрации мицеллообразования (ККМ, CMC) составляют более чем примерно 0,9 г/г для соединения формулы I. В некоторых вариантах реализации настоящего изобретения указанный жидкий растворитель-заполнитель представляет собой каприлат пропиленгликоля (в одном из примеров данный продукт представляет собой продукт, имеющийся в продаже под коммерческим названием Каприол 90 (Capryol 90™), Gattefosse). Жидкий растворитель-заполнитель может присутствовать в диапазоне от примерно 36,5% масс./масс., до примерно 60% масс./масс., в зависимости от величины дозировки, то есть количества соединения формулы I. В другом примере жидкий растворитель-заполнитель представляет собой растворитель, в котором соединение формулы I может быть растворено в концентрациях от примерно 0,7 до 1 г/г, включая монокаприлаты пропиленгликоля (например, типы I и II), ПЭГ-8-каприловые/каприновые глицериды, глициллаурат (например, лаурогликоль (лаурилгликоль™)), глицерин, пропиленгликоль и ПЭГ-8-каприловые/каприновые глицериды.
[0085] В некоторых вариантах реализации настоящего изобретения жидкий растворитель-заполнитель выбран из жидких растворителей-заполнителей, описанных в настоящем документе, которые также совместимы с гидроксипропилметилцеллюлозой и твердыми желатиновыми капсулами, такими как монокаприлат пропиленгликоля типа II (Каприол 90 (Capryol 90™)) и Лаурогликоль (Лаурилгликоль™) 90.
[0086] В некоторых вариантах реализации настоящего изобретения жидкий заключаемый в капсулу состав дополнительно содержит антиоксидант. Антиоксиданты включают аскорбиновую кислоту, метионин, бутилированный гидроксианизол (БГА) и бутилированный гидрокситолуол (БГТ). В одном из примеров указанный антиоксидант содержит БГА. В одном из примеров указанный антиоксидант содержит БГТ. В некоторых вариантах реализации настоящего изобретения указанный жидкий заключаемый в капсулу состав содержит примерно 0,1% масс./масс., антиоксиданта.
[0087] В некоторых вариантах реализации настоящего изобретения указанный жидкий заключаемый в капсулу состав дополнительно содержит добавки, препятствующие кристаллизации. В одном из примеров указанная добавка представляет собой полимер поливинилпирролидона (ПВП).
[0088] Жидкий заключаемый в капсулу состав обеспечивает неожиданно высокие концентрации соединения формулы I, что позволяет получать единые дозированные единицы с высокой дозировкой: от 100 мг до 400 мг. Такие высокие дозы обычно не могут быть достигнуты при помещении активных фармацевтических ингредиентов в липидоподобные жидкие заключаемые в капсулу системы растворителей. Например, было неожиданно обнаружено, что соединение формулы I является поверхностно-активным в присутствии каприлата пропиленгликоля, что предоставляет возможность получения жидких заключаемых в капсулу составов с высокими концентрациями. Было установлено, что критическая концентрация мицеллообразования для GDC-0068 в каприлате пропиленгликоля (например, Каприола 90 (Capryol 90™)) составляет 0,945 г/г.
[0089] Кроме того, для некоторых соединений с известной высокой растворимостью в воде, а также с низкой растворимостью в воде было проведено определение их максимального количества, которое может раствориться в Каприоле 90 (Capryol 90™). Исследуемыми соединениями с высокой растворимостью в воде были аскорбиновая кислота, метформин, ацетилсалициловая кислота и ацетаминофенол. Исследуемыми соединениями с низкой растворимостью в воде были гризеофульвин, индометацин и напроксен. Ни одно из исследованных соединений не растворялось в Каприоле 90 (Capryol 90™) в концентрации, превышающей 10% масс./масс.
[0090] Таким образом, другой аспект настоящего изобретения включает жидкий заключаемый в капсулу состав соединения формулы I, содержащий от примерно 100 мг до примерно 400 мг соединения формулы I (из расчета на свободное основание), от примерно 36,5% масс./масс. до примерно 60% масс./масс. каприлата пропиленгликоля и примерно 0,1% масс./масс. антиоксиданта. В одном из примеров антиоксидант представляет собой БГА. В одном из примеров жидкий заключаемый в капсулу состав содержит 100 мг соединения формулы I. В одном из примеров жидкий заключаемый в капсулу состав содержит 400 мг соединения формулы I. В одном из примеров указанный состав дополнительно содержит капсулу.
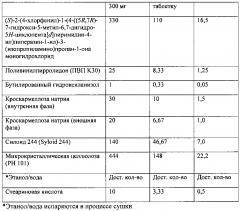
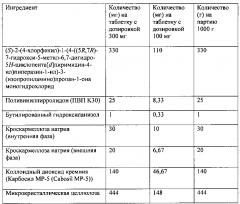
[0091] Другой аспект настоящего изобретения включает таблетированный состав, содержащий аморфное соединение формулы I и наполнитель. В одном из примеров состав содержит аморфное соединение формулы I и диоксид кремния. В другом примере указанный состав дополнительно содержит ингибиторы кристаллизации, такие как ПВП или гидроксипропилметилцеллюлоза (ГПМЦ), и необязательно дополнительно содержит антиоксидант, такой как БГТ или БГА.
[0092] В некоторых вариантах реализации настоящего изобретения таблетка содержит примерно 33% масс./масс. аморфного соединения формулы I, примерно 15% масс./масс. диоксида кремния (в одном из примеров продукт продается под коммерческим названием Карб-о-сил (Cab-o-sil), Cabot, Corp.), примерно 43% масс./масс. микрокристаллической целлюлозы, примерно 5% масс./масс. кроскармеллозы натрия, примерно 2,5% масс./масс. ПВП, примерно 0,1% масс./масс. БГА и примерно 1% масс./масс. стеариновой кислоты.
[0093] Другой аспект включает способ получения аморфного соединения формулы I, включающий приведение соединения формулы I в контакт с растворителем и удаление растворителя с получением аморфного соединения формулы I.
[0094] В альтернативном варианте способ получения аморфного соединения формулы I включает удаление растворителя из сольвата соединения формулы I, такое как сушка или приведение сольвата в контакт с влажным азотом или другим инертным газом.
[0095] В альтернативном варианте способ получения аморфного соединения формулы I включает распылительную сушку раствора соединения формулы I с получением аморфного материала. В одном из примеров распылительной сушки материал (например, кристаллический или мезоморфный материал) растворяют в растворителе и подвергают распылительной сушке с получением аморфного соединения формулы I. Примеры растворителей для использования в процессе распылительной сушки, включают воду и этанол. Исходный материал может представлять собой любую форму соединения формулы I, например сольват соединения формулы I, такой как этилацетатный сольват, или материал, полученный в соответствии с примером 1. В одном из примеров подвергнутый распылительной сушке аморфный продукт содержит от примерно 0,01 до примерно 2,5% остаточного растворителя. В одном из примеров подвергнутый распылительной сушке аморфный продукт содержит от примерно 0,01 до примерно 1,0% остаточного растворителя. В одном из примеров этилацетатный сольват приводят в контакт с водой и подвергают распылительной сушке с получением аморфного соединения формулы I, содержащего менее чем примерно 1,0% масс./масс. воды и примерно 0,25% масс./масс. или менее этилацетата. В другом примере этилацетатный сольват приводят в контакт с этанолом и подвергают распылительной сушке с получением аморфного соединения формулы I, содержащего менее чем примерно 1,0% масс./масс. воды, примерно 2,5% масс./масс. или менее этанола и примерно 0,25% масс./масс. или менее этилацетата. В некоторых вариантах реализации настоящего изобретения указанный способ дополнительно включает сушку подвергнутого распылительной сушке аморфного материала для дальнейшего снижения количества воды и растворителя. В одном из примеров подвергнутое дополнительной сушке подвергнутое распылительной сушке аморфное соединение формулы I содержит менее чем примерно 0,5% растворителя.
[0096] В некоторых вариантах реализации настоящего изобретения приведение соединения формулы I в контакт с растворителем дополнительно включает растворение соединения формулы I в растворителе. В некоторых вариантах реализации настоящего изобретения растворитель содержит этанол. В одном из примеров растворитель содержит воду. В некоторых вариантах реализации настоящего изобретения растворитель содержит смесь этанол : вода, например, в соотношении 1:1. В некоторых вариантах реализации настоящего изобретения растворитель дополнительно содержит добавки, например, ингибиторы кристаллизации, такие как полимеры, например поливинилпирролидон (ПВП) и другие добавки, такие как антиоксиданты или консерванты, например БГА или БГТ.
[0097] Другой аспект включает фармацевтический состав, содержащий аморфное соединение формулы I.
[0098] Другой аспект включает способ получения таблетированного состава, содержащего аморфное соединение формулы I, включающий приведение соединения формулы I в контакт с растворителем, содержащим этанол, с получением смеси; приведение указанной смеси в контакт с наполнителем, содержащим кристаллическую целлюлозу; и удаление растворителя с получением фармацевтического состава, содержащего аморфное соединение формулы I. В некоторых вариантах реализации настоящего изобретения растворитель дополнительно содержит воду. В некоторых вариантах реализации настоящего изобретения растворитель дополнительно содержит стабилизатор, например, полимер ПВП, и антиоксидант, например БГА или БГТ.
[0099] Другой аспект включает способ получения таблетированного состава, включающего приведение в контакт мезоморфной формы соединения формулы I, целлюлозы и диоксида кремния (например, аморфного или коллоидного диоксида кремния). Способ включает приведение мезоморфной формы, целлюлозы и диоксида кремния в контакт со смесью растворителей этанола и воды и удаление смеси растворителей путем сушки смеси с образованием аморфный формы соединения формулы I, которое заключено в указанную смесь. Было неожиданно обнаружено, что такое прямое влажное гранулирование позволяет получить аморфную форму лекарственного вещества формулы I. Гигроскопичности конечного состава, полученного таким прямым влажным гранулированием, и состава, полученного путем опосредованного раствором осаждения одного соединения формулы I, неожиданно оказались схожими.
[00100] В некоторых вариантах реализации настоящего изобретения способ получения таблетки включает (а) растворение антиоксиданта и стабилизатора в смеси (50:50) с растворителем, содержащим этанол и необязательно дополнительно содержащим воду, с получением смеси; (b) растворение соединения формулы I в смеси с получением раствора; (с) гранулирование раствора с наполнителем с образованием гранул; (d) сушку гранул; и (е) прессование гранул с получением таблетки. В одном из примеров указанный способ дополнительно включает перед стадией (е): смешивание дополнительных ингредиентов с получением смеси.
[00101] В некоторых вариантах реализации настоящего изобретения способ гранулирования дополнительно включает гранулирование раствора с наполнителем, содержащим кристаллическую целлюлозу, с высоким усилием сдвига. В некоторых вариантах реализации настоящего изобретения наполнитель содержит микрокристаллическую целлюлозу. В некоторых вариантах реализации настоящего изобретения наполнитель дополнительно содержит коллоидный аморфный диоксид кремния и необязательно дополнительно содержит кроскармеллозу натрия. В одном из примеров наполнитель содержит высокопористую микрокристаллическую целлюлозу и коллоидный диоксид кремния.
[00102] В некоторых вариантах реализации настоящего изобретения сушка гранул дополнительно включает сушку при повышенной температуре. В некоторых вариантах реализации настоящего изобретения температура для сушки гранул находится в диапазоне примерно от 50°C до 60°C.
[00103] Прогнозирование и контролирование величины кристалличности в лекарственной форме важно по нескольким причинам, включая обеспечение предсказуемой биодоступности и контроль качества при производстве. Также важно иметь стабильные лекарственные формы гигроскопичных лекарственных веществ для предотвращения изменения кристаллической структуры лекарственных форм. Мезоморфные формы соединения формулы I, например, конформационно-разупорядоченная кристаллическая форма соединения формулы I, могут иметь аналитически различные уровни кристалличности и являются гигроскопичными. Описанный в настоящем документе способ получения таблеток позволяет пр