Внутриглазные имплантаты, содержащие простамид, и способы их применения
Иллюстрации
Показать всеГруппа изобретений относится к области медицины, а именно к офтальмологии, и предназначена для снижения внутриглазного давления (ВГД) в глазу. Биоразлагаемый внутриглазной имплантат для снижения ВГД содержит матрицу из биоразлагаемого полимера, полиэтиленгликоль 3350 и простамид в качестве активного агента, где простамид и полиэтиленгликоль 3350 связаны с указанной матрицей. Указанная матрица содержит a) поли(D,L-лактид) со сложноэфирной концевой группой, имеющий характеристическую вязкость 0,25-0,35 дл/г; b) поли(D,L-лактид) с кислотной концевой группой, имеющий характеристическую вязкость 0,16-0,24 дл/г, и c) поли(D,L-лактид-со-гликолид) со сложноэфирной концевой группой, имеющий характеристическую вязкость 0,16-0,24 дл/г и мольное отношение D,L-лактида к гликолиду примерно 75:25. Простамид составляет от 18 до 22% имплантата по массе Поли(D,L-лактид) со сложноэфирной концевой группой составляет от 18 до 22% имплантата по массе. Поли(D,L-лактид) с кислотной концевой группой составляет от 13,5 до 16,5% имплантата по массе. Поли(D,L-лактид-со-гликолид) со сложноэфирной концевой группой составляет от 36 до 44% имплантата по массе. Полиэтиленгликоль 3350 составляет от 3,5 до 6,5% имплантата по массе. Характеристическая вязкость каждого из поли(D,L-лактидных) и поли(D,L-лактид-со-гликолидных) полимеров определена для 0,1% раствора указанного полимера в хлороформе при 25°C. Также, обеспечены способ снижения внутриглазного давления в глазу у млекопитающего, устройство для доставки указанного имплантата в глаз и способ изготовления указанного имплантата. Использование группы изобретений позволяет ускорить биоразложение имплантата с меньшим его набуханием при высвобождении эффективного количества биматопроста с практически линейной или постоянной скоростью в течение продолжительного период времени. 4 н. и 14 з.п. ф-лы, 4 табл., 7 ил., 1 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[1] Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США №61/898241, поданной 31 октября 2013 года, содержание которой включено в настоящую заявку во всей полноте посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[2] В настоящей заявке описаны биоразлагаемые внутриглазные имплантаты, обеспечивающие продолжительное высвобождение биматопроста в количестве, которое является эффективным для лечения состояния глаз, в частности глаукомы и глазной гипертензии, и состояний, связанных с глаукомой, таких как повышенное внутриглазное давление. Имплантатам, которые можно изготавливать путем экструзии, придают размер и конфигурацию, подходящие для размещения в передней камере глаза, где имплантат может доставлять простамид непосредственно в ткани, регулирующие выработку и отток внутриглазной жидкости. Важно отметить, что внутриглазные имплантаты, описанные в настоящей заявке, не только выполнены с возможностью обеспечения у пациента уровня биматопроста, снижающего внутриглазное давление, в течение продолжительного периода времени, составляющего 2 месяца или более, но также имеют такой размер, который соответствует углу передней камеры (также называемому радужно-роговичным углом) глаза, что позволяет вводить его в глаз, не повреждая эндотелий роговицы и не нарушая поле зрения. Несмотря на то, что имплантаты согласно настоящему изобретению разработаны для доставки биматопроста, они также могут подходить для замедленной доставки других простамидов. Описаны способы изготовления и применения указанных имплантатов для лечения состояния глаз.
[3] Простамиды представляют собой высокоактивные агенты для понижения внутриглазного давления, подходящие для лечения различных состояний, связанных с глазной гипертензией, таких как глаукома, повышенное внутриглазное давление и другие эпизоды, сопровождающиеся глазной гипертензией, включая эпизоды глазной гипертензии после хирургии или лазерной терапии (1, 4). Простамиды принадлежат к постоянно пополняющемуся семейству С-1 амидов простагландина F2α (1-5). Биосинтез и фармакологические свойства простамидов описаны подробно (1-3, 9). Например, природные простамиды, такие как простамиды F2α, образуются в результате биосинтеза из анандамида по пути, в котором задействована исключительно СОХ-2. СОХ-1 не задействована (1, 2, 15).
[4] Одним из простамидов, который нашел широкое применение для лечения глаз, является биматопрост. Как и другие простамиды, биматопрост не вступает во взаимодействие с рецепторами, чувствительными к простагландину (PG), в какой-либо значительной степени (3, 10). Тем не менее, биматопрост представляет собой высокоактивный агент для борьбы с глазной гипертензией и обладает высокой эффективностью в отношении снижения повышенного внутриглазного давления у пациентов с открытоугольной глаукомой или глазной гипертензией (1, 6-8). Биматопрост, как правило, назначают пациентам для применения в виде офтальмологического раствора, известного под торговой маркой LUMIGAN®. В стандартном курсе терапии пациенты наносят одну каплю раствора LUMIGAN® один раз в день на поверхность пораженного(-ых) глаза(-з) для снижения повышенного внутриглазного давления. Как полагают, биматопрост снижает внутриглазное давление (ВГД) за счет увеличения оттока внутриглазной жидкости по увеосклеральному пути (1, 3).
[5] Несмотря на высокую эффективность снижения внутриглазного давления, регулярная ежедневная инстилляция глазных капель биматопроста, тем не менее, требует, чтобы пациент занимался этим ежедневно. Для некоторых пациентов было бы эффективным использование имплантируемых систем доставки лекарственных средств, таких как внутриглазные имплантаты, которые обеспечивают доставку терапевтически эффективного количества биматопроста в глаз с постоянной скоростью в течение продолжительного периода времени и тем самым снижают внутриглазное давление в глазу с гипертензией непрерывно в течение продолжительного периода времени, такого как 2 месяца или более. Биоразлагаемый внутриглазной имплантат, имеющий размер и конфигурацию, подходящий(-ую) для безопасного и удобного размещения в глазу, и полученный надлежащим образом для доставки терапевтического количества биматопроста в ткани глаза, может эффективно закрывать потребность в соблюдении пациентом схемы лечения, так как пропадает необходимость в ежедневном введении глазных капель, и при этом внутриглазное давление поддерживается на уровне, как правило, обеспечиваемом при местном введении, или на более низком уровне непрерывно в течение продолжительного периода времени (такого как 2 месяца или более), внутриглазной имплантат может улучшать эффективность терапии глаукомы и обеспечивать улучшенные терапевтические результаты у некоторых пациентов. Существует описание внутриглазных имплантатов, содержащих простамидный компонент и биоразлагаемый полимер для продолжительного высвобождения простамида, такого как биматопрост, для лечения состояния глаз, такого как глаукома (см., например, ссылку 4).
[6] В общем случае глаукома представляет собой прогрессирующее заболевание глаза, характеризующееся прогрессирующей оптической нейропатией и связанной с ней потерей поля зрения. Глаукома также может быть связана с повышенным внутриглазным давлением. С учетом этиологии выделяют первичную или вторичную глаукому. Первичная глаукома у взрослых может представлять собой открытоугольную глаукому или острую или хроническую закрытоугольную глаукому. Вторичная глаукома возникает в результате предшествующих заболеваний глаз, таких как увеит, внутриглазная опухоль или увеличенная катаракта.
[7] Причины первичной глаукомы в настоящее время неизвестны. Факторы риска включают высокое или повышенное внутриглазное давление, пожилой возраст и семейный анамнез. Увеличенное или повышенное внутриглазное давление вызвано сокращением оттока внутриглазной жидкости. При первичной открытоугольной глаукоме передняя камера и ее анатомические структуры выглядят нормальными, но существуют затруднения при удалении внутриглазной жидкости. При острой или хронической закрытоугольной глаукоме передняя камера уплощается, камерный угол сужается, и радужная оболочка может заслонять трабекулярную сеть на входе в шлеммов канал. Расширение зрачка может выдавливать корень радужки из угла и приводить к зрачковому блоку и возникновению острого эпизода. Глаза с узкими углами передней камеры предрасположены к острым эпизодам закрытоугольной глаукомы различной степени тяжести.
[8] Вторичная глаукома может быть вызвана каким-либо воздействием на отток внутриглазной жидкости из задней камеры в переднюю камеру и впоследствии в шлеммов канал. Воспалительное заболевание переднего сегмента может предотвращать удаление внутриглазной жидкости за счет инициации полной задней синехии в бомбированной радужке и может нарушать движение внутриглазной жидкости через зрачок, что приводит к повышению внутриглазного давления. Другими распространенными причинами являются внутриглазные опухоли, увеличенная катаракта, окклюзия центральной вены сетчатки, травма глаза, оперативное вмешательство и внутриглазное кровотечение. Если рассматривать все типы в целом, то глаукома возникает примерно у 2% населения после достижения 40-летнего возраста и может протекать годами бессимптомно, а затем прогрессировать и приводить к значительной потере периферического зрения и последующей потере центрального зрения.
[9] Глаукому можно рассматривать как состояние передней и задней камеры глаза, так как клинической задачей при лечении глаукомы может являться не только снижение повышенного внутриглазного давления, связанного с нарушением оттока внутриглазной жидкости из передней камеры, но также предотвращение потери или снижение потери зрения, связанной с повреждением или утратой клеток сетчатки или зрительных нервных клеток (т.е. ганглиозных клеток) в задней камере глаза (т.е. нейропротекция). В клинических испытаниях было показано, что снижение ВГД может способствовать замедлению прогрессирования глаукомы, и постоянное снижение ВГД связано с пониженным риском развития и прогрессирования повреждения зрительных нервов (11-13).
[10] Несоблюдение пациентом схемы местной терапии является одной из основных проблем при предотвращении потери зрения, вызванной глаукомой. Пациенты, которые не принимают лекарственные средства, подвержены наивысшему риску потери зрения, вызванной глаукомой; тем не менее, пациенты, которые принимают лекарственные средства с перерывами, также подвержены риску, так как колебания ВГД также относят к возможным факторам риска, определяющим прогрессирование у некоторых пациентов (14).
[11] Соответственно, системы доставки лекарственного средства с замедленным высвобождением, такие как биоразлагаемые внутриглазные имплантаты, которые могут обеспечивать непрерывную доставку терапевтически эффективного количества антигипертензивного лекарственного средства, такого как биматопрост, непосредственно в переднюю камеру глаза, могут способствовать снижению зависимости пациента от местных средств для лечения глазной гипертензии или других лекарственных средств против глаукомы при контролировании внутриглазного давления и борьбе с симптомами, связанными с глаукомой.
[12] В настоящем изобретении предложены указанные системы доставки лекарственных средств и дополнительные улучшения, связанные с некоторыми существующими биоразлагаемыми внутриглазными имплантатами. Авторы настоящего изобретения разработали состав в виде биоразлагаемого имплантата, который набухает в меньшей степени и подвержен ускоренному биоразложению по сравнению с некоторыми сравнимыми внутриглазными имплантатами, но при этом делает возможным высвобождение терапевтически эффективного количества биматопроста с практически линейной или постоянной скоростью в течение продолжительного периода времени (например, примерно 60 дней) и тем самым обеспечивает долгосрочное ослабление глазной гипертензии у пациента и возможно защиту пациента от некоторых нежелательных эффектов, вызываемых высоким или повышенным внутриглазным давлением.
[13] Указанные качества являются особенно ценными для имплантатов, размещаемых в передней камере глаза (заполненном жидкостью пространстве внутри глаза, расположенном между радужкой и наиболее удаленной поверхностью роговицы, эндотелием роговицы). Так как большинство имплантатов передней камеры имеют более высокую плотность по сравнению с внутриглазной жидкостью, они склонны оседать в нижней части угла передней камеры (на месте соединения передней поверхности радужки и задней поверхности роговицы; также называют радужно-роговичным углом) после введения в переднюю камеру, где они могут вступать в контакт и возможно повреждать эндотелий роговицы. Небольшие слабонабухающие быстроразлагаемые имплантаты (т.е. имплантаты, которые при набухании после размещения в передней камере увеличиваются менее чем в 3 раза (<3Х) относительно начального размера), такие как те, что описаны в настоящей заявке, могут снижать риск развития отека роговицы, вызванного механическим раздражением эндотелия роговицы, у пациента. В противоположность этому, имплантаты, которые при набухании после размещения в передней камере увеличиваются более чем в 3 раза (>3Х) относительно начального размера, могут иметь повышенный риск соприкосновения с клетками эндотелия роговицы и возникновения отека роговицы. Отек роговицы может приводить к помутнению прозрачной в обычных условиях роговицы и потере зрения в случае распространения в центральной части роговицы. Кроме того, небольшой слабонабухающий имплантат, сохраняющий максимальный объем после набухания в течение небольшого периода времени перед уменьшением размера, может обеспечивать безопасное введение имплантата лечащим врачом увеличенной популяции пациентов, включая пациентов с небольшим или узким углом передней камеры. Быстрое биоразложение имплантата после доставки содержащегося в нем лекарственного средства означает, что при необходимости пациентам можно вводить один или более дополнительных имплантатов по схеме продолжительной терапии, при этом отсутствуют опасения, связанные с тем, что какие-либо остаточные имплантаты могут нарушать зрение или удобство.
[14] Все указанные факторы, включая оптимальный размер имплантата (например, длину, диаметр или ширину и общую массу), были учтены при разработке имплантатов, описанных в настоящей заявке.
Список литературы:
1. Woodward et al. (2001) "The pharmacology of Bimatoprost (Lumigan®)" Survey of Ophthalmology Vol. 45, Supplement 4, pp, S337-S345.
2. Woodward et al. (2008) "Prostamides (prostaglandin ethanolamides) and their pharmacology" British J. Pharmacology 153:410-419.
3. Woodward et al. (2004) "Bimatoprost: A novel antiglaucoma agent" Cardiovascular Drug Reviews 22(2): 103-120.
4. Патент США №7799336.
5. Патент США №6395787.
6. Coleman et al. (2003) "A 3-Month Randomized Controlled Trial of Bimatoprost (LUMIGAN®) versus Combined Timolol/Dorzolamide (Cosopt®) in Patients with Glaucoma or Ocular Hypertension" Ophthalmology 110(12): 2362-8.
7. Laibovitz et al. (2001) "Comparison of the ocular hypotensive lipid AGN 192024 with timolol. Dosing, efficacy and safety evaluation of a novel compound for glaucoma management" Arch Ophthalmol 119:994-1000.
8. Cantor (2008) "An update on bimatoprost in glaucoma therapy" Expert Opin. Pharmacother. 3(12): 1753-1762.
9. Brubaker et al. (2001) "Effects of AGN 19024, a new ocular hypotensive agent, on aqueous dynamics" Am. J. Ophthalmol. 131:19-24.
10. Schuster et al. (2000) "Synthetic modification of prostaglandin F2α indicates different structural determinants for binding to the prostaglandin F receptor versus the prostaglandin transporter" Mol. Pharmacology 58:1511-1516.
11. Collaborative Normal-tension glaucoma study group. The effectiveness of intraocular pressure reduction in the treatment of normal-tension glaucoma. Am. J. Ophthalmology 1998; 126:498-505.
12. Heijl et al. (2002) "Reduction of intraocular pressure and glaucoma progression: results from the early manifest glaucoma trial." Arch. Ophthalmol. 120:1268-1279.
13. Kass et al. (2002) "The ocular hypertension treatment study: a randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma" Arch. Ophthalmol. 120:701-713.
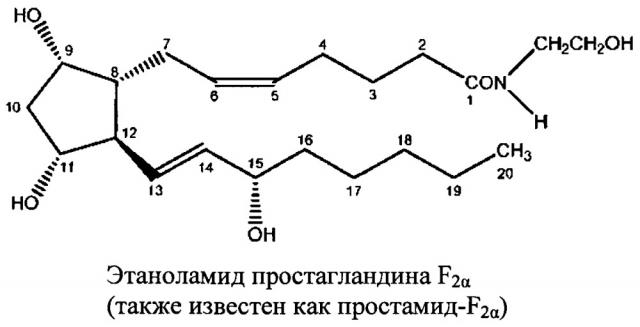
14. Caprioli et al. (2008) "Intraocular pressure fluctuation" Ophthalmology 115(7): 1123-1129.
15. Yu et al. (1997) "Synthesis of prostaglandin E2 ethanolamide from anandamide by cyclooxygenase-2" J. Biol. Chem. 272(34): 21181-21186.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[15] В настоящем изобретении предложен биоразлагаемый внутриглазной имплантат, содержащий биматопрост, для снижения внутриглазного давления (ВГД) в глазу в течение по меньшей мере 2 месяцев. Имплантат может быть эффективным для поддержания пониженного уровня внутриглазного давления (относительно внутриглазного давления в глазу перед введением имплантата) в течение 4 месяцев, 4-6 месяцев или 6-12 месяцев или более 12 месяцев после размещения в глазу. Относительное снижение ВГД в глазу в процентах после введения имплантата может быть различным в зависимости от размера имплантата (а, следовательно, содержания лекарственного средства) и от пациента, но может быть на 10-20%, 20-30% или 10-50% ниже ВГД на исходном уровне (внутриглазного давления в глазу перед введением имплантата) и в некоторых случаях может сохраняться на уровне 20-30% ниже ВГД на исходном уровне в течение по меньшей мере 2 месяцев, 2-3 месяцев, 4 месяцев или более, а в некоторых случаях 6-12 месяцев или более после введения отдельного имплантата.
[16] Имплантат можно вводить в зрительную область глаза пациента для снижения внутриглазного давления в глазу и лечения тем самым гипертензии и состояний глаза, связанных с повышенным внутриглазным давлением, включая глаукому. Имплантат, содержащий биматопрост, описанный в настоящей заявке, имеет специально подобранный размер и предназначен для размещения в передней камере глаза, но при желании может быть предназначен и для применения в стекловидном теле глаза (путем интравитреальной инъекции), а при необходимости и у некоторых пациентов с небольшим или узким углом передней камеры или у пациентов с закрытоугольной глаукомой. Ширину угла передней камеры можно классифицировать согласно системе Шаффера (Shaffer RN. (1960) "Primary glaucomas. Gonioscopy, ophthalmoscopy, and perimetry" Trans Am Acad Ophthalmol Otolaryngol. 64:112-127). Углы 1 и 2 степени по Шафферу можно рассматривать как узкие. Лечение пациентов, имеющих углы 1 или 2 степени, путем имплантации в стекловидное тело глаза, но не в переднюю камеру, может быть желательным для снижения возможных токсических эффектов в роговице. Пациенты с открытыми углами, такие как пациенты, имеющие углы 3 и 4 степени, можно рассматривать как кандидатов для размещения внутрикамерного имплантата или интравитреального имплантата.
[17] Несмотря на то, что внутриглазные имплантаты или системы доставки лекарственных средств, описанные в настоящей заявке, изначально были разработаны для замедленной доставки биматопроста, их также можно применять для доставки других простамидов, включая, но не ограничиваясь ими, соединения, имеющие формулу I, приведенные далее.
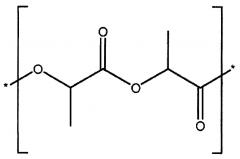
[18] В общем случае внутриглазной имплантат согласно настоящему изобретению содержит биматопрост в качестве активного ингредиента, матрицу биоразлагаемого полимера и необязательно полиэтиленгликоль или состоит из указанных компонентов. Биматопрост (или другой простамид) может составлять от 5% до 90% по массе имплантата или от 5% до 30% по массе имплантата или 18-22% по массе имплантата, но предпочтительно составляет 20% по массе имплантата. Матрица биоразлагаемого полимера в общем случае содержит смесь по меньшей мере трех различных биоразлагаемых полимеров, независимо выбранных из группы, состоящей из поли(D,L-лактидных) полимеров (PLA) и поли(D,L-лактид-со-гликолидных) полимеров (PLGA). Например, матрица биоразлагаемого полимера может содержать первый, второй и третий биоразлагаемый полимер, которые отличаются друг от друга повторяющимися звеньями, характеристической вязкостью или концевыми группами или любой их комбинацией, или состоит из указанных полимеров. В некоторых случаях матрица биоразлагаемого полимера согласно настоящему изобретению может содержать первый, второй, третий и четвертый биоразлагаемые полимеры, независимо выбранные из группы, состоящей из поли(D,L-лактидных) полимеров (PLA) и поли(D,L-лактид-со-гликолидных) полимеров (PLGA), где первый, второй, третий и четвертый полимеры отличаются друг от друга повторяющимися звеньями, характеристической вязкостью или концевыми группами или их комбинацией. В зависимости от агента обрыва цепи, используемого при синтезе полимера, полимер PLA или PLGA может содержать концевую группу свободной карбоновой кислоты или концевую группу сложного алкильного эфира, и его можно называть полимером PLA или PLGA с кислотной концевой группой или сложноэфирной концевой группой (или с концевой сложноэфирной группой), соответственно.
[19] В одном из вариантов реализации матрица биоразлагаемого полимера содержит первый, второй и третий биоразлагаемые полимеры или состоит из указанных полимеров, где первый биоразлагаемый полимер представляет собой поли(D,L-лактидный) полимер со сложноэфирной концевой группой, имеющий характеристическую вязкость 0,25-0,35 дл/г, второй полимер представляет собой поли(D,L-лактидный) полимер с кислотной концевой группой, имеющий характеристическую вязкость 0,16-0,24 дл/г, и третий полимер представляет собой поли(D,L-лактид-со-гликолидный) полимер со сложноэфирной концевой группой, имеющий мольное отношение D,L-лактид : гликолид, составляющее от 73:27 до 77:23 или примерно 75:25, и характеристическую вязкость 0,16-0,24 дл/г, где характеристическая вязкость каждого полимера определена в 0,1% (масс./об.) растворе полимера в хлороформе при 25°С.
[20] Простамид, содержащийся в имплантате, может быть равномерно или неравномерно распределен в матрице биоразлагаемого полимера. Простамид может быть диспергирован внутри матрицы биоразлагаемого полимера.
[21] Как указано выше, имплантат может дополнительно содержать полиэтиленгликоль. Полиэтиленгликоль, содержащийся в имплантате, может иметь среднюю молекулярную массу от 3000 до 20000 г/моль. В одном из вариантов реализации имплантат содержит полиэтиленгликоль 3350 (ПЭГ 3350). Полиэтиленгликоль в общем случае связан с матрицей биоразлагаемого полимера. Например, полиэтиленгликоль может быть диспергирован внутри матрицы биоразлагаемого полимера.
[22] Имплантаты, содержащие простамид, согласно настоящему изобретению предназначены для i) минимизации набухания имплантата в жидкости, наполняющей внутреннюю часть глаза, ii) ускорения разложения имплантата после израсходования содержащегося лекарственного средства, и iii) высвобождения лекарственного средства с по существу постоянной (или практически линейной) скоростью в течение продолжительного периода времени, который может составлять 2 месяца или более после размещения в глазу. Указанные имплантаты рассматривают как хорошо подходящие для долгосрочного снижения внутриглазного давления в глазу, в котором наблюдают гипертензию. Как обсуждалось выше, имплантат имеет размер, соответствующий углу передней камеры (также называемому радужно-роговичным углом) глаза (в частности глаза человека), и не вступает в контакт или не повреждает эндотелий роговицы. Минимизация контакта имплантата с эндотелием роговицы может снижать или устранять возможность развития отека роговицы у пациента, состояния, которое может вызывать нарушение зрения и приводить к возможной потере зрения.
[23] С учетом вышеуказанного, один из вариантов реализации представляет собой биоразлагаемый внутриглазной имплантат для снижения внутриглазного давления или глазной гипертензии у пациента, содержащий матрицу биоразлагаемого полимера и простамид в качестве активного агента, связанный с матрицей биоразлагаемого полимера, где матрица биоразлагаемого полимера содержит или состоит из
a) R203S, который представляет собой поли(D,L-лактид) со сложноэфирной концевой группой, имеющий характеристическую вязкость 0,25-0,35 дл/г;
b) R202H, который представляет собой поли(D,L-лактид) с кислотной концевой группой, имеющий характеристическую вязкость 0,16-0,24 дл/г;
c) RG752S, который представляет собой поли(D,L-лактид-со-гликолид) со сложноэфирной концевой группой, имеющий мольное отношение D,L-лактид : гликолид примерно 75:25 и характеристическую вязкость 0,16-0,24 дл/г; и
d) полиэтиленгликоль 3350;
где простамид составляет 20% имплантата по массе, поли(D,L-лактид) со сложноэфирной концевой группой составляет 20% имплантата по массе, поли(D,L-лактид) с кислотной концевой группой составляет 15% имплантата по массе, поли(D,L-лактид-со-гликолид) со сложноэфирной концевой группой составляет 40% имплантата по массе, и полиэтиленгликоль (ПЭГ) 3350 составляет 5% имплантата по массе, причем характеристическая вязкость каждого поли(D,L-лактидного) и поли(D,L-лактид-со-гликолидного) полимера измерена в 0,1% растворе полимера в хлороформе при 25°С.
[24] В некоторых вариантах реализации простамид представляет собой соединение, имеющее формулу I. В одном из вариантов реализации простамид представляет собой биматопрост.
[25] Примеры внутриглазных имплантатов для применения в способе лечения состояния глаз согласно настоящему изобретению включают имплантаты, приведенные в таблицах 1 и 2 ниже. Например, внутриглазной имплантат для снижения внутриглазного давления и глазной гипертензии у пациента может содержать 20% по массе биматопроста, 15% по массе R203S, 20% по массе RG858S, 40% по массе RG752S и 5% по массе полиэтиленгликоля 3350. RG858S представляет собой поли(D,L-лактид-со-гликолид) со сложноэфирной концевой группой, имеющий характеристическую вязкость 1,3-1,7 дл/г и отношение D,L-лактида к гликолиду, составляющее от 83:17 до 87:13 или примерно 85:15.
[26] Другой вариант реализации представляет собой биоразлагаемый внутриглазной имплантат для лечения состояния глаз у пациента, содержащий 18-22% по массе (масс./масс.) биматопроста, 18-22% по массе R203S, 13,5-16,5% по массе R202H, 36-44% по массе RG752S и 3,5-6,5% по массе полиэтиленгликоля.
[27] Дополнительный вариант реализации представляет собой биоразлагаемый внутриглазной имплантат для лечения состояния глаз у пациента, содержащий 20% по массе (масс./масс.) биматопроста, 20% по массе R203S, 15% по массе R202H, 40% по массе RG752S и 5% по массе полиэтиленгликоля.
[28] Другой вариант реализации представляет собой биоразлагаемый внутриглазной имплантат для лечения состояния глаз у пациента, содержащий 20% по массе (масс./масс.) биматопроста, 15% по массе RG858S, 35% по массе RG752S, 15% по массе RG755S и 15% по массе RG502S. RG755S представляет собой поли(D,L-лактид-со-гликолид), содержащий сложноэфирную концевую группу, имеющий характеристическую вязкость примерно 0,50-0,70 дл/г (при измерении в 0,1% растворе в хлороформе при 25°С) и мольное отношение D,L-лактид : гликолид, составляющее от 73:27 до 77:23 или примерно 75:25. RG502S представляет собой поли(D,L-лактид-со-гликолид), содержащий сложноэфирную концевую группу, имеющий характеристическую вязкость 0,16-0,24 дл/г (при измерении в 0,1% растворе в хлороформе при 25°С) и отношение D,L-лактид : гликолид, составляющее от 48:52 до 52:48 или примерно 50:50.
[29] Другой вариант реализации представляет собой биоразлагаемый внутриглазной имплантат для лечения состояния глаз у пациента, содержащий 20% по массе (масс./масс.) биматопроста, 30% по массе RG858S, 40% по массе RG752S, 5% по массе RG502 и 5% по массе RG502H. RG502H представляет собой поли(D,L-лактид-со-гликолид), содержащий кислую концевую группу, имеющий характеристическую вязкость 0,16-0,24 дл/г (при измерении в 0,1% растворе в хлороформе при 25°С) и отношение D,L-лактид : гликолид примерно 50:50 (такой как, например, RG502H).
[30] Другой вариант реализации представляет собой биоразлагаемый внутриглазной имплантат, содержащий 20% по массе (масс./масс.) биматопроста, 20% по массе RG752S, 50% по массе RG755S, 5% по массе RG502 и 5% по массе RG502H.
[31] Другой вариант реализации представляет собой биоразлагаемый внутриглазной имплантат, содержащий 20% по массе (масс./масс.) биматопроста, 25% по массе RG752S, 50% по массе RG755S и 5% по массе RG502.
[32] Другой вариант реализации представляет собой биоразлагаемый внутриглазной имплантат, содержащий 20% по массе (масс./масс.) биматопроста, 30% по массе RG752S, 20% по массе RG502 и 30% по массе RG858S.
[33] Как указано выше, состав в виде имплантата согласно настоящему изобретению может содержать биматопрост или другой простамид. В некоторых вариантах реализации простамид, содержащийся в имплантате, содержит соединение, имеющее формулу (I)
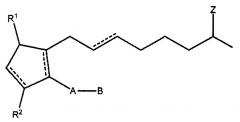
где пунктирные линии представляют собой простую или двойную связь, которая может иметь цис- или транс-конфигурацию, А представляет собой алкиленовый или алкениленовый радикал, содержащий от двух до шести атомов углерода, где радикал может содержать в цепи один или более оксидных радикалов и замещен одной или более гидрокси-, оксо-, алкилокси- или алкилкарбоксигруппами, причем указанный алкильный радикал содержит от одного до шести атомов углерода; В представляет собой циклоалкильный радикал, содержащий от трех до семи атомов углерода, или арильный радикал, выбранный из группы, состоящей из гидрокарбильного арильного и гетероарильного радикалов, содержащих от четырех до десяти атомов углерода, причем гетероатом выбран из группы, состоящей из атомов азота, кислорода и серы; X представляет собой -N(R4)2, причем R4 независимо выбран из группы, состоящей из водорода и низшего алкильного радикала, содержащего от одного до шести атомов углерода; Z представляет собой =O; один из R1 и R2 представляет собой =O, -ОН или -O(CO)R6, а другой представляет собой -ОН или -O(CO)R6, или R1 представляет собой =O, и R2 представляет собой Н, причем R6 представляет собой насыщенную или ненасыщенную ациклическую углеводородную группу, содержащую от 1 до 20 атомов углерода, или -(CH2)mR7, причем m равен 0 или представляет собой целое число от 1 до 10, и R7 представляет собой циклоалкильный радикал, содержащий от трех до семи атомов углерода, или гидрокарбильный арильный или гетероарильный радикал, такой как определено выше.
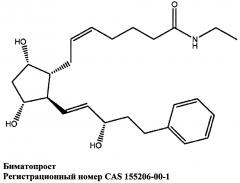
[34] В более конкретном варианте реализации простамид, содержащийся в имплантате, представляет собой биматопрост, имеющий следующую химическую структуру:
[35] Другие примеры простамидов (амидов простагландина F2α) могут включать, но не ограничиваются ими, амиды простагландина F2α, описанные в Woodward et al. (2008) "Prostamides (prostaglandin ethanolamides) and their pharmacology" British J. Pharmacology 153:410-419; и Schuster et al. (2000) "Synthetic modification of prostaglandin F2α indicates different structural determinants for binding to the prostaglandin F receptor versus the prostaglandin transporter" Molecular Pharmacology 58:1511-1516; и амиды простагландина F2α, описанные в патентах США №5688819 и 5834498.
[36] Матрица биоразлагаемого полимера, входящая в состав имплантата согласно настоящему изобретению, может высвобождать простамид со скоростью, обеспечивающей замедленное высвобождение терапевтически эффективного количества простамида из имплантата в течение двух месяцев после размещения имплантата в зрительной области глаза. В некоторых случаях имплантат может быть эффективным для снижения внутриглазного давления в глазу в течение по меньшей мере 4 месяцев, 4-6 месяцев или более, 6-12 месяцев или 12-24 месяцев после размещения имплантата в глазу. Имплантат предназначен специально для размещения в передней камере глаза, но может подходить для размещения в других зрительных областях для лечения состояний, таких как глаукома и глазная гипертензия, или для общего снижения ВГД в глазу. Соответственно, имплантат согласно настоящему изобретению можно размещать, например, в передней камере, задней камере или стекловидном теле глаза. В некоторых случаях имплантат можно размещать в подконъюнктивном или субтеноновом пространстве глаза.
[37] Полиэтиленгликоль (ПЭГ) согласно любому из указанных выше вариантов реализации может иметь среднюю молекулярную массу от 3000 до 20000 г/моль. В предпочтительных вариантах реализации полиэтиленгликоль, входящий в состав имплантата, представляет собой ПЭГ 3350. Например, в одном из вариантов реализации в настоящем изобретении предложен биоразлагаемый внутриглазной имплантат, содержащий 20% по массе (масс./масс.) биматопроста, 20% по массе R203S, 15% по массе R202H, 40% по массе RG752S и 5% по массе полиэтиленгликоля 3350 (состав 2). Более конкретно имплантат может содержать 18-22% по массе (масс./масс.) биматопроста, 18-22% по массе R203S, 13,5-16,5% по массе R202H, 36-44% по массе RG752S и 3,5-6,5% по массе полиэтиленгликоля.
[38] Внутриглазные имплантаты согласно настоящему изобретению могут быть эффективными в отношении снижения внутриглазного давления в глазу с нормальным давлением или гипертензией в течение продолжительного периода времени. В некоторых вариантах реализации способов согласно настоящему изобретению у пациента может присутствовать глаукома нормального давления (ГНД), где внутриглазное давление находится в диапазоне от 11 до 21 мм рт.ст. Для указанных пациентов могут требоваться даже более низкие значения внутриглазного давления для снижения риска прогрессирующего повреждения зрительного нерва и потери поля зрения, и внутриглазное введение имплантата согласно настоящему изобретению может оказывать благоприятное действие. Таким образом, имплантат согласно настоящему изобретению может быть эффективным для лечения всех форм глаукомы, включая глаукому, характеризующуюся повышенным внутриглазным давлением, а также глаукому низкого давления или нормального давления, так как у указанных пациентов снижение внутриглазного давления также может оказывать благоприятное действие.
[39] Имплантат может быть эффективным для снижения внутриглазного давления в глазу на 10-20%, 20-30% и возможно на 30-40% или более (при повышенной скорости высвобождения лекарственного средства) относительно внутриглазного давления (ВГД) в глазу перед введением имплантата в течение 2 месяцев или более, 4 месяцев или более и возможно 6 месяцев или более после размещения имплантата в глазу. Указанные имплантаты могут быть эффективными также для снижения риска развития, отсрочки проявления или замедления прогрессирования глаукоматозного повреждения глаза пациента. Глаукоматозное повреждение глаза может включать нарушение функции и/или структуры зрительного нерва и гибель ганглиозных клеток, которая может приводить к потере периферического поля зрения и в конечном счете потере центрального зрения, что приводит к полной слепоте. Повышенное ВГД является основным фактором риска потери поля зрения при глаукоме.
[40] Соответственно, имплантаты, описанные в настоящей заявке, могут быть эффективными для лечения пациента, страдающего от или имеющего поставленный диагноз состояния глаз, выбранный из глаукомы, открытоугольной глаукомы, первичной открытоугольной глаукомы, закрытоугольной глаукомы (иногда называемой узкоугольной глаукомой), глаукомы нормального давления, глаукомы низкого давления, псевдоэксфолиативной глаукомы, врожденной глаукомы или пигментной глаукомы. Один или более имплантатов согласно настоящему изобретению также могут подходить для снижения и тем самым для лечения глазной гипертензии или повышенного внутриглазного давления. Например, имплантат согласно настоящему изобретению может быть эффективным для снижения внутриглазного давления у пациента с открытоугольной глаукомой, закрытоугольной глаукомой или глазной гипертензией. Пациент может представлять собой человека или млекопитающее, отличное от человека. Способ в общем случае включает стадию размещения имплантата в глаз, пораженный состоянием глаза.
[41] Как следствие возможности высвобождать терапевтически эффективное количество биматопроста в течение продолжительного периода времени (например, в течение 60 дней или более), можно ожидать, что имплантаты согласно настоящему изобретению могут снижать внутриглазное давление у пациента в течение продолжительных периодов (например, в течение 4 месяцев или более) в отсутствие необходимости проведения частых внутриглазных инъекций или регулярной инсталляции глазных капель на поверхность глаза, что может требоваться в случае местной терапии. Соответственно, в некоторых формах настоящего изобретения имплантаты, описанные в настоящей заявке, применяют в качестве монотерапии (т.е. используют отдельно для контролирования ВГД без применения вспомогательных глазных капель против гипертензии) для снижения внутриглазного давления у пациента и для лечения тем самым состояния глаз, такого как описано в настоящей заявке. Тем не менее, имплантат согласно настоящему изобретению при желании можно применять в двойной терапии совместно с таким же или отличающимся терапевтическим агентом, который наносят местно.
[42] Таким образом, один из вариантов реализации представляет собой способ лечения состояния глаз у пациента, включающий размещение биоразлагаемого внутриглазного имплантата согласно настоящему изобретению в глазу(-ах), пораженном(-ых) состоянием глаз, для лечения тем самым состояния глаза(-з). Имплантат предпочтительно размещают в передней камере глаза, но его можно размещать и в задней камере (т.е. в области глаза, расположенной непосредственно позади радужки в ресничной борозде) или в стекловидном теле глаза. Размещение в стекловидном теле (интравитреальное введение) может быть предпочтительным для пациентов с узким углом передней камеры, таких как пациенты, имеющие угол 1 или 2 степени по Шафферу, где радужка расположена весьма близко к трабекулярной сети на предельном уровне, начиная с которого может происходить нарушение оттока внутриглазной жидкости, которое приводит к повышению внутриглазного давления. Пациентам, имеющим угол 1 или 2 степени по Шафферу, следует вводить интравитреальные имплантаты вместо внутрикамерных имплантатов для снижения возможного токсического эффекта в роговице. Угол 0 степени по Шафферу рассматривают как закрытый, при этом радужка полностью закрывает трабекулярную сеть, что приводит к высокому внутриглазному давлению и возможному повреждению зрительного нерва и слепоте. Пациенты, которым может подходить или которые могут переносить максимальное увеличение диаметра внутрикамерного имплантата при набухании примерно до 400 мкм или более, в общем случае имеют угол 3 или 4 степени по Шафферу (широко открытый), тогда как пациентам, имеющим угол 1 и 2 степени, подходят только имплантаты, имеющие максимальный диаметр при набухании, составляющий от примерно 200 мкм до менее чем примерно 400 мкм.
[43] Имплантат предпочтительно обеспечивает терапевтически эффективную дозу простамида в глазу(-ах) в течение по меньшей мере двух месяцев после размещения в глазу и обле