Составы на основе полиинозиновой-полицитидиловой кислоты (poly(i:с)) для лечения инфекций верхних дыхательных путей
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к микрочастицам и композиции, содержащей микрочастицы, для профилактики вирусной инфекции, а также к применению композиции для получения лекарственного средства для профилактики вирусных инфекций верхних дыхательных путей. Микрочастицы состоят из полиинозиновой кислоты и полицитидиловой кислоты, смешанных с одним или более полимерами-носителями и водой, где полимер выбран из крахмала, альгината, карбоксиметилцеллюлозы и дипальмитоилфосфатидилхолина. Осуществление изобретения позволит получить лекарственное средство, обеспечивающее защиту врожденной иммунной системы от вирусных инфекций. 4 н. и 25 з.п. ф-лы, 11 табл., 3 ил.
Реферат
Настоящее изобретение относится к композиции, содержащей микрочастицы полиинозиновой-полицитидиловой кислот (Poly(I:C)) и полимера-носителя, выбранного из крахмала, альгината, бланозы или DPPC (дипальмитоилфосфатидилхолина), для применения в лечении и/или предупреждении инфекций или простуды, и к устройству, предпочтительно к системе назальной доставки, содержащему указанную композицию для применения пациентом, нуждающегося в предупреждении и/или в лечении инфекций или насморка.
Простуда (также известная как назофарингит, острый вирусный ринофарингит, вирусная инфекция верхних дыхательных путей или простуда) является вирусным инфекционным заболеванием верхнего отдела дыхательной системы, вызываемым преимущественно вирусами.
ВИРУСЫ
Простуда является вирусной инфекцией верхних дыхательных путей. Чаще всего вовлеченный вирус представляет собой риновирус (30-50%), тип пикорнавируса с 99 известными серотипами. Другие включают коронавирус (10-15%), вирусы гриппа (5-15%), вирусы парагриппа человека, респираторный синцитиальный вирус человека, аденовирусы, энтеровирусы и метапневмовирус.
В целом более 200 серологически различных типов вирусов вызывают простуды. В простуды у взрослых в особенности вовлечены коронавирусы. Среди более 30 коронавирусов 3 или 4 вызывают инфекции у людей, но их трудно выращивать в лаборатории и их значение, таким образом, понимается хуже. В связи с существованием многих различных типов вирусов и их тенденции к непрерывным мутациям невозможно выработать абсолютный иммунитет к насморку.
КЛИНИЧЕСКИЕ ПРИЗНАКИ И СИМПТОМЫ
Первым признаком вирусного заболевания верхних дыхательных путей часто является болезненное или саднящее горло. Другими распространенными симптомами являются насморк, заложенность носа и чихание. Они иногда дополняются конъюнктивитом ("розовым глазом"), болями в мышцах, усталостью, недомоганием, головной болью, слабостью или потерей аппетита. Кашель и лихорадка, как правило, указывают на грипп, а не на вирусное заболевание верхних дыхательных путей, при этом прогностическая ценность положительного результата составляет около 80%. Симптомы могут быть более тяжелыми у младенцев и маленьких детей, и в этих случаях они могут включать лихорадку и сыпь. Вирусные заболевания верхних дыхательных путей также могут быть более тяжелыми у курильщиков.
Репликация вируса начинается через 2-6 часов после первичного контакта. Симптомы обычно проявляются через 2-5 дней после первичного инфицирования, но изредка наблюдаются уже через 10 часов. Проявление симптомов достигает пика через 2-3 дня после появления симптомов, тогда как появление симптомов гриппа является постоянным и немедленным. В настоящее время не существует способа лечения, сокращающего продолжительность; однако симптомы обычно устраняются самопроизвольно в течение от 7 до 10 дней, при этом проявление некоторых симптомов может продолжаться до трех недель. У детей кашель продолжается более 10 дней в 35-40% и продолжается более 25 дней в 10% случаев. Простуда является наиболее частым инфекционным заболеванием у людей, при этом средний взрослый заражается инфекцией от двух до четырех раз в год, а средний ребенок в возрасте от 6 до 12 лет заражается инфекцией несколько раз в год. В США частота возникновения форм простуды является более высокой в осенний период (осенью) и зимой, при этом большинство инфекций наблюдаются в период с сентября по апрель. Сезонность может быть связана с началом учебного года или связана с тем, что люди проводят больше времени в помещении (в непосредственной близости друг к другу), что повышает вероятность передачи вируса.
ИНФЕКЦИОННЫЙ ПЕРИОД
Простуда является наиболее заразной в течение первых двух-трех дней проявления симптомов, однако он также является заразным в течение двух дней до появления симптомов и может все еще оставаться в некоторой степени заразной до полного устранения симптомов.
РИНОВИРУС ЧЕЛОВЕКА
Риновирус человека является представителем рода Enterovirus семейства Picornaviridae. Частица HRV состоит из безоболочечного капсида размером 27-30 нм, состоящего из 4 полипептидов (VP1, VP2, VP3 и VP4). Капсид вируса содержит геном в виде одноцепочечной РНК, состоящей из приблизительно 7200 оснований. Белок, кодируемый вирусом (VPg), ковалентно присоединен к 5'концу РНК генома. Клиническое течение инфекции, вызванной риновирусом человека (HRV), было хорошо охарактеризовано. HRV могут инфицировать верхние и нижние дыхательные пути, слизистую оболочку носа, носовые пазухи и среднее ухо, и инфекции вызывают симптомы “простуды” (см. выше). Инфекции являются локальными и, как правило, ограничиваются верхними дыхательными путями. Число периферических лейкоцитов может быть повышенным в течение первых 2-3 дней инфекции.
Инфицирование HRV может также приводить к инфекции нижних дыхательных путей, отиту среднего уха (особенно у маленьких детей) и синуситу. Серьезные осложнения риновирусной инфекции (такие как пневмония) являются редкими, и сообщалось, что они наблюдаются у младенцев и маленьких детей, особенно у таковых с первопричинными патологическими состояниями, такими как бронхолегочная дисплазия, врожденный порок сердца, недоношенность и неврологические состояния, и у взрослых с ослабленным иммунитетом (у реципиентов трансплантированного костного мозга). При том, что другие представители семейства Picornaviridae (т.е. вирус полиомиелита, энтеровирус) могут инфицировать центральную нервную систему, об инфекции центральной нервной системы человека, вызываемой HRV, не сообщалось.
ЛЕЧЕНИЕ
Не существует коммерческих противовирусных средств для лечения риновирусных инфекций или предупреждения форм насморка. Лечение инфекций верхних дыхательных путей, вызываемых риновирусами, основано на контроле симптомов (чихания, заложенности носа, ринореи, раздражения глаз, боли в горле, кашля, головных болей, лихорадки, озноба), как правило, при помощи безрецептурных антигистаминных средств, аспирина, средств от кашля и средств против заложенности носа. Контроль более серьезных осложнений инфекций, вызываемых HRV (например, пневмонии), осуществляют при помощи подходящих с медицинской точки зрения стандартов ухода.
СТОИМОСТЬ И МЕДИЦИНСКАЯ НЕОБХОДИМОСТЬ
Согласно данным Всемирной организации здравоохранения в прошлом году в США сообщалось о более чем 1 миллиарде случаев простуды. В США простуда приводит к 75-100 миллионам визитов к врачу ежегодно, при этом их стоимость по предварительным подсчетам составляет 7,7 миллиарда долларов в год. Американцы тратят 2,9 миллиарда долларов на безрецептурные лекарственные средства и еще 400 миллионов долларов на рецептурные лекарства для облегчения симптомов. По оценкам ежегодно пропускается 22-189 миллионов дней занятий в школе в связи с простудой. В результате родители пропускают 126 миллионов рабочих дней, оставаясь дома для ухода за своими детьми. Вдобавок к 150 миллионам рабочих дней, пропускаемых работниками, страдающими простудой, общее экономическое влияние нетрудоспособности, связанной с простудой, превышает 20 миллардов долларов в год. Это составляет 40% потерянного рабочего времени.
Эпителиальные клетки дыхательных путей являются основной мишенью для возбудителей инфекции верхних дыхательных путей (URT), таких как рино- и коронавирусы. Поскольку инфекция, вызываемая этими вирусами, наблюдается до появления симптомов, отражающих элиминацию инфицированных клеток иммунной системой, прямое противовирусное терапевтическое вмешательство вряд ли окажется очень эффективным. В дополнение, установление и поддержание активных уровней противовирусных соединений прямого действия в слизистой оболочке носа является очень сложным в связи с высокими темпами их метаболизма. С другой стороны, ранее было показано, что профилактика путем задействования собственных защитных сил организма и индукции противовирусного состояния в эпителиальных клетках носа приводит к значительной защите от последующего контрольного заражения вирусом, а также к снижению интенсивности симптомов, связанных с заболеванием.
Хотя простуды могут продолжаться в течение только одной или двух недель, тяжелые простуды могут продолжаться до месяца. Взрослые в среднем заболевают простудой два-три раза в год, а дети - от шести до десяти в зависимости от их возраста и продолжительности контакта. Существуют сотни различных серотипов вируса простуды, что делает невозможным разработку стандартной схемы вакцинопрофилактики, которая была бы эффективной против всех из них.
Симптоматическое лечение обычно включает применение снотворных антигистаминных средств для перорального применения и/или сосудосуживающих средств против заложенности носа, обладающих стимулирующими побочными эффектами. Это является эффективным лишь в незначительной степени, и эти побочные эффекты часто ослабляются по мере ослабления самой инфекции. Хотя предотвращение было бы оптимальным решением, по причинам, перечисленным выше, вероятность создания эффективной вакцины широкого спектра действия против всех различных серотипов в ближайшем будущем является весьма малой. Таким образом, люди, в отношении которых не применяется карантин, будут регулярно подвергаться воздействию этих возбудителей инфекции, особенно в течение “холодного времени года”, и, следовательно, подходящее эффективное профилактическое средство широкого спектра действия, не обладающее побочными эффектами, будет оказывать значительное влияние на состояние здоровья населения и производительность на рабочем месте.
Целенаправленное воздействие на врожденную иммунную реакцию, “систему раннего предупреждения” организма, будет решать вышеупомянутые проблемы. Соответствующая стимуляция этой системы, имеющейся в эпителиальных клетках носа, приводит к тому, что клетки думают, что они атакованы вирусом, и запускает противовирусную защитную реакцию. Как только это происходит, клетки становятся невосприимчивыми к последующей атаке вируса. Хотя в некоторых ранних работах, выполненных в конце 1980-х гг., рассматривалось применение иммуностимулирующих молекул, таких как интерферон, для запуска врожденной иммунной реакции, их производство было дорогостоящим, а эффекты сложно было контролировать.
Целью настоящего исследования была разработка состава на основе запускающей молекулы (Poly(I:C)), который можно применять измеримым и контролируемым способом, например, каждые два дня или даже раз в неделю, для приведения в готовность врожденной иммунной системы и обеспечения защиты от вирусной инфекции. В подходе, изложенном ниже, используют существующее средство, Poly(I:C), которое продемонстрировало эффективность, но которое является непрактичным, и делают его подходящим и эффективным, применяя знания о составах.
Toll-подобный рецептор 3 (TLR3) представляет собой белок, который у людей кодируется геном TLR3. TLR3 является представителем семейства Toll-подобных рецепторов в составе образраспознающих рецепторов врожденной иммунной системы, который играет фундаментальную роль в распознавании патогенов и активации врожденного иммунитета. В ряду от дрозофил до людей TLR являются высококонсервативными и обладают структурными и функциональными сходствами. Они распознают патоген-ассоциированные молекулярные образы (PAMP), экспрессируемые возбудителями инфекции, и опосредуют выработку цитокинов, необходимых для развития эффективного иммунитета. Различные TLR проявляют разные паттерны экспрессии. Этот рецептор TLR3 также экспрессируется эпителиальными клетками дыхательных путей и ограничен субпопуляцией дендритных клеток в составе лейкоцитов.
TLR3 распознает двухцепочечную РНК (dsRNA). Двухцепочечная РНК представляет собой РНК с двумя комплементарными цепями, которая может быть образована в ходе цикла репликации вируса. После распознавания TLR 3 индуцирует активацию факторов транскрипции, таких как NF-κB и регуляторный фактор интерферонов 3 (IRF3), для увеличения выработки интерферонов I типа, которые передают сигналы другим клеткам для усиления их противовирусных защитных реакций.
Структура TLR3 представлена в форме большой подковы, которая соединяется с соседней подковой, образуя "димер" из двух подков. Значительная часть поверхности белка TLR3 покрыта молекулами сахаров, что делает его гликопротеином, но на одной внешней стороне (в том числе на предполагаемой границе контакта между двумя подковами) имеется большая поверхность, на которой не содержатся сахара. Эта поверхность также содержит два различных участка, богатых положительно заряженными аминокислотами, которые могут быть местом связывания с отрицательно заряженной двухцепочечной РНК.
Полиинозиновая-полицитидиловая кислота (Poly(I:C)) является двухцепочечной молекулой РНК с распределением по MW до 1000000 дальтон. Poly(I:C) является лигандом Toll-подобного рецептора 3 (TLR3), который имитирует вирусную РНК и является известным стимулятором врожденной иммунной реакции. При назальном введении он индуцирует экспрессию противовирусных белков, таких как интерферон α и β, в назальном эпителии. Было продемонстрировано, что он уменьшает количество и тяжесть риновирусных инфекций.
Poly(I:C) является нестабильной молекулой в водных растворах. На данный момент, чтобы достичь эффективного терапевтического или профилактического эффекта, Poly(I:C) необходимо повторно растворить непосредственно перед применением и вводить каждые 2 часа. Для улучшения комплаентности пациентов и снижения частоты введения дозы был разработан новый состав, являющийся стабильным и демонстрирующий повышенную эффективность.
Poly(I:C) составлялась с несколькими биоадгезивными полимерами, могущими продлевать время пребывания в назальном эпителии и обеспечивать более эффективную и регулируемую стимуляцию врожденной иммунной системы.
Настоящее изобретение обеспечивает определение уникального состава, который можно хранить почти неограниченно при комнатной температуре и который сохраняет свою стимулирующую активность в отношении врожденной иммунной системы.
В дополнение, состав повышает эффективность Poly(I:C) и позволяет осуществлять гораздо менее частое введение дозы при даже большей стимулирующей активности в отношении TLR3.
Настоящее изобретение, таким образом, относится к композиции, содержащей микрочастицы полиинозиновой-полицитидиловой кислоты (Poly(I:C)) и полимера-носителя, выбранного из крахмала, альгината, бланозы или DPPC (дипальмитоилфосфатидилхолина). Микрочастицы являются частицами со средним размером частицы от 0,1 мкм до 100 мкм. Предпочтительно, полимер-носитель представляет собой крахмал, полученный из кукурузы, картофеля или маниока.
Микросферы на основе поли(I:C) и полимера-носителя, или также так называемые микрочастицы, содержащиеся в композиции, получают посредством способа образования частиц, такого как способ распылительной сушки.
Соотношение Poly(I:C)/крахмал согласно настоящему изобретению варьируется в диапазоне от 1/200 (вес/вес) до 1/0,1 (вес/вес), но предпочтительно от 1/100 (вес/вес) до 1/1 (вес/вес) и даже более предпочтительно от 1/100 (вес/вес) до 1/5 (вес/вес), при этом соотношение Poly(I:C)/крахмал от 1/12 до 1/9 (вес/вес) является наиболее предпочтительным.
Dv50 (= суммарный показатель объемного распределения, соответствующий размеру, который не превышают 50% частиц) микрочастиц в композиции согласно настоящему изобретению варьируется в диапазоне от 0,1 микрометра до 200 микрометров, предпочтительно от 1 микрометра до 50 микрометров, более предпочтительно от 2 микрометров до 40 микрометров, еще более предпочтительно от 2 микрометров до 20 микрометров и наиболее предпочтительно от 10 микрометров до 20 микрометров.
Композиция по настоящему изобретению может также быть жидкой композицией, содержащей органический растворитель, где органический растворитель является таковым на основе глицерина, или этанола, или их комбинации.
Композицию по настоящему изобретению можно применять в медицине предпочтительно для применения в предотвращении и/или лечении вирусных инфекций верхних дыхательных путей, например, называемых “простудами”.
Композицию по настоящему изобретению могут применять пациенты, страдающие от астмы и/или COPD (хронического обструктивного заболевания легких), в целях возможного предотвращения и/или лечения наступающих симптомов простуды.
Предпочтительный способ предупреждения и/или лечения инфекций верхних дыхательных путей осуществляют путем назального введения.
Композицию по настоящему изобретению, содержащую микрочастицы полиинозиновой-полицитидиловой кислоты (поли(I:C)) и полимера-носителя, выбранного из крахмала, альгината, бланозы или DPPC (дипальмитоилфосфатидилхолина), можно применять для лечения и/или предотвращения (вирусных) инфекций или простуды, при этом композиция вводится посредством внесения в нос с промежутком времени, который находится в диапазоне от одного дня до одного месяца, более предпочтительно каждые два дня или даже раз в неделю.
Вышеупомянутую композицию, в которой соотношение Poly(I:C)/крахмал варьируется в диапазоне от 1/200 (вес/вес) до 1/0,1 (вес/вес), но предпочтительно от 1/100 (вес/вес) до 1/1 (вес/вес) и даже более предпочтительно от 1/100 (вес/вес) до 1/5 (вес/вес), при этом соотношение Poly(I:C)/крахмал от 1/12 до 1/9 (вес/вес) является наиболее предпочтительным, в сочетании с размером микрочастиц в композиции, варьирующимся в диапазоне от 0,1 микрометра до 200 микрометров, предпочтительно от 1 микрометра до 50 микрометров, более предпочтительно от 2 микрометров до 40 микрометров, еще более предпочтительно от 2 микрометров до 20 микрометров и наиболее предпочтительно от 10 микрометров до 20 микрометров, можно применять для лечения и/или предотвращения (вирусных) инфекций или простуды, при этом указанная композиция вводится посредством внесения в нос с промежутком времени, который находится в диапазоне от одного дня до одного месяца, более предпочтительно каждые два дня или даже раз в неделю.
Частью настоящего изобретения также является устройство, в частности, система назальной доставки, содержащее композицию согласно настоящему изобретению.
Согласно настоящему изобретению Poly(I:C) составляют в виде сухого порошка для назального введения. Для улучшения стабильности Poly(I:C) подвергают распылительной сушке из водной смеси, содержащей высушенный в барабанной сушилке крахмал из восковой кукурузы и Poly(I:C).
Полагают, что крахмал имеет двойную функцию: (1) действует в качестве биоадгезивного средства в носу, (2) амилопектин, присутствующий в высокой концентрации в крахмале из восковой кукурузы, разрушается амилазами в носу с высвобождением Poly(I:C).
Назальное введение предпочтительно выполняют при помощи устройства для введения разовой дозы назального порошка (однодозовое устройство, поставляемое Aptar Pharma, Германия). Однодозовое устройство представляет собой систему активной доставки, что означает, что пациенту не нужно вдыхать, а действие не зависит от пациента. Введение дозы осуществляется путем приведения в действие, контролируемого избыточным давлением. Объем дозы в расчете на одно впрыскивание определяется по концентрации Poly(I:C) в подвергнутом распылительной сушке порошке и отгруженной массе порошка. Порошок будет вводиться в каждую ноздрю с применением нового устройства для каждого впрыскивания.
Как упоминалось ранее, Poly(I:C) представляет собой синтетическую двухцепочечную РНК, состоящую из антипараллельных полинуклеотидных цепей натриевых солей инозиновой кислоты и цитидиловой кислоты. Цепи нековалентно связаны водородными связями, образованными между инозиновыми и цитозиновыми основаниями.
Средняя длина цепи Poly(I:C) варьируется в диапазоне от 300 до 6000 пар оснований, что соответствует от приблизительно 180000 до 3600000 дальтон. Молекулярная формула представляет собой (C10H10N4NaO7P)x⋅(C9H11NaN3O7P)x.
Вышеупомянутый Poly(I:C) можно закупить, но также можно необязательно получить своими силами, применяя, например, следующую процедуру.
Двойной продукт Poly(I:C) изготавливают из отдельных гомополимеров полиинозина (I) и полицитидина (C). Поли I и поли C синтезируют путем полимеризации нуклеозиддифосфатов инозина и цитидина по отдельности в присутствии полинуклеотида фосфорилазы (PNPase). Каждый нуклеозиддифосфат по отдельности полимеризуется с помощью PNPase в течение 20–24 ч. для контроля длины получаемого в результате полимера рибонуклеиновой кислоты. Затем добавляют фермент, протеинкиназу, для завершения реакции полимеризации. Полученные в результате гомополимеры (т.е. одноцепочечные молекулы РНК) подвергают гидролизу для контроля того, чтобы диапазон молекулярных масс каждого полимерного продукта находился в установленных пределах. Гидролизованный продукт обрабатывают этанолом для осаждения одноцепочечных молекул РНК (ssRNA) из раствора. Осадок отделяют от надосадочной жидкости и растворяют в воде. Раствор ssRNA затем фильтруют с удалением макрочастиц, подвергают ультрафильтрации с удалением низкомолекулярных загрязняющих примесей и затем лиофилизируют. Лиофилизированные продукты в виде ssRNA по отдельности тестируют в отношении чистоты, молекулярной массы и других показателей качества для обеспечения соответствия продуктов установленным требованиям.
Отдельные одноцепочечные гомополимеры (поли I и поли C) по отдельности растворяют в 0,015 M хлориде натрия и затем в сочетании с отжигом цепей формируют двухцепочечный двойной продукт (поли I:поли C). После смешивания полученный в результате раствор фильтруют. Фильтрат подвергают ультрафильтрации с удалением низкомолекулярных загрязняющих примесей. Подвергнутый ультрафильтрации продукт затем лиофилизируют. Полученный в результате двойной продукт хранят при -20°C. Лиофилизированный продукт в виде dsRNA тестируют в отношении чистоты, молекулярной массы и других показателей качества для обеспечения соответствия продукта установленным требованиям.
Материалы и способы
Натриевые соли полиинозиновой-полицитидиловой кислоты (Poly(I:C), Midland Certified Reagent Company Inc (Техас, США), № партии 020905, частично прежелатинизированный кукурузный крахмал, Stada AG (Бад-Фильбель, Германия), № партии 93301-9628, натрий-карбоксиметилцеллюлоза (бланоза 7MF), Ashland Aqualon (Уилмингтон, Делавэр, США) № партии 3-30172, дипальмитоилфосфатидилхолин (Lipoid PC 16:0/16:0), Lipoid GmbH (Людвигсхафен, Германия), № партии 563098-01/049, моногидрат лактозы (#316 Fast Flo), Foremost (Барабу, Висконсин, США), № партии 8509052261, альгинат натрия (Protanal LF10/60LS), FMC Biopolymer (Драммен, Норвегия), № партии S19616, абсолютный этанол Chem-Lab (Зедельгем, Бельгия), № партии 17.2712904.400.
Биологическая активность Poly(I:C) in vitro
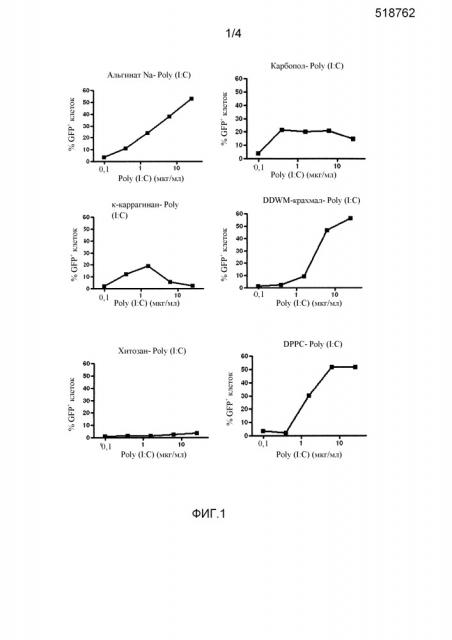
Клетки A549, чувствительные к Poly(I:C) (эпителиальные клетки альвеолярной карциномы человека), инфицировали вектором, содержащим длинный промотор гена IFN-β1 (положения 21069463-21067869 в хромосоме 9), объединенный с конструктом на основе гена зеленого флуоресцентного белка (GFP) и гена люциферазы Renilla (конструктом B1L-GAR5). После стимуляции с помощью Poly(I:C) активируется сигнальный путь IFN, что в результате приводит к активации конструкта с репортерами B1L-GAR5 и экспрессии генов-репортеров GFP и люциферазы. Для получения клона клеток с высокой реактивностью клетки, стимулированные с помощью Poly(I:C), сортировали по высокому уровню экспрессии GFP с помощью проточного цитометра FACS Aria (Becton Dickinson), и из >200 клонов выбрали клон H10 на основе % клеток, реактивных в отношении Poly(I:C). Клетки A549-B1L-GAR5-H10 выращивали до достижения клетками конфлюэнтности во флаконах для тканевых культур, после чего среду обновляли, а клетки культивировали в течение дополнительных четырех дней. Затем клетки собирали при помощи стандартной трипсинизации, подсчитывали и высевали на 96-луночные плоскодонные планшеты при 50000 клеток на лунку и стимулировали в течение ночи интерфероном β (75 ЕД/мл) в 100 мкл. На следующий день к клеткам добавляли 100 мкл смесей Poly(I:C) и полимера-носителя в соотношении Poly(I:C):полимер = 1:5, в результате чего получали конечный объем 200 мкл, и клетки инкубировали в течение дополнительных 24 ч. После инкубирования клетки собирали (при помощи разделения, опосредованного трипсином) и анализировали на проточном цитометре BD-Calibur.
Распылительная сушка Poly(I:C) с полимерами-носителями
Способ распылительной сушки альгината, CMC (бланозы) и частично прежелатинизированного кукурузного крахмала осуществляли в нанораспылительной сушилке B90 и в распылительной мини-сушилке Buchi B290 (Buchi, Флавиль, Швейцария). Как правило, эксперименты по распылительной сушке с помощью нанораспылительной сушилки B90 обуславливали низкие выходы по причине высокой вязкости растворов. Деминерализованную воду фильтровали при помощи фильтра из ацетата целлюлозы на 0,2 микрона (Whatman FP30/0,2 CA-S) и добавляли в аналитический стакан. Наполнители добавляли при перемешивании с помощью магнитной мешалки. После полного растворения в раствор добавляли Poly(I:C). Для всех вариантов применяли общую концентрацию твердых веществ 0,5% (вес/вес) и соотношение Poly(I:C)/наполнитель 1/9 (вес/вес). Составы исходных растворов приведены в таблице 1A.
| Таблица 1AСоставы исходных смесей для вариантов с альгинатом, CMC и частично прежелатинизированным кукурузным крахмалом | |||
| материал | Количество (г) | ||
| альгинат | CMC | частично прежелатинизированный кукурузный крахмал | |
| альгинат Na (Protanal LF 10/60LS) | 1,35 | ||
| Na-CMC (бланоза 7 MF) | 1,35 | ||
| DDWM | 1,35 | ||
| Poly(I:C) | 0,15 | 0,15 | 0,15 |
| Деминерализованная вода | 300 | 300 | 300 |
Для варианта DPPC-Poly(I:C) определяли растворимость DPPC (дипальмитоилфосфатидилхолин) в различных смесях этанол/вода. При распылительной сушке чистого DPPC получаемый выход был низким и составлял примерно 25%. Поэтому рассматривали возможность добавления материала-носителя. По причине осаждения Na-CMC, альгината Na, крахмала из восковой кукурузы и мальтодекстрина при добавлении этанола в качестве носителя для распылительной сушки Poly(I:C) с DPPC выбрали лактозу. Деминерализованную воду фильтровали при помощи фильтра из ацетата целлюлозы на 0,2 микрона (Whatman FP30/0,2 CA-S) и добавляли в аналитический стакан. Лактозу добавляли при перемешивании с помощью магнитной мешалки. После растворения оба раствора смешивали и нагревали до 60°C. После полного растворения раствор охлаждали до комнатной температуры и добавляли Poly I:C. Применяли общую концентрацию твердых веществ 0,28% (вес/вес) и соотношение Poly(I:C)/лактоза/DPPC 1/2,25/6,75 (вес/вес/вес). Состав исходного раствора показан в таблице 1B.
| Таблица 1B Составы исходных смесей для вариантов с DPPC | |
| Материал | Количество (г) |
| DPPC | |
| DPPC (Lipoid PC 16:0/16:0) | 1,35 |
| Абсолютный этанол | 430,80 |
| Моногидрат лактозы (#316 Fast Flo) | 0,45 |
| Poly(I:C) | 0,20 |
| Деминерализованная вода | 287,20 |
Распылительную сушку этих растворов осуществляли в лабораторной распылительной сушилке типа B 290 с петлей для инертного газа (Buchi, Флавиль, Швейцария). Растворы подавались в двухпоточную форсунку (диаметр: 0,7 мм) в верхней части распылительной сушилки посредством перистальтического насоса типа 520U (Watson Marlow, Корнуолл, Великобритания). Распылительная сушилка функционировала в режиме параллельного потока азота. Подвергнутые распылительной сушке частицы собирали в резервуаре, присоединенном к циклонному уловителю. После сбора частиц циклонный уловитель охлаждали до комнатной температуры. Собранный порошок переносили в пузырьки из янтарного стекла в боксе биологической безопасности. Пузырьки продували азотом, закрывали и хранили при 5°C. Параметры способа приведены в таблице 2.
| Таблица 2Условия способа | ||||
| Параметр способа | Целевое значение | |||
| альгинат | CMC | частично прежелатинизированный кукурузный крахмал | DPPC | |
| Температура сушильного азота на входе (°C) | 150 | 150 | 150 | 100 |
| Температура сушильного азота на выходе (°C) | 70 | 70 | 70 | 50 |
| Скорость подачи (г/мин.) | 4,0 | 4,1 | 4,0 | 5,3 |
| Температура конденсатора (°C) | NA | NA | NA | 10 |
| Аспирация сушильного азота (%) | 100 | 100 | 100 | 100 |
| Падение давления азота для мелкодисперсного разбрызгивания (бар) | 0,3 | 0,3 | 0,3 | 0,3 |
| Концентрация кислорода (%) | <6 | <6 | <6 | <6 |
Распылительная сушка дополнительных вариантов Poly(I:C) - частично прежелатинизированный кукурузный крахмал
Способ распылительной сушки осуществляли в распылительной мини-сушилке Buchi B290 (Buchi, Флавиль, Швейцария). Воду, не содержащую нуклеаз, добавляли в аналитический стакан, и частично прежелатинизированный кукурузный крахмал добавляли при перемешивании при помощи Ultra Turax T25 (Janke & Kunkel), пока крахмал полностью не диспергировался. Poly(I:C) растворяли в воде, не содержащей нуклеаз, и перемешивали с помощью магнитной мешалки, пока Poly(I:C) полностью не растворился. Растворенный Poly(I:C) добавляли к диспергированному крахмалу и перемешивали при комнатной температуре, раствор Poly(I:C) получали непосредственно перед распылительной сушкой. Применяли общую концентрацию твердых веществ 10% (вес/вес) или 0,45% и соотношение Poly(I:C)/крахмал 1/200-1/100-1/50-1/24-1/9 (вес/вес). Составы исходных смесей для этих составов показаны в таблице 3A.
| Таблица 3A Составы исходных смесей для вариантов с частично прежелатинизированным кукурузным крахмалом | ||||||
| Материал | Количество (г) | |||||
| 1/200 10% | 1/100 10% | 1/50 10% | 1/24 10% | 1/9 10% | 1/9 0,45% | |
| Частично прежелатинизированный кукурузный крахмал (г) | 50,25 | 25,25 | 25,5 | 12,5 | 9 | 4,5 |
| Poly(I:C) (г) | 0,25 | 0,25 | 0,500 | 0,500 | 1 | 0,5 |
| Вода, не содержащая нуклеаз (г) | 454,5 | 229,5 | 234 | 117 | 90 | 1106 |
Растворы подавались в двухпоточную форсунку (диаметр: 0,7 мм) в верхней части распылительной сушилки посредством перистальтического насоса. Распылительная сушилка функционировала в режиме параллельного потока азота. Подвергнутые распылительной сушке частицы собирали в резервуаре, присоединенном к циклонному уловителю. После сбора частиц стеклянный цилиндр и циклонный уловитель охлаждали до комнатной температуры. Собранный порошок переносили в бутылку из янтарного стекла, и эту бутылку помещали в алюминиевый пароизолированный пакет. Флаконы хранили при комнатной температуре. Параметры способа приведены в таблице 3B.
| Таблица 3ВУсловия способа | ||
| Параметр способа | 200/1–100/1–50/1–24/1–9/1 10% вес/вес | 9/1 0,45% вес/вес |
| Температура сушильного азота на входе (°C) | 180 | 150 |
| Температура сушильного азота на выходе (°C) | 95-112 | 75-95 |
| Скорость подачи (г/мин) | 6-9 | 5-6 |
| Температура конденсатора (°C) | 10 | 10 |
| Аспирация сушильного азота (%) | 100 | 100 |
| Падение давления азота для мелкодисперсного разбрызгивания (бар) | 0,3 | 0,4 |
| Концентрация кислорода (%) | <6 | <6 |
Сканирующая электронная микроскопия
На образцы напыляли частицы золота диаметром +/-30-50 нм. Изображения создавали с помощью сканирующего электронного микроскопа FEI типа Quanta 200F с детектором Эверхарта-Торнли.
Содержание воды - титрование по Карлу Фишеру
Содержание воды в вариантах определяли посредством прямого волюметрического титрования по Карлу Фишеру. Применяли титратор KF V30 (Mettler Toledo, США). Порошок (50-100 мг) переносили в сосуд для титрования, содержащий сухой метанол Hydranal® (Sigma Aldrich), и перемешивали в течение 300 секунд. Титрование осуществляли с помощью Hydranal® композита-2 (Sigma Aldrich) в концентрации 2 мг/мл при помощи бюретки на 5 мл. Для прекращения применяли величину дрейфа, определяющую окончание титрования, составляющую 15 мкг/мин. Образцы анализировали в трех повторностях.
Определение размера частиц
Существует тенденция к оценке данных по распределению размера частиц всего лишь на основе объемного распределения продуктов, представляющих интерес. Таким образом, оценка часто ограничивается сравнением суммарных показателей, соответствующих размеру, который не превышает определенная доля частиц - Dv10, Dv50 и Dv90.
Однако сравнение суммарных показателей, соответствующих размеру, который не превышает определенная доля частиц - dvx, не всегда может быть эффективным в связи с тем фактом, что различные методики и приборы без труда приводят к различным результатам.
В дополнение, из данных по распределению размера (или формы) частиц можно получить больше информации, рассматривая данные в другом аспекте (т.е. применяя другие параметры).
Для определения распределения размера частиц применяли способ тестирования на основе лазерной дифракции.
Анализ выполняли на лазерном дифрактометре Mastersizer 2000 от Malvern, оснащенном модулем диспергирования в жидкой среде Hydro2000S (или эквивалентной системой). Прибор применяют в режиме детекции при включенном синем свете в диапазоне размеров от 20 нм до 2 мм.
Тестирование составов in vivo в мышиной модели гриппа
Все исследования на животных были одобрены комитетом по этике и выполнялись согласно национальным и международным методическим указаниям. Применяли самок швейцарских мышей в возрасте 8-12 недель (Janvier). Все интраназальные обработки проводили под анестезией изофлураном. Для введения определенного количества жидкости каплю наносили непосредственно на верхушку ноздри, и посредством закрывания рта капле позволяли проникнуть через ноздрю в полость носа. Подвергнутые распылительной сушке порошки на основе Poly(I:C) и носителя были свежеприготовленными непосредственно пер