Продуцируемый бактериями микроцин с, новый антимикробный пептид, эффективный против патогенных микроорганизмов, например энтерогеморрагической escherichia coli (ehec)
Иллюстрации
Показать всеНастоящее изобретение относится к биохимии, генной инженерии и биотехнологии, в частности к новым полипептидам с антимикробной активностью в отношении энтерогеморрагических бактерий вида Escherichia coli. Указанные полипептиды предназначены для медицинского использования, дезинфекции поверхностей, консервирования пищевых продуктов и для покрытия перевязочного материала. Изобретение также относится к способу получения указанных полипептидов и к композициям, содержащим указанные полипептиды. Настоящее изобретение позволяет получать новые полипептиды с антимикробной активностью в отношении энтерогеморрагических бактерий. 10 н. и 18 з.п. ф-лы, 6 ил., 3 табл., 5 пр.
Реферат
Область техники
Настоящее изобретение относится к выделенному полипептиду, выделенным молекулам нуклеиновых кислот, кодирующим полипептид микроцин S, и праймерам и зондам, гибридизирующимся с молекулами нуклеиновых кислот. Изобретение также относится к плазмидам и клеткам, включающим молекулы нуклеиновых кислот, антителу, связывающемуся с данным полипептидом, составам, а также способам продукции и использования полипептидов. Настоящее изобретение кроме того относится к медицинскому использованию для лечения или предотвращения микробных инфекций, функциональных расстройств желудочно-кишечного тракта или для лечения опухоли. Изобретение кроме того относится к способу сохранения пищи и способу раневого покрытия.
Предпосылки для создания изобретения
Микроцины - это синтезируемые на рибосомах антимикробные пептиды с низкой молекулярной массой. Синтез продуцируемых энтеробактериями, главным образом, Escherichia coli, микроцинов резко активируется в условиях стресса, таких как ограничение питательных веществ. Микроцины оказывают мощное антимикробное и антибактериальное действие против тесно связанных видов, что дает большое конкурентное преимущество в микрофлоре кишечника (Baquero, F., Bouanchaud, D., Martinez-Perez, M.С. & Fernandez, С. (1978) J Bacteriol 135, 342-347). Продуценты микроцина устойчивы к микроцину, который они продуцируют, что опосредовано по меньшей мере одним придающим устойчивость геном, расположенном в кластере генов. Большинство из 14 известных микроцинов кодированы плазмидой, но описаны также кодированные хромосомой антимикробные/антибактериальные пептиды. Пробиотический штамм Е. coli Nissle 1917 (EcN) продуцирует микроцины М и Н47 (Patzer, S.I., Baquero, М.R., Bravo, D., Moreno, F. & Hantke, K. (2003) Microbiology 149, 2557-2570). Пробиотики определены как живые микроорганизмы, которые при приеме в определенном количестве оказывают благотворное влияние на здоровье помимо присущего им базового питания. Механизмы, которые позволяют штамму быть пробиотиком, поняты плохо. Тем не менее антимикробная деятельность микроцинов может положительно влиять на интестинальный баланс. Предполагая отсутствие патогенных факторов, а также хорошо апробированную клиническую безопасность, штамм, продуцирующий микроцин, может четко соответствовать определению пробиотика. В противоположность энтеробактериальным микроцинам, содержащиеся в пище бактерии молочной кислоты продуцируют пептидные антибиотики, содержащие лантионин. Так называемые лантибиотики грамположительных бактерий уже используются для консервирования пищевых продуктов (Kuipers, A., Rink, R. & Moll, G.N. (2011) Prokaryotic Antimicrobial Peptides: From Genes to Applications (Springer Science+Business Media, Berlin). Еще двумя также обсуждающимися применениями бактериоцинов является их использование в качестве противоопухолевого агента (Hetz, С., Bono, М.R., Barros, L.F. & Lagos, R. (2002) Proc Natl Acad Sci USA99, 2696-2701) или в качестве альтернативы классическим антибиотикам при инфекционных заболеваниях (Dicks, L.М. Т., Heunis, Т.D.J., van Staden, D.A., Brand, A., Sutyak Noll, K. & Chikindas, M.L. (2011) Prokaryotic Antimicrobial Peptides: From Genes to Applications (Springer Science + Business Media, Berlin), Gillor, O., Kirkup, В.C. & Riley, M.A. (2004) Adv. Appl Microbiol 54, 129-146).
В течение десятилетий и в настоящее время лечение бактериальных инфекций главным образом основано на классических антибиотиках. Однако появление патогенов, устойчивых к этим классическим антибиотикам, является огромной проблемой. Следовательно, остающиеся варианты лечения ограничены еще больше. Это негативное влияние также заметно в других экономических важных отраслях промышленности, как, например, в пищевой промышленности.
Раскрытие изобретения
Техническая задача
Настоящее изобретение создано в свете известного уровня техники, описанного выше, и с учетом возрастающего спроса на новые антибактериальные и профилактические агенты для медицины и ветеринарии. Все большим вызовом является терапия штаммов бета-лактамаз (ESBL) расширенного спектра. Цель настоящего изобретения заключается в том, чтобы предложить новый антимикробный полипептид микроцин, который можно использовать в качестве альтернативы традиционным антибиотикам и, таким образом, для борьбы с патогенными микроорганизмами, которые являются продуцентами ESBL. В этом отношении цель настоящего изобретения заключается в том, чтобы предложить новый антимикробный полипептид микроцин, который можно использовать при лечении патогенных грамотрицательных бактерий, включая продуцирующие ESBL Е. coli, а также включая высоко вирулентный энтерогеморрагический штамм Е. coli (ЕНЕС), который является каузативным патогеном, недавно широко распространившимся в Германии (Frank, С., et al. (2011) N Engl J Med 10.1056/NEJMoal 106483; Mellmann, A., et al. (2011) PLoS ONE 6(7): e22751. doi: 10.1371). Клетки ЕНЕС высвобождают повышенные количества шига-токсинов при лечении определенными антибиотиками. Поэтому сообщалось, что пациентам противопоказано лечение антибиотиками. Новый полипептид микроцин должен быть эффективен для лечения и предотвращения инфекций, вызываемых ЕНЕС и энтеропатогенными Е. coli (ЕРЕС). Еще одна цель изобретения заключается в том, чтобы предложить новый антимикробный полипептид микроцен, который можно использовать для лечения функциональных нарушений желудочно-кишечного тракта, в частности синдрома раздраженной толстой кишки, у взрослых и детей. Еще одна цель изобретения заключается в том, чтобы предложить композиции, которые включают клетки нового полипептида микроцина, продуцирующие новый полипептид микроцин для упомянутого медицинского использования. Также цель настоящего изобретения заключается в том, чтобы предложить новый полипептид микроцин, который можно использовать для лечения рака, который можно использовать для консервирования пищевых продуктов и можно использовать для раневого покрытия.
Раскрытие изобретения
Для решения этой задачи настоящее изобретение в одном его аспекте относится к выделенному полипептиду, причем полипептид:
a) включает аминокислотную последовательность, которая по меньшей мере на 50% или больше идентична аминокислотной последовательности SEQ ID NO: 6 или SEQ ID NO: 7;
b) кодирован молекулой нуклеиновой кислоты, включающей нуклеотидную последовательность, которая по меньшей мере на 50% или больше идентична нуклеотидной последовательности, включая нуклеотидную последовательность любой одной из SEQ ID NO: 1, 2, 3, 4 или 5 или ее комплемент;
c) кодирован молекулой нуклеиновой кислоты, которая гибридизирует нуклеотидную последовательность, комплементарную нуклеотидной последовательности, включая последовательность нуклеотидов любой одной из SEQ ID NO: 1, 2, 3, 4 или 5 или ее комплемент в жестких условиях; или d) включает встречающийся в природе аллельный вариант полипептида, включающий аминокислотную последовательность SEQ ID NO: 6 или SEQ ID NO: 7.
Более конкретно, описан выделенный полипептид, причем полипептид:
a) включает аминокислотную последовательность, которая по меньшей мере на 70% или больше идентична аминокислотной последовательности SEQ ID NO: 6 или SEQ ID NO: 7, причем полипептид включает аминокислотную последовательность с антимикробной активностью;
b) кодирован молекулой нуклеиновой кислоты, включающей нуклеотидную последовательность, которая по меньшей мере на 70% или больше идентична нуклеотидной последовательности, включая нуклеотидную последовательность любой одной из SEQ ID NO: 1, 2, 3, 4 или 5 или ее комплемент, причем нуклеотидная последовательность, включая SEQ ID NO: 1, отвечает за продукцию полипептида по меньшей мере с антимикробной активностью или аутоиммунной активностью микроцина S или транспортной активностью микроцина S, причем нуклеотидная последовательность, включающая SEQ ID NO: 2, отвечает за продукцию полипептида с антимикробной активностью, и причем нуклеотидная последовательность, включающая SEQ ID NO: 3, отвечает за продукцию полипептида с аутоиммунной активностью микроцина S, и причем нуклеотидная последовательность, включающая SEQ ID NO: 4, отвечает за продукцию полипептида с транспортной активностью для микроцина S, и причем нуклеотидная последовательность, включающая SEQ ID NO: 5 отвечает за продукцию полипептида с транспортной активностью для микроцина S;
c) кодирован молекулой нуклеиновой кислоты, которая гибридизирует нуклеотидную последовательность, комплементарную нуклеотидной последовательности, включая последовательность нуклеотидов любой одной из SEQ ID NO: 1, 2, 3, 4 или 5 или ее комплемент, в жестких условиях, причем нуклеотидная последовательность, включающая SEQ ID NO: 1 отвечает за продукцию полипептида по меньшей мере с антимикробной активностью или аутоиммунной активностью микроцина S или транспортной активностью микроцина S, причем нуклеотидная последовательность, включающая SEQ ID NO: 2, отвечает за продукцию полипептида с антимикробной активностью, и причем нуклеотидная последовательность, включающая SEQ ID NO: 3, отвечает за продукцию полипептида с аутоиммунной активностью микроцина S, и причем нуклеотидная последовательность, включающая SEQ ID NO: 4, отвечает за продукцию полипептида с транспортной активностью для микроцина S, и причем нуклеотидная последовательность, включающая SEQ ID NO: 5, отвечает за продукцию полипептида с транспортной активностью для микроцина S; или
d) включает встречающийся в природе аллельный вариант полипептида, включающего аминокислотную последовательность SEQ ID NO: 6 или SEQ ID NO: 7, причем полипептид включает аминокислотную последовательность с антимикробной активностью.
Термин "антимикробная активность" должен пониматься как антимикробная активность, вызванная микроцином, конкретно микроцином S.
В еще одном аспекте изобретения представлена выделенная молекула нуклеиновой кислоты, кодирующая полипептид микроцин S, причем упомянутая молекула нуклеиновой кислоты:
a) включает нуклеотидную последовательность, которая по меньшей мере на 50% или больше идентична любой одной из SEQ ID NO: 1, 2, 3, 4 или 5 или ее комплементу,
b) включает молекулу нуклеиновой кислоты, которая гибридизирует нуклеотидную последовательность, комплементарную нуклеотидной последовательности, включая нуклеотидную последовательность любой одной из SEQ ID NO: 1, 2, 3, 4 или 5 или ее комплемент в жестких условиях;
c) включает нуклеотидную последовательность, которая кодирует полипептид, включающий аминокислотную последовательность, которая по меньшей мере на 50% или больше идентична аминокислотной последовательности SEQ ID NO: 6 или SEQ ID NO: 7; или
d) включает молекулу нуклеиновой кислоты, которая кодирует встречающийся в природе аллельный вариант полипептида, включающий аминокислотную последовательность SEQ ID NO: 6 или SEQ ID NO: 7.
Более конкретно, описана выделенная молекула нуклеиновой кислоты, кодирующей полипептид микроцин S, полипептид с аутоиммунной активностью микроцина S или полипептид с транспортной активностью для микроцина S, причем упомянутая молекула нуклеиновой кислоты:
a) включает нуклеотидную последовательность, которая по меньшей мере на 70% или больше идентична любой одной из SEQ ID NO: 1, 2, 3, 4 или 5 или ее комплементу, причем молекула нуклеиновой кислоты, включающая SEQ ID NO: 1, отвечает за продукцию полипептида по меньшей мере с антимикробной активностью или аутоиммунной активностью микроцина S или транспортной активностью микроцина S, молекула нуклеиновой кислоты, включающая SEQ ID NO: 2, отвечает за продукцию полипептида с антимикробной активностью, молекула нуклеиновой кислоты, включающая SEQ ID NO: 3, отвечает за продукцию полипептида с аутоиммунной активностью микроцина S, молекула нуклеиновой кислоты, включающая SEQ ID NO: 4, отвечает за продукцию полипептида с транспортной активностью для микроцина S, и молекула нуклеиновой кислоты, включающая SEQ ID NO: 5, отвечает за продукцию полипептида с транспортной активностью для микроцина S;
b) включает молекулу нуклеиновой кислоты, которая гибридизирует нуклеотидную последовательность, комплементарную нуклеотидной последовательности, включая нуклеотидную последовательность любой одной из SEQ ID NO: 1, 2, 3, 4 или 5 или ее комплемент в жестких условиях, причем молекула нуклеиновой кислоты, включающая SEQ ID NO: 1, отвечает за продукцию полипептида по меньшей мере с антимикробной активностью или аутоиммунной активностью микроцина S или транспортной активностью микроцина S, молекула нуклеиновой кислоты, включающая SEQ ID NO: 2, отвечает за продукцию полипептида с антимикробной активностью, молекула нуклеиновой кислоты, включающая SEQ ID NO: 3, отвечает за продукцию полипептида с аутоиммунной активностью микроцина S, молекула нуклеиновой кислоты, включающая SEQ ID NO: 4, отвечает за продукцию полипептида с транспортной активностью для микроцина S, и молекула нуклеиновой кислоты, включающая SEQ ID NO: 5, отвечает за продукцию полипептида с транспортной активностью для микроцина S;
c) включает нуклеотидную последовательность, которая кодирует полипептид, включающий аминокислотную последовательность, которая по меньшей мере на 70% или больше идентична аминокислотной последовательности SEQ ID NO: 6 или SEQ ID NO: 7, причем полипептид имеет антимикробную активность; или
d) включает молекулу нуклеиновой кислоты, которая кодирует встречающийся в природе аллельный вариант полипептида, включающий аминокислотную последовательность SEQ ID NO: 6 или SEQ ID NO: 7, причем полипептид имеет антимикробную активность.
В разных аспектах изобретение относится к плазмиде, включающей молекулу нуклеиновой кислоты согласно изобретению, и к клетке включающей молекулу нуклеиновой кислоты, и/или полипептид, и/или плазмиду согласно изобретению.
Изобретение также направлено на антитело, которое селективно связывается с полипептидом согласно изобретению.
В еще одном аспекте изобретение относится к композиции, включающей:
a) полипептид согласно изобретению и/или
b) клетку согласно изобретению.
Также раскрыты полипептид, клетка и композиция изобретения для использования для лечения или профилактики.
В одном аспекте полипептид, клетка и композиция изобретения предназначены для использования для лечения или профилактики микробных инфекций, причем, предпочтительно, микробная инфекция включает инфекции с энтеропатогенной и/или энтерогеморрагической Е. coli (ЕРЕС, ЕНЕС), или, предпочтительно, микробная инфекция включает гемолитико-уремический синдром (HUS), предпочтительно энтеропатический гемолитико-уремический синдром.
В еще одном аспекте полипептид, клетка и композиция изобретения предназначены для использования при лечении желудочно-кишечных нарушений, предпочтительно функциональных желудочно-кишечных нарушений.
В еще одном аспекте полипептид, клетка и композиция изобретения предназначены для использования при лечении опухоли.
Изобретение предлагает способ продукции полипептида изобретения, причем способ включает:
использование молекулы нуклеиновой кислоты, праймера или зонда нуклеиновой кислоты, плазмиды или клетки согласно изобретению, или
синтез полипептида изобретения посредством способов синтеза пептида в жидкой фазе или твердой фазе.
Выделенные полипептиды согласно изобретению могут быть получены упомянутым способом продукции полипептида.
В одном дополнительном аспекте предложен способ in vitro для идентификации бактерий, которые чувствительны к микроцину S, причем способ включает использование полипептида, молекулы нуклеиновой кислоты, праймера или зонда нуклеиновой кислоты, клетки, антитела или композиции согласно изобретению.
Изобретение также относится к способу консервирования пищевых продуктов, причем способ включает:
добавление в пищевой продукт по меньшей мере одного вида натурального антимикробного агента, причем агентом является:
a) полипептид согласно изобретению,
b) клетка согласно изобретению и/или
c) композиция согласно изобретению.
В еще одном аспекте изобретение относится к способу раневого покрытия, причем рану покрывают:
a) полипептидом согласно изобретению и/или
b) композицией согласно изобретению.
Благоприятные эффекты изобретения
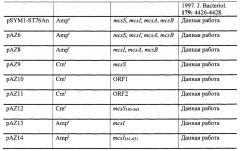
Таким образом, авторы настоящего изобретения идентифицировали полипептид микроцин S, который является новым, ранее не описанным микроцином, нуклеотидная и аминокислотная последовательность которого уникальна. Гены, которые отвечают за эффекты микроцина S, идентифицированы, и их эффекты функционально охарактеризованы. Авторы изобретения неожиданно обнаружили что, в противоположность большинству классических бета-лактамных антибиотиков, микроцин S проявляет ингибирующий эффект в отношении ЕНЕС, включая штамм, вызывающий продуцирующий ESBL О104:Н4, а также О128:Н2 и изолят О157:Н7 ЕНЕС (Фиг. 5). Таким образом, также было обнаружено, что микроцин S эффективен при лечении энтерогеморрагической инфекции Е. coli (ЕНЕС) и энтеропатогенной инфекции Е. coli (ЕРЕС). Поэтому микроцин S можно использовать в качестве альтернативы традиционным антибиотикам для борьбы с патогенными микроорганизмами. Кроме того, возможно использование для консервирования пищевых продуктов, и настоящее изобретение этим завершено. Также было обнаружено, что генный кластер микроцина S (MccS) (SEQ ID NO: 1) E. coli G3/10, кодированный плазмидой pSYM1 (Фиг. 1), состоит из четырех кластерных генов mcsS (SEQ ID NO: 2), mcsI (SEQ ID NO: 3), mcsA (SEQ ID NO: 4) и mcsB (SEQ ID NO: 5). Поскольку E. coli G3/10 является хорошо апробированным пробиотиком, используемым, например, для лечения желудочно-кишечных нарушений, микроцин S необязательно должен быть очищен от этого штамма. MccS должен быть выгодно эффективен in vivo.
Преимущества заключаются в том, что микроцин S не токсичен, не может вызывать аллергию, и патогенным микробам трудно развить устойчивость к нему.
Другие признаки и преимущества изобретения будут очевидны из последующего подробного описания и из формулы изобретения.
Краткое описание чертежей
Фиг. 1 - векторная карта мегаплазмиды pSYM1, кодирующей оперон MccS.
Фиг. 2 - схематическое изображение аминокислотной последовательности гена mcsS, кодирующего прекурсор микроцина S (верхняя панель). Возможный лидерный пептид подчеркнут.Звездочки указывают Cys, вероятно вовлеченный в формирование дисульфидной связи, типичной для микроцинов класса II. Генный кластер микроцина S MccS (нижняя панель) на мегаплазмиде pSYM1 состоит из четырех кластерных генов mcsS, mcsI, mcsA и mcsB.
На Фиг. 3 показана эффективность адгезии ЕРЕС Е2348/69 в эпителиальных клетках кишечника человека после предварительной инкубации со штаммами MDS42 и G4/9 (дикого типа) Е. coli и соответствующими мутантами комплементации плазмиды. Значение использованной звездочки: *р≤0,01.
На Фиг. 4 показана эффективность адгезии ЕРЕС Е2348/69 дикого типа и мутантов, комплементированных плазмидой, к эпителиальным клеткам кишечника человека после предварительной инкубации с разными штаммами, экспрессирующими и не экспрессирующими микроцин. Значение использованных звездочек: *р≤0,01, **р≤0,05, pAZ8 [mcsA, mcsB, mcsI], pAZ13 [mcsI], pAZ14 [mcsI, усечен].
На Фиг. 5 показана эффективность адгезии штаммов O157:Н7 (А), ЕНЕС О104:Н4 серотипа 86-24 ЕНЕС, выделенных в Дрездене (В) и O104:Н4 (С) и O128:Н2 (D) ЕНЕС, выделенных во Франкфурте (на Одере) в эпителиальные клетки кишечника человека после предварительной инкубации с EcN или Е. coli G3/10. Значение использованной звездочки: *р≤0,01 по сравнению с отрицательным контролем.
На Фиг. 6 показаны результаты скрининга mcsS с использованием мультиплексной ПЦР и гена recA в качестве контроля ингибирования.
Краткое описание листинга последовательностей
SEQ ID NO: 1 - нуклеотидная последовательность оперона микроцина S Е. coli G3/10.
SEQ ID NO: 2 - нуклеотидная последовательность гена mcsS Е. coli G3/10.
SEQ ID NO: 3 - нуклеотидная последовательность гена mcsI Е. coli G3/10.
SEQ ID NO: 4 - нуклеотидная последовательность гена mcsA E. coli G3/10.
SEQ ID NO: 5 - нуклеотидная последовательность гена mcsB E. coli G3/10.
SEQ ID NO: 6 - аминокислотная последовательность прекурсорного полипептида микроцина S Е. coli G3/10, включающего лидерную последовательность.
SEQ ID NO: 7 - аминокислотная последовательность полипептида микроцин S Е. coli G3/10 без лидерного пептида.
SEQ ID NO: 8-26 - олигонуклеотидные праймеры, использованные для амплификации генов, содержащихся в опероне или зондах микроцина S (SEQ ID NO: 1) для скрининга на ген mcsS (SEQ ID NO: 2), кодирующий полипептид микроцин S.
Подробное описание изобретения
Определения
Если не определено иное, все технические и научные термины, использованные в настоящем документе, имеют такое же значение, которое обычно понимается специалистом в области, к которой относится изобретение. В случае противоречия настоящее описание, включая определения, имеет преимущество.
Артикли "a", "an" или "the" относятся к слову "один" или "несколько" при использовании в настоящем документе, т.е. это означает "один", "по меньшей мере один" или "один или больше". Например, термин "клетка" может относиться к одной клетке, а также к некоторому множеству клеток.
Термин "включать" также включает варианты осуществления, причем термин "включает" означает "состоит из".
Используемый в настоящем документе термин "идентичность" молекулы аминокислоты или молекулы нуклеиновой кислоты эквивалентен термину "гомология" молекулы аминокислоты или молекулы нуклеиновой кислоты.
Фраза "строгие условия" относится к условиям, в которых зонд молекулы нуклеиновой кислоты будет гибридизироваться с ее мишенью - последовательностью молекул нуклеиновой кислоты, обычно в сложной смеси молекул нуклеиновой кислоты, но не с другими последовательностями. Строгие условия зависят от последовательности и отличаются при разных обстоятельствах. Более длинные последовательности гибридизируются специфически при повышенных температурах. Параметры гибридизации нуклеиновой кислоты можно найти в справочных материалах, излагающих такие способы, например, в публикации "Молекулярное клонирование: лабораторное руководство", Дж. Сэмбрук и др. (J. Sambrook, et al.), eds., Second Edition, Cold Spring Harbor Laboratory Press, Колд-Спринг Харбор, штат Нью-Йорк, 1989, или "Текущие протоколы в молекулярной биологии", Ф.М Осубель и др. (F.M. Ausubel, et al.), eds., John Wiley & Sons, Inc., Нью-Йорк. В общем, строгие условия выбирают так, чтобы они были приблизительно на 5-10°С ниже температуры плавления (Tm) для конкретной последовательности при определенной ионной силе рН. Tm является температурой (при определенной ионной силе, рН, и ядерной концентрации), при которой 50% зондов, комплементарных мишени, гибридизируются с последовательностью-мишенью при равновесии (поскольку последовательности-мишени присутствуют в избытке, при Tm, 50% зондов заняты при равновесии). Строгими условиями будут те, при которых концентрация соли составляет меньше приблизительно 1,0 М иона натрия, обычно приблизительно от 0,01 до 1,0 М концентрации иона натрия (или других солей) при рН 7,0-8,3, и температура составляет по меньшей мере приблизительно 30°С для коротких зондов (например, от 10 до 50 нуклеотидов) и по меньшей мере приблизительно 60°С для длинных зондов (например, больше чем 50 нуклеотидов). Строгие условия Также могут быть достигнуты путем добавления дестабилизирующих агентов, таких как формамид. Для гибридизации высокой строгости положительный сигнал приблизительно по меньшей мере в два раза, а предпочтительно в 10 раз превышает фоновую гибридизацию. Примеры гибридизации высокой строгости или строгих условий гибридизации включают: 50% формамида, 5 х SSC и 1% SDS, инкубированных при 42°С или 5 х SSC и 1% SDS, инкубированных при 65°С с промывкой в 0,2 х SSC и 0,1% SDS при 65°С.
Используемый здесь термин "подобная микроцину активность" полипептида означает, что полипептид имеет сильную антимикробную/антибактериальную активность против тесно связанных видов. Кроме того, это означает, что продуценты микроцина устойчивы к микроцину, который они продуцируют, что опосредовано по меньшей мере одним придающим устойчивость геном, расположенным в одном генном кластере.
Используемый здесь термин "плазмида" относится к молекуле нуклеиновой кислоты, способной реплицироваться в клетке, и с которой может быть оперативно связана другая молекула нуклеиновой кислоты, чтобы вызвать репликация прикрепленного сегмента. Плазмиды, способные направлять экспрессию структурного гена, несущего информацию по целевому полипептиду, здесь названы "экспрессирующими плазмидами".
Используемая здесь фраза "оперативно связанная" означает, что молекула нуклеиновой кислоты изобретения прикреплена к плазмиде так, что экспрессия структурного гена, сформированного молекулой нуклеиновой кислоты, находится под контролем плазмиды.
Термин "регуляторная последовательность" должна включать промоторы, энхансеры и другие элементы управления экспрессией (например, сигналы полиаденилирования).
Термин "конъюгативная плазмида" относится к плазмиде, которая может передаваться от одной клетки другой во время конъюгации.
Используемые здесь термины "трансформация" и "трансфекция" относятся к разным признанным в данной области способам введения инородной нуклеиновой кислоты (например, ДНК) в клетку-хозяин, включая совместное осаждение с фосфатом кальция или хлоридом кальция, трансфекцию, опосредованную DEAE-декстраном, липофекцию или электропорацию.
Используемый здесь термин "пробиотик" относится к живым микроорганизмам, которые после приема в определенном количестве, оказывают благоприятное влияние на здоровье помимо присущей им базовой функции питания.
Используемая здесь "фармацевтическая композиция" относится к препарату из одного или больше активных ингредиентов, описанных в настоящем документе, т.е., полипептиду согласно изобретению (или его фармацевтически приемлемой соли) или клетке согласно изобретению, с другими химическими компонентами, такими как физиологически и фармацевтически приемлемыми носителями и наполнителями. Назначение фармацевтической композиции заключается в том, чтобы облегчить введение соединения в организм.
Ниже, фразы "физиологически приемлемый носитель" и "фармацевтически приемлемый носитель", которые могут использоваться взаимозаменяемо, относятся к носителю или разбавителю, который не вызывает значительного раздражения в организме и не снижает биологическую активность и свойства принимаемого соединения. Одним из ингредиентов, включаемых в фармацевтически приемлемый носитель, может быть, например, полиэтиленгликоль (ПЭГ), биосовместимый полимер с широким диапазоном растворимости в органических и водных средах (Mutter et al. (1979).
Термин "наполнитель" здесь относится к инертному веществу, добавляемому к фармацевтической композиции, чтобы далее облегчить введение активного ингредиента. Примеры наполнителей, но без ограничения, включают карбонат кальция, фосфат кальция, разные сахара и типы крахмала, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли.
Используемый здесь термин "лечение" относится к профилактике, излечению, изменению в благоприятную сторону, уменьшению, ослаблению, минимизации, подавлению или остановке вредных эффектов процесса заболевания.
Используемый здесь термин "пациент" относится к объекту, который может получить выгоду от настоящего изобретения, такому как животное или млекопитающее (например, собака, кошка, овца, свинья, лошадь, корова, человек), предпочтительно пациентом является человек.
Термин "функциональное нарушение желудочно-кишечного тракта" охватывает ряд идиопатических нарушений, которые влияют на разные части желудочно-кишечного тракта.
Полипептиды
Полипептид микроцин S настоящего изобретения отличается его аминокислотной последовательностью и новыми функциональными свойствами. Полипептиды могут быть выделены с использованием способов, известных в данной области. То есть, встречающийся в природе или продуцированный рекомбинантно полипептид микроцин S может быть выделен из клеток или тканей по подходящей схеме очистки с использованием стандартных способов очистки белков. Однако полипептиды микроцин S могут встречаться в природе в клетке или могут быть продуцированы способами рекомбинантной ДНК или альтернативно рекомбинантной экспрессии, и полипептид микроцин S может быть синтезирован химическим путем с использованием стандартных способов синтеза. Здесь полипептид микроцин S классифицирован как микроцин Е. coli, который может быть фенотипически охарактеризован и назван как микроцин S. На Фиг. 2 в верхней панели показана аминокислотная последовательность прекурсора микроцина S. Двойной глициновый лидерный пептид подчеркнут. Звездочки указывают цистеины, возможно вовлеченные в формирование дисульфидной связи, типичной для микроцинов класса И. Аминокислотная последовательность показывает богатый глицином пептид с двойным сайтом расщепления глицина. В описанных здесь способах могут быть использованы полипептиды, имеющие аминокислотную последовательность SEQ ID NO: 6 или SEQ ID NO: 7, или биологически активные варианты полипептидов, имеющих аминокислотную последовательность SEQ ID NO: 6 или SEQ ID NO: 7.
Поэтому в одном предпочтительном варианте осуществления полипептид включает аминокислотную последовательность, которая по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 98% или больше идентична аминокислотной последовательности SEQ ID NO: 6 или аминокислотной последовательности SEQ ID NO: 7.
Для определения процента идентичности двух аминокислотных последовательностей или двух нуклеинокислотных последовательностей эти последовательности выравнивают для целей оптимального сравнения (например, зазоры могут быть введены в одну или обе из первой и второй аминокислотной или нуклеинокислотной последовательности для оптимального выравнивания).
В одном предпочтительном варианте осуществления полипептид кодирован молекулой нуклеиновой кислоты, включающей или состоящий из нуклеотидной последовательности, которая по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 98% или больше идентична нуклеотидной последовательности, включающей нуклеотидную последовательность любой одной из SEQ ID NO: 1, 2, 3, 4 или 5 или ее комплемент.
Затем сравнивают остатки в соответствующих положениях, и если положение в одной последовательности занимает тот же остаток, что и в соответствующем положении в другой последовательности, то молекулы идентичны в этом положении. Процент идентичности между двумя последовательностями поэтому является функцией числа идентичных положений в двух последовательностях (т.е. % идентичности = число идентичных положений / совокупное число положений × 100). Процент идентичности между двумя последовательностями является функцией числа идентичных положений в последовательностях с учетом числа пробелов и длины каждого пробела, которые введены для оптимального выравнивания двух последовательностей.
Сравнение последовательностей и определение процента идентичности между двумя последовательностями может быть выполнено с использованием математического алгоритма. Неограничивающим примером математического алгоритма, используемого для сравнения последовательностей, является алгоритм Карлина и Альшуля (Karlin and Altschul) (1990) Proc. Natl. Acad. Sci. USA 87:2264, с модификацией от 1993 г., Proc. Natl. Acad. Sci. USA 90:5873. Такой алгоритм введен в программы NBLAST и XBLAST (версия 2.0) Альтшуля и др. (1990) J. Mol. Biol. 215:403. Поиски нуклеотидов в BLAST могут быть выполнены с оценкой по программе NBLAST = 100, длина слова = 12, чтобы получить нуклеотидные последовательности, гомологичные молекулам нуклеиновой кислоты изобретения. Поиски белков в BLAST могут быть выполнены в программе XBLAST, оценка = 50, длина слова = 3, чтобы получить аминокислотные последовательности, гомологичные молекулам белков изобретения. Для получения выравниваний с пробелами для целей сравнения можно использовать программу Gapped BLAST, которая описана Альтшулем и др., (1997) Nucleic Acids Research 25(17):3389. При использовании программ BLAST и Gapped BLAST можно использовать параметры по умолчанию соответствующих программ (например, XBLAST и NBLAST). Смотрите http://www.ncbi.nlm.nih.gov. Еще одним предпочтительным неограничивающим примером алгоритма, используемого для сравнения последовательностей, является алгоритм Майерса и Миллера (Myers and Miller), CABIOS (1989). Такой алгоритм включен в программу ALIGN (версия 2.0 или 2.0U), которая является частью пакета программ для выравнивания последовательностей GCG. При использовании программы ALIGN для сравнения аминокислотных последовательностей можно использовать таблицу массовых остатков РАМ120, штраф на длину пробела 12 и штраф на пробел 4. В данной области известны другие алгоритмы для анализа последовательностей, которые включают ADVANCE и ADAM, описанные у Торелли и Роботти (Torelli and Robotti) (1994) Comput. Appl. Biosci. 10:3; и FASTA, описанный у Пирсона и Липмена (Pearson and Lipman) (1988) Proc. Natl. Acad. Sci. USA 85:2444.
В еще одном варианте осуществления полипептид имеет подобную микроцину антимикробную, антибактериальную или противоопухолевую активность. Полипептид является бактериальным полипептидом, предпочтительно бактериальным микроцином S. Кроме того, полипептид ингибирует адгезию бактерий к эпителиальным клеткам кишечника человека. То есть необходимо понимать, что полипептид обеспечивает антимикробную/антибактериальную активность против тесно связанных видов, при этом полипептид не развивает антимикробную/антибактериальную активность против своего продуцента, который имеет устойчивость к микроцину, который он продуцирует. Поэтому полипептид ингибирует адгезию тесно связанных видов бактерий к эпителиальным клеткам кишечника человека.
Предпочтительно, полипептид получают из штамма Е. coli, более предпочтительно из Е. coli G3/10. В других вариантах осуществления Е. coli G3/10 является Е. coli G3/10 DSM 16443.
Кроме того, предпочтительно, чтобы полипептид был биоразлагаемым.
Молекулы нуклеиновых кислот
Геном пробиотического штамма Е. coli G3/10 был полностью секвенирован с использованием технологии "пиросеквенирования" и затем автоматически аннотирован и далее отредактирован вручную.
E. coli G3/10 имеет геном 4935403 пар оснований и шесть плазмид размером от 1,3 т.п.н. до 50 т.п.н. 40 т.п.н. из 50 т.п.н. плазмиды pSYM1 почти полностью идентичны (гомология 99%) с pMAS2027 из уропатогенной Е. coli (Ong, С.L., Beatson, S.А., McEwan, A.G. & Schembri, M.A. (2009) Appl Environ Microbiol 75, 6783-6791). Остальные 10 т.п.н. содержат рамки считывания без гомологии или с низкой гомологией с нуклеотидом и аминокислотными последовательностями, депонированными в базах данных NCBI и ExPASy. Четыре из этих генов несут информацию по полностью новому, ранее не описанному микроцину Е. coli Класса На, включая иммунную и транспортную систему. Этот генный кластер микроцина S (SEQ ID NO: 1), состоящий из четырех кластерных генов mcsS (SEQ ID NO: 2), mcsI (SEQ ID NO: 3), mcsA (SEQ ID NO: 4) и mcsB (SEQ ID NO: 5) был выделен. Этот микроцин был охарактеризован фенотипически и назван микроцином S. Двумя экспортгенами MccS являются mcsA и mcsB (Фиг. 2). Ген mcsA является членом семейства гемолизинов HlyD Е. coli и показывает небольшую гомологию с белком секреции колицина cvaA. Ген mcsB кодирует АВС-транспортер двумя участками трансмембранных доменов и одним пептидазным доменом. Оба экспортгена MccS, которыми являются mcsA и mcsB, несут информацию по полипептидам, которые отвечают за транспорт микроцина S из клеточной, в частности бактериальной цитоплазмы во внеклеточное пространство.
Молекула нуклеиновой кислоты настоящего изобретения, например, молекула нуклеиновой кислоты, имеющая нуклеотидную последовательность любой одной из SEQ ID NO: 1-5 или любой одной из SEQ ID NO: 8-26 или ее части, может быть выделена с использованием стандартных способов молекулярной биологии и заложенной в ней информации о последовательности. Например, при использовании всей или части нуклеинокислотной последовательности любой одной из SEQ ID NO: 1-5 или любой одной из SEQ ID NO: 8-26 в качестве гибридизационного зонда, молекулы нуклеиновых кислот микроцина S могут быть выделены с использованием стандартных способов гибридизации и клонирования (например, как сказано у Сэмбрука, Дж. и др., Molecular Cloning: A Laboratory Manual. 2nd, ed., Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989).
Нуклеиновая кислота изобретения может быть амплифицирована с использованием кДНК, мРНК или, альтернативно, геномной ДНК, в качестве шаблона и подходящих олигонуклеотидных праймеров согласно стандартным способам амплификации ПЦР. Другие подходящие праймеры описаны ниже. Амплифицированную таким образом нуклеиновую кислоту можно клонировать в подходящий вектор и характеризовать путем анализа последовательности ДНК. Кроме того, олигонуклеотиды, соответствующие нуклеотидным последовательностям микроцина S, могут быть получены стандартным способами синтеза, например, путем использования авт