Бромиды производных бензимидазолия в качестве ингибиторов протеин-тирозинфосфатазы типа 1в (ртр1в)
Иллюстрации
Показать всеИзобретение относится к новым соединениям в ряду 1,2,3-замещенных солей бензимидазолия, а именно к бромидам 1,2,3-три и 1,2,3,5-замещенных бензимидазолия общей формулы I
.
Технический результат: получены новые соединения, обладающие ингибиторными свойствами в отношении протеин-тирозинфосфатазы типа 1B (РТР1В), которые могут быть использованы для борьбы с PTP1B-опосредованными заболеваниями. 3 з п. ф-лы, 3 пр., 1 табл., 1 ил.
Реферат
Изобретение относится к новым соединениям в ряду 1,2,3-замещенных солей бензимидазолия, а именно к неописанным ранее бромидам 1,2,3-три- и 1,2,3,5-тетра-замещенных бензимидазолия общей формулы I
где R=NH2, СН2ОН; R1=С6Н4-С6Н5, Н; R2=H, ОСН3; R3=ОСН3, C6H4Br-4; R4=ОСН3, Н в том числе, при условии
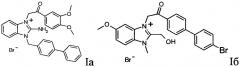
Ia: R=NH2, R1=C6H4-C6H5, R2=H, R3=R4=OCH3
Iб: R=CH2OH, R1=H, R2=OCH3, R3=C6H4Br-4, R4=H.
Бромиды бензимидазолия (I) проявляют свойства ингибитора протеин-тирозин фосфатазы типа 1B (РТР1В) и могут быть использованы для лечения сахарного диабета 2 типа (СД2) и других заболеваний, обусловленных повышенной активностью фосфатазы РТР1В.
Ингибирование РТР1В является перспективным направлением поиска новых лекарственных средств для терапии не только сахарного диабета 2 типа, но и онкологических заболеваний. Повышенная активность РТР1В, выявленная в нескольких линиях злокачественных опухолей, включая хронический миелолейкоз (CML), рак молочной железы, рак яичников и рак предстательной железы, позволяют сделать предположение о регуляторной роли РТР1В в контроле киназной активности в злокачественных клетках [1]. Таким образом, ингибирование PTP1B-активности может представлять собой важную мишень для лечения или предотвращения этих и других злокачественных опухолей. РТР1В ингибиторы могут, таким образом, найти себе применение для лечения или предотвращения злокачественных опухолей и для замедления роста выявленных злокачественных опухолей [2].
Ингибиторы РТР1В могут найти применение также в лечении метаболического синдрома, ожирения и дислипидемии.
Лекарственные средства для лечения пациентов с сахарным диабетом и другими PTP1B-опосредованными заболеваниями посредством ингибирования РТР1В до настоящего времени не введены в клиническую практику. Необходимы новые химические соединения, способные эффективно ингибировать РТР1В.
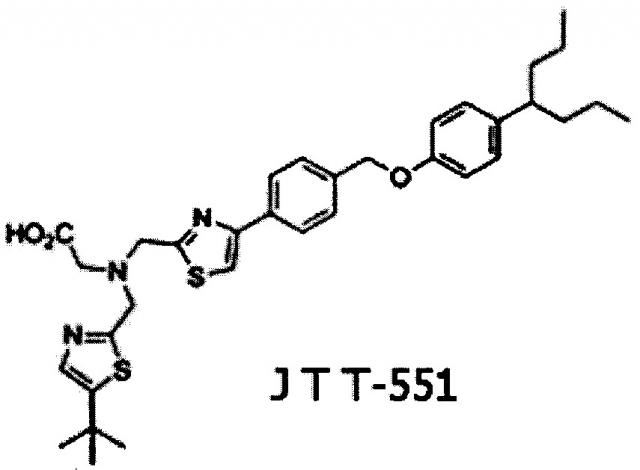
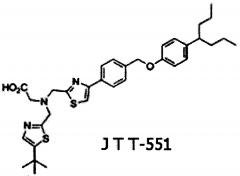
Среди потенциальных ингибиторов РТР1В выделяют бис-тиазольное производное JTT-551, которое находится на стадии доклинического изучения антидиабетических свойств. Так, при пероральном введении JTT-551 у мышей с генетической моделью ожирения линии ob/ob и с сахарным диабетом линии db/db улучшался метаболизм глюкозы, вероятно, благодаря активации сигнального пути инсулина [3]. При хроническом введении JTT-551 у мышей с ожирением, индуцированным высококалорийной диетой, происходило снижение веса и нормализация метаболизма липидов и глюкозы [4].
Для нуклеотида IONIS-PTP1BRx, мишенью которого является ген, продуцирующий РТР1В, в настоящее время завершена II фаза клинических испытаний. У пациентов с СД 2 типа, получавших IONIS-PTP1BRx, на 36 неделе было достигнуто статистически значимое снижение массы тела и уровня HbA1c (по данным Isis Pharmaceuticals Inc., [5]).
Отдельную группу потенциальных ингибиторов РТР1В составляют бифенилы, для производных которых характерен широкий спектр биологических эффектов, в том числе и ингибирование протеин-тирозинфосфатазы 1В [6, 7].
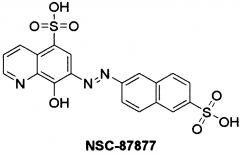
Известено соединение с конденсированными бензольными ядрами -(7Е)-8-оксо-7[6-сульфонафталин-2-ил)гидразинилиден] хинолин-5-сульфокислота (ингибитор NSC-87877), которое является достаточно эффективным ингибитором РТР1В [8].
Перспективным подходом при поиске новых ингибиторов PTP1B является создание и исследование соединений, в молекулах которых комбинируются два типа привилегированных скафолдов [9] - бифенильный (изолированные бензольные ядра) и бензимидазольный, для которых также можно ожидать наличия высокой ингибирующей активности в отношении протеин-тирозинфосфатазы 1В.
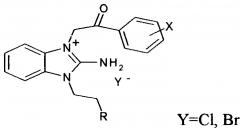
В ряду 1,2,3-замещенных солей бензимидазолия известны не содержащие бифенильного структурного фрагмента галогениды 1-замещенных-3-галогенфенацил-2-аминобензимидазолия, обладающие гемореологическими свойствами (Патент RU №2290404, МПК C07D 487/04, 2006 г.)
Кроме того, в вышеуказанном ряду известны замещенные по амидной группе хлориды 3-карбамоилметил-1-R-2-аминобензимидазолия, которые снижают агрегацию тромбоцитов, обладают антиоксидантной и антиаритмической активностью, и в ряде случаев гипогликимическим действием (ХФЖ, 2012, т. 46, №9, с. 6-10).
В то же время в ряду 1,2,3-замещенных солей бензимидазолия не известны соединения, проявляющие свойства ингибиторов фермента РТР1В.
Техническим результатом изобретения являются новые соединения в ряду 1,2,3-замещенных солей бензимидазолия, содержащие у атома азота имидазольного цикла бифенильный структурный фрагмент, и проявляющие новое для данного ряда свойство ингибиторов фермента РТР1В.
Технический результат достигается соединениями формулы I, в том числе, бромидами формул Ia и Iб
Соединения I, в том числе, бромид 2-амино-3-[(3,4-диметоксифенил)-2-оксоэтил)]-1-бифенил-4-ил-метилбензимидазолия (Ia) и бромид 1-метил-3-[(4'-бромбифенил)-2-оксоэтил]-2-гидроксиметил-5-метоксибензимидазолия (Iб) синтезируют по нижеприведенной схеме
Ia: R=NH2, R1=С6Н4-С6Н5, R2=H, R3=R4=OCH3.
Iб: R=CH2OH, R1=H, R2=OCH3, R3=C6H4Br-4, R4=H
IIa: R=NH2, R1=С6Н4-С6Н5; IIб: R=CH2OH, R1=H, R2=OCH3.
IIIa: R3=R4=OCH3; IIIб: R3=C6H4Br-4, R4=H
Бромид Ia получают исходя из неизвестного ранее 1-(бифенил-4-ил-метил)-1Н-бензимидазол-2-амина (IIа) и 3,4-диметоксифенацилбромида кипячением в ацетонитриле.
Бромид 1-метил-3-[(4'-бромбифенил)-2-оксоэтил]-2-гидроксиметил-5-метоксибензимидазолия (Iб) синтезируют кватернизацией 1-метил-5-метокси-2-оксоэтилбензимидазола (IIб) 4-(4-бромфенил)фенацилбромидом (IIIб). Методики синтеза амина IIа, соединений Ia, б, а также данные исследований биологической активности бромидов Ia, б приведены ниже.
Пример 1. Стадия 1. 1-(Бифенил-4-ил-метил)-1H-бензимидазол-2-амин (IIа).
К раствору 2,66 г (20 ммоля) 2-аминобензимидазола и 2.64 г (40 ммоля) КОН (в расчете на 85% содержание КОН) в 3 мл воды добавляют 20 мл ацетона и перемешивают в течение 20 мин при комнатной температуре. Затем порциями вносят 4,94 г (20 ммоля) 4-бромметилбифенила. После окончания прибавления алкилирующего агента реакционную смесь перемешивают 2 ч при комнатной температуре, затем 30 мин при температуре 45-50°C. Далее реакционную смесь охлаждают и выпавший осадок амина отфильтровывают, промывают водой, холодным спиртом, сушат. Выход амина IIa 5,80 г (97%), Тпл. 245-246°C (ДМФА). ИК-спектр, νmax, см-1: 3987, 3287 (NH2), 1629, 1591, 1521, 1478, 1459 (С=С, C=N). Найдено, %: С 80.02; Н 5.55; N 13.89. C20H17N3. Вычислено, %: С 80.22; Н 5.73; N 14.03. 1Н-ЯМР-спектр (300 МГц, CDCl3), δ, м.д., J (Гц): 5.29 (с, 2Н, NHet-СН2); 6.53 (с, 2Н, NH2); 6.82 (т, J=7.5, 1Н, HAr); 6.92 (т, J=7.5, 1Н, HAr); 7.13 (к, J=7.8, 2Н, HAr), 7.26-7.35 (м, 3Н, HAr); 7.42 (т, J=7.5, 2Н, HAr); 7.59-7.61 (к, J=78.1, 4Н, HAr).
Стадия 2. Бромид 2-амино-3-[(3,4-диметоксифенил)-2-оксоэтил)]-1-бифенил-4-ил-метилбензимидазолия (Ia).
В горячий раствор 1,63 г (5,4 ммол) 1-(бифенил-4-ил-метил)-1H-бензимидазол-2-амина (II) в 10 мл диметилформамида, очищенного от примесей аминов, вносят раствор 1,39 г (5,4 ммол) 3,4-диметоксифенацилбромида в 3 мл ацетонитрила. Затем реакционную массу нагревают до 120-130°C до начала выпадения осадка и выдерживают 6-8 ч при комнатной температуре, после чего осадок бромида Ia отфильтровывают и тщательно промывают 20 мл ацетонитрила и 50 мл ацетона. Выход 85%, Тпл. 226°-226.5°C. ИК-спектр, νmax, см-1; 3149, 3112, 1684, 1601. Найдено, %: С 64.33; Н 4.88; Br 14.11; N 7.33. C30H28BrN3O3. Вычислено, %: С 64.51; Н 5.06; Br 14.30; N 7.52. 1H-ЯМР-спектр (600 МГц, DMSO-d6), δ, м.д., J (Гц): 3.82 (с, 3Н, ОСН3); 3.88 (с, 3Н, ОСН3); 5.57 (с, 2Н, NBzm-CH2); 5.97 (с, 2Н, СН2СО); 7.19-7.20 (д, J=8.58, 1Н, HAr); 7.27-7.35 (м, 3Н HAr); 7.38-7.44 (м, 4Н, HAr); 7.52-7.55 (м, 2Н, HAr); 7.58-7.68 (м, 5Н, HAr); 7.78-7.79 (дд, J=2.07, 1H, HAr); 9.02 (с, 2Н, N+H2).
Пример 2. Стадия 1. Бромид 1-метил-3-[(4'-бромбифенил)-2-оксоэтил]-2-гидроксиметил-5-метоксибензимидазолия (Iб)
Раствор 1,92 г (10 ммоль) 1-метил-5-метокси-2-оксиэтилбензимидазола (IIб) и 3,54 г (10 ммоль) 4-(4-бромфенил)фенацилбромида (IIIб) в 120 мл ацетонитрила кипятят в течение 16 часов. Затем реакционную массу охлаждают на ледяной бане, образовавшийся осадок бромида отфильтровывают, промывают ацетоном, сушат и кристаллизуют из спирта. Выход 87%, Тпл. 233-234°C. ИК-спектр, νmax, см-1: 3184 (ОН), 1689 (С=O). Найдено, %: С 52.58; Н 4.16; Br 29.16; N 4.99. C24H22Br2N2O3. Вычислено, %: С 52.75; Н 4.06; Br 29.28; N 5.13. 1Н-ЯМР-спектр (DMSO-d6), δ, м.д. J (Гц): 3.83 (с, 3Н, N-Me); 4.12 (с, 3Н, ОСН3); 5.00-5.02 (д, J=5.86, 2Н, CH2O); 6.10-6.14 (т, J=6.01, 1H, ОН); 6.41 (с, 2Н, N+-CH2); 7.28-7.32 (дд, J=9.23, 2.3, 1Н, HAr); 7.63-7.64 (д, J=2.1, 1H, HAr); 7.72-7.74 (д, J=7.9, 2Н, HAr); 7.76-7.79 (д, J=7.9, 2Н, HAr); 7.96-7.99 (д, Jср=8.6, 3Н, HAr); 8.19-8.22 (д, J=8.2, 2Н, HAr).
Исследование фармакологической активности
На Фиг. 1 представлен график, показывающий влияние соединений Ia,б на активность РТР1В. По оси ординат - ингибирование активности в % относительно контрольной пробы, по оси абсцисс - десятичный логарифм молярной концентрации соединения.
Пример 3. Определение активности РТР1В
Оценку способности соединений ингибировать РТР1В проводили по методу, описанному в работе [10]. Растворы исследуемых соединений, субстрата n-нитрофенилфосфата и фермента РТР1В готовили ex tempore в свежеприготовленном PTB1B-рабочем буфере (4,7 г/л Трис-HCl, 2,4 г/л Трис-ОН, 8,7 г/л NaCl; рН 7,5), в который также добавляли раствор 1,4-дитиотреитоила в конечной концентрации 3 ммоль/л и 0.1 мг/мл БСА. При необходимости исследуемые вещества растворяли в 10%-ном ДМСО в PTB1B-рабочем буфере (не более 1% ДМСО в конечной концентрации). Смесь 10 мкл раствора исследуемого соединения в конечной концентрации 100 мкмоль/л, 50 мкл 1.2 мкг/мл раствора РТР1В (конечная концентрация 7.9 нмоль/л) преинкубировали в термошейкере при 30°C 10 мин. Затем для инициирования реакции добавляли 40 мкл субстрата реакции - n-нитрофенилфосфата в конечной концентрации 2 ммоль/л (Sigma, США). Далее до повторной инкубации измеряли оптическую плотность реакционной смеси при длине волны 405 нм на микропланшетном ридере (Infinite М200, Tecan, Австрия). Затем реакционная смесь перемешивалась и инкубировалась в термошейкере 20 мин при 30°C. Повторное измерение оптической плотности реакционной смеси проводили при длине волны 405 нм на микропланшетном ридере (Infinite М200, Tecan, Австрия) и оценивали активность фермента по количеству образовавшегося n-нитрофенола. В качестве вещества сравнения использовали ингибитор NSC-87877 (Sigma, США) [8].
Статистическую обработку результатов проводили с использованием U-критерия Манна-Уитни и метода регрессионного анализа для оценки зависимости «доза-эффект» и расчета показателя IC50 (полумаксимальной концентрации ингибирования) в программе GraphPadPrism 6.0.
Результаты исследований
В результате изучения ингибирующей активности в отношении РТР1В в концентрации 100 мкмоль/л исследуемые вещества Ia, Iб и вещество сравнения NSC-87877 значимо подавляли активность фермента (таблица 1). По данному показателю вещества Ia и Iб превосходили эффект NSC-87877 примерно на 33%. Таким образом, у соединений Ia и Iб способность ингибировать активность РТР1В оказалась более выраженной, чем у вещества сравнения NSC-87877, что подтверждается также их показателями IC50.
* - статистически значимо по отношению к NSC-87877 (р≤0,05, U-критерий Манна-Уитни).
Таким образом, у новых производных бифенила под шифрами Ia и Iб выявлены выраженные ингибирующие свойства в отношении РТР1В, которые достоверно превышают активность вещества сравнения NSC-87877.
Литература
1. Liu F., Hill DE, Chemoff J., Direct binding of the proline-rich region of protein tyrosine phosphatase 1B to the Src homology 3 domain of p 130 (cas). J. Biol, Chem., 1996, 271: 31290-31295.
2. Stuible M, Doody KM, Tremblay ML. PTP1B and TC-PTP: Regulators of transformation and tumorigenesis. Cancer Metastasis Rev. 2008; 27: 215-30.
3. S., Ohta Т., Sakata S., Morinaga H., Ito M., Nakagawa Y., Tanaka M., Matsushita M. Pharmacological profiles of a novel protein tyrosine phosphatase 1B inhibitor, JTT-551. Diabetes Obes Metab 2010; 12: 4: 299-306.
4. M., Fukuda S., Sakata S., Morinaga H., Ohta T. Pharmacological effects of JTT-551, a novel protein tyrosine phosphatase 1B inhibitor, in diet-induced obesity mice. J Diabetes Res 2014; 2014: 680348.
5. URL: http://isispharm.com/backup/Pipeline/Therapeutic-Areas/Metabolic-Disease.htm#ISIS-PTP1BRx.
6. Thompson N. Doman, Susan L. McGovern, Bryan J. Witherbee, Thomas P. Kasten ets all. Molecular Docking and High-Throughput Screening for Novel Inhibitors of Protein Tyrosine Phosphatase-1B, J. Med. Chem. 2002, 45, 2213-2221.
7. Zhang LIU, Qian CHAI, Yuan-yuan LI, Qiang SHEN. Discovery of novel PTP1B inhibitors with antihyperglycemic activity, Acta Pharmacologica Sinica (2010) 31: 1005-1012; doi. 10.1038/aps.2010.81, 1
8. Chen L, Sung S, Yip M, Lawrence H. Discovery of a novel shp2 protein tyrosine phosphatase inhibitor. Mol. Pharmacol. 2006; 70: 562-70.
9. DeSimone R.W. et all. Privileged Structures: Applications in Drug Discovery // Combinatorial chemistry &High throughput screening, 2004, v. 7, p. 473-493.
10. Lubben Т., Clampit J., Stashko M., Trevillyan J., Jirousek M.R. In vitro enzymatic assays of protein tyrosine phosphatase 1B. Current Protocols in Pharmacology; 2001: 3.8.1-3.8.18.
1. Бромиды 1,2,3-три- и 1,2,3,5-тетразамещенных бензимидазолия обшей формулы I
где R=NH2, СН2ОН; R1=С6Н4-С6Н5, Н; R2=H, ОСН3; R3=ОСН3, C6H4Br-4; R4=ОСН3, Н.
2. Бромиды по п. 1, где R=NH2, R1=C6H4-C6H5, R2=H, R3=R4=OCH3, а именно бромид 2-амино-3-[(3,4-диметоксифенил)-2-оксоэтил)]-1-бифенил-4-ил-метилбензимидазолия формулы Ia
.
3. Бромиды по п. 1, где R=CH2OH, R1=H, R2=OCH3, R3=C6H4Br-4, R4=H, а именно бромид 1-метил-3-[(4'-бромбифенил)-2-оксоэтил]-2-гидроксиметил-5-метоксибензимидазолия формулы Iб
4. Бромиды по п. 1, обладающие свойством ингибиторов протеин-тирозинфосфатазы типа 1B (РТР1В).