Жидкофазная композиция, обладающая антибактериальным и детоксикационным действием
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к фармацевтике, и предназначено для производства из растительного сырья композитных лекарственных средств комплексного антибактериального и детоксикационного действия. Жидкофазная композиция, обладающая антибактериальным и детоксикационным действием, представляет собой водно-спиртовой раствор водно-спиртового экстракта слоевищ лишайников рода Cladonia, предварительно обработанных диоксидом углерода в состоянии сверхкритической жидкости. Композиция содержит лишайниковые β-олигосахариды в концентрации 3,9±0,3 мг/мл (р<0,05) и лишайниковые ароматические кислоты флавоноидного типа в концентрации 4,3±0,4 мг/мл (р<0,05). При этом содержание этилового спирта в композиции составляет 40±2 об.%. Использование изобретения обеспечивает комплексное антибактериальное и детоксикационное действие. 2 ил., 3 табл.
Реферат
Изобретение относится к химико-фармацевтической промышленности, а именно к производству лекарственных средств и биологически активных добавок к пище из растительного сырья, комплексного антибактериального и детоксикационного действия в отношении внутренних сред организма человека и животных.
Целью заявляемого изобретения является создание комплексного биопрепарата из природного растительного сырья с повышенной антибактериальной и детоксикационной активностью в отношении внутренних сред организма.
Известен препарат антибактериального действия «Бинан» [1], полученный из лишайников рода цетрария Cetraria [2], включенный в Фармакопею СССР. Активное вещество - натриевая соль усниновой кислоты отличается высокими антибиотическими свойствами, очень термоустойчива, хорошо сохраняется на протяжении нескольких лет, эффективна против большого разнообразия грамположительных (G+) и некоторых грамотрицательных, кислоустойчивых бактерий и отдельных грибов, включая мультирезистентные (устойчивые) к антибиотикам штаммы золотистого стафилококка, энтерококка и микобактерий. Причем усниновая кислота оказывает избирательное действие против стрептококка мутирующего, не вызывая побочных эффектов, отрицательно воздействующих на оральную сапрофитную микрофлору [3-7].
Усниновая кислота обладает также следующими направлениями действия:
- противовоспалительным [8];
- обезболивающим и жаропонижающим [9];
- противораковым [10];
- гастропротективным и антиоксидантным [11]. Последнее приводит и к защите от ультрафиолетового излучения, что ценно не только с медицинской, но и с косметологической позиции [12];
- противовирусной, антипротозойной, антипролиферативной, противовоспалительной и обезболивающей активностью [1];
- способствует заживлению ран [13];
- может использоваться для профилактики и лечения десен и патологий парадонта [14].
Другим признанным свойством усниновой кислоты является ее консервирующая способность.
Известно также, что слоевища лишайников другого рода (Cladonia), произрастающих в высоких широтах, содержат большее количество и более широкий спектр структур вторичных лишайниковых веществ из числа лишайниковых ароматических кислот флавоноидного типа: дибензофуранов (изомеры усниновой кислоты), депсидонов (изомеры физодовой кислоты), депсидов (изомеры сферородина, леканоровой, анациевой, рамалиноловой кислот) более выраженного антибактериального действия [15, 16]
Однако, несмотря на вышеуказанную эффективность, препарат Бинан и другие вышеприведенные аналоги, получаемые из слоевищ лишайников, так и не были введены в клиническую практику и не применяются в медицине. Причины этого, по-видимому, следующие:
- большинство вторичных лишайниковых метаболитов, включая усниновую кислоту, во-первых, не растворимы в воде. Во-вторых, находятся в слоевищах лишайников в иммобилизованном виде, будучи включенными в ячейки трехмерной матрицы очень прочных лишайниковых β-полисахаридов. Поэтому при биотехнологическом переделе более 80% их количества не переходит в биоусвояемую форму.
Близким к заявляемому изобретению, в отношении содержания водорастворимых форм биологически активных веществ антибактериального действия является композиция, получаемая из слоевищ лишайников рода Cladonia с помощью механохимической активации на мельнице-активаторе планетарного типа, в присутствии 0,5 масс. % бикарбоната натрия [17, 18].
Известно также, что при любом патологическом процессе, в том числе при бактериальных и вирусных инфекциях, в организме идет накопление эндогенных токсинов, включая медиаторы воспаления - эндотоксины малой и средней молекулярной массы и др. Поэтому обязательной компонентой комплекса лечебного мероприятий должна быть детоксикация не только желудочно-кишечного тракта, но и внутренних сред организма (кровь, лимфа, межклеточные жидкости). Известны медицинские приемы (гемодиализ) и биопрепараты (БАДы) для очистки крови: «Детокс+», «Куркумин» и др. К их недостаткам, относительно заявленной цели, относится отсутствие антибактериального эффекта.
Ранее было показано, что предэкстракционная биотехнологическая обработка слоевищ лишайника диоксидом углерода в состоянии сверхкритической жидкости приводит к частичному разрушению трехмерной β-полисахаридной матрицы с образованием β-олигосахаридов [23, 25], которые обладают следующими отличительными свойствами:
- не гидролизуются в желудочно-кишечном тракте (ЖКТ) и во внутренних средах организма, т.к. содержат прочные β-гликозидные связи, не расщепляемые в кислой среде желудка, а кишечная микрофлора и внутренние среды организма не содержат соответствующие β-гликозидазы;
- содержат большое количество гидрофильных функциональных групп (-ОН, -NH2, =СО и др.) и гидрофобных фрагментов, что обеспечивает образование супрамолекулярных комплексов (СМК) с контактирующими с ними низкомолекулярными соединениями и гидрофильной, и гидрофобной природы, в которых β-олигосахариды выступают в качестве «активного носителя», а низкомолекулярные соединения - «фармаконов»;
- СМК, благодаря бифильной природе лишайниковых β-олигосахаридов, близких по строению к олигогликозидными фрагментами гликокаликса клеточных мембран и их небольшим размерам, хорошо всасываются из желудочно-кишечного тракта в кровь и легко транспортируются через клеточные мембраны;
- после распада СМК во внутренних средах организма (цитоплазма, межклеточные жидкости, кровь, лимфа) β-олигосахариды связывают конечные продукты метаболизма - эндотоксины (молочная и мочевая кислота, мочевина, медиаторы воспаления - эндотоксины малой и средней молекулярной массы и др.), а также экзотоксины (катионы тяжелых металлов, радионуклиды, оксиды углерода и серы, органические токсические соединения, включая фенолы, алкогольные токсины (ацетальдегид, ацетон), бактериальные и вирусные токсины и др.) и выводят их из организма.
Благодаря этим свойствам лишайниковых β-олигосахаридов достигается, во-первых, повышенная усвояемость и биоактивность «фармакона» независимо от степени его гидрофобности/гидрофильности. Во-вторых, обеспечивается проявление детоксикационной активности в отношении внутренних сред организма.
Повышение биоусвояемости и биоактивности «фармакона» актопротекторного действия при комплексообразовании с лишайниковыми β-олигосахаридами и проявление их детоксикационной активности в отношении эндотоксинов: молочной кислоты, мочевины, было установлено, например, при испытаниях биопрепарата «Кладород» состоящего из лишайниковых β-олигосахаридов и флавогликозидов, выделяемых из корней и корневищ родиолы розовой (салидрозида и др.) [19-21].
Детоксикационная активность лишайниковых β-олигосахаридов была установлена в экспериментах по связыванию in vitro тяжелых металлов и модельных органических веществ на примере метиленового синего [22], а также in vivo на примере алкогольных токсинов [23, 24].
Наиболее близкой к заявляемому изобретению, в отношении комплексного детоксикационного и, в меньшей степени, антибактериального действия, является композиция, получаемая из слоевищ лишайников рода Cladonia с помощью технологии их механохимической активации в воздушной среде на мельнице-активаторе планетарного типа [22] - прототип. Композиция, получаемая в соответствии с прототипом, характеризуется содержанием β-олигосахаридов в количестве 2,1±0,2 мг/г и содержанием лишайниковых ароматических кислот флавоноидного типа в количестве 0,20±0,02 мг/г.
К недостаткам прототипа можно отнести недостаточно высокую детоксикационную и существенно сниженную антибактериальную активность, по сравнению с заявляемой композицией. Это обусловлено меньшей степенью разрушения прочной трехмерной матрицы лишайниковых β-полисахаридов и, соответственно, более низкой концентрацией образующихся лишайниковых β-олигосахаридов и деиммобилизуемых лишайниковых кислот антибактериального действия.
Технический эффект (сущность) заявляемого изобретения заключается в расширении спектра биологической активности созданной композиции природных биоактивных веществ из слоевищ лишайников, а именно в наличии, наряду с повышенной антибактериальной активностью за счет высокого содержания деиммобилизованных природных лишайниковых кислот, детоксикационной функции по отношению к внутренним средам организма, благодаря более глубокому гидролизу трехмерной матрицы лишайниковых β-полисахаридов и, соответственно, повышенному содержанию лишайниковых β-олигосахаридов, образующихся в биотехнологическом процессе получения данной композиции из лишайниковых β-полисахаридов.
Технический эффект (сущность) заявляемого изобретения достигается благодаря тому, что при предэкстракционной обработке слоевищ лишайников рода Cladonia диоксидом углерода в состоянии сверхкритической жидкости (t>31,3°C, давление >73 атмосфер) происходит более глубокий частичный гидролиз прочных β-гликозидных связей в лишайниковых β-полисахаридах. При этом, во-первых, в большей концентрации образуются лишайниковые β-олигосахариды, обладающие свойством детоксикации внутренних сред организма. Во-вторых, происходит более полная деиммобилизация лишайниковых кислот антибактериального действия, содержащихся in vivo в прочных (не подвергающихся перевариванию в желудочно-кишечном тракте организма человека и животных (кроме северного оленя), а также во внутренних средах организма) ячейках трехмерной матрицы лишайниковых β-полисахаридов. В-третьих, деиммобилизованные лишайниковые кислоты образуют большее количество супрамолекулярных комплексов с образующимися лишайниковыми β-олигосахаридами за счет чего в 6-8 раз повышается их биодоступность и биоактивность, в целом.
Изобретение может быть реализовано следующим образом.
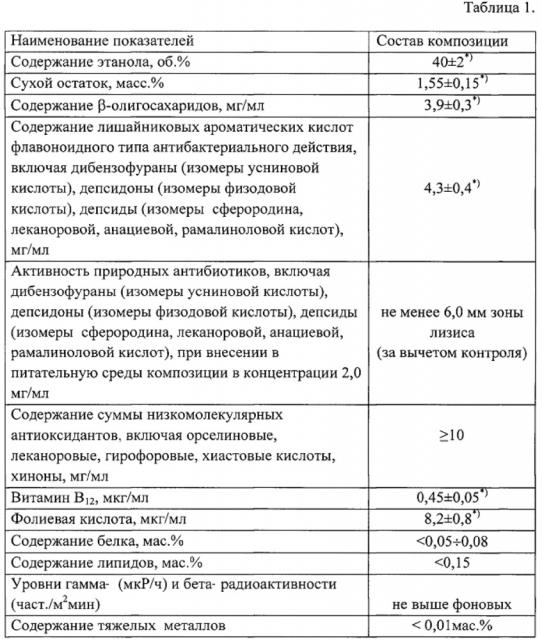
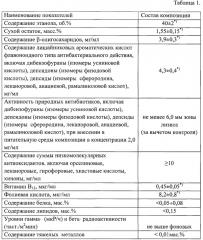
(1) Слоевища лишайника рода Cladonia подвергаются предварительному грубому помолу на мельнице до размеров частиц 0,6÷0,8 мм. (2) Порошок помещается в установку для обработки диоксидом углерода в состоянии сверхкритической жидкости (t=39-42°C, давление - 75-80 атмосфер; фиг. 1). Обработка происходит в течение 10-15 часов. В этих условиях часть лишайниковых β-полисахаридов гидролизуется до растворимых в водно-спиртовой смеси β-олигосахаридов. Свидетельством этого является увеличение концентрации «восстанавливающих концов» (свободных концевых альдегидных групп β-олигосахаридов) в 13,1 раза, с 4,6 до 60,3 мг*экв глюкозы/ г порошка (в прототипе - в 7,3 раза, с 4,6 до 33,5 мг*экв глюкозы/ г порошка). Происходит также деиммобилизация лишайниковых кислот антибактериального действия (3) Порошок, после обработки диоксидом углерода в состоянии сверхкритической жидкости, подвергается экстракции 50 об.%-ным водно-спиртовым раствором в течение 24 часов при комнатной температуре в стандартном ферментере, при которой в раствор переходят β-олигосахариды и лишайниковые кислоты антибактериального действия и между ними образуются супрамолекулярные комплексы. (4) Полученный раствор фильтруется через систему мембранных фильтров с диаметром пор 1,2÷0,5 микрон до получения прозрачной жидкости светло-желтого цвета со специфическим слабым «грибным» запахом. Интенсивность окраски должна соответствовать эталону "3б". (5) Полученный экстракт доводят до содержания этанола 38÷42 об. %. Состав получаемой композиции отражен в таблице 1.
*) p<0,05
(1) Антибактериальное действие
Антибактериальные свойства заявляемой композиции определяли in vitro на культурах десяти бактериальных штаммов условно-патогенных и патогенных микроорганизмов по стандартным и модифицированным методикам по стандартам мутности культур на 5 и 10 единиц, по сравнению с механоактивированным порошком слоевищ лишайников (размеры частиц 10-1000 нм; прототип, контроль):: Staphylococcus aureus - 6538-р; Enteroβacter cloacae; Pseudomonas aeruginosa - 33105; Klebsiella pneumoniae; Salmonella enteritidis; гемолитическая E.coli; E.coli M-17; лактозо-негативная E.coli; Escherichia coli - H-257; Proteus vulgaris. Использовались стандартные питательные среды: среда Эндо, молочно-желточно-солевой агар, среда Плоскирева, мясо-пептонный агар (МПА), которые были приготовлены по стандартной прописи [26], с добавлением в питательную среду контрольного (в количестве 5,0 мг/мл) и исследуемого образца (в количестве 2,0 мг/мл). Газонным методом был произведен посев культур микроорганизмов и после культивации в термостате при 37,0°С оценивалась интенсивность их роста. Результаты оценки приведены в таблице 2.
Условные обозначения: + слабый лизис; ++ частичное лизирование; +++ почти полный лизис; ++++ полный лизис.
Анализ полученных результатов показывает, что благодаря деиммобилизации лишайниковых кислот антибактериального действия (при более глубоком, чем в прототипе, частичном гидролизе лишайниковых β-полисахаридов при обработке слоевищ диоксидом углерода в состоянии сверхкритической жидкости), а также повышению их растворимости и биодоступности в бактериальные клетки (в ситуации in vivo - также лучшей всасываемости в желудочно-кишечном тракте) за счет образования супрамолекулярных комплексов между ними и образующимися лишайниковыми β-олигосахаридами, в 3-5 раз повышается антибактериальная активность заявляемой композиции в отношении патогенных и условно-патогенных микроорганизмов, по сравнению с прототипом.
(2) Детоксикационное действие
Детоксикационные свойства заявляемой композиции определяли, во-первых, in vitro, изучая адсорбционную активность лишайниковых β-олигосахаридов по катионам тяжелых металлов (на примере Рb2+, раствор соли ацетата свинца) и по метиленовому синему (как аналогу органических эндотоксинов малой и средней молекулярной массы - медиаторов воспалительного процесса) (фиг. 2). В раствор адсорбируемого вещества добавляли раствор заявляемой композиции (в контроле - ультрадисперсный порошок прототипа), инкубировали 20 мин или 24 часа, затем проводили фильтрацию через нанофильтр с диаметром пор 10 нм фирмы «Amicon» (США) и определяли остаточную концентрацию адсорбируемого вещества в растворе. В контроле, перед фильтрацией через нанофильтр, центрифугированием отделяли нерастворимую часть ультрадисперсного препарата прототипа, а после нанофильтрации, также как при определении детоксикационного действия заявляемой композиции, определяли остаточную концентрацию адсорбируемого вещества в растворе. В таблице 3 приведены полученные результаты, расчет проводили в мкмолях адсорбированного вещества на г порошка ягеля грубого помола, исходно взятого для получения заявляемой композиции или для получения препарата-прототипа.
*) p<0,05
Следует отметить, что по метиленовому синему даже у прототипа это очень высокая адсорбционная емкость, т.к. даже у таких известных адсорбентов, как полифепан или глина белая, она составляет всего 31,3 и 35,6 мкмоль/г соответственно. Заявляемая же композиция обладает адсорбционной емкостью в 1,7-1,8 раза большей чем прототип. По катионам тяжелых металлов у заявляемой композиции также было отмечено повышение в 1,6-1,7 раза адсорбционной емкости in vitro по сравнению с прототипом. По-видимому, это объясняется более высокой концентрацией лишайниковых β-олигосахаридов в заявляемой композиции, по сравнению с прототипом.
Во-вторых, детоксикационная активность было зарегистрирована in vivo по изменению в крови концентрации «токсина усталости» (молочной кислоты) и мочевины крови в результате ежедневного введения в питьевую воду белым лабораторным мышам линии CD-1 заявленной композиции (в контроле - адекватной дозы прототипа в корм животных), на фоне ежедневной повышенной нагрузки в виде плавания в течение 4 минут, в течение 10 дней. Показано, что при потреблении животными заявляемой композиции на фоне вышеуказанной физической нагрузки снижение уровня молочной кислоты достигало 48-64% (прототипа - 28-43%) по сравнению с контролем (отсутствие добавок); мочевины - 43 и 25% соответственно.
Детоксикационная активность регистрировалась также по содержанию в крови белых лабораторных крыс алкогольных токсинов (основных компонентов сивушных масел - ацетальдегида и ацетона) через 3 часа после алкоголизации (40 об. % раствор этанола в дозе 3 г/кг). При введении в питьевую воду заявляемой композиции снижение уровня ацетальдегида и ацетона достигало 56 и 45,5%, против 31 и 26,8% (добавка в корм композиции прототипа), по сравнению с контролем (отсутствие добавки).
Таким образом, предложенная композиция обладает комплексной повышенной в 3-5 раз антибактериальной и в 1,6-1,8 раз детоксикационной активностью по сравнению с известным средством.
Литература
1. Машковский М.Д. Лекарственные средства: в 2 т. Т. 2. - 14-е изд., перераб, испр. и доп. М., изд-во «Новая Волна», 2000. 608 с.
2. Рассадина, 1957; Атлас лекарственных растений, 1962; фармакопейная статья ФС 42-766-73.
3. Брызгалова В.А. Материалы по изучению антибактериальных свойств препарата Бинан/ в Кн. «Новый антибиотик бинан или натриевая соль усниновой кислоты» // Под ред. Лазарева Н.В., Савич В.П. М. - Л., изд-во АН СССР. 1957, стр. 85-89.
4. Гофрен А.Г. Отчет о местном применении Бинана в хирургической амбулаторной практике. / в Кн. «Новый антибиотик бинан или натриевая соль усниновой кислоты» // Под ред. Лазарева Н.В., Савич В.П. М. - Л., изд-во АН СССР. 1957. - Стр. 123-128.
5. Капацинский Е.В. К вопросу о применении препарата Бинан в хирургической практике. / в Кн. «Новый антибиотик бинан или натриевая соль усниновой кислоты» // Под ред. Лазарева Н.В., Савич В.П. М.-Л., изд-во АН СССР. 1957. - Стр. 134-139.
6. Заугольников С.Д. Экспериментальное изучение противотрихомонадной активности Бинана. / в Кн. «Новый антибиотик бинан или натриевая соль усниновой кислоты» // Под ред. Лазарев Н.В., Савич В.П. М.-Л., изд-во АН СССР. 1957. - Стр. 177-180.
7. Бутомо В.Г. Наблюдения над терапевтическим применением Бинана при лечении трихомонадного кольпита и эрозий шейки матки./ в Кн. «Новый антибиотик бинан или натриевая соль усниновой кислоты» // Под ред. Лазарева Н.В., Савич В.П. М.-Л., изд-во АН СССР. 1957. - Стр. 181-190.
8. , К. (2002) Usnic acid. - Phytochemistry 61 (7), p. 729-736.
9. Okuyama E, Umeyama K, Yamazaki M, Kinoshita Y, Yamamoto Y (1995). Usnic acid and diffractic acid as analgesic and antipyretic components of Usnea diffracta. - Planta Medica. 61: p. 113-115
10. E, Groeneweg J, GG, G, S, К, HM. Cellular mechanisms of the anticancer effects of the lichen compound usnic acid. - Planta Medica, 2010 Jul; 76(10): p. 969-974.
11. Odabasoglu F, Cakir A, Suleyman H, Asian A, Bayir Y, Halici M, Kazaz C. Gastroprotective and antioxidant effects of usnic acid on indomethacin-induced gastric ulcer in rats. - J. Ethnopharmacol., 2006 Jan 3; 103(1): p. 59-65.
12. Kohlhardt-Floehr, C. Boehm F, Troppens S, Lademann J, Truscott TG. (2010) Pro-oxiant and antioxidant behaviour of usnic acid from lichens under UVB irradiation studies on human cells. - J. Photochem Photobiol. B. 101 (1): p. 97-102.
13. Nunes, P. et al. Collagen-based films containing liposome-loaded usnic acid as dressing for dermal burn healing/ Journal of Biomedicine and Biotechnology, Volume 2011, Article ID 761593, 9 pages.
14. Chifiriuc MC, LM, Oprea E, S, Bucur M, L, Enache G, Saviuc C, M, T, G, V. In vitro study of the inhibitory activity of usnic acid on dental plaque biofilm/ Roum Arch Microbiol Immunol. 2009 Oct-Dec; 68(4): p. 215-222.
15. Прокопьев И.А., Порядина Л.Н., Филиппова Г.В., Шеин А.А. Содержание вторичных метаболитов в лишайниках сосновых лесов Центральной Якутии // Химия растительного сырья. - №3. - 2016. - С. 73-78.
16. Ахременко Я.А., Прокопьев И.А., Поляниченко А.А., Федоров А.А. Антибактериальная активность вторичных метаболитов лишайников в отношении условно-патогенных и патогенных микроорганизмов // Тезисы доклада на XI молодежной школе-конференции с международным участием. Москва, 01-02 ноября 2016 г. М.: Изд-во ООО «МАКС Пресс». - С. 110-112.
17. Аньшакова В.В., Кершенгольц Б.М. Способ получения высокоактивного твердофазного биопрепарата антибиотического действия ЯГЕЛЬ из слоевищ лишайников // Патент RU №2467063 С1 от 20.11.2012, приоритет 05.05.2011.
18. В.В. Аньшакова, Б.М. Кершенгольц, В.И. Аньшаков. Интенсификация процессов получения природных веществ антибиотического действия из лишайникового сырья с использованием механохимической технологии // Химия растительного сырья. 2011. №2. С. 133-136.
19. Аньшакова В.В., Степанова А.В., Уваров Д.М., Смагулова А.Ш., Наумова К.Н., Васильев П.П., Кершенгольц Б.М. Актопротекторная активность комплексного битопрепарата на основе таллома лишайников и родиолы розовой // Экология человека. 2015. №5. С. 46-51.
20. K.N. Naumova, V.V. Anshakova, B.M. Kershengolts Nonspecific adaptive reactions of athletes: evaluation and correction // Journal of Biopharmaceuticals. - 2015. - №4. P. 238-239.
21. Аньшакова В.В. Повышение активности действующего вещества лишайниковыми β-олигосахаридами // Биофармацевтический журнал. - 2012. - Т. 4. №4. - С. 42-46.
22. Аньшакова В.В., Шарина А.С., Каратаева Е.В., Кершенгольц Б.М. Способ получения сорбционного материала из слоевищ лишайников // Патент РФ №2464997 от 27.10.2012, приоритет от 20.07.2011.
23. Кершенгольц Б.М., Журавская А.Н., Ремигайло П.А., Филиппова Г.В., Шеин А.А., Шашурин М.М., Кершенгольц Е.Б. Способ получения водки, обладающей пониженным токсическим и наркотическим эффектом // Патент РФ №2318407 от 10.03.2008, приоритет от 10.01.2006.
24. Кершенгольц Б.М., Кунгурцев С.В., Шашурин М.М. Способ профилактики и купирования похмелья с помощью питьевой воды // Патент РФ №2608657 от 23.01.2017, приоритет от 05.06.2015.
25. Кершенгольц Б.М., Кершенгольц Е.Б., Шеин А.А. Комплекс биологически активных веществ, выделенных из лишайников методом СО2 флюидной сверхкритической экстракции, оценка его влияния на состояние крыс при их алкоголизации // Наука и образование. - №2. - 2005. - С. 74-80.
26. МУК 4.2.1890-04. Определение чувствительности микроорганизмов к антибактериальным препаратам проводили в соответствии с методическими указаниями, утвержденными главным государственным санитарным врачом. РФ 04.03.2004.
Жидкофазная композиция, обладающая антибактериальным и детоксикационным действием, представляющая собой водно-спиртовой раствор водно-спиртового экстракта слоевищ лишайников рода Cladonia, предварительно обработанных диоксидом углерода в состоянии сверхкритической жидкости, характеризующаяся тем, что содержит лишайниковые β-олигосахариды в концентрации 3,9±0,3 мг/мл (р<0,05) и лишайниковые ароматические кислоты флавоноидного типа в концентрации 4,3±0,4 мг/мл (р<0,05), при этом содержание этилового спирта в композиции составляет 40±2 об. %.