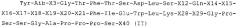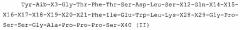Двойные агонисты glp1/gip или тройные агонисты glp1/gip/глюкагона
Иллюстрации
Показать всеНастоящее изобретение относится к производным эксендина-4, которые активируют рецептор глюкагоноподобного пептида 1 (GLP-1) и глюкозозависимого инсулинотропного полипептида (GIP) и необязательно рецептор глюкагона (GCG), их использованию для лечения нарушений метаболического синдрома, включая диабет и ожирение, а также для снижении избыточного потребления пищи. 2 н. и 14 з.п. ф-лы, 8 ил., 11 табл., 9 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к аналогам пептида эксендина-4, которые активируют рецептор глюкагоноподобного пептида 1 (GLP-1) и глюкозозависимого инсулинотропного полипептида (GIP) и, необязательно, рецептор глюкагона (GCG), и к их использованию в медицине, например, при лечении нарушений метаболического синдрома, включая диабет и ожирение, так же как в снижении избыточного потребления пищи.
УРОВЕНЬ ТЕХНИКИ ДЛЯ ИЗОБРЕТЕНИЯ
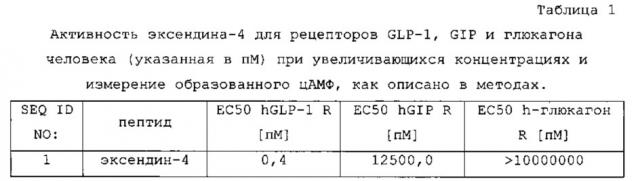
Эксендин-4 представляет собой пептид, состоящий из 39 аминокислот, продуцируемый слюнными железами ядозуба (Heloderma suspectum) (Eng J. et al., J. Biol. Chem., 267:7402-05,1992). Эксендин-4 является активатором рецептора глюкагоноподобного пептида-1 (GLP-1), в то время как для него показана только очень низкая активация рецептора GIP, и он не активирует рецептор глюкагона (см. таблицу 1).
Эксендин-4 разделяет множество глюкорегуляторных действий, наблюдаемых для GLP-1. Клинические и неклинические исследования показали, что эксендин-4 обладает несколькими преимущественными противодиабетическими свойствами, включая глюкозозависимое усиление синтеза и секреции инсулина, глюкозозависимую супрессию секреции глюкагона, замедление опорожнения желудка, уменьшение потребления пищи и массы тела, и увеличение массы бета-клеток и маркеров функционирования бета-клеток (Gentilella R et al., Diabetes Obes Metab., 11:544-56, 2009; Norris SL et al., Diabet Med., 26:837-46, 2009; Bunck MC et al., Diabetes Care., 34:2041-7, 2011).
Эти эффекты являются преимущественными не только для пациентов с диабетом, но также для пациентов, страдающих от ожирения. Пациенты с ожирением обладают более высоким риском получения диабета, гипертензии, гиперлипидемии, сердечно-сосудистых и скелетно-мышечных заболеваний.
По сравнению с GLP-1 и GIP, эксендин-4 является более устойчивым к расщеплению дипептидил-пептидазой-4 (DPP4), что приводит к более длительному времени полужизни и продолжительности действия in vivo (Eng J., Diabetes, 45 (Suppl 2):152A (abstract 554), 1996; Deacon CF, Horm Metab Res, 36: 761-5, 2004).
Показано также, что эксендин-4 является намного более стабильным в отношении деградации нейтральной эндопептидазой (NEP), по сравнению с GLP-1, глюкагоном или оксинтомодулином (Druce MR et al., Endocrinology, 150(4), 1712-1721, 2009).
Тем не менее, эксендин-4 является химически лабильным из-за окисления метионина в положении 14 (Hargrove DM et al., Regul. Pept., 141: 113-9, 2007), так же как дезамидирования и изомеризации аспарагина в положении 28 (WO 2004/035623).
Аминокислотная последовательность эксендина-4 показана как SEQ ID NO: 1:
HGEGTFTSDLSKQMEEEAVRLFIEWLKNGGPSSGAPPPS-NH2
Аминокислотная последовательность GLP-1(7-36)-амида показана как SEQ ID NO: 2:
HAEGTFTSDVSSYLEGQAAKEFIAWLVKGR-NH2
Лираглутид представляет собой продаваемый на рынке химически модифицированный аналог GLP-1, в котором, среди других модификаций, жирная кислота присоединена к лизину в положении 20, приводя к продленной продолжительности действия (Drucker DJ et al, Nature Drug Disc. Rev. 9, 267-268, 2010; Buse, JB et al., Lancet, 374:39-47, 2009).
Аминокислотная последовательность лираглутида показана как SEQ ID NO: 3:
HAEGTFTSDVSSYLEGQAAK((S)-4-карбокси-4-гексадеканоиламинобутирил-)EFIAWLVRGRG-OH
GIP (глюкозозависимый инсулинотропный полипептид) представляет собой пептид из 42 аминокислот, который высвобождается из K-клеток кишечника после приема пищи. GIP и GLP-1 представляют собой два гормона, происходящие из энтероэндокринных клеток кишечника, обеспечивающие инкретиновый эффект, обеспечивающий более 70% ответа инсулина на пероральный тест толерантности к глюкозе (Baggio LL, Drucker DJ. Biology of incretins: GLP-1 и GIP. Gastroenterology 2007; 132: 2131-2157).
Аминокислотная последовательность GIP показана как SEQ ID NO: 4:
YAEGTFISDYSIAMDKIHQQDFVNWLLAQKGKKNDWKHNITQ-OH
Глюкагон представляет собой пептид из 29 аминокислот, который высвобождается в кровоток, когда циркулирующий уровень глюкозы является низким. Аминокислотная последовательность глюкагона показана на SEQ ID NO: 5:
HSQGTFTSDYSKYLDSRRAQDFVQWLMNT-OH
В ходе гипогликемии, когда уровни глюкозы в крови падают ниже нормы, глюкагон подает сигналы печени к разрушению гликогена и высвобождению глюкозы, что вызывает повышение уровня глюкозы в крови до достижения нормального уровня. Гипогликемия является распространенным побочным эффектом у подвергнутых лечению инсулином пациентов с гипергликемией (повышенными уровнями глюкозы в крови), обусловленной диабетом. Таким образом, наиболее преобладающей ролью глюкагона в регуляции глюкозы является противодействие действию инсулина и поддержание уровней глюкозы в крови.
Holst (Holst, J. J. Physiol. Rev. 2007, 87, 1409) и Meier (Meier, J. J. Nat. Rev. Endocrinol. 2012, 8, 728) описывают, что агонисты рецептора GLP-1, такие как GLP-1, лираглутид и эксендин-4, улучшают гликемический контроль у пациентов с T2DM посредством уменьшения уровней глюкозы при голодании и после приема пищи (FPG и PPG). Пептиды, которые связывают и активируют рецептор GLP-1, описаны в патентных заявках WO 98/08871 А1, WO 2008/081418 А1 и WO 2008/023050 А1, полное содержание которых приведено в настоящем документе в качестве ссылки.
Описано, что двойная активация рецепторов GLP-1 и GIP, например, посредством комбинации действий GLP-1 и GIP в одном препарате, приводит к терапевтическому принципу с значительно лучшим уменьшением уровней глюкозы в крови, увеличенной секрецией инсулина и сниженной массой тела у мышей с T2DM и ожирением по сравнению с продаваемым на рынке агонистом GLP-1 лираглутидом (например, VA Gault et al., Clin Sci (Lond), 121, 107-117, 2011). Доказано, что нативные GLP-1 и GIP у человека после совместной инфузии взаимодействуют аддитивным способом с значительно увеличенным инсулинотропным эффектом по сравнению с одним GLP-1 (MA Nauck et al., J. Clin. Endocrinol. Metab., 76, 912-917, 1993).
Разработка гибридных молекул, комбинирующих агонизм рецептора GLP-1, рецептора GIP и рецептора глюкагона, предлагает терапевтический потенциал для достижения значительно лучшего снижения уровней глюкозы в крови, увеличения секреции инсулина и даже более выраженного эффекта на снижение массы тела по сравнению с продаваемым на рынке агонистом GLP-1 лираглутидом (например, VA Gault et al., Clin Sci (Lond), 121, 107-117, 2011).
Соединения по этому изобретению представляют собой производные эксендина-4, для которых показана агонистическая активность для GLP-1 и рецептора GIP и, необязательно, рецептора глюкагона и которые обладают - среди прочих - предпочтительно, следующими модификациями: Tyr в положении 1 и Ile в положении 12.
Неожиданно, обнаружено, что модификация избирательного агониста GLP-1R эксендина-4 посредством Tyr в положении 1 и Ile в положении 12 приводит к пептиду с двойной активностью для рецепторов GLP-1 и GIP. Это наблюдение является неожиданным, поскольку такая же модификация в других агонистах GLP-1, таких как сам GLP-1, не приводит к высокой активности для рецептора GIP, как показано в таблице 2.
Пептиды, которые связывают и активируют рецептор как GIP, так и GLP-1, и необязательно, рецептор глюкагона, и улучшают гликемический контроль, супрессируют увеличение массы тела и уменьшают потребление пищи, описаны в патентных заявках WO 2011/119657 A1, WO 2012/138941 A1, WO 2010/011439 А2, WO 2010/148089 A1, WO 2011/094337 A1, WO 2012/088116 А2, содержание которых приведено в настоящем документе в качестве ссылки. В этих заявках описано, что смешанные агонисты рецептора GLP-1, рецептора GIP и, необязательно, рецептора глюкагона можно разрабатывать как аналоги нативных последовательностей GIP или глюкагона.
Соединения по этому изобретению представляют собой пептидные аналоги эксендина-4, содержащие лейцин в положении 10 и глутамин в положении 13. Krstenansky et al. (Biochemistry, 25, 3833-3839, 1986) показали важность остатков 10-13 глюкагона для его взаимодействий с рецептором и активации аденилатциклазы. В пептидных аналогах эксендина-4 по этому изобретению несколько из подчеркнутых остатков отличаются от указанных остатков глюкагона. В частности, остатки Tyr10 и Tyr13 заменены на лейцин в положении 10 и глутамин, неароматическую полярную аминокислоту, в положении 13. Эта замена, особенно в комбинации с изолейцином в положении 23 и глутаматом в положении 24 приводит к производным эксендина-4 с потенциально улучшенными биофизическими свойствами, такими как растворимость или поведение агрегации в растворе. Неконсервативная замена ароматической аминокислоты на полярную аминокислоту в положении 13 аналога эксендина-4 неожиданно приводит к пептидам с высокой активностью для рецептора GIP и, необязательно, для рецептора глюкагона.
Более того, соединения по этому изобретению представляют собой производные эксендина-4 с ацилированными остатками жирной кислоты в положении 14. Эта функционализация жирной кислоты в положении 14 приводит к улучшенному фармакокинетическому профилю. Неожиданно, функционализация жирной кислоты в положении 14 также приводит к пептидам с значительно более высокой активностью для GIPR, например, к пептидам, показанным в примере 5, таблице 8.
Соединения по этому изобретению представляют собой пептидные аналоги эксендина-4, содержащие альфа,альфа-диалкилированные аминокислоты с основной боковой цепью в положении 20. Неожиданно, модификация последовательности эксендина-4 с помощью одной из этих аминокислот приводит к соединениям с улучшенным биофизическим профилем, таким как растворимость (в частности, при низком рН, особенно при рН 4,5) или поведение агрегации в растворе, когда неприродную аминокислоту включают в положении 20. Полученные аналоги эксендина-4, таким образом, сохраняют их высокую активность для рецептора GLP-1, рецептора GIP и необязательно, для рецептора глюкагона. Включение этих неприродных аминокислот также увеличивает ферментативную стабильность пептидов, потенциально приводя к улучшенным фармакокинетическим свойствам.
КРАТКАЯ СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем документе представлены аналоги эксендина-4, которые потенциально активируют рецептор GLP-1 и GIP и, необязательно, рецептор глюкагона. В этих аналогах эксендина-4 - среди других замен - метионин в положении 14 заменен на аминокислоту, несущую группу -NH2 в боковой цепи, которую далее замещают липофильной боковой цепью (например, жирной кислотой, необязательно, в сочетании с линкером).
Изобретение относится к пептидному соединению, обладающему формулой (I):
где Z представляет собой пептидную группу, обладающую формулой (II)
Х3 представляет собой аминокислотный остаток, выбранный из Gln, Glu и His,
Х12 представляет собой аминокислотный остаток, выбранный из Ile и Lys,
X14 представляет собой аминокислотный остаток, обладающий боковой цепью с группой -NH2, где группа -NH2 боковой цепи функционализирована посредством -C(O)-R5, -C(O)O-R5, -C(O)NH-R5, -S(O)2-R5 или R5, предпочтительно, посредством -C(O)-R5, где R5 может представлять собой группу, содержащую вплоть до 50 или вплоть до 100 атомов углерода и, необязательно, гетероатомы, выбранные из галогена, N, О, S и/или Р,
X15 представляет собой аминокислотный остаток, выбранный из Asp и Glu,
X16 представляет собой аминокислотный остаток, выбранный из Ser, Lys, Glu и Gln,
Х17 представляет собой аминокислотный остаток, выбранный из Arg, Lys, Ile, Glu, Gln, Leu, Aib, Tyr и Ala,
X18 представляет собой аминокислотный остаток, выбранный из Ala, Arg, Lys, Aib, Leu и Tyr,
X19 представляет собой аминокислотный остаток, выбранный из Ala, Val, Gln и Aib,
Х20 представляет собой аминокислотный остаток, выбранный из Gln, Aib, Phe, Leu, Lys, His, Arg, Pip, (S)MeLys, (R)MeLys, (S)MeOrn и (R)MeOrn,
X21 представляет собой аминокислотный остаток, выбранный из Asp, Glu, Leu и Tyr,
Х28 представляет собой аминокислотный остаток, выбранный из Asn, Ala, Arg, Lys, Aib и Ser,
X29 представляет собой аминокислотный остаток, выбранный из Gly, Thr, Aib, D-Ala и Ala,
X40 отсутствует или представляет собой аминокислотный остаток, обладающий боковой цепью с группой -NH2, где группа -NH2 боковой цепи, необязательно, функционализирована посредством -C(O)-R5, -C(O)O-R5, -C(O)NH-R5, -S(O)2-R5 или R5, предпочтительно, посредством -C(O)-R5, где R5 может представлять собой группу, содержащую вплоть до 50 или вплоть до 100 атомов углерода и, необязательно, гетероатомы, выбранные из галогена, N, О, S и/или Р,
R1 представляет собой NH2,
R2 представляет собой ОН или NH2.
или его соль или сольват.
Соединения по изобретению являются агонистами рецептора GLP-1 и GIP и, необязательно, агонистами рецептора глюкагона, как определено по наблюдению, что они являются способными стимулировать образование внутриклеточного цАМФ. Определение активности in vitro в клеточных анализах агонистов количественно оценивают посредством определения концентраций, вызывающих 50% активацию максимального ответа (ЕС50), как описано в методах.
В конкретных вариантах осуществления, изобретение, таким образом, относится к пептидному соединению, обладающему формулой (I):
где Z представляет собой пептидную группу, обладающую формулой (II)
Х3 представляет собой аминокислотный остаток, выбранный из Gln, Glu и His,
Х12 представляет собой аминокислотный остаток, выбранный из Ile и Lys,
Х14 представляет собой аминокислотный остаток, обладающий боковой цепью с группой -NH2, где группа -NH2 боковой цепи функционализирована посредством -C(O)-R5, -C(O)O-R5, -C(O)NH-R5, -S(O)2-R5 или R5, предпочтительно, посредством -C(O)-R5, где R5 представляет собой группу, содержащую вплоть до 50 или вплоть до 100 атомов углерода и, необязательно, гетероатомы, выбранные из галогена, N, О, S и/или Р,
Х15 представляет собой аминокислотный остаток, выбранный из Asp и Glu,
X16 представляет собой аминокислотный остаток, выбранный из Ser, Lys, Glu и Gln,
Х17 представляет собой аминокислотный остаток, выбранный из Arg, Lys, Ile, Glu, Gln, Leu, Aib, Tyr и Ala,
X18 представляет собой аминокислотный остаток, выбранный из Ala, Arg, Lys, Aib, Leu и Tyr,
X19 представляет собой аминокислотный остаток, выбранный из Ala, Val, Gln и Aib,
Х20 представляет собой аминокислотный остаток, выбранный из Gln, Aib, Phe, Leu, Lys, His, Arg, Pip, (S)MeLys, (R)MeLys, (S)MeOrn и (R)MeOrn,
X21 представляет собой аминокислотный остаток, выбранный из Asp, Glu, Leu и Tyr,
Х28 представляет собой аминокислотный остаток, выбранный из Asn, Ala, Arg, Lys, Aib и Ser,
X29 представляет собой аминокислотный остаток, выбранный из Gly, Thr, Aib, D-Ala и Ala,
X40 отсутствует или представляет собой аминокислотный остаток, обладающий боковой цепью с группой -NH2, где группа -NH2 боковой цепи, необязательно, функционализирована посредством -C(O)-R5, -C(O)O-R5, -C(O)NH-R5, -S(O)2-R5 или R5, предпочтительно, посредством -C(O)-R5, где R5 может представлять собой группу, содержащую вплоть до 50 или вплоть до 100 атомов углерода и, необязательно, гетероатомы, выбранные из галогена, N, О, S и/или Р,
R1 представляет собой NH2,
R2 представляет собой ОН или NH2.
или его соль или сольват, где пептидное соединение обладает относительной активностью по меньшей мере 0,04%, предпочтительно по меньшей мере 0,08%, более предпочтительно, по меньшей мере 0,2% по сравнению с активностью природного GIP для рецептора GIP.
Кроме того, пептидное соединение, в частности, с лизином в положении 14, который далее замещают липофильным остатком, обладает относительной активностью по меньшей мере 0,07%, предпочтительно, по меньшей мере 0,1%, более предпочтительно, по меньшей мере 0,14%, более предпочтительно, по меньшей мере 0,35% и даже более предпочтительно, по меньшей мере 0,4% по сравнению с активностью GLP-1(7-36) для рецептора GLP-1.
Кроме того, пептидное соединение, в частности с лизином в положении 14, который далее замещают липофильным остатком, обладает относительной активностью по меньшей мере 0,04% (т.е. ЕС50<1000 пМ), более предпочтительно, 0,08% (т.е. ЕС50<500 пМ) и даже более предпочтительно, 0,2% (т.е. ЕС50<200 пМ) по сравнению с активностью природного GIP для рецептора GIP (ЕС50=0,4 пМ).
Необязательно, в некоторых вариантах осуществления, пептидное соединение, в частности, с лизином в положении 14, который далее замещают липофильным остатком, обладает относительной активностью по меньшей мере 0,1%, предпочтительно, по меньшей мере 0,2%, более предпочтительно, по меньшей мере 0,3%, более предпочтительно, по меньшей мере 0,4% и даже более предпочтительно, по меньшей мере 0,5% по сравнению с активностью природного глюкагона для рецептора глюкагона.
Термин «активность», как применяют в настоящем документе, предпочтительно относится к способности соединения активировать рецептор GLP-1 человека, рецептор GIP человека и, необязательно, рецептор глюкагона человека. Более предпочтительно, термин «активность», как применяют в настоящем документе, относится к способности соединения стимулировать образование внутриклеточного цАМФ. Термин «относительная активность», как применяют в настоящем документе, понимают как обозначающий способность соединения активировать рецептор в конкретном соотношении по сравнению с другим агонистом рецептора или по сравнению с другим рецептором. Активацию рецепторов агонистами (например, посредством измерения уровня цАМФ) определяют, как описано в настоящем документе, например, как описано в примерах.
В соответствии с одним из вариантов осуществления, соединения по изобретению обладают ЕС50 для рецептора hGLP-1 500 пМ или менее, предпочтительно, 200 пМ или менее; более предпочтительно, 150 пМ или менее, более предпочтительно, 100 пМ или менее, более предпочтительно, 90 пМ или менее, более предпочтительно, 80 пМ или менее, более предпочтительно, 70 пМ или менее, более предпочтительно, 60 пМ или менее, более предпочтительно, 50 пМ или менее, более предпочтительно, 40 пМ или менее, более предпочтительно, 30 пМ или менее, и более предпочтительно, 20 пМ или менее.
В соответствии с одним из вариантов осуществления, соединения по изобретению обладают ЕС50 для рецептора hGIP 500 пМ или менее, предпочтительно, 200 пМ или менее; более предпочтительно, 150 пМ или менее, более предпочтительно, 100 пМ или менее, более предпочтительно, 90 пМ или менее, более предпочтительно, 80 пМ или менее, более предпочтительно, 70 пМ или менее, более предпочтительно, 60 пМ или менее, более предпочтительно, 50 пМ или менее, более предпочтительно, 40 пМ или менее, более предпочтительно, 30 пМ или менее, и более предпочтительно, 20 пМ или менее.
В соответствии с другим вариантом осуществления, соединения по изобретению обладают, необязательно, ЕС50 для рецептора h-глюкагона 500 пМ или менее, предпочтительно, 200 пМ или менее; более предпочтительно, 150 пМ или менее, более предпочтительно, 100 пМ или менее, более предпочтительно, 90 пМ или менее, более предпочтительно, 80 пМ или менее, более предпочтительно, 70 пМ или менее, более предпочтительно, 60 пМ или менее, более предпочтительно, 50 пМ или менее, более предпочтительно, 40 пМ или менее, более предпочтительно, 30 пМ или менее, и более предпочтительно, 20 пМ или менее.
В соответствии с другим вариантом осуществления, соединения по изобретению обладают ЕС50 для рецептора hGLP-1 500 пМ или менее, предпочтительно, 200 пМ или менее; более предпочтительно, 150 пМ или менее, более предпочтительно, 100 пМ или менее, более предпочтительно, 90 пМ или менее, более предпочтительно, 80 пМ или менее, более предпочтительно, 70 пМ или менее, более предпочтительно, 60 пМ или менее, более предпочтительно, 50 пМ или менее, более предпочтительно, 40 пМ или менее, более предпочтительно, 30 пМ или менее, и более предпочтительно, 20 пМ или менее, и/или ЕС50 для рецептора hGIP 500 пМ или менее, предпочтительно, 200 пМ или менее; более предпочтительно, 150 пМ или менее, более предпочтительно, 100 пМ или менее, более предпочтительно, 90 пМ или менее, более предпочтительно, 80 пМ или менее, более предпочтительно, 70 пМ или менее, более предпочтительно, 60 пМ или менее, более предпочтительно, 50 пМ или менее, более предпочтительно, 40 пМ или менее, более предпочтительно, 30 пМ или менее, и более предпочтительно, 20 пМ или менее, и/или необязательно, ЕС50 для рецептора h-глюкагона 500 пМ или менее, предпочтительно, 200 пМ или менее; более предпочтительно, 150 пМ или менее, более предпочтительно, 100 пМ или менее, более предпочтительно, 90 пМ или менее, более предпочтительно, 80 пМ или менее, более предпочтительно, 70 пМ или менее, более предпочтительно, 60 пМ или менее, более предпочтительно, 50 пМ или менее, более предпочтительно, 40 пМ или менее, более предпочтительно, 30 пМ или менее, и более предпочтительно, 20 пМ или менее.
В другом варианте осуществления ЕС50 для обоих рецепторов, т.е. для рецептора hGLP-1 и для рецептора hGIP, составляет 500 пМ или менее, более предпочтительно, 200 пМ или менее, более предпочтительно, 150 пМ или менее, более предпочтительно, 100 пМ или менее, более предпочтительно, 90 пМ или менее, более предпочтительно, 80 пМ или менее, более предпочтительно, 70 пМ или менее, более предпочтительно, 60 пМ или менее, более предпочтительно, 50 пМ или менее, более предпочтительно, 40 пМ или менее, более предпочтительно, 30 пМ или менее, более предпочтительно, 20 пМ или менее.
В другом варианте осуществления, ЕС50 для всех трех рецепторов, т.е. для рецептора hGLP-1, для рецептора hGIP и для рецептора h-глюкагона, составляет 500 пМ или менее, более предпочтительно, 200 пМ или менее, более предпочтительно, 150 пМ или менее, более предпочтительно, 100 пМ или менее, более предпочтительно, 90 пМ или менее, более предпочтительно, 80 пМ или менее, более предпочтительно, 70 пМ или менее, более предпочтительно, 60 пМ или менее, более предпочтительно, 50 пМ или менее, более предпочтительно, 40 пМ или менее, более предпочтительно, 30 пМ или менее, более предпочтительно, 20 пМ или менее.
ЕС50 для рецептора hGLP-1, рецептора hGIP и рецептора h-глюкагона можно определять, как описано в методах в настоящем документе и как использовали для получения результатов, описанных в примере 5.
Соединения по изобретению обладают способностью снижать проходимость кишечника, увеличивать содержимое желудка и/или снижать потребление пищи пациентом. Эти виды активности соединений по изобретению можно оценивать в моделях на животных, известных специалисту в данной области, а также описанных в настоящем документе в методах. Результаты этих экспериментов описаны в примере 10. Предпочтительные соединения по изобретению могут увеличивать содержимое желудка мышей, предпочтительно, самок NMRI-мышей, если введены в форме однократной дозы, предпочтительно, подкожной дозы, 0,02 мг/кг массы тела по меньшей мере на 25%, более предпочтительно по меньшей мере на 30%, более предпочтительно по меньшей мере на 40%, более предпочтительно по меньшей мере на 50%, более предпочтительно по меньшей мере на 60%, более предпочтительно, по меньшей мере на 70%, более предпочтительно, по меньшей мере на 80%.
Предпочтительно, этот результат измеряют через 1 час после введения соответствующего соединения и через 30 мин после введения болюса, и/или оно снижает проходимость кишечника мышей, предпочтительно, самок NMRI-мышей, если введено в форме однократной дозы, предпочтительно, подкожной дозы, 0,02 мг/кг массы тела, по меньшей мере на 45%; более предпочтительно, по меньшей мере на 50%, более предпочтительно, по меньшей мере на 55%, более предпочтительно, по меньшей мере на 60%, и более предпочтительно, по меньшей мере 65%; и/или снижает потребление пищи мышами, предпочтительно, самками NMRI-мышей, в течение периода 22 час, если введены в форме однократной дозы, предпочтительно, подкожной дозы 0,01 мг/кг массы тела по меньшей мере на 10%, более предпочтительно, 15%, и более предпочтительно, 20%.
Соединения по изобретению обладают способностью снижать уровень глюкозы в крови, и/или снижать уровни HbA1c у пациента. Эти виды активности соединений по изобретению можно оценивать в моделях на животных, известных специалисту в данной области, а также описанных в настоящем документе в методах. Результаты таких экспериментов описаны в примерах 8 и 9.
Предпочтительные соединения по изобретению могут снижать уровень глюкозы в крови мышей, предпочтительно, у самок дефицитных по рецептору лептина db/db мышей с диабетом в течение периода 24 час, если введены в форме однократной дозы, предпочтительно, подкожной дозы, 0,01 мг/кг массы тела, по меньшей мере на 4 нмоль/л; более предпочтительно, по меньшей мере на 6 нмоль/л, более предпочтительно, по меньшей мере на 8 нмоль/л. Если дозу увеличивают до 0,1 мг/кг массы тела, более выраженное снижение уровня глюкозы в крови можно наблюдать у мышей в течение 24 час, если она введена в форме однократной дозы, предпочтительно, подкожной дозы. Предпочтительно, соединения по изобретению приводят к снижению по меньшей мере на 7 нмоль/л/ более предпочтительно, по меньшей мере на 9 нмоль/л, более предпочтительно, по меньшей мере на 11 нмоль/л. Соединения по изобретению предпочтительно снижают увеличение уровней HbA1c у мышей в течение периода 4 недель, если введены в ежесуточной дозе от 0,01 мг/кг до приблизительно инициирующего количества.
Соединения по изобретению также обладают способностью снижать массу тела пациента. Эти виды активности соединений по изобретению можно оценивать в моделях на животных, известных специалисту в данной области, а также описанных в настоящем документе в методах и в примере 7.
Неожиданно, обнаружено, что пептидные соединения формулы (I), в частности, соединения с лизином (или близкими аналогами) в положении 14, который далее замещают липофильным остатком, обладают очень сильной активацией рецептора GLP-1 и GIP; кроме того, в комбинации с аминокислотами, подобными Gln в положении 3, также можно обеспечивать очень сильную активацию рецептора глюкагона.
В литературе (Murage EN et al., Bioorg. Med. Chem. 16 (2008), 10106-10112) описано, что для аналога GLP-1 с ацетилированным лизином в положении 14 показана значительно сниженная активность по сравнению с природным GLP-1.
Более того, окисление (in vitro или in vivo) метионина, присутствующего в коровой структуре эксендина-4, не является более возможным для пептидных соединений формулы (I).
Кроме того, соединения по изобретению предпочтительно обладают высокой растворимостью при кислых и/или физиологических значениях рН, например, при рН 4,5 и/или при рН 7,4 при 25°С, в другом варианте осуществления по меньшей мере 0,5 мг/мл и в конкретном варианте осуществления по меньшей мере 1,0 мг/мл.
Более того, в соответствии с одним из вариантов осуществления, соединения по изобретению предпочтительно обладают высокой стабильностью при хранении в растворе. Предпочтительными условиями анализа для определения стабильности при хранении в течение 7 суток при 25°С в растворе при рН 4,5 или рН 7,4. Оставшееся количество пептида определяют посредством хроматографических анализов, как описано в методах и примерах. Предпочтительно, через 7 суток при 25°С в растворе при рН 4,5 или рН 7,4, количество оставшегося пептида составляет по меньшей мере 80%, более предпочтительно, по меньшей мере 85%, даже более предпочтительно, по меньшей мере 90% и даже более предпочтительно, по меньшей мере 95%.
Предпочтительно, соединения по настоящему изобретению содержат пептидную группу Z (формула II), представляющую собой линейную последовательность из 39-40 аминокарбоновых кислот, в частности α-аминокарбоновых кислот, соединенных пептидными, т.е. карбоксамидными, связями.
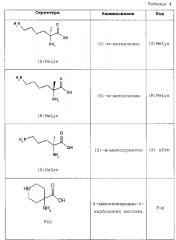
В одном варианте осуществления положение Х14 представляет собой аминокислотный остаток с функционализированной группой -NH2 боковой цепи, такой как функционализированный Lys, Orn, Dab или Dap, более предпочтительно, функционализированный Lys, и Х40 отсутствует или представляет собой Lys.
Аминокислотный остаток с группой -NH2 боковой цепи, например, Lys, Orn, Dab или Dap, может являться функционализированным в том отношении, что по меньшей мере один атом Н группы -NH2 боковой цепи заменен на -C(O)-R5, -C(O)O-R5, -C(O)NH-R5, -S(O)2-R5 или R5, предпочтительно, на -C(O)-R5, где R5 представляет собой группу, содержащую вплоть до 50 или вплоть до 100 атомов углерода и необязательно, гетероатомы, выбранные из галогена, N, О, S и/или Р.
В конкретных вариантах осуществления R5 может содержать липофильную группу, например, ациклическую линейную или разветвленную насыщенную углеводородную группу, где R5 в частности содержит ациклическую линейную или разветвленную (С4-С30) насыщенную или ненасыщенную углеводородную группу, и/или циклическую насыщенную, ненасыщенную или ароматическую группу, в частности, моно-, би-, или трициклическую группу, содержащую 4-14 атомов углерода и 0, 1 или 2 гетероатомов, выбранных из N, О и S, например, циклогексил, фенил, бифенил, хроманил, фенантренил или нафтил, где ациклическая или циклическая группа может являться незамещенной или замещенной, например, галогеном, -ОН и/или CO2H.
Более предпочтительные группы R5 могут содержать липофильную группу, например, ациклическую линейную или разветвленную (C12-С22) насыщенную или ненасыщенную углеводородную группу. Липофильную группу можно присоединять к группе -NH2 боковой цепи посредством линкера во всех стереоизомерных формах, например, линкера, содержащего одну или несколько, например, 2, 3 или 4, аминокислотных линкерных групп, таких как γ-аминомасляная кислота (GABA), ε-аминогексановая кислота (ε-Ahx), γ-Glu и/или β-Ala. В одном варианте осуществления липофильная группа присоединена к группе -NH2 боковой цепи посредством линкера. В другом варианте осуществления липофильная группа напрямую присоединена к группе -NH2 боковой цепи. Конкретные примеры аминокислотных линкерных групп представляют собой (β-Ala)1-4, (γ-Glu)1-4, (ε-Ahx)1-4 или (GABA)1-4. Предпочтительные аминокислотные линкерные группы представляют собой β-Ala, γ-Glu, β-Ala-β-Ala и γ-Glu-γ-Glu.
В следующей таблице 3 перечислены конкретные предпочтительные примеры групп -C(O)-R5, которые выбраны из группы, состоящей из (S)-4-карбокси-4-гексадеканоиламинобутирила-, (S)-4-карбокси-4-октадеканоиламинобутирила-, 4-гексадеканоиламинобутирила-, 4-{3-[(R)-2,5,7,8-тетраметил-2-((4R,8R)-4,8,12-триметил-тридецил)-хроман-6-илоксикарбонил]-пропиониламино}-бутирила-, 4-октадеканоиламинобутирила-, 4-((Z)-октадец-9-эноиламино)-бутирила-, 6-[(4,4-дифенилциклогексилокси)-гидроксифосфорилокси]-гексаноила-, гексадеканоила-, (S)-4-карбокси-4-(15-карбоксипентадеканоиламино)-бутирила-, (S)-4-карбокси-4-{3-[3-((2S,3R,4S,5R)-5-карбокси-2,3,4,5-тетрагидроксипентаноиламино)-пропиониламино]-пропиониламино}-бутирила-, (S)-4-карбокси-4-{3-[(R)-2,5,7,8-тетраметил-2-((4R,8R)-4,8,12-триметилтридецил)-хроман-6-илоксикарбонил]-пропиониламино}-бутирила-, (S)-4-карбокси-4-((9Z,12Z)-октадека-9,12-диэноиламино)-бутирила-, (S)-4-карбокси-4-[6-((2S,3R,4S,5R)-5-карбокси-2,3,4,5-тетрагидрокси-пентаноиламино)-гексаноиламино]-бутирила-, (S)-4-карбокси-4-((2S,3R,4S,5R)-5-карбокси-2,3,4,5-тетрагидрокси-пентаноиламино)-бутирила-, (S)-4-карбокси-4-тетрадеканоиламинобутирила-, (S)-4-(11-бензилоксикарбонилундеканоиламино)-4-карбоксибутирила-, (S)-4-карбокси-4-[11-((2S,3R,4R,5R)-2,3,4,5,6-пентагидрокси-гексилкарбамоил)-ундеканоиламино]-бутирила-, (S)-4-карбокси-4-((Z)-октадец-9-эноиламино)-бутирила-, (S)-4-карбокси-4-(4-додецилоксибензоиламино)-бутирила-, (S)-4-карбокси-4-генэйкозаноиламинобутирила-, (S)-4-карбокси-4-докозаноиламинобутирила-, (S)-4-карбокси-4-((Z)-нонадец-10-эноиламино)-бутирила-, (S)-4-карбокси-4-(4-децилоксибензоиламино)-бутирила-, (S)-4-карбокси-4-[(4'-октилоксибифенил-4-карбонил)-амино]-бутирила-, (S)-4-карбокси-4-(12-фенилдодеканоиламино)-бутирила-, (S)-4-карбокси-4-эйкозаноиламинобутирила-, (S)-4-карбокси-4-((s)-4-карбокси-4-гексадеканоиламинобутириламино)-бутирила-, (S)-4-карбокси-4-((S)-4-карбокси-4-октадеканоиламинобутириламино)-бутирила-, 3-(3-октадеканоиламинопропиониламино)-пропионила-, 3-(3-гексадеканоиламинопропиониламино)-пропионила-, 3-гексадеканоиламино-пропионила-, (S)-4-карбокси-4-[(R)-4-((3R,5S,7R,8R,9R,10S,12S,13R,14R,17R)-3,7,12-тригидрокси-8,10,13-триметилгексадекагидроциклопента[a]фенантрен-17-ил)-пентаноиламино]-бутирила-, (S)-4-карбокси-4-[(R)-4-((3R,5R,8R,9S,10S,13R,14S,17R)-3-гидрокси-10,13-диметилгексадекагидроциклопента[a]фенантрен-17-ил)-пентаноиламино]-бутирила-, (s)-4-карбокси-4-((9S,10R)-9,10,16-тригидроксигексадеканоиламино)-бутирила-, тетрадеканоила-, 11-карбоксиундеканоила-, 11-бензилоксикарбонилундеканоила-, (S)-4-карбокси-4-((S)-4-карбокси-4-тетрадеканоиламинобутириламино)-бутирила-, 6-[гидрокси-(нафталин-2-илокси)-фосфорилокси]-гексаноила-, 6-[гидрокси-(5-фенилпентилокси)-фосфорилокси]-гексаноила-, 4-(нафталин-2-сульфониламино)-4-оксобутирила-, 4-(бифенил-4-сульфониламино)-4-оксобутирила-, (S)-4-карбокси-4-{(S)-4-карбокси-4-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетиламино]-бутириламино}-бутирила-, (S)-4-карбокси-4-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбокси-гептадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетиламино]-бутирила-, (S)-4-карбокси-2-{(S)-4-карбокси-2-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбокси-гептадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетиламино]-бутириламино}-бутирила-, (S)-4-карбокси-2-[2-(2-{2-[2-(2-{2-[(s)-4-карбокси-4-(17-карбокси-гептадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетиламино]-бутирила-, (S)-4-карбокси-4-{(S)-4-карбокси-4-[2-(2-{2-[(S)-4-карбокси-4-(17-карбокси-гептадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-бутириламино}-бутирила-, (S)-4-карбокси-4-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-бутирила-, (S)-4-карбокси-2-{(S)-4-карбокси-2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-бутириламино}-бутирила-, (S)-4-карбокси-2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-бутирила-, 2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетила-, 2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)-бутириламино]-этокси}-этокси)-ацетил, (S)-4-карбокси-4-((S)-4-карбокси-4-{(S)-4-карбокси-4-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)-бутириламино]-бутириламино}-бутириламино)-бутирила, 2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(16-1Н-тетразол-5-илгексадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетила-, 2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(16-карбоксигексадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетила-, (S)-4-карбокси-4-{(S)-4-карбокси-4-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)-бутириламино]-бутириламино}-бутирила-, (S)-4-карбокси-4-((S)-4-карбокси-4-{2-[2-(2-{2-[2-(2-{(S)-4-карбокси-4-[10-(4-карбоксифенокси)-деканоиламино]-бутириламино}-этокси)-этокси]-ацетиламино}-этокси)-этокси]-ацетиламино}-бутирила-, (S)-4-карбокси-4-{(S)-4-карбокси-4-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(7-карбоксигептаноиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетиламино]-бутириламино}-бутирила-, (s)-4-карбокси-4-{(S)-4-карбокси-4-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(11-карбоксиундеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетиламино]-бутириламино}-бутирила-, (s)-4-карбокси-4-{(S)-4-карбокси-4-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(13-карбокситридеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетиламино]-бутириламино}-бутирила-, (S)-4-карбокси-4-{(S)-4-карбокси-4-[2-(2-{2-[2-(2-{2-[(s)-4-карбокси-4-(15-карбоксипентадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетиламино]-бутириламино}-бутирила- и (S)-4-карбокси-4-{(S)-4-карбокси-4-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)-бутириламино]-этокси}-этокси)-ацетиламино]-этокси}-этокси)-ацетиламино]-бутириламино}-бутирила-.
Еще более предпочтительными являются стереоизомеры, в частности, энантиомеры этих групп, либо S-, либо R-энантиомеры. Термин «R» в таблице 3 предназначен для обозначения участка присоединения -C(O)-R5 на пептидном остове, т.е., в частности, ε-аминогруппы Lys.