Разделение биспецифических антител и побочных продуктов процесса получения биспецифических антител с применением гидроксиапатитной хроматографии
Иллюстрации
Показать всеДанное изобретение относится к способам, включающим применение гидроксиапатитной хроматографии для выделения биспецифического антитела из раствора, который также содержит один или более чем один побочный продукт, характерный для производства биспецифических антител. Побочные продукты, характерные для производства биспецифических антител (bispecific antibody specific byproducts - BASB), включают фрагменты биспецифического антитела и варианты антитела с большей молекулярной массой, где указанный фрагмент и/или вариант содержит Fc-домен, но не проявляет аффинности к двум различным эпитопам и/или антигенам, к которым проявляет аффинность нужное биспецифическое антитело. Таким образом, способы согласно данному изобретению включают отделение биспецифического антитела от одного или более чем одного из его BASB. Гидроксиапатитные хроматографические способы согласно данному изобретению могут быть использованы по отдельности или также могут быть объединены со стандартными процессами очистки и технологическими операциями, известными в данной области, для достижения какого-либо уровня чистоты биспецифического антитела, необходимого, например, для терапевтических и/или диагностических применений. 11 з.п. ф-лы, 19 ил., 6 пр.
Реферат
Область изобретения
Данное изобретение относится к способам, включающим применение гидроксиапатитной хроматографии для выделения биспецифического антитела из раствора, который также содержит один или более чем один побочный продукт, характерный для получения биспецифического антитела. Побочные продукты, характерные для получения биспецифических антител (bispecific antibody specific byproducts, "BASB"), включают фрагменты биспецифического антитела и варианты антитела с большей молекулярной массой, где фрагмент и/или вариант содержит Fc-домен, но не проявляет аффинность к двум различным эпитопам и/или антигенам, которую проявляет нужное биспецифическое антитело. Таким образом, способы согласно данному изобретению включают отделение биспецифического антитела от одного или более чем одного из его BASB. Способы гидроксиапатитной хроматографии согласно данному изобретению могут быть использованы по отдельности или могут быть дополнительно объединены со стандартными способами очистки и технологическими операциями, которые известны в данной области, для достижения какого-либо уровня чистоты биспецифического антитела, необходимого, например, для терапевтических и/или диагностических применений.
Уровень техники
Терапевтический потенциал биспецифических антител уже давно является признанным. Биспецифические антитела предлагают IgG-подобную платформу, которая способна связываться с двумя антигенами или двумя эпитопами одновременно. Таким образом, биспецифические антитела предлагают потенциальный инструмент для модуляции взаимодействия по меньшей мере двух молекул и/или взаимодействия по меньшей мере двух систем, содержащих молекулы. Такая модуляция может представлять собой, например, модуляцию взаимодействия двух клеток, где распознаваемый антиген, антигены и/или эпитопы экспрессируются на поверхности клеток. Примеры терапевтического применения биспецифических антител включают, например, модуляцию клеточного сигналинга (например, путем усиления или нарушения взаимодействия нужных поверхностных рецепторов или лигандов) и терапию рака (например, помощь в нацеливании клеток иммунной системы на раковые клетки).
Несмотря на интерес к терапевтическому применению биспецифических антител их коммерческое производство оказалось проблематичным. Первые попытки были сосредоточены на слиянии двух гибридомных клеточных линий, каждая из которых экспрессирует моноспецифические двухвалентные антитела ("квадромная методика", см., например, Milstein and Cuello, Nature 305 (1983), 537-540). Хотя квадрома экспрессирует молекулы антитела, сразу стало очевидным, что экспрессированные молекулы содержали различные комбинации двух родительских тяжелых и двух родительских легких цепей. Одновременная экспрессия всех четырех родительских цепей приводит к смеси 10 различных вариантов почти идентичных молекул, где только один вариант из десяти (т.е. только незначительная часть всех экспрессированных молекул) содержал должным образом спаренные тяжелые и легкие цепи, необходимые для проявления нужной биспецифической активности (см., например, Suresh et al., Methods Enzymol. 121 (1986), 210-228). Соответственно, внимание было обращено на альтернативные конструкции на основе биспецифических антител в попытке устранить проблемы производства, например, одноцепочечные гибриды вариабельных доменов антител. Тем не менее, многие из этих форматов существенно отличаются от архетипической структуры антител, и было обнаружено, что они обладают терапевтическими недостатками, такими как плохие фармакокинетические свойства и/или потеря эффекторной активности (например, из-за отсутствия Fc-доменов). Кроме того, многие конструкции также демонстрировали тенденцию к агрегации и повышенный потенциал иммуногенности из-за наличия нечеловеческих или искусственных доменов, таких как линкерные области.
Ввиду ограниченности альтернативных биспецифических форматов и несмотря на производственные трудности сохраняется интерес к биспецифическим антителам, имеющим архетипическую архитектуру антитела (в частности, IgG-подобную архитектуру). Принципиально при производстве нужного биспецифического антитела, имеющего IgG-подобную архитектуру, возникают две проблемы. Поскольку такая молекула требует надлежащей ассоциации двух различных тяжелых цепей и двух различных легких цепей, необходимо (1) индуцировать гетеродимеризацию двух различных тяжелых цепей в качестве предпочтительной реакции над гомодимеризацией и (2) оптимизировать дискриминацию среди возможных комбинаций взаимодействий между легкой цепью и тяжелой цепью так, чтобы экспрессированная молекула содержала только нужные взаимодействия легкой цепи и тяжелой цепи. Эти два вопроса были эффективно решены.
Во-первых, было показано, что гетеродимеризация двух различных тяжелых цепей усиливается по сравнению с гомодимеризационными взаимодействиями с помощью методики "ключ в замке", или "KiH" ("knobs into holes"). В методике KiH в СН3-домен одной из тяжелых цепей вводятся большие аминокислотные боковые цепи, которые укладываются надлежащим образом в спроектированные полости в СН3-домене другой тяжелой цепи (см., например, Ridgeway et al., Protein Eng. 9 (1996), 617-621, и Atwell et al., J. Mol. Biol. 270 (1997), 677-681). Таким образом, гетеродимеры тяжелых цепей, как правило, более стабильны, чем любой из гомодимеров, и образуют большую долю экспрессируемых полипептидов.
Во-вторых, ассоциация нужных пар легкой цепи/тяжелой цепи может быть индуцирована изменением одного Fab биспецифического антитела (Fab-области) для "перемены мест" константных или константных и вариабельных областей между легкой и тяжелой цепями. Таким образом, в модифицированном Fab-домене тяжелая цепь будет содержать, например, домены CL-VH или CL-VL, а легкая цепь будет содержать домены CH1-VL или CH1-VH, соответственно. Это предотвращает взаимодействие тяжелой/легкой Fab-частей модифицированных цепей (т.е. модифицированной легкой или тяжелой цепи) с Fab-частями и тяжелой/легкой цепи стандартной/немодифицированной ветви. Для пояснения, тяжелая цепь в Fab-домене модифицированной ветви, содержащая домен CL, преимущественно не взаимодействует с легкой цепью немодифицированной ветви/Fab-домена, который также содержит CL-домен (предотвращая "неподходящее" или ненужное спаривание тяжелой/легкой цепей). Эта методика предотвращения ассоциации "неподходящих" легкой/тяжелой цепей называется методикой "CrossMab" и, в сочетании с методикой KiH, приводит к удивительно повышенной экспрессии нужных биспецифических молекул (см., например, Schaefer et al., PNAS 108(2011), 11187-11192). Альтернативно или дополнительно, одна ветвь антитела может быть модифицирована таким образом, что Fab-домен представляет собой scFab или scFv, оставляя только одну "свободную" легкую цепь в системе.
Несмотря на недавние успехи в экспрессии биспецифических антител применение молекул остается ограниченным из-за формирования побочных продуктов, характерным образом связанных с их производством (побочные продукты, характерные для производства биспецифических антител, "BASB"), и проблем, связанных с отделением BASB от нужных молекул. По сравнению с очисткой стандартных антител экономная очистка биспецифических антител от производственных сред представляет собой уникальную задачу. Производство стандартного антитела основано на димеризации идентичных субъединиц "тяжелая цепь/легкая цепь". Напротив, производство биспецифического антитела требует димеризации двух различных субъединиц "тяжелая цепь/легкая цепь", каждая из которых содержит отличающуюся тяжелую цепь, а также отличающуюся легкую цепь. Таким образом, производство биспецифического антитела требует надлежащего взаимодействия вплоть до четырех пептидных цепей. Соответственно, часто наблюдаются цепные неправильные спаривания (например, гомодимеризация пептидов идентичных тяжелых цепей или ненадлежащие ассоциации тяжелой цепи/легкой цепи), как и неполная сборка белка из-за несбалансированной экспрессии различных цепей антитела. Обычно наблюдаемые BASB включают антител (содержащие одну пару тяжелой цепи/легкой цепи) и антител (содержащие полное антитело без одной легкой цепи). Дополнительные BASB могут наблюдаться в зависимости от используемого биспецифического формата. Например, когда один вариабельный домен биспецифического антитела сконструирован в виде одноцепочечного Fab (scFab), то может наблюдаться побочный продукт "5/4 антитела" (содержащий дополнительный вариабельный домен тяжелой или легкой цепи). Такие соответствующие побочные продукты, как правило, не видны при производстве стандартного антитела.
Кроме того, BASB могут демонстрировать конкретную невыгодную активность, которую они сохраняют в конечном очищенном продукте. Что касается стандартных антител, т.е. моноспецифических антител, можно видеть, что описанные выше побочные продукты содержат по меньшей мере один функциональный антигенсвязывающий сайт. Таким образом, такой побочный продукт в препарате моноспецифического антитела, вероятно, будет частично, если не полностью, терапевтически функциональным и, таким образом, он вызывает мало беспокойства при любой схеме очистки. Напротив, BASB представляют собой примеси, которые, в зависимости от биспецифического формата, могут отрицательно сказаться на активности нужного биспецифического препарата. Таким образом, их отделение от нужной молекулы в процессе очистки становится критическим. Например, функциональность биспецифической молекулы может зависеть от одной молекулы, проявляющей связывающую активность по отношению к двум различным антигенам. Если молекула проявляет связывающую активность по отношению только к одному целевому антигену (например, как в или антител, описанных выше), то ее связывание с этим целевым антигеном будет блокировать связывание полнофункционального биспецифического антитела, являясь потенциальным антагонистом нужной активности биспецифической молекулы. Наконец, моноспецифические побочные продукты производства биспецифического антитела, по-видимому, снижают эффективность конечного биспецифического препарата, если они не отделены. Кроме того, многие из описанных в данном документе BASB, которые имеют экспонированные области, обычно способствующие взаимодействию "пептид-пептид", проявляют тенденцию к иммуногенности и агрегации.
К сожалению, большинство коммерческих схем производства и очистки антител непригодны или не способны отделить биспецифические антитела от вышеописанных специфических побочных продуктов. Стандартные схемы очистки антител, как правило, включают по меньшей мере два различных режима хроматографии, т.е., как правило, используют по меньшей мере два хроматографических механизма для отделения нужного иммуноглобулина(ов) от побочных продуктов/примесей. Первый режим, как правило, является хроматографией на основе аффинности, которая использует специфическое взаимодействие между белком, который нужно очистить (т.е. белком, представляющим интерес), и иммобилизованным реагентом захвата. Поскольку аффинные реагенты могут представлять собой самую дорогую часть схемы очистки, желательно снизить применение аффинных лигандов и/или максимизировать применимость конкретной схемы (и аффинного реагента) к целому ряду продуктов. Наиболее часто используемыми аффинными лигандами при очистке иммуноглобулина (и применимыми к широкому диапазону продуктов на основе иммуноглобулинов) являются Fc-связывающие агенты или агенты, связывающие константный домен, такие как белок А, белок G, белок L, KappaSelect™ и LambdaFabSelect™. Тем не менее, разделяющая активность этих агентов, связывающих Fc- или константный домен, основана на присутствии Fc-, κ-, и/или λ-доменов, которые, что немаловажно, являются общими как для биспецифических антител, так и для их характерных побочных продуктов (т.е. BASB). Соответственно, лиганды с аффинностью к Fc- или константному домену сами по себе не являются достаточными для очистки биспецифических антител от BASB, и проведение дополнительных очисток на основе аффинности и/или молекулоспецифической (т.е. антигенспецифической) очистки, вероятно, приведет к экономически невыгодным схемам.
Кроме того, на основании знаний в области данного изобретения также трудно поверить, что добавление других общих процессов очистки, используемых в коммерческих схемах обработки антитела, будет достаточным для удовлетворительного отделения биспецифических антител от BASB. Наиболее распространенными способами очистки, используемыми в сочетании с аффинной хроматографией для коммерческой очистки антитела, являются стандартные способы хроматографии, которые отделяют белок, представляющий интерес, от нежелательных побочных продуктов/примесей на основании различий в размерах, заряде (например, значении изоэлектрической точки, или "IEP"), растворимости и/или степени гидрофобности. Такие способы включают ионообменную хроматографию, эксклюзионную хроматографию, аффинную хроматографию на иммобилизованном металле и гидроксиапатитную хроматографию. Тем не менее, эти распространенные хроматографические процессы, использующие стандартные протоколы, непригодны для отделения биспецифического антитела от BASB: эксклюзионная хроматография является экономически нецелесообразной для крупномасштабных очисток, а различия в IEP между биспецифическим антителом и BASB считались слишком малыми для их разделения с помощью ионообменной хроматографии.
Поэтому известные способы выделения антител из растворов, содержащих побочные продукты, характерные для их производства (например, Fc-содержащие фрагменты антител), являются неэффективными для очистки биспецифических антител и/или могут быть нежелательными по экономическим причинам (например, применение дополнительных этапов аффинной хроматографии). Соответственно, существует потребность в новых и/или усовершенствованных схемах очистки биспецифических антител от производственных растворов (и, в частности, от BASB, содержащихся в них), где указанные схемы могут отвечать требованиям биотехнологической промышленности по производству диагностических и терапевтических продуктов (например, демонстрировать экономическую эффективность, пропускную способность и чистоту продукта).
Сущность изобретения
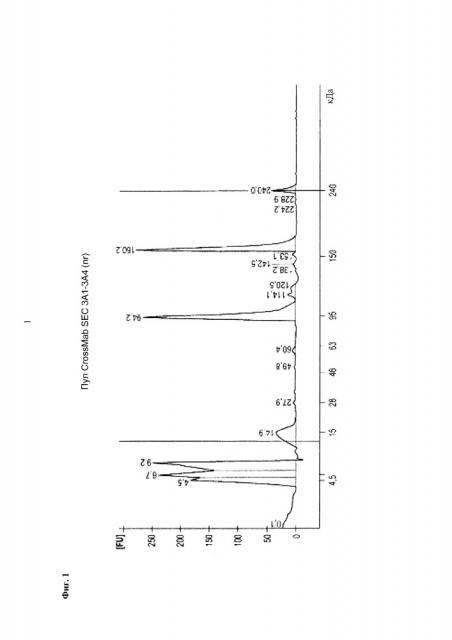
Данное изобретение относится к способам, использующим гидроксиапатитную хроматографию для выделения биспецифического антитела из раствора, содержащего биспецифическое антитело и один или более чем один побочный продукт, характерный для производства (например, рекомбинантного производства) биспецифического антитела. Побочные продукты, характерные для производства (например, рекомбинантного производства) биспецифических антител (также упоминаемые в данном документе как побочные продукты, характерные для биспецифических антител, "BASB"), являются полипептидными вариантами биспецифического антитела с большей или меньшей молекулярной массой, которые теряют нужную биспецифическую активность. Например, BASB могут проявлять специфичность в отношении только одного из двух эпитопов или антигенов, распознаваемых биспецифическим антителом, и/или могут обладать существенно сниженной аффинностью для одного или обоих эпитопов или антигенов, распознаваемых биспецифическим антителом. Типичные BASB включают (i) фрагменты биспецифического антитела (т.е. пептидные или полипептидные варианты с меньшей молекулярной массой), которые включают, но не ограничиваясь ими, антител (имеющие одну пару тяжелой цепи/легкой цепи) и антител (имеющие гетеро- или гомодимер тяжелых цепей антитела и одну легкую цепь антитела); и (ii) полипептидные варианты с большей молекулярной массой, которые включают, но не ограничиваясь ими, 5/4 антител (имеющие гетеродимер тяжелых цепей антитела (одна из которых содержит фрагмент антитела scFab или scFv) и две легких цепи антитела) (см., например, фиг. 1). В частности, способы согласно данному изобретению направлены на отделение биспецифического антитела, содержащего Fc-домен, от одного или более чем одного BASB, где один или более чем один BASB также содержит Fc-домен.
Авторы данного изобретения неожиданно обнаружили, что гидроксиапатитные хроматографические способы, описанные в данном документе, могут отделить нужное биспецифическое антитело, содержащее Fc-домен, от одного или более чем одного BASB, также содержащего Fc-домен, в потоке сырьевого продукта. Следовательно, способы данного изобретения могут быть особенно полезны в сочетании со стандартными схемами очистки антител, которые в противном случае содержат технологические операции, недостаточные для отделения биспецифического антитела от BASB. Способы, описанные в данном документе, также могут быть особенно полезны в сочетании со стандартными процессами очистки антител для доведения конечного потока продукта (содержащего биспецифическое антитело) до конечной композиции и/или чистоты.
Изобретение относится к способу выделения биспецифического антитела, содержащего Fc-домен, из раствора, содержащего указанное биспецифическое антитело, причем этот способ включает (а) контактирование раствора с гидроксиапатитной хроматографической средой, (b) адсорбцию биспецифического антитела на гидроксиапатитной хроматографической среде и (с) элюирование биспецифического антитела из гидроксиапатитной среды в присутствии хлорид-ионов, где раствор, содержащий биспецифическое антитело, также включает или содержит (i) один или более чем один фрагмент биспецифического антитела (где указанный фрагмент также содержит Fc-домен) и/или (ii) один или более чем один полипептид, имеющий молекулярную массу, большую, чем молекулярная масса биспецифического антитела, и содержащий по меньшей мере одну из двух тяжелых цепей указанного биспецифического антитела (где один или более чем один указанный полипептид также содержит Fc-домен). Как таковое, изобретение также охватывает применение гидроксиапатитной хроматографической среды для выделения биспецифического антитела, включающего Fc-домен, из раствора, содержащего биспецифическое антитело, где указанное применение включает (а) контактирование гидроксиапатитной хроматографической среды с указанным раствором, (b) адсорбцию биспецифического антитела на гидроксиапатитной хроматографической среде и (с) элюирование биспецифического антитела из гидроксиапатитной среды в присутствии хлорид-ионов, где раствор, содержащий биспецифическое антитело, также включает (i) один или более чем один фрагмент биспецифического антитела (где указанный фрагмент также содержит Fc-домен) и/или (ii) один или более чем один полипептид, имеющий молекулярную массу, превышающую молекулярную массу указанного биспецифического антитела, и содержащий по меньшей мере одну из двух тяжелых цепей указанного биспецифического антитела (где один или более чем один указанный полипептид также содержит Fc-домен).
Раствор, содержащий биспецифическое антитело и один или более чем один BASB, контактирует с гидроксиапатитной хроматографической средой в условиях, позволяющих связывание биспецифического антитела и/или биспецифического антитела и одного или более чем одного BASB с хроматографической средой. Предпочтительно, условия, подходящие для связывания биспецифического антитела и одного или более чем одного BASB, представляют собой условия, в которых раствор имеет низкое значение проводимости. Растворы с низкими значениями проводимости, подходящие для раскрытых в данном документе способов, как правило, имеют значения примерно или не более чем примерно 13 мСм/см. Растворы с низкими значениями проводимости, подходящие для раскрытых в данном документе способов, могут также иметь значения проводимости примерно или не более чем примерно 10,6 мСм/см, или примерно или не более чем примерно 8,5 мСм/см. Неограничивающие примеры растворов с низкими значениями проводимости включают буферные растворы с рН примерно от 6,5 до 8,0, содержащие концентрацию фосфат-ионов в диапазоне от примерно 1 мМ до примерно 20 мМ, предпочтительно примерно 10 мМ; концентрацию ионов кальция в диапазоне от примерно 0,001 мМ до примерно 0,5 мМ, предпочтительно примерно 0,1 мМ; и концентрацию хлорид-ионов в диапазоне от примерно 10 мМ до примерно 200 мМ, предпочтительно примерно 50 мМ. Раствор с низким значением проводимости для применения в способах согласно данному изобретению может иметь значение рН примерно от 6,5 до 7,5, концентрацию фосфат-ионов по меньшей мере 10 мМ, концентрацию ионов кальция по меньшей мере 0,1 мМ и концентрацию хлорид-ионов от примерно 50 мМ до примерно 500 мМ. Альтернативно или дополнительно, раствор с низким значением проводимости для применения в способах согласно данному изобретению, могут иметь значение рН от примерно 6,5 до 7,5, концентрацию ионов фосфата примерно 10 мМ, концентрацию ионов кальция примерно 0,1 мМ и концентрацию хлорид-ионов от примерно 50 мМ до примерно 500 мМ. Фосфат-ионы в растворе могут быть обеспечены с помощью любой подходящей фосфатной соли из известных в данной области и/или описанных в данном документе или с помощью их комбинации. Неограничивающие примеры фосфатных солей, пригодных для применения в растворе в соответствии со способами данного изобретения, включают NaH2PO4, Na2HPO4, KН2РO4 и K2НРO4. Ионы кальция в растворе могут быть обеспечены с помощью любой подходящей кальциевой соли из известных в данной области и/или описанных в данном документе или с помощью их комбинации. Неограничивающие примеры солей кальция, пригодных для применения в растворе в соответствии со способами данного изобретения, включают CaCl2. Хлорид-ионы в растворе могут быть обеспечены с помощью любой подходящей хлоридной соли из известных в данной области и/или описанных в данном документе, включая соли, используемые для обеспечения ионов кальция, или с помощью их комбинации, при условии, что концентрации ионов кальция поддерживаются в диапазонах, указанных в данном описании. Неограничивающие примеры хлоридных солей, пригодных для применения в растворе в соответствии со способами данного изобретения, включают NaCl и KCl. Иллюстративные комбинации солей, обеспечивающих хлорид-ионы, для применения в этих воплощениях включают NaCl, СаСl2 и KCl. В предпочтительных воплощениях раствор, содержащий биспецифическое антитело и один или более чем один BASB, в условиях, подходящих для их первоначального связывания с гидроксиапатитной хроматографической средой, представляет собой раствор, содержащий (в дополнение к биспецифическому антителу и одному или более чем одному BASB) примерно 10 мМ NaH2PO4, примерно 50 мМ NaCl, 20 мМ MES и примерно 0,1 мМ CaCl2 при рН примерно от 6,5 до 7,5. Как известно в данной области, связывающий буфер в одиночку (без биспецифического антитела и одного или более чем одного BASB), включая воплощения, конкретно перечисленные в этом параграфе, может быть использован в качестве уравновешивающего буфера для гидроксиапатитной хроматографической среды и/или в качестве промывочного буфера на одном или более чем одном этапе хроматографического процесса.
Элюирование биспецифического антитела достигается исключительно путем увеличения концентрации хлорид-ионов. Элюирование осуществляют с помощью элюирующего буфера, имеющего низкую исходную проводимость, где концентрация хлорид-ионов впоследствии неуклонно возрастает. Условия выбора связывающего раствора с низкой проводимостью, описанные непосредственно выше (т.е. раствора, содержащего биспецифическое антитело и один или более чем один BASB, в условиях, позволяющих их связывание с гидроксиапатитной хроматографической средой), в равной степени относятся к выбору исходного состава элюирующего буфера согласно данному изобретению (т.е. также имеющего низкую исходную проводимость). Соответственно, исходный состав элюирующего буфера может быть таким же или может отличаться от состава связывающего раствора/связывающего буфера, описанного непосредственно выше или в другой части данного документа. В некоторых воплощениях исходный состав элюирующего буфера является таким же, как состав связывающего раствора/связывающего буфера. В других воплощениях исходный состав элюирующего буфера отличается от состава связывающего раствора/связывающего буфера. Элюирующий буфер предпочтительно содержит как фосфат-, так и хлорид-ионоы. В некоторых воплощениях элюирующий буфер имеет исходный состав примерно 10 мМ NaH2PO4, примерно 50 мМ NaCl, примерно 20 мМ MES и примерно 0,1 мМ CaCl2 при рН от примерно 6,5 до 7,5.
Данное изобретение относится к способам, включающим повышение концентрации хлорид-ионов в элюирующем буфере, чтобы элюировать биспецифическое антитело из хроматографической среды. Концентрация хлорид-ионов может увеличиваться в соответствии с линейным градиентом, выполненным ступенчатым градиентом (см., например, реализованный ступенчатый градиент увеличения хлорид-ионов, представленный на фиг. 6) или в соответствии с комбинацией этих двух градиентов. Оптимизация градиента для элюирования биспецифического антитела из хроматографической среды и/или для отделения биспецифического антитела от BASB (т.е. чтобы элюировать один, а другой оставить связанным со средой) находится в пределах возможностей специалиста в данной области благодаря знаниям, содержащимся в данном документе. Концентрация хлорид-ионов может быть увеличена в элюирующем буфере путем увеличения концентрации одной или более чем одной хлоридной соли. Неограничивающие примеры хлоридных солей, которые могут быть добавлены к элюирующему буферу для повышения концентрации хлорид-ионов, включают NaCl и KCl. Как известно в области хроматографии белка, относительные концентрации ионов кальция и фосфат-ионов нужно контролировать или оценивать, чтобы предотвратить осаждение кальция и фосфата из одного или более чем одного раствора в процессах согласно данному изобретению. В некоторых воплощениях концентрацию хлорид-ионов в элюирующем буфере повышают путем увеличения концентрации NaCl. В предпочтительных воплощениях исходная концентрация хлорид-ионов в элюирующем буфере составляет примерно 50 мМ (что может быть обеспечено одной или более чем одной хлоридной солью) и впоследствии увеличивается в ходе элюирования того биспецифического антитела, которое необходимо элюировать. Специалист в данной области сможет легко определить максимальную концентрацию хлорид-ионов, необходимую для элюирования адсорбированного биспецифического антитела, с помощью стандартных способов, известных в данной области и соответствующих знаниям и способам, описанным в данном документе. В некоторых воплощениях максимальная концентрация хлорид-ионов для элюирования биспецифического антитела и/или отделения биспецифического антитела от одного или более чем одного BASB составляет примерно 200 мМ, 250 мМ, 300 мМ, 350 мМ, 400 мМ или 500 мМ. Иллюстративный элюирующий буфера в соответствии со способами согласно данному изобретению имеет исходный состав примерно 10 мМ NaH2PO4, примерно 50 мМ NaCl, примерно 20 мМ MES и примерно 0,1 мМ CaCl2 при рН примерно от 6,5 до 7,5, где концентрация хлорид-ионов впоследствии повышается путем увеличения концентрации NaCl в соответствии с линейным, ступенчатым или линейно-ступенчатым градиентом до примерно 500 мМ в ходе этапа элюирования.
Элюирование биспецифического антитела предпочтительно достигается во фракции элюата, причем эта фракция содержит биспецифическое антитело, но не содержит по меньшей мере один из BASB, адсорбированых на гидроксиапатитной хроматографической среде. Способы согласно данному изобретению, в частности, позволяют отделить биспецифическое антитело по меньшей мере от одного BASB, где указанный по меньшей мере один BASB представляет собой антитела, антитела или 5/4 антитела. Другими словами, способы согласно изобретению позволяют выделить биспецифическое антитело, содержащее Fc-домен, из раствора, содержащего указанное биспецифическое антитело и один или более чем один BASB, включая (а) контактирование раствора с гидроксиапатитной хроматографической средой, (b) адсорбцию биспецифического антитела на гидроксиапатитной хроматографической среде и (с) элюирование биспецифического антитела из гидроксиапатитной среды в присутствии хлорид-ионов, где фракция элюата из этапа (с), которая содержит биспецифическое антитело, не содержит или не содержит по меньшей мере один из одного или более чем одного BASB, и где указанный один или более чем один BASB представляет собой антитела, антитела или 5/4 антитела. Поскольку производительность гидроксиапатитной хроматографической среды, как известно в данной области, может меняться в зависимости от биологических молекул (например, биспецифических антител и BASB), следует понимать, что термин "отделяет" и аналогичные термины и фразы, используемые в данном описании в отношении разделения и/или очистки биспецифического антитела от одного или более чем одного BASB, не обязательно должны быть интерпретированы как абсолютные выражения. Скорее, используемые в данном документе и в соответствии с пониманием в данной области, эти термины используются с пониманием того, что элюированное биспецифическое антитело может считаться отделенным и/или очищенным, но при этом может содержать некоторую минимальную контаминацию по меньшей мере одним из указанных одного или более чем одного BASB (которые также изначально были адсорбированы на гидроксиапатитной хроматографической среде). Соответственно, используемые в данном документе термины "отделенное", "очищенное", "не содержит" и аналогичные термины и фразы, используемые в отношении растворов биспецифических антител, полученных согласно способам данного изобретения, используются для обозначения того, что общее количество одного или более чем одного BASB в элюате или фракции(ях) элюата, содержащей биспецифическое антитело, составляет не более 10% от общего количества биспецифического антитела. В предпочтительных воплощениях термины "отделяет"/"отделенное", "очищенное", "не содержит" и аналогичные термины и фразы, используемые в отношении растворов биспецифических антител, полученных согласно способам данного изобретения, используются для обозначения того, что общее количество одного или более чем одного BASB в элюате или фракции(ях) элюата, содержащих биспецифическое антитело, составляет не более 5% от общего количества биспецифического антитела. В других воплощениях элюированное биспецифическое антитело содержит менее 4%, менее 3%, менее 2%, менее 1% или не контаминировано по меньшей мере одним из одного или более чем одного BASB. Аналогично, фразу "не содержит" и аналогичные фразы в отношении одного или более чем одного BASB и элюата и/или фракции (фракций) элюата не следует понимать как абсолютные выражения. Скорее, как известно в данной области, фразы показывают, что фракция (фракции) элюата по существу не содержит (не содержат) характерный один или более чем один BASB, т.е. может содержать минимальное количество BASB. Соответственно, используемый в данном документе элюат или фракция(и) элюата, содержащая биспецифическое антитело и не содержащая один или более чем один BASB, может содержать некоторое количество одного или более чем одного BASB, которое не превышает 5% от общего количества биспецифического антитела. Используемый в данном параграфе и на протяжении всего описания относительный процент общего количества одного или более чем одного BASB по сравнению с общим количеством биспецифического антитела в одной или более чем одной фракции, содержащей биспецифическое антитело, может быть определен с помощью любого способа, известного в данной области или описанного в данном документе. В неограничивающих примерах он может быть рассчитан на основе сравнения количеств, определенных или оцененных в SDS-PAGE-анализе, MS-анализе или в анализе связывания на основании протоколов BIAcore, Octet или ELISA.
Способы согласно данному изобретению применимы к любому формату биспецифического антитела, известному в данной области и/или описанному в данном документе. Соответственно, биспецифическое антитело может содержать пептидные цепи антитела (например, тяжелую цепь и/или легкую цепь) или его антигенсвязывающие фрагменты из любого подходящего источника антитела, включая, но не ограничиваясь ими, антитела, полученные из животных источников (например, антитела мыши, крысы, хомяка, морской свинки, кролика, козы, овцы, собаки, лошади, коровы, обезьяны, примата и/или курицы), а также химерные, человеческие и гуманизированные антитела; может содержать пептидные цепи (например, тяжелую цепь и/или легкую цепь), имеющие константные домены (например, домен CL, СН1, СН2 и СН3) из антитела из любого подходящего источника, включая, но не ограничиваясь ими, подходящие животные источники, определенные в данном документе, и человеческие антитела; может содержать пептидные цепи (например, тяжелую цепь и/или легкую цепь), имеющие один или более чем один константный домен (например, один или более чем один из доменов CL, СН1, СН2 и СН3) из антитела из любого подходящего источника, рекомбинантно гибридного или химически конъюгированного с фрагментом антитела, который сохраняет свою антигенсвязывающую функцию, включая, но не ограничиваясь ими, scFv, scFab, Fd, dAb, одиночный вариабельный домен тяжелой цепи и одиночный вариабельный домен легкой цепи; и/или может содержать пептидные цепи (например, тяжелую и/или легкую цепь), имеющие человеческие или гуманизированные каркасные домены. В некоторых воплощениях биспецифическое антитело, содержащее Fc-домен согласно изобретению, представляет собой биспецифическое антитело типа "ключ в замке" ("KiH") (т.е. содержит две тяжелые цепи, разработанные в соответствии со способами KiH, известными в данной области, и/или как описано в данном документе). Методика KiH может быть объединена (или может не быть объединена) с другими методиками разработки биспецифического антитела. Неограничивающие примеры таких других методик разработки биспецифического антитела включают методики, применяемые к одному или более чем одному из вариабельных доменов биспецифического антитела, такие как методики CrossMab и/или слияние антигенсвязывающего фрагмента (например, scFab) с одним или более чем одним константным доменом тяжелой цепи. Изобретение также охватывает применение CrossMab и методик слияния тяжелой цепи антигенсвязывающего фрагмента (например, scFab), независимых от методик KiH. Соответственно, биспецифическое антитело согласно изобретению может включать применение только одной методики, выбранной среди методики KiH, методики CrossMab и методики слияния тяжелой цепи антигенсвязывающего фрагмента, или оно может включать применение более чем одной из этих методик. Для удобства используемые в данном описании антитела, разработанные в соответствии с методиками KiH, CrossMab и методикой слияния тяжелой цепи антигенсвязывающего фрагмента, указываются как "биспецифические KiH-антитела", "биспецифические CrossMab-антитела" и/или "гибридные антитела тяжелой цепи антигенсвязывающего фрагмента", соответственно. В некоторых воплощениях данного изобретения биспецифическое антитело является гибридным антителом тяжелой цепи антигенсвязывающего фрагмента, где одна тяжелая цепь биспецифического антитела содержит scFab, который рекомбинантно слит или химически конъюгирован с шарнирной СН2-СН3-областью тяжелой цепи антитела (т.е. "биспецифическое антитело scFab"). В некоторых воплощениях биспецифическое антитело в соответствии со способами согласно изобретению представляет собой биспецифическое KiH-антитело, биспецифическое CrossMab-антитело, биспецифическое scFab-антитело, биспецифическое KiH-CrossMab-антитело или биспецифическое KiH-scFab-антитело. В некоторых воплощениях биспецифическое антитело в соответствии со способами согл