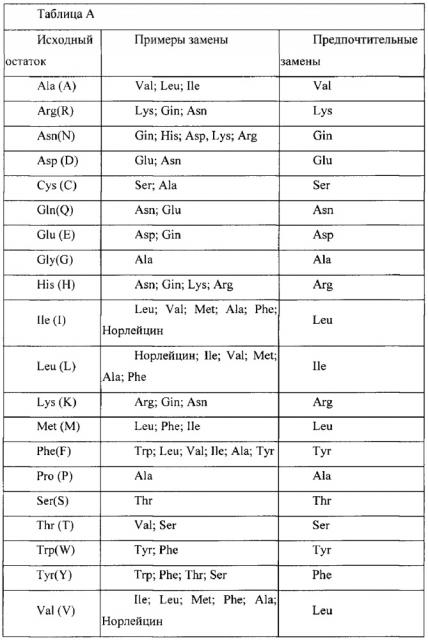
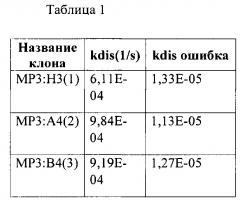
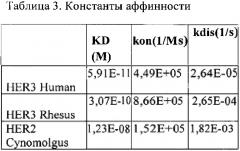
Биспецифичные анти-her2/анти-her3 антитела
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описано биспецифическое антитело, которое специфично связывается с HER2 человека или яванского макака и HER3, включающее: вариабельный домен тяжелой цепи VHH, который специфично связывается с HER3, где вариабельный домен тяжелой цепи VHH содержит аминокислотные последовательности, по меньшей мере на 75% гомологичные последовательностям SEQ ID NO: 1-3, и антитело или его антигенсвязывающий домен, которые специфично связываются с HER2 человека или яванского макака. Изобретение также относится к ДНК, кодирующей указанное антитело, соответствующему экспрессионному вектору и способу продукции, а также к способу лечения с использованием указанного биспецифичного антитела. 11 н. и 20 з.п. ф-лы, 36 ил., 7 табл., 27 пр.
Реферат
Область техники
Настоящее изобретение относится к области биотехнологии, а именно к антителам и применению данных антител. Более конкретно, настоящее изобретение относится к биспецифичным антителам, которые специфически связываются с HER2 и HER3. Изобретение также относится к нуклеиновой кислоте, кодирующей данное антитело, вектору экспрессии, способу получения антитела и применению антитела для лечения заболеваний или нарушений, связанных с HER2 и HER3.
Уровень техники
Группа рецепторов эпидермального фактора роста (human epidermal factor receptor, HER), также именуемая ErbB-рецепторами, относится к семейству трансмембранных рецепторных тирозинкиназ. Это семейство включает в себя рецептор эпидермального фактора роста (epidermal growth factor receptor, EGFR), также называемый ErbB-1 (или HER1), и гомологичные рецепторы ErbB-2 (HER2), ErbB-3 (HER3) и ErbB-4 (HER4). Эти рецепторы в большом количестве экспрессируются на поверхности эпителиальных клеток (обзор представлен в публикации Yarden and Pines 2012). Повышение уровня экспрессии HER рецепторов или их лигандов, таких как херегулин (HRG) или фактор эпидермального роста (EGF), часто наблюдается у пациентов с онкологическими заболеваниями (Wilson, Fridlyand et al. 2012).
Связывание лиганда с внеклеточным доменом тирозинкиназ вызывает процесс димеризации рецепторов, который может проходить как между двумя идентичными рецепторами (гомодимеризация), так и между разными рецепторами внутри одного семейства (гетеродимеризация). Димеризация активирует внутриклеточные домены тирозинкиназ и вызывает их аутофосфорилирование. Это, в свою очередь, запускает ряд нисходящих пролиферативных сигнальных каскадов, в том числе опосредованных митоген-активируемыми протеинкиназами, а также сигнальный путь AKT, направленный на выживание клетки (описано в работе Yarden and Pines, 2012). Для ErbB-2 не удалось обнаружить специфичных эндогенных лигандов, и предполагается, что в норме активация этого рецептора происходит путем гетеродимеризации (Sergina, Rausch et al. 2007), тогда как активация рецептора ErbB-3 может происходить с участием лигандов. К таким лигандам относятся, среди прочих, нейрегулин (NRG) или херегулин (HRG).
Нарушение регуляции ErbB-рецепторов приводит к образованию и росту опухолей (Yarden, Sliwkowski et al. 2001). Известным примером служит амплификация и гиперэкспрессия рецептора ErbB2, которая наблюдается в 20-30% случаев рака молочной железы и рака желудка. Несмотря на отсутствие высокоаффинных лигандов, ErbB2-рецепторы успешно участвуют в реализации сигнальных путей, направленных на выживание клеток. Это происходит посредством образования гетеродимеров с другими рецепторами ErbB-семейства, например, с ErbB-3-рецептором.
Лекарственные препараты, направленно действующие на ErbB2-рецепторы (Baselga, Swain et al. 2009), позволили значительно улучшить результаты лечения у многих пациентов с опухолями, характеризующимися повышенной экспрессией ErbB2. Однако у значительной части пациентов такое лечение оказывается неэффективным, а у тех, кто изначально отвечал на терапию, со временем развивается резистентность (Nahta, Yu et al. 2006). Активация ErbB3-рецептора его лигандом может обуславливать резистентность к ErbB-направленной терапии (Huang, Gao et al. 2010; Sergina, Rausch et al. 2007; Gijsen, King et al. 2011). Экспрессия ErbB3-рецептора повышается в опухолевых клетках, устойчивых к трастузумабу (huMAb4D5-8, rhuMAb HER2, HERCEPTIN®; патент США №5821337, Narayan, Wilken et al. 2009), и ассоциируется с неблагоприятным прогнозом у пациентов с раком молочной железы (Sassen, Rochon et al. 2008; Witton, Reeves et al. 2003). Несмотря на отсутствие активного киназного домена, ErbB3 образует гетеродимеры с другими представителями семейства ErbB рецепторов, что приводит к фосфорилированию фосфоинозитид-3-киназы (PI3K) и активации мощных внутриклеточных сигнальных каскадов. Рецептор ErbB3 является предпочтительным партнером для ErbB2 при димеризации (Graus-Porta, Beerli et al. 1997; Tzahar, Waterman et al. 1996). Было показано, что гетеродимер ErbB2/ErbB3 является наиболее мощным активатором каскада AKT по сравнению с другими димерами ErbB-рецепторов, при этом включение онкогенных сигнальных путей строго зависит от наличия ErbB3 (Holbro, Beerli et al. 2003; Lee-Hoeflich, Crocker et al. 2008). Однако, поскольку у ErbB3-рецептора отсутствует активный киназный домен, и в опухолевых клетках не происходит его амплификамии и значительной гиперэкспрессии, основной мишенью для лекарственных препаратов, атакующих данную гетеродимерную единицу, оставался рецептор ErbB2.
В патентном документе WO 2009068625 описано нанотело, специфичное в отношении HER2.
Другие HER2-aнтитeлa с различными свойствами описаны в Tagliabue et al. Int. J. Cancer 47:933-937 (1991); McKenzie et al. Oncogene 4:543-548 (1989); Maier et al. Cancer Res. 51:5361-5369 (1991); Bacus et al. Molecular Carcinogenesis 3:350-362 (1990); Stancovski et al. PNAS (USA) 88:8691-8695 (1991); Bacus et al. Cancer Research 52:2580-2589 (1992); Xu et al. Int. J. Cancer 53:401-408 (1993); WO 94/00136; Kasprzyk et al. Cancer Research 52:2771-2776 (1992); Hancock et al. Cancer Res. 51:4575-4580 (1991); Shawver et. al., Cancer Res. 54:1367-1373 (1994); Arteaga et al. Cancer Res. 54:3758-3765 (1994); Harwerth et al. J. Biol. Chem. 267:15160-15167 (1992); U.S. Patent No. 5,783,186; и Klapper et al. Oncogene 14:2099-2109 (1997); патент США №5783186; и Klapper et al. Oncogene 14: 2099-2109 (1997).
В международной заявке WO 97/35885 описаны HER3-антитела. В международной заявке WO 2003/013602 описаны ингибиторы HER-активности, включая HER-антитела. В международных публикациях WO 2007/077028 и WO 2008/100624 также описаны HER3-антитела.
В настоящее время активно ведутся разработки мультиспецифичных антител, которые специфично связываются с рецепторами семейства HER, с целью уменьшения нежелательных побочных эффектов и токсичности.
В патенте ЕА 022201 В1 описан агент, способный связываться с опухолевой клеткой и убивать опухолевую клетку или ингибировать пролиферацию опухолевых клеток, содержащий линкер на основе человеческого сывороточного альбумина (HSA), который может быть специфичен к HER2/HER3.
В патенте RU 2491294 C2 описано димерное антитело, которое специфично к HER2/HER3.
В патентном документе WO 2011143414 описано изолированное, рекомбинантное антитело, обладающее аффинностью связывания с сигнальной молекулой рецептора ErbB, выбранной из группы, состоящей из по меньшей мере одного из EGFR, ErbB2, ErbB3 и ErbB4. Вышеуказанное антитело может представлять собой моноклональное антитело, поликлональное антитело, одноцепочечное Fv антитело, димерное антитело, тримерное антитело, тетрамерное антитело, биспецифическое антитело, мини-антитело.
В патентном документе WO 2012158818 описано мультиспецифичное антитело, специфичное, в частности, к HER2 и HER3.
В патентных документах WO 2014182970, WO 2015066543, WO 2007084181 описаны биспецифические антитела к HER2/HER3.
В патентных документах WO 2008119353, WO 2015153765 и WO 2015173248 описаны способы получения биспецифического антитела к HER2/HER3.
В патентном документе ЕР 2727943 описаны триспецифические антитела к HER2/HER3/ EGFR.
Важным открытием явилось обнаружение в крови представителей семейства Camelidae (верблюды, ламы, викуньи) в значительном количестве особых неканонических антител с упрощенной структурой (Hamers Casterman С., Atarhouch Т., Muyldermans S., Robinson G., Hamers C, Bajyana Songa E., BendahmanN., Hamers R. 1993. Naturally occurring antibodies devoid of light chains. Nature. 363, 446-448). Такие антитела ("heavy chain antibody", HCAb) состоят из димера только одной укороченной тяжелой цепи (без СН1-домена), а легкая цепь при этом отсутствует. Антигенузнающий участок HCAb формируется лишь одним вариабельным доменом тяжелой цепи (VHH), который непосредственно связан через шарнирную область с Fc-доменом. Часто вместо VHH используют термин "однодоменное антитело", "nanobody" (нанотело), "мини-антитело" или "наноантитело". Как оказалось, такая монодоменная структура в изолированном виде, кроме малых размеров (12-15 кДа), обладает рядом преимуществ перед классическими IgG антителами, а именно - агрегационной, химической и термостабильностью. Антитела VHH можно эффективно клонировать и экспрессировать в бактериях и дрожжах. Обладая такими свойствами, они получили технологическое развитие как в терапевтическом направлении, развиваемом компанией "Ablynx", так и области лабораторной и промышленной хроматографии с линейкой носителей CaptureSelect.
Неканонические антитела (HCAb), состоящие из димера только тяжелой цепи иммуноглобулина, впервые обнаружены при электрофоретическом анализе иммуноглобулинов в сыворотке крови различных представителей семейства верблюдовых (Hamers Casterman С, Atarhouch Т., Muyldermans S., Robinson G., Hamers C, Bajyana Songa E., BendahmanN., Hamers R. 1993. Naturally occurring antibodies devoid of light chains. Nature. 363, 446-448). Относительная доля HCAb варьирует от примерно 15-25% (всех IgG) у лам и викуний до примерно 60-80% у верблюдов (С.В. Тиллиб "Верблюжьи наноантитела" - эффективный инструмент для исследований, диагностики и терапии Молекулярная биология, 2011, том 45, №1, с. 77-85).
Как предполагают, неканонические антитела (HCAb), по крайней мере, в случае верблюдовых, представляют собой результат относительно недавней эволюции генов канонических антител. Два константных домена тяжелых цепей, СН2 и СН3, в случае HCAb и классических антител высококонсервативны. В составе антител HCAb домен, соответствующий первому константному СН1-домену классических антител, отсутствует. Геном одногорбого верблюда (вид Dromedary) содержит кластер из примерно пятидесяти VH- и сорока VHH-генеративных генов, за которыми располагаются множественные гены D-сегментов, J-сегментов и гены константных участков (Сμ, Сγ, Сε, Сα). Очевидно, что некоторые из Сγ-генов предназначены для формирования HCAb (мутация приводит к потере СН1-домена), в то время как остальные - для формирования классических антител (с сохраняемым СН1-доменом). Одни и те же гены сегментов D и J могут случайным образом соединяться как с одним из VH-, так и с одним из VHH-генов. Это указывает на то, что гены VH и VHH находятся в одном и том же локусе (Nguyen V.K., Hamers R., Wyns L., Muyldermans S.1999. Loss of splice consensus signal is responsible for the removal of the entire CH1 domain of the functional camel IGG2A heavy-chain antibodies. Mol. Immunol. 36, 515-524; Woolven B.P., Frenken L., van der Logt P., Nicholls P.J. 1999. The structure of the llama heavy chain constant genes reveals a mechanism for heavy-chain antibody formation. Immunogenetics. 50, 98-101; Nguyen V.K., Hamers R., Wyns L., Muyldermans S.2000. Camel heavy-chain antibodies: diverse germline VHH and specific mechanisms enlarge the antigen-binding repertoire. EMBO J. 19, 921-931; De Genst E., Saerens D., Muyldermans S., Conrath K. 2006. Antibody repertoire development in camelids. Develop. Comp. Immunol. 30, 187-198).
Организация вариабельных доменов неканонических антител (VHH) и вариабельных доменов (VH) классических антител весьма сходна, т.к. у человека VH-домены подкласса IgG3 имеют особо выраженную гомологию с VH и VHH верблюдовых. В обоих случаях V-домены состоят из четырех консервативных каркасных участков FR, которые окружают три гипервариабельных участка, определяющих комплементарность, CDR. Также в обоих случаях формируется типичная для V-домена иммуноглобулина пространственная структура из двух β-слоев, один из которых состоит из четырех аминокислотных цепочек и второй - из пяти (Muyldermans S., Cambillau С., Wyns L. 2001. Recognition of antigens by single-domain antibody fragments: the superfluous luxury of paired domains. TIBS. 26, 230-235; De Genst E., Silence K., Decanniere K., Loris R., Kinne J., Muyldermans S. 2006. Molecular basis for the preferential cleft recognition by dromedary heavy chain antibodies. Proc. Natl. Acad. Sci. USA. 103, 4586-4591). В этой структуре все три гипервариабельных участка кластеризуются с одной стороны V-домена, где они участвуют в распознавании антигена и располагаются в петлях, соединяющих β-структуры. Однако имеются и важные отличия, связанные с функционированием VHH в формате одного домена. Так, гипервариабельные участки CDR1 и CDR3 VHH заметно увеличены. Часто в гипервариабельных участках VHH обнаруживаются цистеиновые остатки сразу в двух участках (чаще всего - в CDR1 и CDR3, реже - в CDR2 и CDR3). При исследовании кристаллических структур VHH показано, что эти цистеиновые остатки формируют дисульфидные связи, и это дополнительно стабилизирует структуру петель данного антитела (De Genst Е., Silence K., Decanniere K., Loris R., Kinne J., Muyldermans S. 2006. Molecular basis for the preferential cleft recognition by dromedary heavy chain antibodies. Proc. Natl. Acad. Sci. USA. 103, 4586-4591). Наиболее явный и воспроизводимый отличительный признак VHH - четыре замены гидрофобных аминокислотных остатков на гидрофильные во втором каркасном участке (Val37Phe, Gly44Glu, Leu45Arg, Trp47Gly, согласно нумерации Кабат (Kabat) и соавт. (Kabat Е., Wu Т.Т., Perry Н.М., Gottesman K.S., Foeller С. 1991. Sequence of proteins of immunological interest. US Public Health Services. NIH, Bethesda, MD, Publication no. 91-3242)). Этот каркасный участок у VH-домена высококонсервативен, обогащен гидрофобными аминокислотными остатками и особо важен при образовании связи с вариабельным доменом VL легкой цепи. В этом аспекте VHH-домен сильно отличается: указанные замены гидрофобных аминокислот на гидрофильные делают невозможной ассоциацию VHH и VL. Эти замены также объясняют обычно высокую растворимость VHH (наноантитела) при его получении в виде рекомбинантного белка (Nguyen V.K., Desmyter A., Muyldermans S. 2001. Functional heavy-chain antibodies in camelidae. Adv. Immunol. 79, 261-296).
Репертуары возможных паратопов (антигенсвязывающих структур антитела) HCAb и классических антител, по-видимому, могут заметно отличаться. Так как эти два типа антител сосуществуют в одном организме, то можно предполагать, что они не конкурируют, а взаимно дополняют друг друга. Действительно, не раз отмечалось, что оба типа антител могут возникать параллельно, взаимоисключающе или в разных соотношениях, по отношению к разным эпитопам антигенного материала при иммунизации одного и того же животного. Несмотря на предполагаемое меньшее разнообразие возможных паратопов у однодоменных антител по сравнению с классическими двухдоменными антителами, работы многих авторов убедительно продемонстрировали, что HCAb могут быть получены против самых разнообразных эпитопов весьма широкого спектра антигенов (Muyldermans S., Baral T.N., Retamozzo V.C., et al. 2009. Camelid immunoglobulins and nanobody technology. Vet. Immunol. Immunopathol. 128(1-3), 178-183). Очевидно, этому способствуют заметно увеличенные гипервариабельные участки CDR1 и CDR3. Следует также отметить удивительно большое (в сравнении с V-доменами классических антител) число соматических гипермутаций в VHH, накапливающихся, по-видимому, в процессе аффинного созревания антител в ходе иммунизации (de Genst Е., Silence K., Decanniere K., Loris R., Kinne J., Wyns L., Muyldermans S. 2005. Strong in vivo maturation compensates for structurally restricted H3 loops in antibody repertoires. J. Biol. Chem. 280, 14114-14121). Рентгеноструктурный анализ показал, что антигенсвязывающие петлевые участки VHH способны образовывать необычные для классических V-доменов структуры (De Genst Е., Silence K., Decanniere K., Loris R., Kinne J., Muyldermans S. 2006. Molecular basis for the preferential cleft recognition by dromedary heavy chain antibodies. Proc. Natl. Acad. Sci. USA. 103, 4586-4591; de Genst E., Silence K., Decanniere K., Loris R., Kinne J., Wyns L., Muyldermans S. 2005. Strong in vivo maturation compensates for structurally restricted H3 loops in antibody repertoires. J. Biol. Chem. 280, 14114-14121). Если в случае VH- и VL-доменов классических антител все шесть гипервариабельных участков вносят более или менее одинаковый вклад в связывание антигена, то в случае VHH обычно для формирования паратопа более важен CDR3-участок. Показано, что CDR3-участок в VHH (но не в VH или VL) может образовывать необычные длинные пальцеобразные выступающие структуры, которые могут углубляться в структуру антигена, в частности, распознавать активные центры ферментов (De Genst Е., Silence K., Decanniere K., Loris R., Kinne J., Muyldermans S. 2006. Molecular basis for the preferential cleft recognition by dromedary heavy chain antibodies. Proc. Natl. Acad. Sci. USA. 103, 4586-4591). Малыми размерами антигенсвязывающего участка (VHH) и его способностью формировать необычные выступающие паратопы объясняется возможность получения HCAb, способных распознавать недоступные для классических антител эпитопы, например, при образовании антител, являющихся эффективными ингибиторами ферментов (Lauwereys М., Ghahroudi М., Desmyter A., Kinne J., Holzer W., De Genst E., Wyns L., Muyldermans S. 1998. Potent enzyme inhibitors derived from dromedary heavy chain antibodies. EMBO J. 17, 3512-3520).
При всем своем высоком потенциале уникальной, в сравнении с классическими IgG антителами, специфичности, использование монодоменных VHH для терапевтического применения в ряде случаев ограниченно из-за быстрого выведения этой малой молекулы из организма. Существует ряд решений по улучшению фармакокинетики VHH структур, которые включают использование химической конъюгации с ПЭГ (PEG) и ковалентное соединение с полипептидом, опосредующим уменьшенный клиренс из крови, такими как сывороточный альбумин человека (HSA) и Fc-фрагмент классического антитела человека, в виде гибридных белков, период полувыведения в крови которых составляет до трех недель (Kontermann RE. 2009 Strategies to extend plasma half-lives of recombinant antibodies. BioDrugs.; 23(2):93-109; Ken Coppieters, Torsten Dreier, Karen Silence, Hans de Haard, Marc Lauwereys, Peter Casteels, Els Beirnaert, Heidi Jonckheere, 2006 Formatted anti-tumor necrosis factor alpha VHH proteins derived from camelids show superior potency and targeting to inflamed joints in a murine model of collagen-induced arthritis Arthritis & Rheumatology.; 54(6): 1856-66; Gabrielle Richard, Ashley J Meyers, Michael D McLean, Mehdi Arbabi-Ghahroudi, Roger MacKenzie, J Christopher Hall 2013. In Vivo Neutralization of α-Cobratoxin with High-Affinity Llama Single-Domain Antibodies (VHHs) and a VHH-Fc Antibody. PLoS One 22; 8(7):e69495). Также показано успешное применение малых пептидов, присоединяемых с помощью методов генной инженерии к VHH и способных к высокоаффиному нековалентному взаимодействию с этими же компонентами (HSA и IgG) в крови человека (Jan Terje Andersen, Maria Gonzalez-Pajuelo, Stian Foss, Ole J.B. Landsverk, Pinto, Alexander Szyroki, Hans J. de Haard, Michael Saunders, Peter Vanlandschoot Inger Sandlie 2012, Selection of Nanobodies that Target Human Neonatal Fc Receptor Scientific Reports, 3, 1118). Однако технологичность и иммуногенность этих подходов остается пока неясной и находится только на стадии проверки применимости как в клинических исследованиях так и на более ранних стадиях исследований.
Кроме того, наибольшее ограничение при применении антител в качестве препаратов для лечения различных заболеваний накладывает агрегационная и химическая стабильность, аффинность и иммуногенность. Т.к. большинство моноклональных антител в настоящее время получают на основе мышиных, применение таких антител у пациентов приводит к развитию иммунного ответа на терапию антителами, например, аллергических реакций. Такие типы иммунного ответа могут повлечь за собой в конечном итоге потерю эффективности при лечении по меньшей мере и, в худшем случае, к возможным тяжелым анафилактическим реакциям. С другой стороны, агрегационно или химически нестабильные терапевтические антитела при хранении препарата ухудшают его терапевтические свойства и могут усиливать иммуногенность при введении в организм пациента.
В связи с вышесказанным, актуальным является создание биспецифических антител на основе антител VHH, которые эффективно воздействуют на сигнальную систему HER, в частности на HER2 и/или HER3, и при этом которые имели бы, по сравнению с известными ранее антителами, улучшенные функциональные и терапевтические свойства, в частности, повышенную агрегационную, химическую и термостабильность, и улучшенную аффинность, и в то же время отличались бы легкостью и простотой получения, в т.ч. и в промышленно значимых масштабах.
Биспецифическая молекула BCD090 селективно связывается с гетеродимером ErbB2/ErbB3, что приводит к образованию неактивного тримера. Эта молекула является более эффективным ингибитором активации ErbB3 и ErbB2 рецепторов, чем моноклональные антитела против ErbB2 или ErbB3.
Краткое описание изобретения
Настоящее изобретение относится к биспецифическим связывающим молекулам, в частности антителам, направленным для связывания с рецепторами HER2 и HER3. Такие антитела могут быть использованы для лечения заболевания или нарушения, опосредуемого HER2 и HER3, например, выбранного из группы: рака молочной железы (РМЖ), злокачественных новообразований желудка, немелкоклеточного рака легкого, злокачественных новообразований головы и/или шеи. По сравнению с существующими в настоящее время способами лечения таких заболеваний, включая лечение антителами, предполагается, что биспецифичные связывающие молекулы, в частности антитела, направленные для связывания с рецепторами HER2 и HER3, по настоящему изобретению, в частности биспецифическая молекула BCD090, могут обеспечить наилучший клинический ответ, применяемые как отдельно, так и в сочетании с другой терапией.
В одном из аспектов настоящее изобретение относится к биспецифическому антителу, которое специфично связывается с HER2 и HER3. Данное антитело содержит вариабельный домен тяжелой цепи VHH, специфичный к HER3, и антитело или его антигенсвязывающий домен, которые специфично связываются с HER2. В некоторых вариантах осуществления изобретения вариабельный домен тяжелой цепи VHH, специфичный к HER3, и антитело или его антигенсвязывающий домен, которые специфично связываются с HER2, связаны между собой пептидным линкером.
В некоторых вариантах биспецифическое антитело включает вариабельный домен тяжелой цепи VHH, содержащий аминокислотную последовательность по меньшей мере на 75% гомологичную последовательности SEQ ID NO: 3. В некоторых вариантах биспецифическое антитело включает вариабельный домен тяжелой цепи VHH, который содержит аминокислотную последовательность SEQ ID NO: 3.
В некоторых вариантах осуществления изобретения биспецифическое антитело включает вариабельный домен тяжелой цепи VHH, специфичный к HER3, который содержит аминокислотные последовательности, гомологичные по меньшей мере на 75% последовательностям SEQ ID NO: 1-3. В некоторых вариантах осуществления изобретения вариабельный домен тяжелой цепи VHH, специфичный к HER3, содержит аминокислотные последовательности, гомологичные по меньшей мере на 80% последовательностям SEQ ID NO: 1-3. В некоторых вариантах осуществления изобретения вариабельный домен тяжелой цепи VHH, специфичный к HER3, содержит аминокислотные последовательности, гомологичные по меньшей мере на 85% последовательностям SEQ ID NO: 1-3. В некоторых вариантах осуществления изобретения вариабельный домен тяжелой цепи VHH, специфичный к HER3, содержит аминокислотные последовательности, гомологичные по меньшей мере на 90% последовательностям SEQ ID NO: 1-3. В некоторых вариантах осуществления изобретения вариабельный домен тяжелой цепи VHH, специфичный к HER3, содержит аминокислотные последовательности, гомологичные по меньшей мере на 95% последовательностям SEQ ID NO: 1-3. В некоторых вариантах осуществления изобретения вариабельный домен тяжелой цепи VHH специфичный к HER3, содержит аминокислотные последовательности, гомологичные по меньшей мере на 98% последовательностям SEQ ID NO: 1-3. В некоторых вариантах осуществления изобретения вариабельный домен тяжелой цепи VHH, специфичный к HER3, содержит аминокислотные последовательности, представленные последовательностями SEQ ID NO: 1-3.
В некоторых вариантах осуществления изобретения биспецифическое антитело включает вариабельный домен тяжелой цепи VHH, который конкурирует за связывание или связывается с тем же эпитопом, что связывающий домен, содержащий аминокислотную последовательность SEQ ID NO: 4.
В некоторых вариантах осуществления изобретения биспецифическое антитело включает последовательность вариабельного домена тяжелой цепи VHH, специфичного к HER3, по меньшей мере на 90% гомологичную аминокислотной последовательности SEQ ID NO: 4. В некоторых вариантах осуществления изобретения последовательность вариабельного домена тяжелой цепи VHH, специфичного к HER3, является по меньшей мере на 95% гомологичной аминокислотной последовательности SEQ ID NO: 4. В некоторых вариантах осуществления изобретения последовательность вариабельного домена тяжелой цепи VHH, специфичного к HER3, является по меньшей мере на 98% гомологичной аминокислотной последовательности SEQ ID NO: 4. В отдельном варианте осуществления изобретения последовательность вариабельного домена тяжелой цепи VHH, специфичного к HER3, состоит из аминокислотной последовательности SEQ ID NO: 4.
В некоторых вариантах осуществления биспецифическое антитело включает антитело, специфичное к HER2, которое представляет собой полноразмерное антитело IgG. В некоторых вариантах осуществления изобретения полноразмерное антитело, специфичное к HER2, относится к изотипу IgG1, IgG2, IgG3, IgG4 человека. В некоторых вариантах осуществления изобретения полноразмерное антитело, специфичное к HER2, содержит тяжелую и легкую цепи, которые, соответственно, содержат аминокислотные последовательности, по меньшей мере на 80% гомологичные последовательностям SEQ ID NO: 5 и SEQ ID NO: 6. В некоторых вариантах осуществления изобретения полноразмерное антитело, специфичное к HER2, содержит тяжелую и легкую цепи, которые, соответственно, содержат аминокислотные последовательности, по меньшей мере на 90% гомологичные последовательностям SEQ ID NO: 5 и SEQ ID NO: 6. В некоторых вариантах осуществления изобретения полноразмерное антитело, специфичное к HER2, содержит тяжелую и легкую цепи, которые, соответственно, содержат аминокислотные последовательности, по меньшей мере на 95% гомологичные последовательностям SEQ ID NO: 5 и SEQ ID NO: 6. В некоторых вариантах осуществления изобретения полноразмерное антитело, специфичное к HER2, содержит тяжелую и легкую цепи, которые, соответственно, содержат аминокислотные последовательности, по меньшей мере на 98% гомологичные последовательностям SEQ ID NO: 5 и SEQ ID NO: 6. В отдельном варианте осуществления изобретения полноразмерное антитело, специфичное к HER2, содержит тяжелую и легкую цепи, которые, соответственно, содержат аминокислотные последовательности SEQ ID NO: 5 и SEQ ID NO: 6.
В некоторых вариантах осуществления изобретения биспецифическое антитело, которое специфично связывается с HER2 и HER3, включает антигенсвязывающий домен, который специфично связывается с HER2.
В некоторых вариантах осуществления изобретения биспецифическое антитело, которое специфично связывается с HER2 и HER3, представляет собой ассиметричное антитело.
В некоторых вариантах осуществления изобретения биспецифическое антитело включает вариабельный домен тяжелой цепи VHH, специфичный к HER3, и антитело или его антигенсвязывающий домен, которые специфично связываются с HER2 которые связаны между собой пептидным линкером из более чем пяти аминокислот. В некоторых вариантах осуществления изобретения, аминокислотные остатки пептидного линкера выбраны из G, А, S, P, E, T, D и К. Вариабельный домен тяжелой цепи VHH присоединен к N-концу или С-концу легкой или тяжелой цепи антитела, специфичного против HER2, через пептидный линкер.
В некоторых вариантах осуществления изобретения биспецифическое антитело имеет константу диссоциации KD связывания с HER2 человека не более 10-10 М и обезьяны не более 10-7 М, KD связывания с HER3 человека не более 10-9 М и обезьяны не более 10-8 М.
В одном из аспектов настоящее изобретение относится к раствору для ингибирования биологической активности HER2 и/или HER3 у субъекта, который включает биспецифическое антитело, которое специфично связывается с HER2 и HER3, и один или несколько фармацевтически приемлемых эксципиентов.
В некоторых вариантах осуществления изобретения раствор для ингибирования биологической активности HER2 и/или HER3 у субъекта имеет такую агрегационную стабильность, что при концентрациях более 10 мг/мл и хранении при t=4°С в течение более чем 6 месяцев содержание агрегатов не увеличивается более чем на 5% от исходного содержания в растворе.
В некоторых вариантах осуществления изобретения раствор для ингибирования биологической активности HER2 и/или HER3 у субъекта имеет такую агрегационную стабильность, что при концентрациях более 10 мг/мл и при повышении температуры до 37°С в течение более чем 2 недель содержание агрегатов не увеличивается более чем на 5% от исходного содержания в растворе.
В некоторых вариантах осуществления изобретения раствор для ингибирования биологической активности HER2 и/или HER3 у субъекта имеет такую агрегационную стабильность, что при концентрациях более 10 мг/мл и повышении температуры до 50°С в течение более чем 6 часов содержание агрегатов не увеличивается более чем на 5% от исходного содержания в растворе.
В одном из аспектов настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, которое содержит нуклеотидную последовательность, кодирующую любую из биспецифичных связывающих молекул, описанных в настоящем документе.
В одном из аспектов настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, которая содержит нуклеотидную последовательность, которая кодирует любой вариабельный домен тяжелой цепи VHH, описанный в настоящем документе.
В одном из аспектов настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, которая содержит нуклеотидную последовательность, которая кодирует тяжелую цепь, легкую цепь или обе цепи антитела, специфичного к HER2, описанную в настоящем документе.
В одном из аспектов настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, которая содержит следующее:
a) любую нуклеотидную последовательность, которая кодирует вариабельный домен тяжелой цепи VHH, описанный в настоящем документе;
b) любую нуклеотидную последовательность, которая кодирует тяжелую цепь антитела, специфичного к HER2, описанную в настоящем документе;
c) любую нуклеотидную последовательность, которая кодирует легкую цепь антитела, специфичного к HER2, описанную в настоящем документе; или
d) любое сочетание а)-с).
В одном из аспектов настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, которая содержит нуклеотидную последовательность, кодирующую любой вариабельный домен тяжелой цепи VHH, описанный в настоящем документе, и любую нуклеотидную последовательность, кодирующую тяжелую цепь, легкую цепь или обе цепи антитела, специфичного к HER2, описанные в настоящем документе, в некоторых случаях дополнительно содержит нуклеотидную последовательность, кодирующую пептидный линкер.
В одном из аспектов настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, которая кодирует любую из аминокислотных последовательностей SEQ ID NO: 1-6.
В одном из аспектов настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, которая содержит нуклеотидную последовательность, которая кодирует любое из биспецифических антител, которые специфично связываются с HER2 и HER3, описанных в настоящем документе. В некоторых вариантах осуществления изобретения выделенная молекула нуклеиновой кислоты содержит последовательность ДНК, которая кодирует любое из биспецифических антител, которые специфично связываются с HER2 и HER3, описанных в настоящем документе.
В одном из аспектов настоящее изобретение относится к вектору, содержащему любую из выделенных молекул нуклеиновой кислоты, описанных выше, при этом указанный вектор далее содержит последовательности, контролирующие экспрессию.
В одном из аспектов настоящее изобретение относится к способу получения клетки-хозяина для получения любого из вышеописанных антител, где способ включает трансформирование клетки любым вышеуказанным вектором.
Настоящее изобретение также относится к клетке-хозяину, содержащей любую из вышеописанных нуклеиновых кислот.
В одном из аспектов настоящее изобретение относится к способу получения любых биспецифических антител, которые специфично связывается с HER2 и HER3, описанные в настоящем документе, который включает получение клетки-хозяина, как описано выше, культивирование указанной клетки-хозяина в культуральной среде в условиях, достаточных для получения указанного антитела, а также, при необходимости, с последующим выделением и очисткой полученного антитела.
В одном из аспектов настоящее изобретение относится к фармацевтической композиции для профилактики или лечения заболевания или нарушения, опосредуемого HER2 и HER3, которая содержит любое биспецифическое антитело, которое специфично связывается с HER2 и HER3, описанное в настоящем документе, в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами.
В некоторых вариантах осуществления изобретения фармацевтическая композиция, которая содержит любое биспецифическое антитело, которые специфично связывается с HER2 и/или HER3, описанное в настоящем документе, предназначена для профилактики или лечения, заболевания или нарушения, опосредуемого HER2 и HER3, выбранного из группы: рака молочной железы (РМЖ), злокачественных новообразований желудка, немелкоклеточного рака легкого, злокачественных новообразований головы и/или шеи.
В одном из аспектов настоящее изобретение относится к способу ингибирования биологической активности HER2 и/или HER3 у субъекта, нуждающемуся в таком ингибировании, который включает введение субъекту эффективного количества любого биспецифического антитела, которое специфично связывается с HER2 и HER3, описанного в настоящем документе.
В одном из аспектов настоящее изобретение относится к способу лечения заболевания или нарушения, опосредованного HER2 и/или HER3, который включает введение субъекту, нуждающемуся в таком лечении, любого биспецифического антитела, которые специфично связывается с HER2 и HER3, описанного в настоящем документе, или любого раствора, описанного в настоящем документе, который содержит любое биспецифическое антитело, которое специфично связывается с HER2 и HER3, описанного в настоящем документе, или любой фармацевтической композиции, описанной в настоящем документе, которая содержит любое биспецифическое антитело, которое специфично связывается с HER2 и HER3, описанное в настоящем документе, в терапевтически эффективном количестве.
В некоторых вариантах осуществления изобретения способ лечения предназначен для лечения заболевания или нарушения, где заболевание или нарушение выбрано из группы: рака молочной железы (РМЖ), злокачественных новообразований желудка, немелкоклеточного рака легкого, злокачественных новообразований головы и/или шеи.
В одном из аспектов настоящее изобретение относится к применению любого биспецифического антитела, которое специфично связывается с HER2 и HER3, описанного в настоящем документе, или любого раствора, описанного в настоящем документе, который содержит любое биспецифическое антитело, которое специфично связывается с HER2 и HER3, описанного в настоящем документе, или любой фармацевтической композиции, описанной в настоящем документе, которая содержит любое биспецифическое антитело, которое специфично связывается с HER2 и HER3, описанное в настоящем документе, для лечения у субъекта, нуждающегося в таком лечении, заболевания или нарушения, опосредуемого HER2 и/или HER3.
В некоторых вариантах осуществления изобретения применение для лечения у субъекта, нуждающегося в таком лечении, заболевания или нарушения, опосредуемого HER2 и/или HER3, где заболевание или нарушение выбрано из группы: рака молочной железы (РМЖ), злокачественных новообразований желудка, немелкоклеточного рака легкого, злокачественных новообразований головы и/или шеи.
Краткое описание чертежей
Фиг. 1. Схема получения биспецифического антитела anti-HER2/anti-HER3.
Фиг. 2. Последовательность белка HER3-His6-FLAG (HER3HF).
Фиг. 3. Последовательность белка 3DHER3-His6-EPEA (3DHER3HE).
Фиг. 4. Последовательность белка HER3-Fc-His6 (HER3-Fc).
Фиг. 5. Последовательность контрольного антитела ahti-HER3 AV203 с опубликованной последовательностью (от AVEO, Biogen, WO 2011/136911 А2)
Фиг. 6. Очищенные препараты белков HER3HF, 3DHER3HE, HER3-Fc.
Фиг. 7. Очищенный препарат контрольного антитела против HER3.
Фиг. 8. Титр антител против HER3 человека, полученный путем иммунизации Lama glama.
Фиг. 9. Карта плазмиды для фагового дисплея Fab фрагментов антител.
Фиг. 10. Карта плазмиды для секреционной экспрессии Fab фрагментов антител в E. coli.
Фиг. 11. График зависимости сигнала связывания поликлонального фага со специфическими и неспецифическими антигенами после селекции иммунной фаговой библиотеки.
Фиг. 12. Иммуноферментный анализ взаимодействия моноспецифического aнти-HER3 антитела с HER3 и другими антигенами.
Фиг. 13. ИФА связывания BCD-090 антитела с различными ортологичными белками HER2.
Фиг. 14. ИФА связывания BCD-090 антитела с различными ортологичными белками HER3.
Фиг. 15. Кривые ассоциации/диссоциации для комплекса HER3 человека/ BCD090, полученные для двух различных концентраций аналита.
Фиг.16. Кривые ассоциации/диссоциации для комплекса HER3 макаки резус/ BCD090, полученные для двух различных концентраций аналита.
Фиг. 17. Кривые ассоциации/диссоциации для комплекса HER2 макаки циномолгус/ BCD090, полученные для семи различных концентраций аналита.
Фиг. 18. Кривые ассоциации/диссоциации для комплекса HER2 человека/ВСD090.
Фиг. 19. Сенсограмма измерения одновременного связывания BCD090 антителом обоих лигандов HER2 и HER3 человека на приборе OctetRED96.
Фиг. 20. График зависимости процента живых клеток линии MCF7 в зависимости от концентрации антител в среде через 72 часа в СO2 инкубаторе. Планки погрешностей отражают стандартное отклонение, рассчитанное по трем повторам для каждой концентрации антитела.
Фиг. 21. График зависимости процента живых клеток линии ВТ474 в зависимости от концентрации антител в среде через 72 часа в СO2 инкубаторе. Планки погрешностей отражают стандартное отклонение, рассчитанное по трем повторам для каждой концентрации антитела.
Фиг. 22. График зависимости процента живых клеток линии A431NS в зависимости от концентрации антител в среде через 72 часа в СO2 инкубаторе. Планки погрешностей отраж