Штамм мицелиального гриба trichoderma longibrachiatum tw-14-220 - продуцент целлюлаз, бета - глюканаз и ксиланаз для кормопроизводства и способ получения кормового комплексного ферментного препарата
Иллюстрации
Показать всеПредложены штамм мицелиального гриба Trichoderma Longibrachiatum TW-14-220T - продуцент комплекса ферментов эндоглюканаз, бета-глюканаз и ксиланаз, разрушающих некрахмальные полисахариды, и способ получения кормового ферментного препарата с использованием штамма мицелиального гриба Trichoderma longibrachiatum TW-14-220T. Группа изобретений относится к биотехнологии. Способ получения кормового комплексного ферментного препарата предусматривает глубинное культивирование штамма гриба Trichoderma Longibrachiatum TW-14-220T, депонированного во Всероссийской Коллекции Микроорганизмов под регистрационным номером ВКМ F-4642D на подходящих ферментационных питательных средах с последующим центрифугированием, фильтрацией, ультрафильтрацией и лиофилизацией культуральной жидкости. Группа изобретений позволяет повысить степень биодеградации некрахмальных полисахаридов. 2 н.п. ф-лы, 4 табл., 3 пр.
Реферат
Изобретение относится к области биотехнологии и может быть использовано для разрушения некрахмальных полисахаридов (НКП) злаков, биодеградации клеточных стенок растений и микроорганизмов, переработки отходов промышленности и сельского хозяйства, в кормопроизводстве, в микробиологической промышленности, в различных отраслях спиртовой и пищевой промышленности, при проведении ферментативного гидролиза (осахаривания) целлюлозы и целлюлозосодержащего сырья.
Микробные целлюлазы и гемицеллюлазы, способные гидролизовать основные полимерные компоненты растительного сырья, представляют одну из доминирующих на мировом рынке групп промышленных ферментов (1, 2). Ферментные препараты (ФП) целлюлаз и гемицеллюлаз широко применяются для гидролиза растительной биомассы с образованием сбраживаемых сахаров для последующего получения биоэтанола, органических кислот, антибиотиков. Целлюлазы используют в пищевой, текстильной, целлюлозобумажной промышленности, при производстве моющих средств (2, 3).
Перспективным направлением является применение целлюлаз и гемицеллюлаз в кормопроизводстве. Основой большинства рационов моногастричных сельскохозяйственных животных и птицы являются злаковые культуры с высоким содержанием водорастворимых НКП, обладающих антипитательными свойствами. Водорастворимые НКП повышают вязкость перевариваемой массы, затрудняют гидролиз питательных компонентов и всасывание продуктов гидролиза стенками кишечника, образуют комплексы с белком, снижая его переваримость, способствуют развитию патогенной микрофлоры в кишечнике, изменяют физиологию и морфологию пищеварительного тракта. Использование экзогенных карбогидраз целлюлолитического и гемицеллюло-литического действия устраняет антипитательные свойства водорастворимых НКП и разрушает матрикс клеточных стенок оболочек зерна, что приводит к снижению вязкости перевариваемой массы, повышает доступность питательных компонентов для действия пищеварительных ферментов, высвобождает сахара, необходимые для роста молочнокислых бактерий, способствует нормализации микрофлоры кишечника, увеличивает энергетическую ценность и усвояемость кормов (4, 5, 6).
Особенностью целлюлолитического ферментативного комплекса является синергетическое действие ферментов экзо- и эндодействия. Эндоглюканаза (эндо-β-1,4-глюканаза, КМЦаза, целлюлаза, КФ 3.2.1.4) гидролизует внутренние β-1,4-глюкозидные связи, удаленные от концов полимерной цепи целлюлозы, находящиеся в ее аморфных участках, уменьшая степень полимеризации и приводя к образованию коротких волокон целлюлозы и целлоолигосахаридов. Эндо-1,4-β-глюканаза также неупорядоченным образом гидролизует внутренние связи в β-1,4-глюканах и олигосахаридах. Экзоглюканазы (целлобиогидролазы (ЦБГ), авицелаза) отщепляют целлобиозу от нередуцирующего (КФ 3.2.1.91) или редуцирующего (КФ 3.2.1.176) конца молекул целлюлозы или ее фрагментов, образовавшихся под действием эндоглюканазы и находящихся, в основном, в кристаллических участках целлюлозы. β-Глюкозидаза (целлобиаза, КФ 3.2.1.21) высвобождает глюкозу из β-D-глюкозидов, низкомолекулярных целлоолигосахаридов и целлобиозы (7, 8, 9, 10).
Действие эндоглюканаз способствует быстрому снижению вязкости субстрата, что делает перспективным их применение в кормопроизводстве, а ЦБГ и β-глюкозидаза обеспечивают накопление сбраживаемых углеводов, что наиболее актуально в технологии производства биоэтанола.
Для гидролиза гемицеллюлоз используют ферменты гемицеллюлолитического комплекса, такие как эндоксиланазы, β-ксилозидазы, эндоманнаназы, α-маннозидазы, α-арабинофуранозидазы и α-галактозидазы (11). Гемицеллюлазы можно разделить на деполимеризующие ферменты, которые расщепляют основную цепь, и ферменты, удаляющие заместители, которые препятствуют действию деполимеризующих ферментов (12). Базовыми компонентами большинства кормов для сельскохозяйственных животных и птицы в России являются злаковые культуры – пшеница, рожь, тритикале, и продукты их переработки, такие как зерновая послеспиртовая барда (13). Поэтому гемицеллюлоза ксилан, составляющий до 30–35% материала клеточных стенок зерновых культур, является одним из основных компонентов кормов для животных (4).
Ключевыми ферментами для деградации ксиланов, основная цепь которых состоит из β-1,4-D-связанных остатков ксилозы, являются ксиланазы. Ксиланазы (эндо-1,4-в-ксиланазы, КФ 3.2.1.8) катализируют неупорядоченный гидролиз внутренних β-1,4-D-ксилозидных связей в основной цепи ксилана с образованием коротких ксилоолигомеров, обладающих пребиотическими свойствами, быстро снижая степень полимеризации субстрата (14, 15). Ксилан ограничивает доступ целлюлаз к целлюлозе, поэтому присутствие ксиланаз в целлюлолитических ферментных комплексах существенно повышает эффективность гидролиза растительных целлюлозосодержащих субстратов (12).
Высокую целлюлолитическую активность проявляют мицелиальные грибы родов Trichoderma, Penicillium, Humicola и Aspergillus, а также некоторые бактериальные штаммы родов Pseudomonas, Bacillus и др. Предпочтительным источником целлюлаз для промышленного производства ферментов являются грибные штаммы, благодаря высокой продуктивности при росте на дешевых ферментационных средах (16, 17).
Основным источником коммерческих целлюлаз традиционно являются мицелиальные грибы рода Trichoderma (T.viride, T.longibrachiatum, T.reesei), отличающиеся высокой продуктивностью и широким спектром синтезируемых ферментов. В настоящее время большинство коммерческих целлюлолитических препаратов получают на основе штаммов гриба T.reesei, продуцирующего наиболее сбалансированный комплекс ферментов для глубокой декструкции целлюлозосодержащих растительных субстратов с получением сбраживаемых углеводов для последующего производства биоэтанола (18, 4). T.reesei, T.longibrachiatum и T.viride являются близкородственными штаммами и характеризуются сходным составом ферментного комплекса (19).
T.reesei синтезирует полный набор целлюлаз, включающий ЦБГ, эндоглюканазы и β-глюкозидазы, которые действуют синергетически, расщепляя кристаллическую целлюлозу до глюкозы. Основными компонентами целлюлазного комплекса T.reesei являются ЦБГ I (59 – 68 кДа), ЦБГ II (50 – 58 кДа), ЭГ I (50 – 55 кДа) и ЭГ II (48 кДа), составляющие до 90 – 95% общего секретируемого белка. При этом на долю ЦБГ I приходится до 50 – 60% от всех целлюлаз, а ЦБГ II составляет около 20% целлюлаз. ЭГI и ЭГII составляют около 20% от всех целлюлаз. Минорными компонентами являются ЭГ III (25 кДа), ЭГ IV (55 кДа) и ЭГ V (23 кДа), ЭГ IV не обладает целлюлолитической активностью, но является усилителем действия ЭГ (4, 18, 20, 21). β-Глюкозидазы (БГЛ I (75 кДа) и БГЛ II (114 кДа)) синтезируются T. reesei в небольших количествах, и основная их часть связана с клеточной стенкой (21, 22).
Из гемицеллюлаз T. reesei наиболее известны ксиланазы, маннаназы и ксилоглюканазы. Основным ферментом гемицеллюлазного комплекса T.reesei является ксиланаза. Ксиланазная активность T.reesei состоит из ксиланаз I (19 кДа), II (21 кДа), III (32 кДа) и IV (43 кДа), и действующих на ксилан эндоглюканаз. В ксиланазном комплексе T. reesei превалирует ксиланаза II. Ксиланаза III обнаружена у мутантного штамма T. reesei PC-3-7, полученного на основе T.reesei QM 9414, и составляет более 25% от всей ксиланазной активности (21, 23, 24). Оптимум pH для ксиланазы I около 4,0-4,5, для ксиланазы II – 5,0-5,5, для ксиланазы III – 6,0-6,5, для ксиланазы IV – 3,5-4,0 (21). Состав ферментного комплекса T.reesei в большой степени зависит от источника углерода в ферментационной среде (19). Следует отметить существенное преобладание в составе секретируемого в культуральную жидкость (КЖ) внеклеточного ферментного комплекса T. reesei ферментов целлобиогидролаз, в особенности целлобиогидролазы 1 (ЦБГ1) по сравнению с другими ферментами внеклеточного комплекса, в первую очередь с эндоглюканазами (ЭГ) и ксиланазами (25).
Целлюлазы и гемицеллюлазы являются дорогостоящими ферментами, поэтому актуально проведение исследовательских работ как по снижению себестоимости получаемых препаратов за счет повышения продуктивности штаммов, так и по изменению соотношения основных компонентов комплекса с целью максимально эффективного использования ФП в различных технологических процессах, в зависимости от вида сырья и характеристик конечного продукта (12, 26). Для решения определенных практических задач, например, для увеличения питательной ценности комбикормов путем уменьшения их вязкости в желудочно-кишечном тракте животных и птицы за счет разрушения НКП зерна злаков при использовании ФП в качестве кормовых добавок, требуется повышенная активность ферментов эндо-демолимеразного действия – ЭГ и ксиланаз (при сохранении определенного уровня активности ЦБГ).
Большинство исследований по созданию высокоактивных продуцентов целлюлаз направлено на получение продуцентов комплексных ФП, обеспечивающих конверсию лигноцеллюлозного сырья с образованием сбраживаемых сахаров для последующего получения биоэтанола, при этом особое внимание уделяется уровню биосинтеза ЦБГ, играющим ключевую роль в процессах конверсии целлюлозы (27). На базе штамма T.reesei QM6a получен ряд мутантных и рекомбинантных суперпродуцентов целлюлаз с увеличенной способностью к продукции осахаривающих ферментов – ЦБГ и БГЛ (18, 28). Альтернативу штамму T.reesei представляют продуценты рода Penicillium. Штаммы Penicillium характеризуются более высоким уровнем активности БГЛ и ЦБГ I, обеспечивая повышение выхода глюкозы в 1,5 – 3 раза, что является их основным преимуществом для получения ФП для применения в производстве биотоплива (18).
В связи с интенсивным развитием направления кормового применения ФП карбогидраз, проводятся исследования по получению препаратов целлюлаз и гемицеллюлаз второго поколения, адаптированных к кормовым задачам, что заключается, прежде всего, в сбалансированном составе, обеспечивающем максимальную эффективность при переработке зернового сырья с целью повышения его кормовой ценности. Ключевыми карбогидразами для кормовых препаратов являются ферменты эндо-деполимеразного действия – ксиланазы и эндоглюканазы, обеспечивающие быстрое снижение степени полимеризации основных компонентов НКП растительного сырья. Карбогидразы осахаривающего действия – ЦБГ и БГЛ, являются в данном случае «балластными» компонентами (29).
Основную долю коммерческих целлюлаз и ксиланаз в кормопроизводстве составляют ФП на основе штаммов Trichoderma, обладающих высокой секреторной способностью (4, 18). Однако для повышения эффективности использования ФП целлюлаз и гемицеллюлаз в кормовой отрасли требуется дальнейшее увеличение в их составе доли ферментов эндодействия.
Известен рекомбинантный штамм Penicillium verruculosum B10 EGII, созданный с целью получения ФП для кормопроизводства. Штамм содержит плазмиду pPrCBHI-EGII, несущую ген гомологичной эндо-1,3/1,4-β-глюканазы P.verruculosum под промотором ЦБГ1, для увеличения биосинтеза эндоглюканазы за счет снижения активности ЦБГ1 (30). Активности штамма по авицелу, КМЦ и ксилану при культивировании в колбах составляют 3,4, 148 и 165 ед/мл соответственно, а при культивировании в лабораторных ферментерах – 17, 1300 и 1100 ед/мл соответственно (31).
Наиболее близким по технической сущности к предлагаемому изобретению является мутантный штамм T.longibrachiatum TW-420 ВКМ F-3880D, полученный c помощью многоступенчатого мутагенеза с применением ультрафиолетового облучения и последующей селекции из культуры T.longibrachiatum TW-307 ВКМ F-3865D (32).
При глубинном культивировании штамма T.longibrachiatum TW-420 ВКМ F-3880D в качалочных колбах в оптимизированных условиях на жидкой питательной среде на основе микрокристаллической целлюлозы (МКЦ), кукурузного экстракта и глюкозы при рН 6,0 уровень активности целлюлаз по фильтровальной бумаге (ФБ) и карбоксиметилцеллюлозе (КМЦ), β-глюканаз и ксиланаз составляет 8, 110, 105 и 250 ед/мл соответственно. При глубинном культивировании в ферментере на среде с МКЦ, кукурузным экстрактом и глюкозой, с подпиткой лактозой, глюкозой и ксилозой (во второй фазе ферментации) при рН в ферментационной среде 6,0 активности целлюлаз по ФБ и КМЦ, β-глюканаз и ксиланаз, составляют 32, 960, 900 и 2700 ед/мл соответственно.
Следует отметить, что активность по ФБ и авицелу характеризует уровень биосинтеза ЦБГ, т.е. целлюлаз экзо-деполимеразного действия, не оказывающих существенного влияния на повышение питательной ценности кормов. Активность эндоглюканаз, интенсивно гидролизующих НКП злаков с образованием пребиотических олигосахаридов, значительно повышая усвояемость и кормовую ценность растительного сырья, определяется по способности к гидролизу КМЦ и β-глюкана. Соответственно, для получения кормовых ФП требуется штамм с увеличенным уровнем активности ферментов по КМЦ и β-глюкану. Ксиланазная активность также является важнейшим показателем для кормовых ФП ввиду высокого содержания в злаковых культурах арабиноксилана.
Техническая задача, на решение которой направлено предлагаемое изобретение, состоит в получении нового высокоактивного штамма мицелиального гриба – продуцента внеклеточного ферментного комплекса карбогидраз, обладающего повышенной активностью эндоглюканаз и ксиланаз по отношению к целлобиогидролазной активности.
Технический результат, который может быть получен при осуществлении изобретения, заключается в обеспечении высокой эффективности обработки целлюлозо- и гемицеллюлозосодержащих субстратов, в том числе при гидролизе НКП кормов для сельскохозяйственных животных и птиц, для биодеградации клеточных стенок растений и микроорганизмов, для осахаривания и переработки целлюлозосодержащих отходов промышленности и сельского хозяйства.
Сущность объекта изобретения – новый штамм мицелиального гриба T.longibrachiatum TW-14-220 – продуцент целлюлаз и ксиланаз.
Штамм T.longibrachiatum TW-14-220 депонирован во Всероссийской коллекции микроорганизмов при Институте биохимии и физиологии микроорганизмов им. Г.К.Скрябина РАН под №ВКМ F4642 D.
Штамм T.longibrachiatum TW-14-220 получают с помощью многоступенчатого мутагенеза и селекции из штамма T.longibrachiatum TW-420 ВКМ F-3880D. Для мутагенеза используют γ-излучение, которое обладает высокой проникающей способностью, вызывает ионизацию атомов и является мощным мутагенным фактором.
Методика мутагенеза. Споры гриба, выросшего на поверхности скошенного ГКА, суспендируют в дистиллированной воде с добавлением Twin-80 (0,01%), фильтруют через стеклянный фильтр и подвергают мутагенной обработке на γ-установке камерного типа ГУТ-200 М в РНЦ «Курчатовский институт» (Россия). Доза облучения составляет от 1500 до 2500 Гр, время обработки – 4-6 часов, температура облучения спор – 20-23°С, среда облучения – воздух.
Облученные споры высевают на чашки Петри с селективными средами, основу которых составляет среда Гетчинсона с добавлением 0,5% КМЦ, культивируют при 28°С в течение 2 суток и проводят окрашивание Конго Красным. Мутанты с улучшенной продукцией отбирают визуально по увеличенным зонам просветления вокруг колоний. Наиболее активные мутанты, отобранные на чашках, проверяют на продуктивность синтеза целлюлаз, β-глюканаз и ксиланаз при культивировании в жидкой среде в качалочных колбах. Отобранные при культивировании в колбах наиболее активные варианты снова (многократно) подвергают облучению и селекции на чашках и колбах, как описано выше.
Схема мутагенеза и селекции штамма T.longibrachiatum TW- 420 ВКМ F-3880D
T.longibrachiatum TW- 420
(Активности: КМЦ-азы -100%; β-глюканазы -100%; ксиланазы -100%)
↓
(– облучение дозой -1250 Гр в течение 4-6 ч, селекция
↓
Мутантный шт. T.longibrachiatum TW- 420 (1)
(нестабильный при пересевах)
(Активности: КМЦ-азы -110%; β-глюканазы -107%; ксиланазы -120%)
(
(– облучение дозой -2000 Гр в течение 4 ч, селекция
(
Мутантный шт. T.longibrachiatum TW- 420 (2)
(нестабильный при пересевах)
(Активности: КМЦ-азы -110%; β-глюканазы -110%; ксиланазы -125%)
(
(– облучение дозой -2500 Гр в течение 4 ч, селекция
↓
Мутантный шт. T.longibrachiatum TW-14 -220 ВКМ F4642 D
(стабильный штамм при пересевах)
(Активности: КМЦ-азы- 130%; β-глюканазы -120%; ксиланазы -150%)
Хранение штамма. На агаризованных средах (глюкозо-картофельный агар, Мальц-агар), при 4°С при обязательных пересевах не реже одного раза в течение 3-6 месяцев; в лиофилизированном состоянии спор с применением защитных сред.
Культурально-морфологические признаки штамма. При росте на Мальц-агаре диаметр колоний достигает 80-90 мм на 7 сутки при росте при 25°С. Мицелий развит преимущественно субстратный, гиалиновый; воздушный, скудный, белый.
Конидиальная зона сформирована многочисленными компактными подушечками диаметром до 2-2,5 мм, изначально белого цвета, с возрастом – зеленого. Обратная сторона – светло-зеленовато-желтая.
Конидиеносцы неокрашенные, гладкостенные, формируются преимущественно на субстратном мицелии, главные ветви длинные и прямые, иногда извитые, до 4-5 мм шириной у основания, постепенно сужающиеся к вершине до 2 мкм ширины; боковые ветви образуются через неравные интервалы, обычно короткие, формируются под углом к вершине конидиеносцев. Фиалиды одиночные, булавовидные или широко бутыловидные, часто искривленные, размер – 5-10 х 2-3 мкм. Конидии одноклеточные, зеленоватые, гладкостенные, эллипсоидальные, 4-7 х 2,5-4 мкм, собраны в небольшие головки на вершинах фиалид.
При культивировании в глубинных условиях с использованием растворимых субстратов (глюкоза, фруктоза, лактоза) образуется рыхлый разветвленный мицелий со слабой пеллетизацией, удельная начальная скорость роста мицелия составляла 0,3 ч–1, в конце культивирования 0,1 ч-1.
Физиолого-биохимические признаки штамма. Мезофилен. Оптимальная температура роста мицелия 32°С (29-34°С), оптимум для образования целлюлаз 28°С (26-29°С), оптимум для образования ксиланаз – 32-34оС. Оптимальные значения рН роста и секреции целлюлаз 3,5-5,0. Оптимальные значения рН для секреции ксиланаз 5,5-6,0. Рост мицелия наблюдается и при рН 2,5, но при этом не наблюдается очень слабое образование целлюлаз и других карбогидраз.
Резистентность к нистатину слабая. При поверхностном культивировании устойчив к концентрации до 0,5 мкг/мл, при концентрации 2,5 мкг/мл рост полностью подавляется. При добавлении в среду дигитонина (3,5-4,0 мкг/мл) или бенгальского розового (30-50 мкг/мл) размер колоний уменьшается.
Является прототрофом. Способен ассимилировать глюкозу, лактозу, глицерин, галактозу, ксилозу, D-маннит, маннозу, трегалозу, L- и D-арабинозу, сорбозу, сорбит, рибозу.
Не ассимилирует: L-рамнозу, D-глюкозамин, дезоксирибозу, дезоксигалактозу, 2-дезокси-D-глюкозу, 5-тио-D-глюкозу.
Использует аммонийный и органический азот, очень плохо ассимилирует нитратную форму азота.
Образует ферментные системы, позволяющие расти на соответствующих комплексных субстратах: целлюлозе, крахмале, ксилане, ламинарине, β-глюкане, лихенине, галактоманнане, пектине и хитине. Способен утилизировать молочную кислоту при концентрации ниже ингибирующей.
Катаболитная репрессия биосинтеза карбогидраз значительно снижена. Проверка катаболитной репрессии биосинтеза карбогидраз заключается в следующем. Конидии пересевают в пробирки с минимальной средой, содержащей минеральные соли, дрожжевой экстракт (0,5 г/л), аморфную целлюлозу (10 г/л), а также исследуемый репрессор или антиметаболит (глюкоза, 2-дезокси-D-глюкоза, лактоза, глицерин и др.). Диаметр пробирки – 9 мм, высота столбика агара 50-60 мм. Пробирку инкубируют 4 суток при 30°С и затем 20 ч при 45°С.Об устойчивости биосинтеза карбогидраз к катаболитной репрессии судят по глубине зоны деструкции аморфной целлюлозы (по размеру зоны просветления столбика агара в пробирке) в присутствии репрессора или антиметаболита).
Отличие от исходного штамма. Полученный мутант T.longibrachiatum TW-14-220 по своим морфологическим признакам при росте на глюкозо-картофельном агаре, на агаре для споруляции (мальц-агаре) отличается от исходного штамма T.longibrachiatum ВКМ TW- 420 (F-3880D) повышенной интенсивностью спороношения, цветом пигмента, более быстрым ростом на твердых средах. Кроме того, отличается повышенной способностью при глубинном культивировании на жидких средах к биосинтезу эндоглюканаз и ксиланаз.
Патогенность. Данный вид мицелиального гриба относится к IV группе патогенности в соответствии с санитарно-эпидемиологическими правилами «Безопасность работы с микроорганизмами III – IV групп патогенности (опасности) и возбудителям паразитарных болезней» (СП 1.3.2322-08), утвержденными Постановлением Главного государственного санитарного врача РФ №4 от 28 января 2008 г.
Культивирование штамма T.longibrachiatum TW-14-220 проводят в аэробных условиях на питательной жидкой водной среде, содержащей один или несколько субстратов – источников углерода, являющихся индукторами биосинтеза ферментов. В качестве субстратов могут использоваться и субстраты, не являющиеся индукторами. Штамм способен в соответствующих условиях проведения процесса культивирования на основе использования растворимых субстратов, например, лактозы, глюкозы, ксилозы, секретировать в КЖ комплекс ферментов – карбогидраз (целлюлаз, ксиланаз и сопутствующих ферментов). Глюкоза в среде культивирования может быть заменена более дешевым продуктом – гидролизатом крахмала.
Для определения активности целевых ферментов используют следующие субстраты: для эндоглюканазной активности – водорастворимую Na-соль КМЦ, для β-глюканазной активности – β-глюкан ячменя, для ксиланазной активности – ксилан березы. Для характеристики целлобиогидролазной активности определяли активность по авицелу (МКЦ).
Реакцию гидролиза КМЦ, β-глюкана и ксилана проводят в 0,1M Na-ацетатном буфере, рН 5,0, в течение 5 мин при 50°С, реакцию гидролиза МКЦ проводят при рН 5,0, в течение 60 мин при 40°С. Во всех случаях концентрация полисахаридного субстрата в реакционной смеси составляет 5 г/л. В качестве продуктов гидролиза полисахаридных субстратов определяют восстанавливающие сахара (ВС) методом Сомоджи-Нельсона.
За единицу авицелазной, КМЦ-азной, β-глюканазной и ксиланазной активностей принимают такое количество фермента, которое в течение 1 минуты в приведенных выше условиях гидролиза освобождает 1 мкмоль ВС эквивалентных 1 мкмолю глюкозы (33).
ФП, полученные с помощью предлагаемого штамма, могут быть использованы в виде КЖ, в виде жидких концентрированных препаратов, получаемых с помощью ультрафильтрации или упаривания КЖ, или в виде сухих препаратов, получаемых высушиванием или гранулированием.
Возможность использования изобретения иллюстрируется примерами, которые не ограничивают объем и сущность притязаний, связанных с ними.
Пример 1. Для получения посевного материала культуру гриба Т. longibrachiatum TW-14-220 выращивают на СМ-агаре при 28°С в течение 7 суток и далее - при комнатной температуре на свету с течение 5 суток до появления светло-зеленых конидий. Состав СМ-агара (в г/л): глюкоза - 10, дрожжевой экстракт - 5, KH2PO4 - 10, агар - 20.
Засев колб проводят 1 мл суспензии спор, смытых с агара водой, содержащей 0,1% Твина-80. Культивирование штамма осуществляют в аэробных условиях в качалочных колбах Эрленмейера объемом 750 мл, содержащих 100 мл жидкой водной среды следующего состава, в г/л: МКЦ - 20, глюкоза - 20, кукурузный экстракт - 60, (NH4)2SO4 - 6, KH2PO4 - 2, MgSO4×7H20 - 0,6; рН 6,0. Колбы инкубируют на качалке при 28°С и 200 об/мин в течение 120 часов.
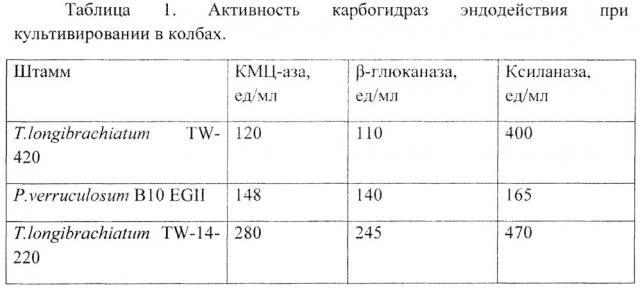
Активности по КМЦ, β-глюкану и ксилану в КЖ составляют 280, 245 и 470 ед/мл соответственно (Табл. 1).
При культивировании исходного штамма Т. longibrachiatum TW-420 (F-3880D) в качалочных колбах в указанных выше условиях активности КМЦ-азная, β-глюканазная и ксиланазная составляют 120, 110 и 400 ед/мл соответственно (Табл. 1).
Культивирование P. verruculosum В10 EGII в колбах в оптимизированных условиях позволяет получить активности по КМЦ, β-глюкану и ксилану - 148, 140 и 165 ед/мл соответственно (Табл. 1).
Пример 2. Проводят процесс культивирования штамма Т. longibrachiatum TW-14-220 в ферментере типа АНКУМ 2М с рабочим объемом 6,0 л. Аэрация составляет 1 объем воздуха на 1 объем ферментационной среды в 1 минуту. Ферментер инокулируют 500 мл инокулята (вегетативного мицелия).
Получение инокулята осуществляют следующим образом. Суспензией конидий, полученных на СМ-агаре (по примеру 1) засевают качалочные колбы, содержащие питательную среду (ПС-1) следующего состава (в г/л): глюкоза - 20, кукурузный экстракт - 45, KH2 PO4 - 15, (NH4)SO4 - 4,6, MgSO4×7H2O - 0,3, CaCl2 - 0,3, MnSO4 - 0,002, FeSO4 - 0,002, ZnSO4 - 0,002, pH (исходный) 4,5-5,0. Культивирование проводят в аэробных условиях в качалочных колбах Эрленмейера объемом 750 мл, содержащих 100 мл жидкой среды. Колбы культивируют на качалке при 28-29°С и 220 об/мин в течение 2-х суток.
Первую фазу культивирования ферментере (на этой фазе гриб главным образом растет и накапливает биомассу) осуществляют в течение 24 ч при рН 4,2 и 28°С на жидкой питательной среде (ПС-2) следующего состава (в г/л): глюкоза - 20, кукурузный экстракт - 120, гидролизат крахмала (600 мл на 6 л среды, начальная концентрация ВС в среде 4,9-5,5%), (NH4)2SO4 - 6, KH2PO4 - 3, MgSO4×7H2O - 0,6. Через 24 часа начинают вторую фазу культивирования (фаза биосинтеза внеклеточных ферментов, на протяжении которой происходит увеличение активности ферментов в КЖ). На второй фазе ферментации в ферментер непрерывно добавляют смесь лактоза: глюкоза: ксилоза в соотношении 1:1:1 так, чтобы общая концентрация ВС в среде не превышала уровня 1-2 г/л. В процессе ферментации через 60 ч после ее начала в среду вносят минеральные соли: в количестве, которое добавляли в начале процесса культивирования. Температуру во второй фазе поддерживают 32°С, а рН - 6,0. Ферментация заканчивается через 120 часов.
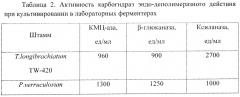
Активности по КМЦ, β-глюкану и ксилану в КЖ на 120 часов ферментации составляют 1100, 1000 и 3200 ед/мл соответственно (Табл. 2).
При культивировании исходного штамма Т. longibrachiatum TW-420 (F-3880D) активности КМЦ-азы, β-глюканазы и ксиланазы в КЖ на 120 часов культивирования в аналогичных условиях составляют 960, 900 и 2700 ед/мл соответственно (Табл. 2).
Активности КМЦазы, β-глюканазы и ксиланазы штамма Р. verruculosum В10 EGII при культивировании в лабораторных ферментерах составляют 1300 1250 и 1100 ед/мл соответственно (Табл. 2).
Таким образом, новый мутантный штамм Т. longibrachiatum TW-14-220 демонстрирует увеличение ксиланазной активности на 20% по сравнению с исходным штаммом Т. longibrachiatum TW-420 и в 3,2 раза - по сравнению с рекомбинантным продуцентом P. verruculosum B10 EGII при высоком уровне активности эндоглюканазы. Активность эндоглюканазы по КМЦ нового штамма на 15% превышает активность прототипа и лишь на 18% ниже по сравнению с рекомбинантным штаммом, содержащим дополнительный ген ЭГII.
Пример 3. Проводят процесс культивирования штамма Т. longibrachiatum TW-14-220, а также штамма Т. longibrachiatum TW-420 в ферментерах типа АНКУМ 2М с рабочим объемом 6,0 л (по примеру 2). По окончании ферментации грибную биомассу удаляют путем центрифугирования (4000 об/мин в течение 20 мин на центрифуге Avanti JXN-26, «Beckman coulter», США) свободную от клеток КЖ концентрируют с помощью ультрафильтрации (с пределом отсечения 10 кДа), ультраконцентрат замораживают при температуре -70°С и сушат на лиофильной сушке Benchtop 2K ES («VirTis», США) с получением сухого ФП (который представляют собой желто-коричневый легко растворимый в водной среде порошок).
Общая (на 1 г сухого ФП) и удельная (на 1 мг белка) активности ФП приведены в Табл. 3. Из данных Табл. 3 следует, что общая и удельная активности эндоглюканаз, определенных по КМЦ, в ФП на основе мутантного штамма Т. longibrachiatum TW-14-220, увеличились в 1,9 и 1,7 раз соответственно по сравнению с ФП на основе прототипа (Т. longibrachiatum TW-420). Общая и удельная активности ксиланаз в ФП на основе мутантного штамма увеличились в 2 раза.
Определение компонентного состава сухих ФП проводят с помощью аналитического фракционирования с использованием системы высокоэффективной жидкостной хроматографии (FPLC). Для этого проводят анионообменную хроматографию ФП на колонке с носителем Source 15Q («Pharmacia», Швеция). Образец ФП, содержащий 10 мг белка, наносят в стартовом буфере Bis-Tris/HCl при рН 6.8; связавшиеся белки элюируют в градиенте концентрации NaCl от 0 до 0,4 М. Не связавшиеся с Source 15Q белки подвергают фракционированию с помощью гидрофобной хроматографии на колонке Source 15ISO («Pharmacia», Швеция). Образец наносят на колонку Source 15ISO при начальной концентрации сульфата аммония 1,4 М в 50 мМ Na-ацетатном буфере с рН 5,0, элюирование белков проводят в линейном ниспадающем от 1,4 до 0 М градиенте сульфата аммония. В полученных в ходе элюирования фракциях измеряют активность по отношению к КМЦ, бета-глюкану, ксилану, микрокристаллической целлюлозе, пНФ-глюкозиду, а также определяют концентрацию белка (по Лоури). Для анализа качественного и количественного состава хроматографических фракций, элюируемых с колонок, используют электрофорез в полиакриламидном геле в денатурирующих условиях (ДДС-ЭФ). С помощью полученных данных по ферментному составу, объему и содержанию белка каждой из фракций определяют компонентный состав ФП (табл. 4).
Из данных табл. 4 очевидно, что в ФП на основе нового мутантного штамма существенно увеличилась доля Ксиланазы 3 (в 2,5 раза) и примерно в 8 раз снизилось содержание ЦБГ1.
Таким образом, предлагаемый штамм T.longibrachiatum TW-14-220 обладает способностью продуцировать одновременно высокую эндоглюканазную, β-глюканазную и ксиланазную активности по отношению к целлобиогидролазной активности, что создает возможность получения ФП со сбалансированным комплексом ферментов для гидролиза НКП злаков.
Для достижения высокой продуктивности штамма не требуется применения сложных и дорогих питательных сред. Для культивирования могут использоваться питательные среды, традиционно применяемые в промышленных технологиях получения такого рода технических ФП.
ФП, получаемые на основе предлагаемого штамма, позволяют существенно увеличить эффективность их использования в различных областях биотехнологии и, особенно, в качестве кормовых добавок.
Список литературы
1. Li S,YangX,YangS, Zhu M, Wang X (2012) Technology Prospecting on Enzymes: Application, Marketing and Engineering. Computational and Structural Biotechnology Journal. 2 (3): e201209017. doi: http://dx.doi.org/l0.5936/csbj.201209017.
2. Sajith S, Priji P, Sreedevi S, Benjamin S (2016) An Overview on Fungal Cellulases with an Industrial Perspective. J Nutr Food Sci 6: 461. doi:10.4172/2155-9600.1000461.
3. Zeng, R.; Yin, X.-Y.; Ruan, T.; Hu, Q.; Hou, Y.-L.; Zuo, Z.-Y.; Huang, H.; Yang, Z.-H. A Novel Cellulase Produced by a Newly Isolated Trichoderma virens. Bioengineering 2016, 3, 13.
4. Bedford M.R. Enzymes in farm animal nutrition / M.R. Bedford, G.G. Partridge. – UK: CAB International, 2010. – 319 p.
5. Khattak F.M. Enzymes in poultry nutrition / F.M. Khattak, T.N. Pasha, Z. Hayat, A. Mahmud // J. Anim. Pl. Sci. – 2006. – V. 16(1-2). – P. 1-7.
6. Asmare B. Effect of common feed enzymes on nutrient utilization of monogastric animals / B. Asmare // IJBMBR. – 2014. – V. 5(4). P. 27-34.
7. Sajith S, Priji P, Sreedevi S, Benjamin S (2016) An Overview on Fungal Cellulases with an Industrial Perspective. J Nutr Food Sci 6: 461.
8. Sahin S., Ozmen İ., Biyik H. H. Purification and Characterization of Endo-[beta]-1, 4-Glucanase from Local Isolate Trichoderma Ouroviride //International Journal of Bioscience, Biochemistry and Bioinformatics. – 2013. – Т. 3. – №. 2. – С.129.
9. Sukumaran R. K., Singhania R. R., Pandey A. Microbial cellulases-production, applications and challenges. – 2005.
10. Haddad Momeni M. H. et al. Expression, crystal structure and cellulase activity of the thermostable cellobiohydrolase Cel7A from the fungus Humicola grisea var. thermoidea //Acta Crystallographica Section D: Biological Crystallography. – 2014. – Т. 70. – №. 9. – С.2356-2366.
11. Karboune S. et al. Properties of selected hemicellulases of a multi-enzymatic system from Penicillium funiculosum //Bioscience, biotechnology, and biochemistry. – 2009. – Т. 73. – №. 6. – С.1286-1292.
12. Van Dyk J. S., Pletschke B. I. A review of lignocellulose bioconversion using enzymatic hydrolysis and synergistic cooperation between enzymes-factors affecting enzymes, conversion and synergy //Biotechnology advances. – 2012. – Т. 30. – №. 6. – С.1458-1480.
13. Сх И. А. Великорецкая, А. С.Середа, Е. В. Костылева, Т.Н. Веселкина, Н.В. Цурикова, А.П. Синицын. Эффективность комплексного ферментного препарата Пенициллопепсин как добавки для кормов на основе зерновых культур. // Хранение и переработка сельхозсырья. - 2016. - №1. - С.27–31.
14. Shallom D., Shoham Y. Microbial hemicellulases //Current opinion in microbiology. – 2003. – Т. 6. – №. 3. – С.219-228.
15. Polizeli M. et al. Xylanases from fungi: properties and industrial applications //Applied microbiology and biotechnology. – 2005. – Т. 67. – №. 5. – С.577-591.
16. Imran M. et al. Cellulase production from species of fungi and bacteria from agricultural wastes and its utilization in industry: A review //Advances in Enzyme Research. – 2016. – Т. 4. – №. 02. – С.44.
17. Singh S., Bali V., Sharma L., Mangla J. Production of Fungal Amylases Using Cheap, Readily Available Agriresidues, for Potential Application in Textile Industry // BioMed Research International. 2014. V. 2014. P. 1-9. doi:10.1155/2014/215748.
18. Gusakov A. V. Alternatives to Trichoderma reesei in biofuel production //Trends in biotechnology. – 2011. – Т. 29. – №. 9. – С.419-425.
19. Gupta V. G. et al. (ed.). Biotechnology and biology of trichoderma. – Newnes, 2014.
20. Rahman Z. et al. Evaluation and characterization of Trichoderma reesei cellulase and xylanase promoters //Applied microbiology and biotechnology. – 2009. – Т. 82. – №. 5. – С.899-908.
21. Xiong H. et al. Production and characterization of Trichoderma reesei and Thermomyces lanuginosus xylanases. – Helsinki University of Technology, 2004.
22. Lynd L. R. et al. Microbial cellulose utilization: fundamentals and biotechnology //Microbiology and molecular biology reviews. – 2002. – Т. 66. – №. 3. – С.506-577.
23. López G., Estrada P. Effect of temperature on xylanase II from Trichoderma reesei QM 9414: a calorimetric, catalytic, and conformational study //Enzyme research. – 2014. – Т. 2014.
24. Herold S. et al. Xylanase gene transcription in Trichoderma reesei is triggered by different inducers representing different hemicellulosic pentose polymers //Eukaryotic cell. – 2013. – Т. 12. – №. 3. – С.390-398.
25. Марков А.В. Свойства ферментных комплексов, продуцируемых мутантными штаммами Trichoderma reesei, автореферат канд. дисс., 2003.
26. Zhang Y. H. P., Himmel M. E., Mielenz J. R. Outlook for cellulase improvement: screening and selection strategies //Biotechnology advances. – 2006. – Т. 24. – №. 5. – С.452-481.
27. Bernhard Seiboth, Christa Ivanova, Verena Seidl-Seiboth (2011). Trichoderma reesei: A Fungal Enzyme Producer for Cellulosic Biofuels, Biofuel Production-Recent Developments and Prospects, Dr. Marco Aurelio Dos Santos Bernardes (Ed.), InTech, DOI: 10.5772/16848.
28. WO 2011133111А1. Trichoderma viride strain for cellulolytic enzyme production. 2011.
29. Синицын А.П., Синицына О.А., Короткова О.Г. Ферментные новшества // Агробизнес.- 2016. - Т. 38, №4. - С.88–92.
30. Патент РФ 2532840. Штамм гриба Penicillium verruculosum B10EGII продуцент эндо-1,3/1,4-β-глюканазы, целлюлазы, β-глюкозидазы и ксиланазы и способ получения кормового комплексного ферментного препарата. 2014.
31. Немашкалов В.А. Биосинтез карбогидраз гриба Penicillium verruculosum при культивировании на различных целлюлозосодержащих субстратах. Автореферат канд. дисс., 2012.
32. Патент РФ 2303065. Штамм мицелиального гриба Trichoderma longibrachiatum – продуцент целлюлаз, бета-глюканаз и ксиланаз. 2007.
33. А.П.Синицын, А.В.Гусаков, В.М.Черноглазов. Биоконверсия лигноцеллюлозных материалов, Учебное пособие, М.: Изд-во МГУ, 1995, с.144-156.
1. Штамм мицелиального гриба Trichoderma longibrachiatum, депонированный в ВКМ под номером F-4642D, - продуцент комплекса ферментов эндоглюканаз, бета-глюканаз и ксиланаз, разрушающих некрахмальные полисахариды.
2. Способ получения кормового комплексного ферментного препарата с повышенным содержанием эндоглюканаз, бета-глюканаз и ксиланаз путем глубинного культивирования штамма Trichoderma longibrachiatum F-4642D по п. 1 на оптимизированной питательной среде в ферментерах с последующей фильтрацией, ультрафильтрацией и лиофилизацией культуральной жидкости.