Пиридинилпиразолохинолиновые соединения
Иллюстрации
Показать всеИзобретение относится к соединению, представленному формулой (I), или к его фармацевтически приемлемой соли, где R1 является группами, имеющими формулы, представленные ниже, и R2 является 3-метилтетрагидро-2H-пиран-4-ильной группой или 4-метоксициклогексильной группой. Заявленные соединения являются ингибиторами PDE9. Изобретение также относится к конкретным соединениям и фармацевтической композиции, содержащей соединение формулы (Ш), или его фармацевтически приемлемую соль. Кроме того, объектами изобретения являются средство для облегчения когнитивного нарушения при болезни Альцгеймера и способ облегчения указанного нарушения. 10 н. и 3 з.п. ф-лы, 1 ил., 3 табл., 4 пр.
R1: или или
Реферат
Область техники
[0001] Настоящее изобретение относится к пиридинилпиразолохинолиновым соединениям, обладающим ингибирующей активностью в отношении фосфодиэстеразы 9 (PDE9), и их фармацевтически приемлемым солям, и их фармацевтическим применениям.
Уровень техники
[0002] Известно, что циклический гуанозинмонофосфат (далее по тексту называемый cGMP), функционирующий в качестве вторичного мессенджера в клетках, играет важную роль в различных физиологических функциях, в том числе в протекании обучения и развитии памяти.
[0003] На постсинаптическом участке нервных цепей головного мозга монооксид азота (далее по тексту называемый NO), биосинтезируемый синтетазой монооксида азота, активирует гуанилатциклазу, которая является cGMP-синтазой. Активированная гуанилатциклаза биосинтезирует cGMP из гуанозинтрифосфата. cGMP активирует cGMP-зависимую протеинкиназу (далее по тексту называемую PKG), фосфорилирующую различные белки, участвующие в пластичности синапсов. Известно, что активация каскада NO/cGMP/PKG участвует в индукции пластичности синапсов (долговременная потенциация; далее по тексту называемая LTP) гиппокампа, который известен как нейронная основа для протекания обучения и развития памяти (например, см. непатентную литературу 1). Лекарственный препарат, активирующий передачу сигнала по каскаду, известен как улучшающий LTP гиппокампа и протекание обучения у животных, в то же время лекарственный препарат, ингибирующий каскад, известен как оказывающий противоположное действие (непатентная литература 2). Следовательно, исходя из этих фактов, ожидается, что повышение cGMP в головном мозге приведет к улучшению протекания обучения и развитию памяти.
[0004] cGMP метаболизируется до 5'-GMP без PKG-активирующего действия фосфодиэстеразой (далее по тексту называемой PDE). PDE, как известно, имеет 11 семейств, и известно, что PDE9 специфично метаболизирует cGMP и экспрессируется в головном мозге, селезенке, тонком кишечнике и т.п. (например, см. непатентную литературу 3). То есть, ожидается, что ингибирование PDE9 повысит cGMP в головном мозге. Согласно опубликованным данным, ингибитор PDE9 действительно усиливает LTP гиппокампа и улучшает протекание обучения и развитие памяти в тесте по распознанию нового объекта/тесте обучения пассивному избеганию или др. у животных (непатентная литература 4). С клинической точки зрения активность гуанилатциклазы уменьшается, и наблюдают возможность уменьшения уровня cGMP в верхней височной доле у пациентов с болезнью Альцгеймера (непатентная литература 5). Таким образом, есть вероятность, что PDE9 имеет множество тесных взаимосвязей с патологиями нейродегенеративных заболеваний и психиатрических заболеваний, в частности, с патологиями когнитивных дисфункций и др. при болезни Альцгеймера, таких как болезнь Александера, синдром Альперса, болезнь Альцгеймера, боковой амиотрофический склероз (ALS; известный как болезнь Лу Герига или поражение двигательных нейронов), атаксия-телеангиэктазия, болезнь Баттена (также известная как болезнь Шпильмайера-Фогта-Шегрена-Баттена), деменция Бинсвангера (подкорковая ангиосклеротическая энцефалопатия), биполярное расстройство, губчатая энцефалопатия крупного рогатого скота (BSE), болезнь Канавана, индуцированная химиотерапией деменция, синдром Коккейна, кортико-базальная дегенерация, болезнь Крейтцфельда-Якоба, депрессия, синдром Дауна, дегенерация лобно-височной доли (в том числе лобно-височная деменция, семантическая деменция и прогрессивная небеглая афазия), болезнь Герстманна-Штраусслера-Шейнкера, глаукома, болезнь (хорея) Хантингтона, связанная с ВИЧ деменция, гиперкинез, болезнь Кеннеди, синдром Корсакова (конфабуляторный амнестический синдром), болезнь Краббе, деменция с тельцами Леви, прогрессивная логопеническая афазия, болезнь Мачадо-Джозефа (спиноцеребеллярная атаксия 3 типа), рассеянный склероз, множественная атрофия (оливопонтоцеребеллярная атрофия), тяжелая миастения, болезнь Паркинсона, болезнь Пелицеуса-Мерцбахера, болезнь Пика, пресенильная деменция (легкое когнитивное нарушение), первичный боковой склероз, первичная прогрессивная афазия, вызванная облучением деменция, болезнь Рефсума (заболевание, вызванное накоплением фитановой кислоты), болезнь Сандхоффа, болезнь Шильдера, шизофрения, семантическая деменция, сенильная деменция, синдром Шая-Дрейджера, спиноцеребеллярная атаксия, спинальная мышечная атрофия, болезнь Стила-Ричардсона-Ольшевского (прогрессирующий супрануклеарный паралич), и сосудистый амилоидоз, и сосудистая деменция (деменция вследствие множественных инфарктов).
[0005] Недавно стало известно следующее соединение, которое обладает PDE9-ингибирующей активностью и предназначено для предупреждения или терапии болезни Альцгеймера (патентная литература 1).
[0006] Приведенное выше соединение представляет собой пиразолопиримидиновое производное, и при этом соединение имеет структуру, абсолютно отличную от пиразолохинолинового каркаса.
[0007] С другой стороны, в качестве соединения с пиразолохинолиновым каркасом известно следующее описанное в патентной литературе 2 соединение,
,
где кольцо A является бензольным кольцом или подобным; а R6 является прямой связью или подобным.
Тем не менее, кольцо B в вышеприведенном соединении означает бензольное кольцо или подобное. Хотя утверждают, что вышеупомянутое соединение обладает ингибирующей активностью в отношении PDE4 и его используют при различных типах воспалительных заболеваний, нет описания для предпосылок ингибирующей активности в отношении PDE9 и т.п.
[0008] В качестве соединений, обладающих PDE9-ингибирующей активностью, известны следующие описанные в патентной литературе 3 и патентной литературе 4 соединения.
[0009] Любое из вышеупомянутых соединений представляет собой хиноксалиновое производное и является соединением со структурой, абсолютно отличной от пиразолохинолинового каркаса.
[0010] В качестве соединения с пиразолохинолиновым каркасом и PDE9-ингибирующей активностью известно следующее описанное в патентной литературе 5 соединение,
,
где либо R1, либо R2 является группой, представленной формулой
.
[0011] Структура приведенного выше соединения ограничена по R1 и R2, таким образом, соединение является соединением со структурой, абсолютно отличной от соединения по настоящему изобретению.
Список противопоставленных материалов
Патентная литература
[0012] [Патентная литература 1] WO 2008/139293
[Патентная литература 2] WO 2007/032466
[Патентная литература 3] WO 2008/072779
[Патентная литература 4] WO 2010/101230
[Патентная литература 5] WO 2012/033144
Непатентная литература
[0013] [Непатентная литература 1] Domek-Lopacinska et al., "Cyclic GMP metabolism and its role in brain physiology", J Physiol Pharmacol., vol. 56, Suppl 2: pp. 15-34, 2005.
[Непатентная литература 2] Wang X., "Cyclic GMP-dependent protein kinase and cellular signaling in the nervous system", J. Neurochem., vol. 68, pp. 443-456, 1997.
[Непатентная литература 3] Fisher et al., "Isolation and characterization of PDE9A, a novel human cGMP-specific phosphodiesterase", J. Biol. Chem., vol. 273: pp. 15559-15564, 1998.
[Непатентная литература 4] van der Staay et al., "The novel selective PDE9 inhibitor BAY 73-6691 improves learning and memory in rodents", Neuropharmacology, vol. 55: pp. 908-918, 2008.
[Непатентная литература 5] Bonkale et al., "Reduced nitric oxide responsive soluble guanylyl cyclase activity in the superior temporal cortex of patients with Alzheimer's disease", Neurosci. Lett., vol 187, pp. 5-8, 1995.
Краткое описание изобретения
Техническая проблема
[0014] Целью настоящего изобретения является получение нового соединения, или его фармацевтически приемлемой соли, которое обладает PDE9-ингибирующим действием, и содержащей его фармацевтической композиции.
Решение проблемы
[0015] В результате всесторонних исследований для решения вышеупомянутых задач было обнаружено новое пиридинилпиразолохинолиновое соединение или его фармацевтически приемлемая соль, обладающая PDE9-ингибирующим действием.
[0016] То есть, в настоящем изобретении изложены следующие <1>-<14>.
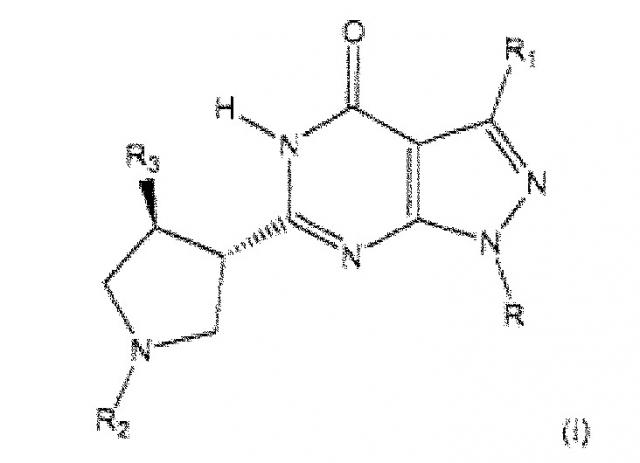
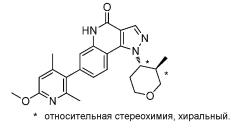
<1> Соединение, представленное формулой (I), или его фармацевтически приемлемая соль,
,
где R1 является группой, представленной формулой
,
группой, представленной формулой
,
или группой, представленной формулой
,
и R2 является 3-метилтетрагидро-2H-пиран-4-ильной группой или 4-метоксициклогексильной группой.
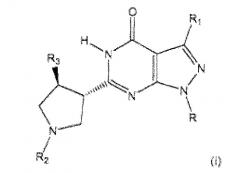
<2> Соединение или его фармацевтически приемлемая соль по <1>, где соединение представлено формулой (II)
,
где R3 является группой, представленной формулой
,
или группой, представленной формулой
.
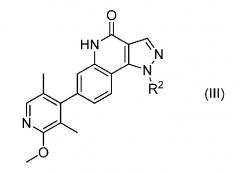
<3> Соединение или его фармацевтически приемлемая соль по <1>, где соединение представлено формулой (III)
,
где R2 является 3-метилтетрагидро-2H-пиран-4-ильной группой или 4-метоксициклогексильной группой.
<4> (-)-7-(6-Метокси-2,4-диметилпиридин-3-ил)-1-((3R*,4R*)-3-метилтетрагидро-2H-пиран-4-ил)-1H-пиразоло[4,3-c]хинолин-4(5H)-он((-)-цис) или его фармацевтически приемлемая соль:
<5> (-)-7-(6-Метокси-2,4-диметилпиридин-3-ил)-1-((3R*,4S*)-3-метилтетрагидро-2H-пиран-4-ил)-1H-пиразоло[4,3-c]хинолин-4(5H)-он ((-)-транс) или его фармацевтически приемлемая соль:
<6> (-)-7-(2-Метокси-4,6-диметилпиридин-3-ил)-1-((3R*,4S*)-3-метилтетрагидро-2H-пиран-4-ил)-1H-пиразоло[4,3-c]хинолин-4(5H)-он ((-)-транс) или его фармацевтически приемлемая соль:
<7> (-)-7-(2-Метокси-3,5-диметилпиридин-4-ил)-1-((3R*,4R*)-3-метилтетрагидро-2H-пиран-4-ил)-1H-пиразоло[4,3-c]хинолин-4(5H)-он ((-)-цис) или его фармацевтически приемлемая соль:
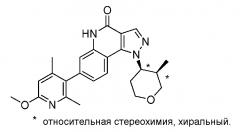
<8> 7-(2-Метокси-3,5-диметилпиридин-4-ил)-1-(транс-4-метоксициклогексил)-1H-пиразоло[4,3-c]хинолин-4(5H)-он или его фармацевтически приемлемая соль:
.
<9> Фармацевтическая композиция, содержащая соединение или фармацевтически приемлемую соль по <1> в качестве активного ингредиента.
<10> Фармацевтическая композиция по <9>, которая является ингибитором PDE9.
<11> Фармацевтическая композиция по <9> для повышения концентрации внутримозгового cGMP.
<12> Средство для облегчения когнитивного нарушения при болезни Альцгеймера, содержащее соединение или его фармацевтически приемлемую соль по <1>.
<13> Способ облегчения когнитивного нарушения при болезни Альцгеймера, включающий введение пациенту соединения или его фармацевтически приемлемой соли по <1>.
<14> Соединение или его фармацевтически приемлемая соль по <1> для применения для облегчения когнитивного нарушения при болезни Альцгеймера.
Полезные эффекты изобретения
[0017] Пиридинилпиразолохинолиновые соединения (далее про тексту называемые соединение (I)), представленные формулой (I), или их фармацевтически приемлемая соль по настоящему изобретению обладают PDE9-ингибирующим действием, как показано в данных по активности в описанном далее примере фармакологического теста. Соединение (I) по настоящему изобретению в основном характеризуется значением IC50, составляющим 1000 нM или ниже, в качестве PDE9-ингибирующего действия, и предпочтительным является соединение, характеризующееся значением IC50, составляющим 100 нM или ниже.
[0018] Соединение (I) по настоящему изобретению обладает PDE9-ингибирующим действием, поэтому ожидают повышение концентрации внутримозгового cGMP. PDE9-ингибирующее действие и повышение cGMP приводит к улучшению протекания обучения и развития памяти, и соединение (I) характеризуется возможным применением в качестве терапевтического средства от когнитивных дисфункций и подобного при болезни Альцгеймера.
Описание вариантов осуществления
[0019] Далее будет подробно описано содержание настоящего изобретения.
[0020] По всему настоящему описанию структурные формулы соединений для удобства будут демонстрировать только один конкретный изомер, но настоящее изобретение включает все изомеры, такие как геометрические изомеры, оптические изомеры, стереоизомеры и таутомеры, предполагаемые структурами соединения, а также смеси их изомеров, и, таким образом, соединения могут являться изомерами и их смесями в любой необходимой пропорции, не ограничиваясь формулами, которые показаны для удобства. Таким образом, например, соединения по настоящему изобретению могут существовать в виде оптически активных форм или рацемических смесей, все из которых включены без ограничения согласно настоящему изобретению, и независимо от того, являются ли они рацемическими смесями или оптически активными формами, их можно применять в качестве смесей с оптически активными формами в любой необходимой пропорции. Тем не менее, будет понятно, что некоторые изомеры, или рацемические смеси, или другие смеси изомеров могут проявлять большую активность, чем другие.
[0021] Также могут существовать полиморфные кристаллы, и можно использовать любую кристаллическую форму или их смесь без каких-либо ограничений, а также аморфные формы, и соединения по настоящему изобретению также включают как ангидрат, так и сольват (особенно, гидрат).
[0022] Также в настоящее изобретение включены соединения формулы (I), меченные изотопами. Меченное изотопом соединение является таким же, как и соединение (I), за исключением того, что один или несколько атомов заменены атомами с атомными массами или массовыми числами, отличными от обычно встречаемых в природе. Изотопы, которые можно включить в соединение по настоящему изобретению, являются изотопами, например, водорода, углерода, азота, кислорода, фтора, фосфора, серы, йода и хлора, и включают 2H, 3H, 11C, 14C, 15N, 18O, 18F, 32P, 35S, 123I и 125I.
[0023] Вышеупомянутые меченные изотопом соединения, например, соединения, в которых включены такие радиоизотопы, как 3H и/или 14C, пригодны для анализа распределения в ткани лекарственных препаратов и/или субстратов. Полагают, что 3H и 14C пригодны для облегчения их получения и выявления. Изотопы 11C и 18F считаются пригодными для PET (позитронно-эмиссионной томографии); а изотопы 125I считаются пригодными для SPECT (однофотонной эмиссионной компьютерной томографии); и все они пригодны для визуализации головного мозга. Замена на более тяжелый изотоп, такой как 2H, обуславливает некоторые терапевтические преимущества, в том числе повышение периода полувыведения in-vivo или понижение необходимой дозы вследствие более высокой метаболической стабильности, и, следовательно, считается пригодной в определенной ситуации. Вышеупомянутые меченные изотопами соединения можно аналогично получить путем осуществления процедур, раскрытых в приведенных далее примерах с применением меченных изотопами реагентов, которые можно легко использовать вместо реагентов, которые не мечены изотопом.
[0024] Далее в данном документе будут описаны значения терминов, символов и т.п., описываемых в настоящем описании, и будет подробно описано настоящее изобретение.
[0025] Ниже будут объяснены определения и предпочтительные примеры R1 и R2 в соединении, представленном формулой (I).
R1 является группой, представленной формулой
,
группой, представленной формулой
,
или группой, представленной формулой
.
[0026] R2 является 3-метилтетрагидро-2H-пиран-4-ильной группой или 4-метоксициклогексильной группой.
[0027] "Фармацевтически приемлемая соль" в настоящем описании конкретно не ограничена при условии, что соль образована с помощью соединения по настоящему изобретению, и конкретные примеры включают соли неорганической кислоты, соли органической кислоты, соли неорганического основания, соли органического основания и соли кислых или основных аминокислот.
[0028] Если только "фармацевтически приемлемая соль" в настоящем описании является солью, образованной в подходящем соотношении, за исключением любого особым образом ограничивающего описания, то количество молекул кислоты на одну молекулу соединения в образованной соли, хотя особым образом не ограничено, предпочтительно составляет от приблизительно 0,1 до приблизительно 5 молекул, предпочтительнее от приблизительно 0,5 до приблизительно 2 молекул и еще предпочтительнее приблизительно 0,5, приблизительно 1 или приблизительно 2 молекулы на одну молекулу соединения.
[0029] Предпочтительные примеры солей неорганических кислот включают гидрохлориды, гидробромиды, сульфаты, нитраты и фосфаты, и предпочтительные примеры солей органических кислот включают ацетаты, сукцинаты, фумараты, малеаты, тартраты, цитраты, лактаты, стеараты, бензоаты, метансульфонаты, п-толуолсульфонаты и бензолсульфонаты.
[0030] Предпочтительные примеры солей неорганических кислот включают соли щелочных металлов, такие как соли натрия и соли калия, соли щелочноземельных металлов, такие как соли кальция и соли магния, соли алюминия и соли аммония, и предпочтительные примеры солей органических оснований включают соли диэтиламина, соли диэтаноламина, соли меглюмина и соли N,N'-дибензилэтилендиамина.
[0031] Предпочтительные примеры солей кислых аминокислот включают аспартаты и глутаматы, и предпочтительные примеры солей основных аминокислот включают соли аргинина, соли лизина и соли орнитина.
[0032] [Фармацевтический препарат]Соединение формулы (I) по настоящему изобретению или его фармацевтически приемлемую соль можно фармацевтически получить с помощью общеизвестного способа, и можно сделать лекарственную форму, например, пероральный препарат (таблетка, гранула, порошок, капсула, сироп и т.п.), инъекционный препарат (для внутривенного введения, для внутримышечного введения, для подкожного введения, для внутрибрюшинного введения и для других введений) и препарат для наружного применения (действующий через кожу препарат (мазь, пластырь и т.п.), глазные капли, капли в нос, суппозиторий и т.п.).
[0033] В случае получения перорального твердого препарата к соединению формулы (I) или его фармацевтически приемлемой соли, при необходимости, добавляют наполнитель, связующее, разрыхлитель, смазывающее вещество, краситель и т.п., и с помощью общеизвестных способов можно получить таблетку, гранулу, порошок и капсулу. При необходимости, таблетку, гранулу, порошок, капсулу и т.п. можно покрыть пленочной оболочкой.
Примеры наполнителя включают лактозу, кукурузный крахмал и кристаллическую целлюлозу; примеры связующего включают гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу; примеры разрыхлителя включают карбоксиметилцеллюлозу кальция и кроскармеллозу натрия; примеры смазывающего вещества включают стеарат магния и стеарат кальция; примеры красителя включают оксид титана; и примеры пленкообразователя включают гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, но эти добавки, разумеется, не ограничены данными примерами.
Каждый из этих твердых препаратов, таких как таблетки, капсулы, гранулы и порошки, обычно может содержать от 0,001 до 99,5% по весу, предпочтительно от 0,01 до 90% по весу и т.д., соединения формулы (I) или его фармацевтически приемлемой соли.
[0034] В случае получения инъекционного препарата (для внутривенного введения, для внутримышечного введения, для подкожного введения, для внутрибрюшинного введения или для других введений) к соединению формулы (I) или его фармацевтически приемлемой соли, при необходимости, добавляют регулятор pH, буферное средство, суспендирующее средство, солюбилизатор, антиоксидант, консервант (антисептик), изотоническое средство и т.п., и инъекционный препарат можно получать с помощью общеизвестного способа. Препараты можно лиофилизировать с получением лиофилизированных препаратов по типу растворяемых непосредственно перед приемом.
Примеры регулятора pH и буферного средства включают органические кислоты или неорганические кислоты или их соли; примеры суспендирующего средства включают метилцеллюлозу, полисорбат 80 и карбоксиметилцеллюлозу натрия; примеры солюбилизатора включают полисорбат 80 и полиоксиэтиленсорбитанмонолаурат; примеры антиоксиданта включают α-токоферол; примеры консерванта включают метилпараоксибензоат и этилпараоксибензоат; и примеры изотонического средства включают глюкозу, хлорид натрия и маннит, но эти добавки, разумеется, на ограничены данными примерами.
Каждый из этих инъекционных препаратов обычно может содержать от 0,000001 до 99,5% по весу, предпочтительно от 0,00001 до 90% по весу и т.д., соединения формулы (I) или его фармацевтически приемлемой соли.
[0035] В случае получения препарата для наружного применения сырьевой материал основы добавляют к соединению формулы (I) или его фармацевтически приемлемой соли и, при необходимости, добавляют, например, консервант, стабилизатор, регулятор pH, антиоксидант, краситель и т.п., и с помощью традиционных способов можно получить, например, действующий через кожу препарат (мазь, пластырь и др.), глазные капли, капли в нос, суппозиторий и др.
В качестве подлежащих применению сырьевых материалов основы можно использовать различные сырьевые материалы, которые обычно используют, например, для лекарственных препаратов, лечебно-профилактической косметики и косметических средств. Конкретные их примеры включают такие сырьевые материалы, как животные и растительные масла, минеральные масла, сложноэфирные масла, воска, эмульгаторы, высшие спирты, жирные кислоты, силиконовые масла, поверхностно-активные вещества, фосфолипиды, спирты, многоатомные спирты, водорастворимые полимеры, глинистые минералы и очищенную воду.
Каждый из этих препаратов для наружного применения обычно может содержать от 0,000001 до 99,5% по весу, предпочтительно от 0,00001 до 90% по весу и т.п., соединения формулы (I) или его фармацевтически приемлемой соли.
[0036]Из соединения по настоящему изобретению можно получить химический зонд для захвата целевого белка для физиологически активного низкомолекулярного соединения. То есть, соединение по настоящему изобретению можно преобразовать в зонд для аффинной хроматографии, фотоаффинный зонд и т.п. путем введения группы-метки, линкера или т.п. во фрагмент, не относящийся к структурному фрагменту, необходимому для проявления активности соединения, с помощью методики, описанной в J. Mass Spectrum. Soc. Jpn., Vol. 51, No. 5, 2003, p. 492-498, WO2007/139149 и т.д.
[0037] Примеры группы-метки, линкера или т.п., используемых в химическом зонде, включают группы, показанные в группе, состоящей из следующих (1)-(5):
(1) группы-метки для белков, такие как фотоаффинные группы-метки (например, бензоильная группа, бензофеноновая группа, азидогруппа, карбонильная азидогруппа, диазиридиновая группа, еноновая группа, диазогруппа и нитрогруппа) и хемоаффинные группы (например, кетонные группы, в которых атом альфа-углерода заменен атомом галогена, карбамоильная группа, сложноэфирная группа, алкилтиогруппа, акцептор Михаэля из α,β-ненасыщенного кетона, сложного эфира и др. и оксирановая группа);
(2) расщепляемые линкеры, такие как -S-S-, -O-Si-O-, моносахариды (глюкозная группа, галактозная группа и др.), и дисахариды (лактоза и др.), и олигопептидные линкеры, расщепляемые посредством ферментативной реакции;
(3) группы с меткой для флуоресцентной in situ гибридизации, такие как биотин и 3-(4,4-дифтор-5,7-диметил-4H-3a,4a-диаза-4-бора-s-индацен-3-ил)пропионильная группа;
(4) меченные радиоактивным изотопом группы 125I, 32P, 3H, 14C или т.п.; флуоресцентные группы-метки, такие как флуоресцеин, родамин, дансил, умбеллиферон, 7-нитрофуразанил и 3-(4,4-дифтор-5,7-диметил-4H-3a,4a-диаза-4-бора-s-индецен-3-ил)пропионильная группа; хемилюминесцентные группы, такие как люциферин и люминол; и маркеры, способные обнаруживать ионы тяжелых металлов, такие как ионы металлов-лантаноидов и ионы радия; и
(5) группы для прикрепления к твердым носителям, таким как стеклянные шарики, стеклянные пластины, титровальные микропланшеты, агарозные гранулы, агарозные слои, полистирольные гранулы, полистирольные слои, полиамидные гранулы и полиамидные слои.
Зонды, полученные путем введения групп-меток, выбранных из группы, состоящей из вышеприведенных (1)-(5) и т.д., в соединение по настоящему изобретению согласно способам, описанным в вышеупомянутых документах и т.п., можно применять в качестве химических зондов для выявления меченых белков, что является применимым для поиска мишеней для разработки новых лекарственных средств.
Примеры
[0038] Соединение (I) по настоящему изобретению можно получить, например, с помощью способов, описанных в следующих примерах, и эффекты соединения можно подтверждать с помощью способов, описанных в следующих примерах тестов. Однако эти способы являются лишь иллюстративными, и настоящее изобретение в любом случае не ограничено следующими конкретными примерами, и можно осуществить изменения и модификации, не выходя за объем настоящего изобретения.
[0039] Следует отметить, что соединения, названия которых приведены в литературных источниках и т.п., получали согласно приведенным в литературном источнике сведениям и т.п.
[0040] Сокращения, используемые в настоящем описании, хорошо известны специалистам в данной области техники. В настоящем описании будут использованы следующие сокращения.
CDI: 1,1'-карбонилдиимидазол;
DCM: дихлорметан;
DIPEA: N,N-диизопропилэтиламин;
DMF: N,N-диметилформамид;
DMF-DMA: N,N-диметилформамида диметилацеталь;
DMSO: диметилсульфоксид;
DTT: дитиотреитол;
EDC: 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид;
EDTA: этилендиаминтетрауксусная кислота;
EGTA: гликолевый эфир диаминтетрауксусной кислоты;
HOBT: 1-гидроксибензотриазол;
KTB: трет-бутоксид калия;
MTBE: трет-бутилметиловый эфир;
н-: нормальный;
п-: пара.
Комплекс Pd(dppf)Cl2 DCM: комплекс [1,1’-бис(дифенилфосфин)ферроцен]дихлорпалладия(II) DCM
Pd(PPh3)4: тетракис(трифенилфосфин)палладий(0),
трет-: третичный;
TEA: триэтиламин;
TFA: трифторуксусная кислота;
THF: тетрагидрофуран;
Tris: трисгидроксиметиламинометан.
1H-ЯМР: спектрометрия на основе протонного ядерного магнитного резонанса
LC-MS: жидкостная хроматография-масс-спектрометрия
[0041] "Комнатная температура" в следующих примерах и примерах получения обычно означает от приблизительно 10°C до приблизительно 35°C. % означает весовой процент, если не указано иное.
[0042] Химический сдвиг в спектре протонного ядерного магнитного резонанса регистрируют в δ-единицах (ppm) относительно тетраметилсилана; а постоянную взаимодействия регистрируют в герцах (Гц). Сокращения паттернов расщепления являются следующими: s: синглет, d: дуплет, t: триплет, q: квартет, m: мультиплет, brs: широкий синглет и brd: широкий дуплет.
[0043] Для разделения оптических изомеров соединения использовали Parallex FlexTM, изготовленный Biotage (колонка: одна из CHIRALPAK R AD-H, IA, IB и IC, изготовленной Daicel Corp., и CHIRALCELR OD-H и OJ-H, изготовленной Daicel Corp.; размер колонки 2 см Ф × 25 см). Вращение плоскости поляризации (+/-) измеряли с помощью хирального детектора OR-2090 (Hg-Xe лампа, 150 Вт), изготовленного JASCO.
Что касается хроматографии, в случае, где приведено описание колоночной хроматографии на силикагеле, использовали Parallel Prep, изготовленный Yamazen Corp., (колонка: колонка Hi-FlashR (силикагель), изготовленная Yamazen Corp., размер: один из S (16×60 мм),M (20×75 мм), L (26×100 мм), 2L (26×150 мм) и 3L (46×130 мм)) или силикагель сферической формы для хроматографии PSQ60B R, изготовленный Fuji Silysia Chemical Ltd., силикагель для хроматографии BW-300R, изготовленный Fuji Silysia Chemical Ltd., WakogelR C-200, изготовленный Wako Pure Chemical Industries, Ltd., или силикагель 60R (70-230 меш), изготовленный Merck Ltd. Japan. В случае, где приведено описание колоночной хроматографии на NH-силикагеле, использовали Parallel Prep, изготовленный Yamazen Corp., (колонка: колонка Hi-FlashR(амино), изготовленная Yamazen Corp., размер: один из S (16×60 мм),M (20×75 мм), L (26×100 мм), 2L (26×150 мм) и 3L (46×130 мм)) или NH-силикагель (200-350 меш), изготовленный Fuji Silysia Chemical Ltd.
[0044] (±)- означает рацемическую смесь, а (+)- и (-)- означают (+) тип и (-) тип энантиомера, соответственно.
[0045] Названия следующих соединений использовали, как указано в “E-notebook” версии 12 (Perkin Elmer), за исключением традиционно используемых реагентов.
[0046] Пример получения 1
Синтез 3-бром-6-метокси-2,4-диметилпиридина
[0047] (1) Синтез 5-бром-4,6-диметилпиридин-2-ола
2-Амино-5-бром-4,6-диметилпиридин (15 г) растворяли в смешанном растворе серной кислоты (14,2 мл) и воды (212 мл). К раствору добавляли раствор нитрита натрия (6,18 г) в воде (31 мл) при 0°C. Реакционную смесь перемешивали в течение 1 ч при комнатной температуре и экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния и отфильтровывали осушитель. Фильтрат концентрировали при пониженном давлении, к остатку добавляли MTBE, и осажденное твердое вещество оставляли и затем отфильтровывали. Полученное твердое вещество промывали с помощью MTBE с получением титульного соединения (13,7 г).
ESI-MS масса/заряд 204 [M+H]+
[0048] (2) Синтез 3-бром-6-метокси-2,4-диметилпиридина
Смесь 5-бром-4,6-диметилпиридин-2-ола (7 г), метилйодида (21,6 мл) и карбоната серебра (19,1 г) в хлороформе (140 мл) перемешивали при комнатной температуре в течение 36 часов. Реакционную смесь подавали на подушку силикагеля и элюировали смешанным растворителем (этилацетат:н-гептан=2:8). Полученную фракцию концентрировали при пониженном давлении с получением титульного соединения (6,98 г).
1H-ЯМР (400 МГц, CDCl3) δ (ppm): 2,32-2,35 (м, 3H), 2,56-2,58 (м, 3H), 3,88 (с, 3H), 6,43-6,48 (м, 1H).
ESI-MS масса/заряд 216 [M+H]+
[0049] Пример получения 2
Синтез 3-бром-2-метокси-4,6-диметилпиридина
[0050] (1) Синтез 3-бром-2-хлор-4,6-диметилпиридина
2-Хлор-4,6-диметилпиридин-3-амин (2,85 г) растворяли в бромистоводородной кислоте (15 мл, 48% водный раствор), и охлаждали до 0°C. Затем к раствору медленно по каплям добавляли раствор нитрита натрия (1,51 г) в воде (2 мл) и смесь перемешивали при 0°C в течение 15 мин. К этому раствору по каплям добавляли суспензию бромида меди(I) (4,18 г) в бромистоводородной кислоте (5 мл, 48% водный раствор), и после перемешивания при 0°C в течение 10 минут его дополнительно перемешивали при 60°C в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры и затем экстрагировали этилацетатом. Органический слой подавали непосредственно на подушку NH-силикагеля и элюировали этилацетатом. Полученную фракцию концентрировали при пониженном давлении и остаток очищали при помощи колоночной хроматографии на NH-силикагеле (этилацетат/н-гептан, 0%-30%) с получением титульного соединения (2,97 г).
ESI-MS масса/заряд 220 [M+H]+
[0051] (2) Синтез 3-бром-2-метокси-4,6-диметилпиридина
Смесь 3-бром-2-хлор-4,6-диметилпиридина (2,97 г), 28% метанольного раствора метоксида натрия (11,0 мл) и DMF (30 мл) перемешивали при 80°C в течение 36 часов. К реакционной смеси добавляли воду и экстрагировали диэтиловым эфиром. Органический слой концентрировали при пониженном давлении и остаток очищали при помощи колоночной хроматографии на силикагеле (этилацетат/н-гептан, от 0 до 10%) с получением титульного соединения (2,33 г).
1H-ЯМР (400 МГц, CDCl3) δ (ppm): 2,33-2,34 (м, 3H), 2,36-2,38 (м, 3H), 3,98 (с, 3H), 6,61-6,64 (м, 1H).
ESI-MS масса/заряд 216 [M+H]+
[0052] Пример получения 3
Синтез (2-метокси-3,5-диметилпиридин-4-ил)бороновой кислоты
[0053] (1) Синтез 2-фтор-3-йод-5-метилпиридина
2,69M гексановый раствор н-бутиллития (224 мл) добавляли по каплям к смеси диизопропиламина (92 мл) и THF (1,2 л) при -18°C в атмосфере азота. После завершения добавления по каплям смесь перемешивали, одновременно повышая температуру до -5°C за период времени 20 минут. Реакционную смесь охлаждали до -73°C и затем к ней по каплям добавляли раствор 2-фтор-5-метилпиридина (61 г) в THF (240 мл). Реакционную смесь перемешивали при -75°C в течение 3,5 ч. К реакционной смеси по каплям добавляли раствор йода (139 г) в THF (24 мл). Реакционную смесь перемешивали при -75°C в течение 1 ч и 55 мин. По завершении реакции к реакционной смеси добавляли воду (220 мл) при такой же температуре. Смесь перемешивали в течение 5 мин при такой же температуре. Реакционную смесь нагревали до комнатной температуры и затем добавляли воду (1,2 л). К смеси добавляли водный раствор (300 мл) пентагидрата тиосульфата натрия (136 г) и воду (300 мл) и полученную смесь перемешивали в течение 10 мин. Смесь экстрагировали при помощи MTBE (1,2 л). Органический слой промывали солевым раствором (500 мл). Объединенный водный слой экстрагировали при помощи MTBE (1 л). Объединенный органический слой сушили над безводным сульфатом магния. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. После добавления к остатку н-гептана смесь охлаждали. Осажденное твердое вещество отфильтровывали и затем промывали н-гептаном. Фильтрат охлаждали и осажденное твердое вещество отфильтровывали. Данную процедуру повторяли 5 раз с получением титульного соединения (109,69 г).
1H-ЯМР (400 МГц, CDCl3) δ (ppm): 2,29-2,31 (м, 3H), 7,93-8,14 (м, 2H).
ESI-MS масса/заряд 238 [M+H]+
[0054] (2) Синтез 2-фтор-4-йод-3,5-диметилпиридина
2,69M гексановый раствор н-бутиллития (215 мл) добавляли по каплям к смеси диизопропиламина (88 мл) и THF (1,2 л) при -18°C в атмосфере азота. После завершения добавления по каплям смесь перемешивали, одновременно повышая температуру до -5°C за период времени 30 мин. Реакционную смесь охлаждали до -72°C и затем к ней добавляли раствор 2-фтор-3-йод-5-метилпиридина (109,69 г) в THF (240 мл). Реакционную смесь перемешивали при -74°C в течение 1,5 ч. К реакционной смеси по каплям добавляли раствор метилйодида (36 мл) в THF (160 мл). Реакционную смесь перемешивали при температуре от -70°C до -74°C в течение 2 ч. По завершении реакции к реакционной смеси добавляли воду (200 мл) при такой же температуре. Смесь перемешивали в течение 2 мин при такой же температуре. Реакционную смесь нагревали до комнатной температуры и затем добавляли воду (1,2 л). Полученную смесь перемешивали в течение 3 мин, к ней дополнительно добавляли воду (300 мл). Смесь экстрагировали при помощи MTBE (1,2 л). Органический слой промывали солевым раствором (500 мл). Объединенный водный слой экстрагировали при помощи MTBE (1 л). Объединенный органический слой сушили над безводным сульфатом магния. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. После добавления к остатку н-гептана (100 мл) смесь охлаждали. Осажденное твердое вещество отфильтровывали и затем промывали н-гептаном. Фильтрат охлаждали и осажденное твердое вещество отфильтровывали. Данную процедуру повторяли 2 раза с получением титульного соединения (86,9 г).
1H-ЯМР (400 МГц, CDCl3) δ (ppm): 2,39-2,40 (м, 6H), 7,80-7,82 (м, 1H).
ESI-MS масса/заряд 252 [M+H]+
[0055] (3) Синтез 4-йод-2-метокси-3,5-диметилпиридина
К раствору 2-фтор-4-йод-3,5-диметилпиридина (97,4 г) в THF (954 мл) добавляли 28% метанольный раствор метоксида натрия (185 мл) при 20°C. Смесь перемешивали при температуре от 55 до 65°C в течение 2 ч. После охлаждения реакционной смеси для разделения добавляли MTBE (1 л) и воду (1 л). Органический слой промывали солевым раствором. Объединенный водный слой экстрагировали при помощи MTBE (500 мл × 2). Объединенный органический слой сушили над безводным сульфатом магния. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. После добавления к остатку н-гептана (50 мл) смесь перемешивали при 0°C в течение 1 ч. Осажденное твердое веществ