Вакцинная композиция
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к иммунологии, и может быть использовано для получения вакцинной композиции для введения в ротовую полость человека или животного. Вакцинная композиция содержит по меньшей мере мере один антиген, выделенный из объекта с инфекционным заболеванием, и по меньшей мере один агент, выбранный из группы, состоящей из агониста toll-подобного рецептора 4 (TLR4). Где агонист toll-подобного рецептора 4 (TLR4) включает по меньшей мере один агент, выбранный из группы, состоящей из липополисахарида или его соли, где липополисахарид или его соль выделены из Escherichia coli, Salmonella, Pantoea, Acetobacterium, Zymomonas, Xanthomonas или Enterobacter. Использование агонистов TLR4 эффективно для индуцирования иммунного ответа слизистой в качестве адъюванта в вакцине при подъязычном введении, вызывая увеличенную продукцию IgG в сочетании инфекционным антигеном. 4 з.п. ф-лы, 13 ил., 7 табл., 18 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
[0001]
Настоящее изобретение относится к вводимой подъязычно вакцинной композиции, которая может быть использована в качестве профилактического или терапевтического агента для инфекционных заболеваний. Настоящее изобретение, конкретно, относится к вакцинной композиции, способной эффективно индуцировать системный иммунный ответ и иммунный ответ слизистой, когда по меньшей мере один агент, выбранный из группы, состоящей из агониста toll-подобного рецептора 4 (TLR4), агониста toll-подобного рецептора 2/6 (TLR2/6) и циклического динуклеотида, или их производных или солей, вводят подъязычно в качестве адъюванта вместе с антигеном, выделенным из объекта с инфекционным заболеванием.
УРОВЕНЬ ТЕХНИКИ
[0002]
В настоящее время коммерческие вакцинные препараты наиболее часто применяют в форме инъекций. Вакцина в форме инъекции индуцирует иммунный ответ (выработка антитела IgG) в крови (системный), но не индуцирует иммунного ответа слизистой (выработка антитела IgA) и, таким образом, предотвращает постинфекционный рост патогена, но имеет проблемы по части защиты против патогенной инфекции в слизистой оболочке.
В этих обстоятельствах вакцинация через путь слизистой в последние годы привлекала к себе внимание. Конкретно, наибольший резонанс имела разработка вакцины, содержащей вирус гриппа в качестве антигена для введения через слизистую (трансназальное введение).
[0003]
Вакцина, вводимая через слизистую, индуцирует системный иммунитет (выработка антитела IgG), а также индуцирует иммунитет слизистой (выработка антитела IgA). Антитело IgA не распознает определенный тип патогена заболевания, которое подвергается лечению, и каждый год адаптируется к эпидемической изменчивости патогенна, и, таким образом, предполагается, что является эффективным для предотвращения пандемии.
Одной из причин привлекательности трансназального введения является то, что введение антигена в слизистую желудка чувствительно к влиянию желудочного сока и протеаз, которое с трудом предотвратимо, тогда как введение антигена в слизистую носа свободно от этих влияний. Кроме того, на слизистой носовой полости имеется ткань распознавания антигенов, называемая NALT, которая благоприятна для иммунного ответа. Это другая причина имеющегося интереса к вакцине для трансназального введения.
Однако введение антигена в слизистую носовой полости, будучи высокоэффективным, обладает недостатками, которые наиболее вероятно вызывают критические побочные эффекты, такие как острая энцефалопатия или подобные; само по себе трансназальное введение является трудоемким и тяжелым для практического применения у пожилых, младенцев или в подобных случаях; и стабильный эффект не гарантирован благодаря физическим факторам, таким как носовая слизь или подобное.
[0004]
С другой стороны, было множество попыток индуцировать системный иммунитет и иммунитет слизистой посредством перорального введения антигена через слизистую желудочно-кишечного тракта (кишечник) и тому подобное после проглатывания. Задачей, поставленной здесь, является предотвращение разрушения антигена, вызванного желудочным соком или протеазами. Для решения этой задачи были разработаны методы нейтрализации желудочного сока с помощью большого содержания антацида, или для защиты антигена использовали методы покрытия, такие как микросферы или подобное.
Однако разработки были практически успешными только для вакцин, которые сами по себе стабильны в желудочном соке, такие как ослабленная полиовирусная вакцина и ослабленная ротавирусная вакцина.
[0005]
Альтернативно, противоаллергическая вакцина является примером препарата перорального введения для индуцирования иммунного ответа посредством доставки через слизистую ротовой полости (конкретно, слизистой подъязычной области) без проглатывания. Эта вакцина была обозначена как подъязычная иммунотерапия (SLIT), и она работает с помощью непрерывного подъязычного введения выделенного из растения экстракта, содержащего белок, который является аллергическим антигеном (аллергеном) для стимулирования иммунотолерантности против аллергена и уменьшения аллергической реакции. В последние годы SLIT широко применяется в Европе, и множество продуктов доступно сегодня на рынке.
На терапии с использованием такого препарата, который индуцирует иммунный ответ через путь слизистой ротовой полости, конкретно, через путь слизистой подъязычной области, сфокусировано внимание, так как она обеспечивает лучшее качество жизни пациента (QOL) и меньший риск анафилактического шока, меньше критических побочных эффектов, чем у традиционной терапии, для которой требуется подкожная инъекция аллергена (подкожная иммунотерапия).
Однако SLIT использовали только для препаратов для стимулирования конкретной иммунотолерантности, но она при этом не являлась терапией для активации иммунитета. Как правило, маловероятно, что введение в слизистую ротовой полости развивает иммунитет, а также предполагается трудной активация иммунитета, даже если развивается иммунотолерантность.
[0006]
Есть сообщения о примерах индуцирования иммунитета слизистой и системного иммунитета посредством пути через слизистую ротовой полости, конкретно, через путь слизистой подъязычной области, включающих следующее.
OVA-специфичный системный иммунный ответ (выработка IgG) и OVA-специфичный иммунный ответ слизистой (выработка IgA), как предполагается, подтверждаются, когда OVA, используемый в качестве антигена, и холерный токсин, используемый в качестве адъюванта, вводили подъязычно (см., например, Патентный документ 1). Однако предположительно, высоконейротоксичный холерный токсин использовали в качестве адъюванта, и вопросы безопасности оставались при этом открытыми.
[0007]
Использование OVA в качестве антигена и 3-O-дезацилированного монофосфориллипида A, агониста TLR4, в качестве адъюванта, и их подъязычное введение, как предполагается, является причиной OVA-специфичного системного иммунного ответа (выработка IgG), а также OVA-специфичного иммунного ответа слизистой (выработка IgA) (см., например, Патентный документ 2). В данном варианте агонист TLR4 вводили подъязычно в качестве адъюванта, однако не представлено ни одного примера, касающегося антигена, выделенного из объекта с инфекционным заболеванием, и адаптивность эффекта по отношению к типу антигена не очевидна. Кроме того, сравнительно большие дозы OVA, которые составили 80-160 мкг, и для 3-O-дезацилированного фосфориллипида 20-40 мкг, не являются практическими при рассмотрении вопросов безопасности.
[0008]
Вариант способа синтеза глюкопиранозиллипида, синтетического адъюванта (см., например, Патентный документ 3) также описывает индуцирование иммунного ответа слизистой с помощью введения через слизистую антигена в комбинации с адъювантом. Индуцирование сывороточного IgG и IgA в носовой жидкости также предполагается с помощью введения в носовую полость мыши MALP-2, лиганда TLR2/6 вместе с β-галактозидазой в качестве антигена (см., например, Патентный документ 4). Однако нет никаких примеров относительно антигена, выделенного из объекта с инфекционным заболеванием, или относительно его введения в слизистую ротовой полости, и, таким образом, адаптивность эффекта не очевидна. Использование циклического динуклеотида c-di-GMP или c-di-AMP в качестве адъюванта вместе с β-галактозидазой в качестве антигена и их внутриносовое введение мыши также рассматривалось для осуществления индуцирования сывороточного IgG (см., например, Патентный документ 5), однако в данном варианте не упоминается индуцирование IgA посредством трансназального введения, и нет никаких примеров относительно антигена, выделенного из объекта с инфекционным заболеванием, или относительно введения через слизистую ротовой полости, и, таким образом, адаптивность эффекта не очевидна.
СПИСОК ПРОЦИТИРОВАННОЙ ЛИТЕРАТУРЫ
Документы патентной литературы
[0009]
Патентный документ 1: заявка на патент США № 2008/0112974
Патентный документ 2: JP 2003-519669 T
Патентный документ 3: заявка на патент США № 2010/0310602
Патентный документ 4: заявка на патент США № 2005/0276813
Патентный документ 5: заявка на патент США № 2008/0286296
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Техническая задача
[0010]
При обстоятельствах, описанных выше, настоящее изобретение имеет целью предложение вакцинной композиции с подъязычным введением, которая может быть использована в качестве профилактического или терапевтического агента для инфекционных заболеваний и которая эффективно индуцирует системный иммунный ответ или иммунный ответ слизистой.
Решение задачи
[0011]
Авторы настоящего изобретения проводили интенсивные исследования для решения проблемы и обнаружили, что эффективно индуцировался системный иммунный ответ и иммунный ответ слизистой, когда по меньшей мере один агент, выбранный из группы, состоящей из агониста toll-подобного рецептора 4 (TLR4), агониста toll-подобного рецептора 2/6 (TLR2/6) и циклического динуклеотида или их производных или солей, вводится перорально, практически подъязычно, в качестве адъюванта вместе с антигеном, выделенным из объекта с инфекционным заболеванием, посредством чего осуществили настоящее изобретение.
[0012]
Более конкретно, настоящее изобретение относится к вакцинной композиции для введения в ротовую полость человека или животного, причем вакцинная композиция содержит по меньшей мере один антиген, выделенный из объекта с инфекционным заболеванием, и по меньшей мере один агент, выбранный из группы, состоящей из: агониста toll-подобного рецептора 4 (TLR4), агониста toll-подобного рецептора 2/6 (TLR2/6) и циклического динуклеотида или их производного или соли.
[0013]
В вакцинной композиции по настоящему изобретению антиген, выделенный из объекта с инфекционным заболеванием, предпочтительно представляет собой антиген, выделенный из вируса гриппа.
Антиген, выделенный из вируса гриппа, предпочтительно представляет собой белок гемагглютинина.
Антиген, выделенный из вируса гриппа, предпочтительно представляет собой инактивированный цельный вирус.
Агонист toll-подобного рецептора 4 (TLR4) предпочтительно включает по меньшей мере один агент, выбранный из группы, состоящей из: липополисахарида или его соли и монофосфориллипида или его соли.
Липополисахарид или его соль предпочтительно выделены из Escherichia coli, Salmonella, Pantoea, Acetobacterium, Zymomonas, Xanthomonas или Enterobacter; и монофосфориллипид или его соль предпочтительно выделены из Salmonella или представляют собой синтетический глюкопиранозиллипид.
Агонист toll-подобного рецептора 2/6 (TLR2/6) предпочтительно включает диацилированный липопептид или его производное или соль.
Диацилированный липопептид предпочтительно включает Pam2CSK4, MALP-2, FSL-1 или их производные или соли.
Циклический динуклеотид предпочтительно включает c-di-GMP, c-di-AMP или их производные или соли.
В вакцинной композиции по настоящему изобретению введение в ротовую полость предпочтительно представляет собой введение в слизистую подъязычной области.
Вакцинная композиция по настоящему изобретению предпочтительно индуцирует иммунный ответ слизистой и системный иммунный ответ, и иммунный ответ слизистой представляет собой выработку антиген-специфичных антител IgA, а системный иммунный ответ представляет собой выработку антиген-специфичных антител IgG, а также представляет собой развитие антиген-специфичного клеточно-опосредованного иммунитета.
Далее подробно описывается настоящее изобретение.
[0014]
Вакцинная композиция по настоящему изобретению содержит по меньшей мере один антиген, выделенный из объекта с инфекционным заболеванием.
Вышеописанный антиген, выделенный из объекта с инфекционным заболеванием, относится к любым веществам, на которые направленно воздействует иммунный ответ, вырабатываемый в тестируемом организме. Вышеописанный антиген, выделенный из объекта с инфекционным заболеванием, также может быть мишенью иммунного ответа (например, старение иммунокомпетентных клеток, выработка цитокинов, выработка антител и т.д.) при контакте с иммунокомпетентной клеткой.
[0015]
Антиген, выделенный из объекта с инфекционным заболеванием, используемый в настоящем изобретении, не ограничивается антигеном, который является инфекционным патогеном или который выделен из инфекционного патогена.
Заболевание, развивающееся из вышеописанного инфекционного патогена, ничем не ограничено и включает вирусные заболевания, вызванные инфекцией вирусами, такими как аденовирус, герпесвирус (например, HSV-I, HSV-II, CMV или VZV), поксивирусы (например, вариолы или вакцинии, или ортовирусы, такие как контагиозного моллюска, или подобные), пикорнавирусы (например, риновирусы или энтеровирусы), ортомиксовирусы (например, вирус гриппа), парамиксовирусы (например, вирус парагриппа, вирус свинки, вирус кори, респираторный синцитиальный вирус (RSV)), коронавирусы (например, SARS), паповирусы (например, вирус папилломы, который вызывает появление остроконечной кондиломы, обыкновенных бородавок или подошвенных бородавок), гепаднавирусы (например, вирус гепатита В), флавивирусы (например, вирус гепатита С или вирус денге) или ретровирусы (например, лентивирусы, такие как HIV, или подобные) и так далее; бактериальные заболевания, вызванные инфекцией бактерий, таких как Escherichia, Enterobacter, Salmonella, Staphylococcus, Shigella, Listeria, Aerobacter, Helicobacter, Klebsiella, Proteus, Pseudomonas, Streptococcus, Chlamydiaceae, Mycoplasma, Pneumococci, Neisseria, Clostridium, Bacillus, Corynebacterium, Mycobacterium, Campyrobacter, Vibrion, Serratia, Providencia, Chromobacterium, Brucella, Yersinia, Haemophilus или Bordetella и тому подобное; грибковые заболевания, такие как хламидиоз, кандидоз, аспергиллез, гистоплазмоз, криптококковый менингит, прежде всего, но не ограничиваясь этим; малярия, пневмония Pneumocystis carinii, лейшманиоз, криптоспоридиоз, токсоплазмоз, трипаносомная инфекция и тому подобное.
[0016]
В настоящем изобретении антиген, выделенный из объекта с инфекционным заболеванием, предпочтительно представляет собой антиген, выделенный из вируса гриппа.
Вирус гриппа, используемый в изобретении, относится к оболочечным РНК-вирусам, которые принадлежат к семейству Orthomyxoviridae и имеют диаметр частиц примерно 100 нм, и классифицируются по Типам А, В и С на основе антигенности их внутреннего белка. Вирус гриппа состоит из кора внутреннего нуклеокапсида, окруженного вирусной оболочкой, имеющей структуру липидного бислоя, или состоит из рибонуклеиновой кислоты (РНК), ассоциированной с нуклеопротеином, и из внешнего гликопротеина. Внутренний слой вышеописанной вирусной оболочки состоит в основном из матриксных белков, а внешний слой состоит в основном из липидных материалов, выделенных из клетки-хозяина. РНК вируса гриппа обладает сегментной структурой. Кроме того, всемирная пандемия гриппа вызывается вирусом гриппа Типа A. Вирус гриппа Типа A содержит 2 типа гликопротеинов оболочки, гемагглютинин (HA) и нейраминидазу (NA), и на основании типа антигена HA классифицируется на 16 подтипов, а NA на 9 подтипов.
В настоящем изобретении антигены, выделенные из вирусов гриппа Типа A и В, предпочтительно используют в качестве вышеописанного антигена, выделенного из объекта с инфекционным заболеванием. Подтипы вирусов гриппа Типа A и Типа В, описанные выше, не ограничиваются ими и могут представлять собой любой из подтипов, выделенных к настоящему времени, или подтипы, которые будут выделены в будущем.
[0017]
В настоящем изобретении антиген, выделенный из вирусов гриппа, не ограничивается тем, что он представляет собой по меньшей мере часть множества компонентов, составляющих вышеописанные вирусы гриппа. Примеры включают инактивированный цельный вирус, в котором очищенная вирусная частица инактивирована с помощью органического растворителя/ПАВ или с помощью других реагентов, или субъединицу вируса, полученную путем удаления примесей из инактивированного цельного вируса и путем очистки HA и/или NA и тому подобное. Субъединица HA или инактивированный цельный вирус являются предпочтительными в свете иммуногенности. Инактивированный цельный вирус предпочтительно инактивирован с использованием формалина или подобным образом. Субъединица HA (отделенная), которая содержит очень мало примесей и которой требуется адъювант, особенно эффективна.
Способ получения антигена вируса гриппа ничем не ограничен, и любой известный способ используется без ограничения. Примеры включают способ, в котором вирусным штаммом, выделенным из инфицированного гриппом животного или из пациента, имеющего грипп, инфицируют куриное яйцо или что-то подобное и инкубируют обычным образом, получая таким образом антиген из раствора очищенного неразведенного вируса. Альтернативно, также может использоваться антиген, выделенный из вируса, полученного в культуре клеток с использованием генно-инженерных методов.
[0018]
Вакцинная композиция по настоящему изобретению может сдержать антиген, выделенный из объекта с инфекционным заболеванием, в эффективном количестве, но предпочтительно содержащийся в количестве, например, в интервале от 0,001 до 1000 мкг к его суммарному количеству на одного индивидуума при введении. Более предпочтительно, количество составляет 0,01-100 мкг и, еще более предпочтительно, 0,1-50 мкг. Количество менее 0,001 мкг может привести в результате к недостаточному функционированию профилактического или терапевтического агента для инфекционных заболеваний, тогда как количество, превышающее 1000 мкг, может поднимать вопросы безопасности. Кроме того, термин "на индивидуума" относится к любым млекопитающим, причем человек является предпочтительным млекопитающим.
[0019]
Вакцинная композиция по настоящему изобретению содержит по меньшей мере один агент, выбранный из группы, состоящей из агониста toll-подобного рецептора 4 (TLR4), агониста toll-подобного рецептора 2/6 (TLR2/6) и циклического динуклеотида или их производных или солей.
Эти соединения служат в качестве адъювантов в вакцинной композиции по настоящему изобретению.
[0020]
Предпочтительные примеры агониста toll-подобного рецептора 4 (TLR4) включают липополисахарид или его соль. Кроме того, подразумевается, что термин "липополисахарид" включает дополнительно к липополисахариду его производные при условии, что они будут сохранять свойства липополисахарида. Термин "соль" относится к любой соли органической кислоты или к соли неорганической кислоты, причем фармацевтически приемлемая соль является предпочтительной.
Липополисахарид может представлять собой экстракт из клеточной стенки грам-отрицательных бактерий или его модифицированный продукт или синтетический продукт.
Примеры грам-отрицательных бактерий включают Escherichia sp., Shigella sp., Salmonella sp., Klebsiella sp., Proteus sp., Yersinia sp., V. cholerae sp., Vparahaemolyticus sp., Haemophilus sp., Pseudomonas sp., Legionella sp., Bordetella sp., Brucella sp., Francisella tularensis sp., Bacteroides sp., Neisseria sp., Chlamydia sp., Plesiomonas sp., Prophyromonas sp., Pantoea sp., Agrobacterium sp., Stenortophomonas sp., Enterobacter sp., Acetobacter sp., Xanthomonas sp., Zymomonas sp. и тому подобные.
Среди них предпочтительными грамотрицательными бактериями являются те, что имеют происхождение из Escherichia sp., Salmonella sp., Pantoea sp., Acetobacter sp., Zymomonas sp., Xanthomonas или Enterobacter sp. Эти бактерии используются во многих пищевых продуктах и в фитотерапии в течение многих лет, и безопасность в живом организме гарантирована. Конкретно, бактерии Pantoea в настоящее время используются в качестве продуктов здорового питания и гарантируют больше эффективности. Экстракты, выделенные из этих бактерий, или их модифицированные продукты также могут использоваться без дополнительной обработки.
[0021]
Когда липополисахарид используется в форме экстракта из клеточной стенки вышеописанных грамотрицательных бактерий или представляет собой очищенный липополисахарид, то, как правило, будет предполагаться безопасность в живом организме, и модифицированный продукт также может использоваться в целях их детоксикации. С другой стороны, Acetobacter sp. (Acetobacter aceti, Acetobacter xylinum, Acetobacter orientalis или им подобные), Zymomonas sp. (Zymomonas mobilis или им подобные), Xanthomonas sp. (Xanthomonas campestris или им подобные), Enterobacter sp. (Enterobacter cloacae или им подобные) и Pantoea sp. (Pantoea agglomerans или им подобные) используются во многих пищевых продуктах и в фитотерапии в течение многих лет, и безопасность в живом организме гарантирована. Экстракты, выделенные из этих бактерий, или очищенный липополисахарид также могут использоваться без дополнительной обработки.
[0022]
Агонист toll-подобного рецептора 4 (TLR4) может представлять собой производное липополисахарида, и его примеры включают липид A, где полисахаридный компонент удаляют из липополисахарида, или монофосфориллипид A, 3-дезацилированный MPL и так далее, и их соли.
Липид A, где удален полисахаридный компонент из липополисахарида, может представлять собой изолят, выделенный из вышеописанных грам-отрицательных бактерий, или может представлять собой продукт, синтезированный так, что он имеет такую же структуру, как у изолята, выделенного из вышеописанных грам-отрицательных бактерий.
Предпочтительно используемые примеры модифицированного продукта липида A представляют собой дефосфорилированный монофосфориллипид (MPL) или его соль. Кроме того, подразумевается, что термин "монофосфориллипид (MPL)" включает дополнительно к монофосфориллипиду (MPL) его производные при условии, что они будут сохранять свойства липополисахарида.
Конкретно, 3-дезацилированный монофосфориллипид (3D-MPL), который уже использовался в качестве адъюванта для медицинских целей, или не дезацилированный синтетический глюкопиранозиллипид рассматривается в описании Патентной заявки США № 2010/0310602 как предпочтительный в свете безопасности в живом организме.
Бактерии Salmonella, ранее используемые и безопасные, также предпочтительно использовались в качестве источника монофосфориллипида.
[0023]
Агонист toll-подобного рецептора 2/6 (TLR2/6) предпочтительно содержит диацилированный липопептид или его производное или соль.
Диацилированный липопептид предпочтительно содержит по меньшей мере один агент, выбранный из группы, состоящей из ранее использованных и, таким образом, безопасных Pam2CSK4, MALP-2 и FSL-1 или их производных или солей.
[0024]
Агонист toll-подобного рецептора 2/6 (TLR2/6) может представлять собой экстракт из клеточной мембраны микоплазмы или может представлять собой их модифицированный продукт или синтетический продукт.
Примеры микоплазмы включают Mycoplasma pneumoniae, Mycoplasma genitalium, Mycoplasma hominis, Ureaplasma, Mycoplasma salivarium, Mycoplasma fermentans, Mycoplasma gallisepticum, Mycoplasma hyopneumoniae, Mycoplasma laboratorium, Mycoplasma mycoides, Mycoplasma ovipneumoniae и тому подобное.
[0025]
Когда агонист toll-подобного рецептора 2/6 (TLR2/6) используется в форме экстракта из клеточной мембраны микоплазмы или представляет собой очищенный диацилированный липопептид, то, как правило, будет предполагаться безопасность в живом организме, и модифицированный продукт также может использоваться в целях их детоксикации.
Циклический динуклеотид может представлять собой циклический нуклеотид бис-дипурина или его производное или соль, и, в свете безопасности, предпочтительные примеры включают c-di-GMP, c-di-AMP или их производные или соли.
[0027]
Каждый из вышеописанных агентов в виде агониста TLR4, агониста TLR2/6 и c-di-GMP функционирует в достаточной степени, чтобы служить подъязычным адъювантом. Конкретно, агонист TLR4 доступен по низкой цене и используется у человека. Например, Pantoea LPS, один из вышеописанных агонистов TLR4, широко используется в продуктах здорового питания и полезен, так как легко адаптируется для человека.
[0028]
Вакцинная композиция по настоящему изобретению предпочтительно может содержать 3 вышеописанных адъюванта (TLR4, TLR2/6, циклический динуклеотид) в количестве, например, в интервале от 0,1 мкг до 100 мг по отношению к ее суммарному количеству. Количество менее 0,1 мкг может привести в результате к недостаточному функционированию профилактического или терапевтического агента для инфекционных заболеваний, тогда как количество, превышающее 100 мг, может поднимать вопросы безопасности. Более предпочтительно, нижняя граница содержания вышеописанных адъювантов составляет 0,3 мкг, и, более предпочтительно, верхняя граница содержания составляет 50 мг.
[0029]
Кроме того, в вакцинной композиции по настоящему изобретению могут использоваться другие стандартно используемые известные адъюванты, так что в комбинации с этими адъювантами композиция содержит по меньшей мере один адъювант, выбранный из группы, состоящей из трех вышеописанных адъювантов.
[0030]
Вакцинная композиция по настоящему изобретению может быть приготовлена путем добавления, если это необходимо, других компонентов (например, фосфатного буфера и так далее) к вышеописанному антигену, выделенному из объекта с инфекционным заболеванием, и адъювантов и путем их смешивания с использованием встряхивания с помощью известного метода.
Вакцинная композиция по настоящему изобретению также может быть составлена в виде раствора, твердого препарата или спрея, и где подходящим образом используется, если это целесообразно, вспомогательное вещество, связующий агент, отдушка, ароматизатор, подсластитель, краситель, консервант, антиоксидант, стабилизатор, поверхностно-активное вещество и/или подобные, дополнительно к материалам, описанным выше.
Эти добавки ничем не ограничиваются, и могут использоваться стандартно используемые известные материалы.
[0031]
Твердые препараты в рамках изобретения охватывают таблетки, таблетки с покрытием, дезинтегрирующие таблетки, порошки, гранулы, мелкодисперсные гранулы, перорально дезинтегрируемые таблетки, пероральные пластинки, желе и пленки и не ограничиваются тем, что это твердые препараты, вводимые в слизистую ротовой полости или подъязычной области.
[0032]
Вакцинную композицию по настоящему изобретению вводят в ротовую полость человека или животных (млекопитающих, птиц или подобных), но введение в ротовую полость предпочтительно представляет собой введение в слизистую подъязычной области. Как описано ранее, как правило, маловероятно, что при введении в слизистую ротовой полости развивается иммунитет, а также предполагается трудной активация иммунитета, даже если развивается иммунотолерантность. Однако в вакцинной композиции по настоящему изобретению используются определенные адъюванты, описанные выше, в комбинации по меньшей мере с одним антигеном, выделенным из объекта с инфекционным заболеванием, и, таким образом, вакцинная композиция эффективно индуцирует системный иммунный ответ даже при введении в слизистую ротовой полости.
Введение в слизистую подъязычной области также дает возможность композиции быть менее подверженной влиянию желудочного сока и протеаз в отличие от введения антигена в слизистую желудочно-кишечного тракта; и быть свободной от потенциальных критических побочных эффектов, таких как острая энцефалопатия или подобные; быть более легкой в применении у пожилых, младенцев и т.п.; и обеспечивать стабильные эффекты, не нарушаемые физическими факторами, такими как слизь носовой полости и тому подобное, в отличие от введения антигена посредством трансназального введения в слизистую носовой полости.
[0033]
Способ введения вакцинной композиции по настоящему изобретению является таким, как описано ранее. Доза определяется согласно виду животного, возрасту, полу, массе тела животного, которому осуществляется введение, и т.п. и, например, составляет, как правило, 0,1-50 мкг при однократном введении или при более чем двухкратном введении, когда в качестве антигена, выделенного из объекта с инфекционным заболеванием, используется HA. Вакцинную композицию, предпочтительно, вводят несколькими дозами, и в этом случае композицию предпочтительно вводят с интервалом 1-4 недели. Для использования инактивированного цельного вируса в качестве антигена, выделенного из объекта с инфекционным заболеванием, дозу определяют на основе HA. Кроме того, масса HA представляет собой значение, измеренное с помощью титра SRD или с помощью метода Лоури.
Полезные эффекты изобретения
[0034]
В вакцинной композиции по настоящему изобретению используются определенные адъюванты, описанные выше, в комбинации по меньшей мере с одним антигеном, выделенным из объекта с инфекционным заболеванием, и, таким образом, вакцинная композиция эффективно индуцирует системный иммунный ответ и иммунный ответ слизистой даже при введении в слизистую ротовой полости, конкретно в слизистую подъязычной области.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0035]
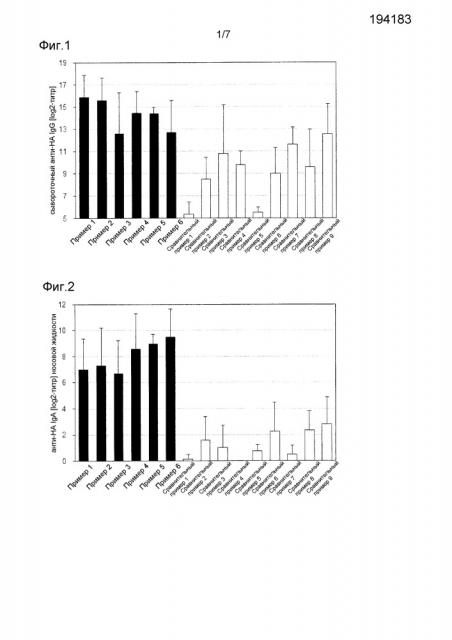
Фиг.1 представляет собой график, демонстрирующий результаты титра IgG, специфичного к HA вируса гриппа, в мышиной сыворотке в примерах 1-6 и в сравнительных примерах 1-9.
Фиг.2 представляет собой график, демонстрирующий результаты титра IgA, специфичного к HA вируса гриппа, в мышиной носовой жидкости в примерах 1-6 и в сравнительных примерах 1-9.
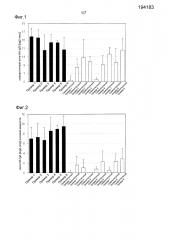
Фиг.3 представляет собой график, демонстрирующий результаты титра IgG, специфичного к HA вируса гриппа, в мышиной сыворотке в примерах 7-9 и в сравнительных примерах 10-12.
Фиг.4 представляет собой график, демонстрирующий результаты титра IgA, специфичного к HA вируса гриппа, в мышиной носовой жидкости в примерах 7-9 и в сравнительных примерах 10-12.
Фиг.5 представляет собой график, демонстрирующий коэффициент выживаемости мышей с вирусом гриппа в примере 10, в сравнительных примерах 13 и 14.
Фиг.6 представляет собой график, демонстрирующий результаты титра IgG, специфичного к HA вируса гриппа, в мышиной сыворотке в примере 11, в сравнительных примерах 1 и 14.
Фиг.7 представляет собой график, демонстрирующий результаты титра IgA, специфичного к HA вируса гриппа, в мышиной носовой жидкости в примере 11, в сравнительных примерах 1 и 14.
Фиг.8 представляет собой график, демонстрирующий результаты титра IgG, специфичного к HA вируса гриппа, в мышиной сыворотке в примерах 12 и 13, в сравнительных примерах 15, 16 и 1.
Фиг.9 представляет собой график, демонстрирующий результаты титра IgA, специфичного к HA вируса гриппа, в мышиной носовой жидкости в примерах 12 и 13, в сравнительных примерах 15, 16 и 1.
Фиг.10 представляет собой график, демонстрирующий результаты титра IgG, специфичного к HA вируса гриппа, в мышиной сыворотке в примерах 12, 14 и 15, в сравнительных примерах 16 и 1.
Фиг.11 представляет собой график, демонстрирующий результаты титра IgA, специфичного к HA вируса гриппа, в мышиной носовой жидкости в примерах 12, 14 и 15 и в сравнительных примерах 16 и 1.
Фиг.12 представляет собой график, демонстрирующий результаты титра IgG, специфичного к HA вируса гриппа, в мышиной сыворотке в примерах 16 и 17, в сравнительных примерах 17 и 18.
Фиг.13 представляет собой график, демонстрирующий результаты титра IgA, специфичного к HA вируса гриппа, в мышиной носовой жидкости в примерах 16 и 17, в сравнительных примерах 17 и 18.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0036]
Далее по тексту настоящее изобретение будет описано более подробно со ссылкой на следующие примеры, но не ограничиваясь ими.
[0037]
Пример 1
Фосфатный буфер (Nacalai Tesque, Inc.) добавляли к 76,3 мкл (236 мкг/мл) раствора, содержащего антиген HA вируса гриппа (A/IvPR8/34(H1N1), Учреждение по Исследованию Микробных Заболеваний Университета Осака (The Research Foundation for Microbial Diseases of Osaka University)), и 30 мкл (1 мг/мл) раствора, содержащего липополисахарид E. Coli (Nacalai Tesque, Inc.) для приготовления 120 мкл вакцинной композиции.
Пять мышей (в возрасте 7 недель, C57BL/6 самки мышей, Япония SLC, Inc.), приготовленных заранее, анестезировали (Somnopentyl, Kyoritsu Seiyaku Corporation) и вводили каждой мыши подъязычно 20 мкл приготовленной вакцинной композиции.
Через 1 неделю после введения мышей анестезировали снова и вводили каждой мыши подъязычно 20 мкл приготовленной вакцинной композиции.
Еще через неделю после второго введения собирали сыворотку и носовую жидкость мышей и измеряли с помощью тИФА титр IgG, специфичного к НА вируса гриппа, в сыворотке и титр IgA, специфичного к НА вируса гриппа, в носовой жидкости. Метод измерения описан подробно ниже.
[0038]
Примеры 2-6
Вакцинные композиции готовили так же, как в примере 1, за исключением того, что в примере 2 вместо липополисахарида E. coli использовали липополисахарид Pantoea (macrophi inc.), в примере 3 использовали глюкопиранозиллипид (MPLAs, InvivoGen), в примере 4 использовали FSL-1 (InvivoGen), в примере 5 использовали Pam2CSK4 (InvivoGen) и в примере 6 использовали c-di-GMP (циклический дигуанозинмонофосфат, Biolog Inc.). Тест проводили с помощью той же процедуры, что и в примере 1, в дозах, представленных в таблице 1.
[0039]
Сравнительный пример 1
Пять мышей (в возрасте 7 недель, C57BL/6 самки мышей, Япония SLC, Inc.), приготовленных заранее, анестезировали, готовили 120 мкл фосфатного буфера (Nacalai Tesque, Inc.) и 20 мкл оттуда вводили подъязычно каждой мыши. Тест проводили с помощью такой же последовательности процедуры, как в примере 1.
[0040]
Сравнительный пример 2
Вместо фосфатного буфера (Nacalai Tesque, Inc.) добавляли до 76,3 мкл (236 мкг/мл) раствора, содержащего антиген HA вируса гриппа (A/IvPR8/34(H1N1)), Учреждение по Исследованию Микробных Заболеваний Университета Осака (The Research Foundation for Microbial Diseases of Osaka University), для приготовления 120 мкл вакцинной композиции. Тест проводили с помощью той же последовательности процедуры, что и в примере 1, в дозах, представленных в таблице 1.
[0041]
Сравнительные примеры 3-9
Вакцинные композиции готовили так же, как в сравнительном примере 2, за исключением того, что дополнительно к раствору, содержащему антиген HA вируса гриппа (A/IvPR8/34(H1N1)), Учреждение по Исследованию Микробных Заболеваний Университета Осака (The Research Foundation for Microbial Diseases of Osaka University), в сравнительном примере 3 использовали пептидогликан (PGN, выделенный из Salmonella, InvivoGen), в сравнительном примере 4 использовали зимосан (zymosan) (Nacalai Tesque, Inc.), в сравнительном примере 5 использовали Pam3CSK4 (InvivoGen), в сравнительном примере 6 использовали Poly (I:C) (InvivoGen), в сравнительном примере 7 использовали флагеллин (InvivoGen), в сравнительном примере 8 использовали имиквимод (InvivoGen) и в сравнительном примере 9 использовали CpG (InvivoGen). Тест проводили с помощью той же процедуры, что и в примере 1 в дозах, представленных в таблице 1.
[0042]
| [Таблица 1] | ||||
| № | Антиген | Адъювант | ||
| Доза (мкг/масса тела/время) | Лиганд | Название вещества | Доза (мкг/масса тела/время) | |
| Пример 1 | 3 | TLR4 | E. coli LPS | 5 |
| Пример 2 | 3 | TLR4 | Pantoea LPS | 5 |
| Пример 3 | 3 | TLR4 | GLA | 5 |
| Пример 4 | 3 | TLR2/6 | FSL-1 | 5 |
| Пример 5 | 3 | TLR2/6 | Pam2CSK4 | 5 |
| Пример 6 | 3 | неясно | c-di-GMP | 138 |
| Сравнительный пример 1 | - | - | - | - |
| Сравнительный пример 2 | 3 | - | - | - |
| Сравнительный пример 3 | 3 | TLR2 | PGN | 100 |
| Сравнительный пример 4 | 3 | TLR2/Дектин 1 | зимосан | 5 |
| Сравнительный пример 5 | 3 | TLR2/1 | Pam3CSK4 | 5 |
| Сравнительный пример 6 | 3 | TLR3 | поли I:C | 5 |
| Сравнительный пример 7 | 3 | TLR5 | Флагеллин | 5 |
| Сравнительный пример 8 | 3 | TLR7 | Имиквимод | 5 |