Кристаллические частицы для приготовления твердых лекарственных форм для лечения бактериальных инфекций, реакционная смесь, содержащая такие частицы, и фармацевтическая композиция для лечения бактериальных инфекций
Иллюстрации
Показать всеПредложена кристаллические частицы, содержащие (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-гидроксиметил оксазолидин-2-он диводород фосфат, имеющие рентгенограмму, характеризующуюся пиками при 14.7°, 15.2°, 16.6°, 20.3°, 26.8° и 28.2°, а также составы на их основе, пригодные для использования в фармацевтической промышленности. Предложены новые кристаллические частицы, характеризующиеся средним диаметром от 1,0 мкм до 44,0 мкм, содержанием помимо основного вещества воды и как минимум одного соединения, выбранного из:
и
,
которые обладают повышенной стабильностью при изготовлении твердых лекарственных форм для лечения бактериальных инфекций. 3 н. и 8 з.п. ф-лы, 12 ил., 12 табл., 15 пр.
Реферат
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Область техники, к которой относится изобретение
[0002] Настоящее описание относится к кристаллической форме (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-гидроксиметил оксазолидин-2-он диводород фосфата и способам применения кристаллической формы. Кристаллическая форма может быть использована в качестве фармацевтически активного соединения в композициях, которые являются полезными для ингибирования роста бактерий или для лечения пациентов, страдающих от бактериальных инфекций.
Описание уровня техники
[0003] Патентная публикация US 20070155798, которая приводится здесь для ссылки во всей ее целостности, раскрывает ряд сильнодействующих антибактериальных оксазолидинонов, включающий
где R=Н, РО(ОН)2 и PO(ONa)2.
[0004] Хотя эта патентная заявка раскрывает способы получения соединений, таких как свободная кислота (где R=РО(ОН)2) и динатриевая соль (где R=PO(ONa)2), в ней отсутствует информация о том, что любое из этих соединений было стабильно в кристаллической или очищенной форме. Дополнительно, эти способы включают использование реагентов, которые являются химически агрессивными, например, трифторуксусная кислота или взрывоопасными, например, этиловый эфир, и таким образом не подходят для коммерческого использования. Как обсуждается в деталях ниже, попытки кристаллизовать динатриевую соль авторами настоящего изобретения привели к получению высоко гигроскопичной, нестабильной формы соли, которая стала аморфной при высушивании.
[0005] В уровне техники существует необходимость в стабильной, не гигроскопичной кристаллической форме свободной кислоты (где R=РО(ОН)2) или ее соли, которая может быть аккуратно перенесена и взвешена для применения в фармацевтических средствах. Также предпочтительно, чтобы кристаллическая форма не образовывала большое число полиморфных модификаций, поскольку некоторые из полиморфов препятствуют способности воспроизвести идентичные полиморфы в процессе получения. Получение конкретной кристаллической формы, обладающей этими свойствами, это эмпирический процесс, и специалист в данной области не сможет предсказать, какая из форм свободной кислоты фармацевтического соединения или одной из соответствующих солей будет кристаллизоваться, если будет, в указанных условиях кристаллизации. Дополнительно специалист в данной области не может предсказать, какая из кристаллических форм будет обладать лучшими свойствами стабильности, способностью к переносу, отсутствию гигроскопичности и воспроизводимости.
[0006] Дополнительно улучшенные способы получения свободной кислоты раскрыты в патентной заявке US 12/577,089, переданной Траюс Терапьютикс, Инк., которая приводится здесь для ссылки во всей ее целостности. Существуют сложности в фильтрации кристаллического материала и переработке кристаллического материала в дозированные формы, такие как таблетки, потому что свободная кислота образует мелкие частицы, которые удлиняют время процесса. Таким образом, в уровне техники существует необходимость в кристаллической форме соединения и соответствующих способах, которые преодолевают эти сложности.
[0007] Дополнительным преимуществом было бы иметь очищенное соединение, которое подходило для применения в фармацевтических композициях.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0008] Неожиданно (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-гидроксиметил оксазолидин-2-он диводород фосфат 1 (R=РО(ОН)2), оказался более стабильным и не гигроскопичным, чем уже проверенные солевые формы. Дополнительно в отличии от обычной кристаллизации, где условия кристаллизации, например, растворитель и температура, определяют конкретную кристаллическую форму, одна и та же кристаллическая форма 1 (R=РО(ОН)2), была получена, используя различные растворители и условия кристаллизации. Таким образом, эта кристаллическая форма была очень стабильной, воспроизводимой и идеальной для коммерческого производства, поскольку она уменьшила количество шансов, что другие полиморфы образуют загрязняющие примеси во время производства. Однако, во всех предварительных испытаниях свободная кислота кристаллизуется в виде мелких частиц, затрудняя фильтрование и переработку.
[0009] Для преодоления трудностей с фильтрованием и переработкой кристаллического (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-гидроксиметил оксазолидин-2-он диводород фосфата 1 (R=РО(ОН)2), процессы, описанные здесь, приводят к значительному снижению времени фильтрования, помогают избежать использования токсичных растворителей, и значительно увеличивают легкость получения дозированных форм, таких как таблетки. Было обнаружено, что осуществление различных процессов можно контролировать с помощью распределения по размерам частиц полученного материала, что является полезным для получения кристаллической формы, и для коммерческого и фармацевтического использования. Неожиданно было установлено, что процесс увеличения размера частиц уменьшает количество примеси димера в сравнении с процессом получения свободной кислоты, описанной в патентной заявке США 12/577,089. Таким образом, различные способы получения и использования кристаллической формы также представлены.
[0010] Дополнительно, используя способы получения свободной кислоты, описанные в патентной заявке США 12/577,089, права на которую переданы тому же патентообладателю, что и в настоящей заявке, и применяя способы кристаллизации, описанные здесь, кристаллическая свободная кислота, имеющая, по меньшей мере, 96% чистоты по весу может быть получена в форме, которая содержит соединение, имеющее следующую формулу:
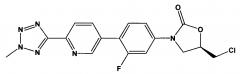
(здесь и далее «хлор содержащие примеси», то есть (R)-5-(хлорметил)-3-(3-фтор-4-(6-(2-метил-2Н-тетразол-5-ил)пиридин-3-ил)фенил)оксазолидин-2-он в количестве менее 1%.
[0011] Подобным образом, используя способы получения свободной кислоты, раскрытой в патентной заявке США 12/577,089, права на которую переданы тому же правообладателю, что и настоящая заявка, и используя способы кристаллизации, описанные здесь, кристаллическая свободная кислота, имеющая, по меньшей мере, 96% чистоту по весу может быть получена в форме, которая содержит соединение, имеющую следующую формулу:
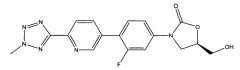
(здесь и далее "TR-700"), то есть, 5R)-3-{3-фтор-4-[6-(2-метил-2Н-1,2,3,4-тетразол-5-ил)-пиридин-3-ил]-фенил}-5-гидроксиметил-1,3-оксазолидин-2-он, в количестве, меньше 1%.
[0012] Кристаллическая свободная кислота может иметь один или более атрибутов, описанных здесь.
[0013] В некоторых аспектах, очищенный кристаллический (R)-3-(4-(2-(2-метил-теразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-гидроксиметил оксазолидин-2-он диводород фосфат, то есть свободная кислота имеет чистоту, по меньшей мере, около 96% по весу. В некоторых вариантах осуществления изобретения, кристаллическая свободная кислота имеет средний диаметр, по меньшей мере, около 1.0 мкм.
[0014] В некоторых вариантах осуществления изобретения, фармацевтическая композиция содержит свободную кислоту или соль и, по меньшей мере, один фармацевтически приемлемый носитель, экципиент или дилюент.
[0015] В некоторых вариантах осуществления изобретения способ лечения бактериальной инфекции включает введение эффективного количества кристаллической свободной кислоты или ее соли субъекту, которому это необходимо. Способы могут также включать лечение бактериальной инфекции, включающей введение свободной кислоты, фармацевтической композиции или соли субъекту, которому это необходимо.
[0016] В некоторых аспектах способы получения свободной кислоты включают высушивание кристаллического (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-гидроксиметил оксазолидин-2-он диводород фосфата или фармацевтической композиции, содержащей его соль.
[0017] Эти и другие варианты осуществления изобретения описаны в деталях ниже.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0018] Фигура 1 представляет собой Фурье-Раман спектр кристаллического соединения 1 (R=РО(ОН)2).
[0019] Фигура 2 представляет собой рентгенограмму кристаллического соединения 1 (R=РО(ОН)2).
[0020] Фигура 3 представляет собой термограмму дифференциальной сканирующей калориметрии (DSC) кристаллического соединения 1 (R=РО(ОН)2).
[0021] Фигура 4 демонстрирует 1Н ЯМР спектр соединения 1 (R=РО(ОН)2).
[0022] На Фигуре 5 изображена диаграмма кристаллического соединения 1 (R=РО(ОН)2) методами термогравиметрии и инфракрасной спектроскопии.
[0023] Фигура 6 представляет собой диаграмму, демонстрирующую свойства динамической сорбции паров (DVS) кристаллического соединения 1 (R=РО(ОН)2).
[0024] Фигура 7 представляет собой схематический процесс получения соединения 1 (R=РО(ОН)2) (TR-701 FA) в форме таблеток.
[0025] Фигура 8 представляет собой схематический процесс получения соединения 1 (R=РО(ОН)2) (TR-701 FA) в виде раствора для лиофилизации.
[0026] Фигура 9 представляет собой схематический процесс получения соединения 1 (R=РО(ОН)2) (TR-701 FA) для инъекции, 200 мг/ампула: стерильная фильтрация, наполнение и лиофилизация.
[0027] Фигура 10 представляет собой распределение частиц по размерам кристаллической свободной кислоты без контролирования размера частиц как описано здесь.
[0028] Фигура 11 представляет собой распределение частиц по размерам кристаллической свободной кислоты, выполненное используя лабораторные процессы для контроля размера частиц, представленное здесь.
[0029] Фигура 12 распределение частиц по размерам кристаллической свободной кислоты, используя увеличенный в масштабе производственный процесс для контроля размера частиц, описанный здесь.
ДЕТАЛЬНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ.
[0030] R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-гидроксиметил оксазолидин-2-он диводород фосфат 1 (R=РО(ОН)2), который иногда именуется как «свободная кислота» или "TR-701 FA" и некоторые его соли были получены в различных условиях кристаллизации для определения какой из материалов образует самое стабильное и наименее гигроскопичное кристаллическое соединение. Эмпирический процесс получения кристаллических форм свободной кислоты и ее солей привел к отбору кристаллической свободной кислоты, которая дополнительно к лучшей стабильности и отсутствию гигроскопичности, могла быть воспроизведена в различных условиях кристаллизации, затем эта форма была очищена и высушена.
[0031] Большинство из солей, которые были проверены, было трудно получить в кристаллической форме или они были нестабильны в очищенной или высушенной форме. Например, в отношении моно-натриевой соли, получение стабильного гидрата не было обнаружено. Также материал содержал свыше 10% по весу воды и таким образом материал был очень гигроскопичным, и при этом не стабильным для желаемого использования.
[0032] Кристаллический гидрат динатриевой соли был получен, но он оказался нестабильным и содержал 19.6% воды по весу. Однако динатриевая соль оказалась очень хорошо растворимой. В результате высушивания гидрата аморфные образцы были получены. Содержание воды в аморфном образце составило 6.2% по весу.
[0033] Кристаллический твердый материал не был выделен для дикалиевой соли.
[0034] Полу-кальциевая соль была получена в виде кристалла, однако, она была слишком гигроскопичной.
[0035] Кристаллический материал полу-магниевой соли был получен, но как оказалось, он содержал различные гидраты соли, а присутствие различных полиморфов является нежелательным для применения в лекарственных формах. В одном эксперименте, магниевая соль имела температуру плавления 152.8°С, что указывает на меньшую стабильность этого материала по сравнению со свободной кислотой.
[0036] Полученные кристаллы свободной кислоты, которые не были гигроскопичными при фильтровании и высушивании, продемонстрировали растворимость в 0.1 мг/мл (рН=3.2 насыщенного раствора). Температура плавления кристаллического материала составила 255-258°С, и таким образом материал был очень стабилен при относительно высокой температуре.
[0037] В целом условия кристаллизации являются обычно критическими для формирования конкретного полиморфа; однако, неожиданно оказалось, что один и тот полиморф свободной кислоты был получен в различных условиях, в которых кристаллическая свободная кислота образовывалась.
[0038] В некоторых вариантах осуществления изобретения, кристаллический материал является не гигроскопичным, поэтому он не поглощает и удерживает воду из атмосферного воздуха. В некоторых вариантах осуществления изобретения, «не гигроскопичный» материал имеет содержание воды менее приблизительно 5%. 4%, 3%, 2%, 1%, 0.9%, 0.8%, 0.7%, 0.6%, 0.5%, 0.4%, 0.3%, 0.2% или 0.1% воды по весу.
[0039] Преимущественно, свободная кислота может быть использована как для получения твердой лекарственной формы, так и формы для внутривенного (IV) введения. При анализе было обнаружено, что динатриевая соль, хотя и является нестабильной для твердых форм, таких как таблетки, была очень хорошо растворимой и подходящей для форм IV введения. При этом в других вариантах осуществления изобретения, стерильный лиофилизированный порошок для инъекций был получен из динатриевой соли in situ с гидроксидом натрия и последующей лиофилизацией полученного раствора. Динатриевая соль является хорошо растворимой, и поэтому лучше восстанавливать ее стерильной водой с получением раствора. В некоторых вариантах осуществления изобретения полученный раствор может быть добавлен в емкость для внутривенного введения. Емкость может содержать изотонический раствор, такой как 0.9% хлорид натрия или 5% декстрозу.
[0040] В некоторых вариантах осуществления изобретения, солевой раствор, такой как динатриевая или мононатриевая соль, может быть лиофилизован путем замораживания раствора в лиофилизаторе до приблизительно -50 -30°С со скоростью около 0.1-1 градуса/минуту и выдерживания в течение 200-700 минут, в этой точке в камере лиофилизатора создается давление около 200-250 миллиторр и температура увеличивается до -30 -10°С со скоростью 0.5-3 градуса/минуту. Продукт выдерживается при -30 -10°С в течение приблизительно 1000-2500 минут и затем температуру увеличивают до приблизительно 21-35°С со скоростью 0.1-1 градус/минуту и выдерживают в течение 1000-2500 минут с получением желаемого продукта.
[0041] В вариантах некоторых способов получения, кристаллическая свободная кислота (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-гидроксиметил оксазолидин-2-он диводород фосфат 1 (R=РО(ОН)2) может быть получена подкислением водного раствора соответствующей соли, такой как динатриевая соль 1 (R=PO(ONa)2).
[0042] Любая соль свободной кислоты 1 (R=РО(ОН)2) может быть использована для восстановления свободной кислоты с помощью подкисления. В некоторых вариантах осуществления, соль представляет собой соль щелочного или щелочноземельного металла. В других вариантах осуществления изобретения, соль представляет собой соль щелочного металла, такая как динатриевая соль 1 (R=РО(ОН)2).
[0043] Было обнаружено, что выбор кислоты не является критическим. Любая кислота является кислотообразующей в достаточной степени для двойного протонирования динатриевого фосфата 1 (R=PO(ONa)2), или другой соли с получением свободной кислоты 1 (R=РО(ОН)2). В некоторых вариантах осуществления изобретения кислота представляет собой HCl, HBr или H2SO4.
[0044] После растворения соли (R)-3-(4-(2-(2-метил-тетразол-5-ил)-пиридин-5-ил)-3-фтор-фенил)-5-гидрокси-метил оксазолидин-2-он диводород фосфата, и затем, подкисления солевого раствора с образованием кристаллов, кристаллы могут быть отфильтрованы из супернатанта. В некоторых вариантах осуществления изобретения, влажные кристаллы могут быть высушены, например, используя вакуум или лиофилизацию кристаллов.
[0045] В некоторых вариантах осуществления изобретения термин кристаллический относится к однородному кристаллическому материалу кристаллического (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-гидроксиметил оксазолидин-2-он диводород фосфата, таким как по существу чистые кристаллы.
[0046] Термины "приблизительно, "около" и "по существу" при их использовании здесь для указания количества, близкого к заявляемому, при котором все еще выполняется желаемая функция или достигается желаемый результат. Например, термины "приблизительно, "около" и "по существу" могут относиться к количеству, которое отличается от заявляемого значения в пределах менее 10%, менее 5%, менее 1%, менее 0.1% и менее 0.01%.
[0047] Например, в фармацевтической промышленности, стандартной практикой является обеспечение по существу чистого материала при изготовлении фармацевтических композиций. Таким образом, в некоторых вариантах осуществления изобретения «по существу чистый» относится к степени чистоты, необходимой для получения лекарственных средств, которые могут включать, например, небольшое количество аморфного или другого материала, при этом материал все еще обладает достаточной способности к переносу, не является гигроскопичным и имеет чистоту, подходящую для фармацевтического применения. В некоторых вариантах осуществления изобретения кристаллическая свободная кислота, которая является по существу чистой, содержит, по меньшей мере, около 96% кристаллической свободной кислоты по весу, например, по меньшей мере, приблизительно 96.1%, 96.2%, 96.3%, 96.4%, 96.5%, 96.6%, 96.7%, 96.8%, 96.9%, 97%, 97.1%, 97.2%, 97.3%, 97.4%, 97.5%, 97.6%, 97.7%, 97.8%. 97.9%, 98%, 98.1%, 98.2%, 98.3%, 98.4%, 98.5%, 98.6%, 98.7%, 98.8%, 98.9%, 99%, 99.1%, 99.2%, 99.3%, 99.4%, 99.5%, 99.6%, 99.7%, 99.8%, 99.9% или 100% кристаллической свободной кислоты по весу. В некоторых вариантах осуществления изобретения ди- или мононатриевая соль в фармацевтических составах, описанных здесь, содержит, по меньшей мере, 96%, 96.1%, 96.2%, 96.3%, 96.4%, 96.5%, 96.6%, 96.7%, 96.8%, 96.9%. 97%, 97.1%, 97.2%, 97.3%, 97.4%, 97.5%, 97.6%, 97.7%, 97.8%, 97.9%, 98%, 98.1%, 98.2%, 98.3%, 98.4%, 98.5%, 98.6%, 98.7%, 98.8%, 98.9%, 99%, 99.1%, 99.2%, 99.3%, 99.4%, 99.5%, 99.6%, 99.7%, 99.8%, 99.9% или 100% кристаллической соли по весу. В полученных лекарственных средствах является полезным обеспечить не вязкий твердый кристаллический (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-гидроксиметил оксазолидин-2-он диводород фосфат, который может быть перенесен и аккуратно взвешен для применения, например, в таблетках и капсулах. Таким образом, в некоторых вариантах осуществления изобретения, кристаллический материал находится в переносимой форме так, что частицы не сильно прилипают одна к другой или к сосуду, в котором они находятся так, что возможно однородно перенести материал из сосуда.
[0048] Получение свободной кислоты (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-гидроксиметил оксазолидин-2-он диводород фосфата 1 (R=РО(ОН)2) и его динатриевой соли 1 (R=РО(ONa)2) описано в патентной публикации No. 2007/0155798 и патентной заявке США No. 12/577,089, права на последнюю из указанных заявок переданы тому же правообладателю, что и у настоящей заявки.
[0049] В вариантах осуществления изобретения в некоторых способах получения, кристаллическая свободная кислота (R)-3-(4-(2-(2-метилтетразол-5-ил)пиридин-5-ил)-3-фторфенил)-5-гидроксиметил оксазолидин-2-он диводород фосфат 1 (R=РО(ОН)2) может быть получена подкислением водного раствора соответствующей соли, например, динатриевой соли 1 (R=PO(ONa)2).
[0050] Любая соль свободной кислоты 1 (R=РО(ОН)2) может быть использована для восстановления свободной кислоты подкислением. В некоторых вариантах осуществления изобретения, соль представляет собой соль щелочного или щелочноземельного металла. В других вариантах осуществления изобретения, соль представляет собой соль щелочного металла, такого как динатриевая соль 1 (R=РО(ОН)2).
[0051] В дополнительных вариантах осуществления изобретения сама по себе свободная кислота может быть использована для получения кристаллической формы например, растворением в диполярном апротонном растворителе: диметил сульфоксиде (ДМСО) или 1-метил-2-пирролидоне (NMP); а затем следует добавление растворителя, вызывающего кристаллизацию, такого как этанол, ацетон, ацетонитрил, диоксан, гептан, изопропиловый спирт, метанол, тетрагдрофуран, толуол, вода, дихлорметан, метил изобутил кетон и этилацетат. В некоторых вариантах осуществления изобретения растворители, применяемые для растворения или для кристаллизации, могут представлять собой чистый растворитель или смесь чистых растворителей или могут быть в форме жидкости, пара или второго слоя. В некоторых вариантах осуществления изобретения из последних двух случаев, растворитель, вызывающий кристаллизацию может быть использован согласно способу выращивания кристаллов диффузией из паровой фазы, или способом расслоения растворителей, оба из которых хорошо известны в уровне техники.
[0052] В дополнительных способах получения, свободная кислота может быть растворена, по меньшей мере, в одном диполярном апротонном растворителе, таком как ДМСО или NMP при повышенной температуре, и кристаллическая свободная кислота 1 (R=PO(OH)2) получается охлаждением раствора согласно хорошо известным способам из уровня техники. Растворитель может быть чистым сам по себе или представлять собой смесь чистых растворителей.
[0053] При получении лекарственных средств полезно обеспечить твердое кристаллическое соединение, которое может быть легко переведено в дозированные формы, например, таблетки. Также желательно сократить промежуток времени, необходимый для получения соединения. В некоторых вариантах осуществления изобретения для того, чтобы удовлетворить эти потребности, описан способ получения кристаллического соединения 1 (R=РО(ОН)2), который приводит к получению большого размера частиц, что значительно сокращает время фильтрования, поскольку, как известно, мелкие частицы замедляют процесс фильтрования. В других вариантах осуществления изобретения кристаллическое вещество 1 (R=РО(ОН)2) имеет определенное распределение частиц по размерам, что напрямую следует из способа получения вне зависимости от фильтрования материала для получения такого распределения.
[0054] В некоторых вариантах осуществления изобретения больший размер частиц кристаллов соединения 1 (R=РО(ОН)2) может быть получен, используя процедуру осаждения при высокой температуре. Дополнительно, в вариантах, где кислота используется для получения свободной кислоты из соли, было обнаружено, что увеличение скорости, при которой реакционную смесь добавляют к кислоте, влияет на размер частиц и делает частицы больше. При этом реакционная смесь может взаимодействовать с раствором кислоты так быстро, как это возможно так, что по существу происходит незамедлительный контакт с раствором кислоты. В обычных способах реакционная смесь взаимодействует с раствором кислоты более медленно, потому что раствор кислоты добавляют к реакционной смеси и таким образом реакционная смесь не может взаимодействовать с раствором кислоты до некоторого времени после добавления раствора кислоты, что приводит к гораздо более маленькому размеру частиц. Было обнаружено, что действие обратное этой стадии, то есть добавление реакционной смеси к раствору кислоты позволяет реакционной смеси практически незамедлительно взаимодействовать за время введения реакционной смеси в раствор кислоты, что приводит к получению материала с большим размером частиц. В некоторых вариантах осуществления изобретения незамедлительный контакт осуществляют добавлением реакционной смеси к раствору кислоты. Реакционная смесь может быть прокачана через раствор кислоты за промежуток времени, например, за несколько часов, например 1-4 часа.
[0055] В некоторых вариантах осуществления изобретения, водный этанол- или ТГФ-содержащий раствор TR-701FA может быть получен добавлением раствора бикарбоната натрия, например, 2-10% раствора по весу, такого как 5% раствор. В некоторых вариантах осуществления изобретения, раствор может быть добавлен к водному раствору кислоты и этанолу или ТГФ с образованием свободной кислоты. В некоторых вариантах осуществления изобретения приблизительно от 0.5-10, приблизительно 1.5-3.0 или приблизительно 2.2 эквивалента 1 М HCl может быть использовано. Дополнительно в некоторых вариантах осуществления изобретения, приблизительно 1-10 объемов, 2-6 объемов или 4 объема этанола могут быть использованы. ТГФ также может быть использован. В некоторых вариантах осуществления изобретения раствор, содержащий соляную кислоту и этанол, может поддерживаться при температуре около 40-100°С, около 60-70°С или около 65-70°С. Содержание кислоты и спирта могут быть приведены в соответствие. TR-701FA закристаллизовался во время этого добавления с получением меньшего количества небольших кристаллов в продукте по сравнению с ранее раскрытыми способами.
[0056] В некоторых вариантах осуществления изобретения этанол или ТГФ препятствуют гелеобразованию свободной кислоты во время процесса.
[0057] Обычно распределение частиц по размерам измеряется, используя анализатор лазерной дифракции размера частиц, а именно Malvern Mastersizer. D10 (мкм) представляет собой диаметр, ниже которого лежит 10% общего объема частиц. D50 (мкм) представляет собой медианный диаметр. D90 (мкм) представляет собой диаметр, ниже которого лежит 90% общего объема частиц.
[0058] В некоторых вариантах осуществления изобретения, когда размер частиц не контролируется, 10% общего объема частиц может иметь диаметр меньше приблизительно 0.28 мкм, медианный диаметр может быть около 0.79 мкм, и 90% общего объема частиц может иметь диаметр меньше приблизительно 0.44 мкм. Контроль (за увеличением) размера частиц, используя способы, описанные здесь, приводит к тому, что частицы становятся значительно больше по размеру в целом.
[0059] В некоторых вариантах осуществления изобретения, когда размер частиц контролируется, используя способы, описанные здесь, для увеличения размера частиц, 10% общего объема частиц может иметь средний диаметр, по меньшей мере, около 0.5 мкм, и/или медианный диаметр может быть, по меньшей мере, около 1.0 мкм, и/или 90% общего объема частиц могут иметь средний диаметр, по меньшей мере, около 45 мкм. В некоторых вариантах осуществления изобретения, когда размер частиц контролируется (для увеличения размера частиц), 10% общего объема может иметь средний диаметр около 0.5-10 мкм, например, около 1-5 мкм. Например, когда размер частиц контролируется (для увеличения размера частиц), 10% общего объема может иметь средний диаметр около 0.5, 0.6, 0.7, 0.8, 0.9, 1.0, 1.1, 1.2, 1.3, 1.4, 1.5, 1.6, 1.7, 1.8, 1.9, 2.0, 2.1, 2.2, 2.3, 2.4, 2.5, 2.6, 2.7, 2.8, 2.9, 3.0, 3.1, 3.2, 3.3, 3.4, 3.5, 3.6, 3.7, 3.8, 3.9, 4.0, 4.1, 4.2, 4.3, 4.4, 4.5, 4.6, 4.7, 4.8, 4.9, 5.0, 5.1, 5.2, 5.3, 5.4, 5.5, 5.6, 5.7, 5.8, 5.9, 6.0, 6.1, 6.2, 6.3, 6.4, 6.5, 6.6, 6.7, 6.8, 6.9, 7.0, 7.1, 7.2, 7.3, 7.4, 7.5, 7.6, 7.7, 7.8, 7.9, 8.0, 8.1, 8.2, 8.3, 8.4, 8.5, 8.6, 8.7, 8.8, 8.9, 9.0, 9.1, 9.2, 9.3, 9.4, 9.5, 9.6, 9.7, 9.8, 9.9 или 10.0 мкм.
[0060] В некоторых вариантах осуществления изобретения, когда размер частиц контролируется (для увеличения размера частиц), медианный диаметр может быть больше, чем приблизительно 1.0 мкм и иметь средний медианный диаметр приблизительно 1-44 мкм, приблизительно 1-40 мкм, приблизительно 10-35 мкм, приблизительно 20-30 мкм или около 25-29, например, около 27 мкм. В некоторых вариантах осуществления изобретения, когда размер частиц контролируется для увеличения размера частиц, средний медианный диаметр может быть приблизительно равен 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 38, 39, 40, 41, 42, 43 или 44 мкм. Например, средний медианный диаметр может быть равен приблизительно 25, 25.1, 25.2, 25.3, 25.4, 25.5, 25.6, 25.7, 25.8, 25.9, 26, 26.1, 26.2, 26.3, 26.4, 26.5, 26.6, 26.7, 26.8, 26.9, 27, 27.1, 27.2, 27.3, 27.4, 27.5, 27.6, 27.7, 27.8, 27.9, 28, 28.1, 28.2, 28.3, 28.4, 28.5, 28.6, 28.7, 28.8, 28.9 или 29 мкм.
[0061] В некоторых вариантах осуществления изобретения, когда размер частиц контролируется, 90% общего объема частиц может иметь средний диаметр, по меньшей мере, около 45 мкм, такой как приблизительно 45-100, приблизительно 45-80, приблизительно 55-75 или приблизительно 64-68, например, приблизительно 66. В некоторых вариантах осуществления изобретения, когда размер частиц контролируется, 90% общего объема частиц может иметь средний диаметр около 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 мкм. Например, 90% 90% общего объема частиц может иметь средний диаметр приблизительно 64, 64.1, 64.2, 64.3, 64.4, 64.5, 64.6, 64.7, 64.8, 64.9, 65, 65.1, 65.2, 65.3, 65.4, 65.5, 65.6, 65.7, 65.8, 65.9, 66, 66.1, 66.2, 66.3, 66.4, 66.5, 66.6, 66.7, 66.8, 66.9, 67, 67.1, 67.2, 67.3, 67.4, 67.5, 67.6, 67.7, 67.8, 67.9 или 68 мкм.
[0062] Кристаллическая свободная кислота 1 (R=РО(ОН)2) может быть охарактеризована Фурье-Раман спектром, как показано на Фигуре 1 и рентгенограммой, как показано на Фигуре 2, с соответствующими данными, представленными в Таблице 1 и 2 соответственно. На Фигуре 3, Фигуре 4, Фигуре 5 и Фигуре 6 показаны термограмма дифференциальной сканирующей калориметрии ⋅ (DSC), 1Н ЯМР спектр, диаграмма, полученная методами термогравиметрии и инфракрасной спектроскопии, и диаграмма, демонстрирующая свойства динамической сорбции паров (DVS) соответственно.
[0063] В некоторых вариантах осуществления изобретения, отличительные пики для кристаллической свободной кислоты включают следующие пики: 14.7°, 15.2°, 16.6°, 20.3°, 26.8° и 28.2°.
[0064] В других вариантах осуществления изобретения, отличительные пики для кристаллической свободной кислоты включают следующие пики: 10.6°, 13.9°, 14.7°, 15.2°, 16.6°, 20.3°, 26.8° и 28.2°.
[0065] В некоторых вариантах осуществления изобретения кристаллическая свободная кислота содержит примеси, которые присутствуют в количестве меньше 1% очищенной кристаллической свободной кислоты. Эти примеси включают
то есть 5(R)-3-{3-фтор-4-[6-(2-метил-2Н-1,2,3,4-тетразол-5-ил)-пиридин-3-ил]-фенил}-5-гидроксиметил-1,3-оксазолидин-2-он ("TR-700") и/или
то есть (R)-5-(хлорметил)-3-(3-фтор-4-(6-(2-метил-2Н-тетразол-5-ил)пиридин-3-ил)фенил)оксазолидин-2-он ("хлор содержащая примесь").
[0066] Из обычно получаемого материала, имеющего примеси, которые были идентифицированы, используя ВЭЖХ в Примере 15, по меньшей мере, 2% по весу хлор содержащей примеси присутствует. В очищенной кристаллической свободной кислоте, полученной, используя способ получения свободной кислоты, описанной в патентной заявке США 12/577,089, права на которую были переданы тому же правообладателю, что и по настоящей заявке, и способы кристаллизации, описанные здесь, хлор содержащая примесь присутствует в количестве приблизительно меньше 1% по весу, например, меньше приблизительно 0.9%, 0.8%, 0.7%, 0.6%, 0.5%, 0.4%, 0.3%, 0.2% или 0.1% по весу кристаллической свободной кислоты. В некоторых вариантах осуществления изобретения количество хлор содержащей примеси может быть снижено до 0.1% по весу, например, менее чем приблизительно 0.09%, 0.08%, 0.07%, 0.06%, 0.05%, 0.04%, 0.03%, 0.02% или 0.01% по весу кристаллической свободной кислоты. В некоторых вариантах осуществления изобретения очищенная кристаллическая свободная кислота вообще не содержит этой примеси.
[0067] Из обычно получаемого материала, имеющего примеси, которые были идентифицированы, используя ВЭЖХ в Примере 15, по меньшей мере, 1% по весу TR-700 примеси присутствует. В очищенной кристаллической свободной кислоте, полученной, используя способ получения свободной кислоты, описанный в патентной заявке США 12/577,089, права на которую были переданы тому же правообладателю, что и по настоящей заявке, и способы кристаллизации, описанные здесь, TR-700 примесь присутствует в количестве приблизительно меньше 1% по весу. В некоторых вариантах осуществления изобретения кристаллическая свободная кислота содержит менее 0.9%, 0.8%, 0.7%, 0.6%, 0.5%, 0.4%, 0.3%, 0.2% или 0.1% по весу TR-700 примеси. В некоторых вариантах осуществления изобретения очищенная кристаллическая свободная кислота вообще не содержит TR-700 примеси.
[0068] Дополнительно, очищенная кристаллическая свободная кислота, полученная, используя способ получения свободной кислоты, описанный в патентной заявке США 12/577,089, права на которую были переданы тому же правообладателю, что и по настоящей заявке, и способы кристаллизации, описанные здесь, может также отличаться от кристаллической свободной кислоты, полученной обычным способом присутствием следующих соединений. Например, следующие примеси не были обнаружены в образце кристаллической свободной кислоты, полученной обычным способом, как показано в Примере 15:
(здесь и далее "дез-метил TR-701"), то есть диводород ((5R)-3-{3-фтор-4-[6-(2H-1,2,3,4-тетразол-5-ил)-3-пиридинил]фенил}-2-оксо-1,3-оксазолан-5-ил)метил фосфат;
(здесь и далее "пералкилированная-фосфорилированная примесь"), то есть, 5-((3-(3-фтор-4-(6-(2-метил-2Н-тетразол-5-ил)пиридин-3-ил)фенил)-2-оксаоксазолидин-5-ил)метокси)-3-гидроксипропан-2-ил диводород фосфат и, 3-((3-(3-фтор-4-(6-(2-метил-2Н-тетразол-5-ил)пиридин-3-ил)фенил)-2-оксаоксазолидин-5-ил)метокси)-2-гидроксипропил диводород фосфат;
(здесь и далее "один из ОА-700 смешанных диэфиров"), то есть, 3-{[(5R)-3-{3-фтор-4-[6-(2-метил-2Н-тетразол-5-ил)пиридин-3-ил]фенил}-2-оксо-1,3-оксазолидин-5-ил]метокси}-2-гидроксипропил [(5R)-3-{3-фтор-4-[6-(2-метил-2Н-тетразол-5-ил)пиридин-3-ил]фенил}-2-оксо-1,3-оксазолидин-5-ил]метил водород фосфат; и/или
(здесь и далее "другой из ОА-700 смешанных диэфиров"), то есть 2-{[(5R)-3-{3-фтор-4-[6-(2-метил-2Н-тетразол-5-ил)пиридин-3-ил]фенил}-2-оксо-1,3-оксазолидин-5-ил]метокси}-1-гидроксиэтил [(5R)-3-{3-фтор-4-[6-(2-метил-2Н-тетразол-5-ил)пиридин-3-ил]фенил}-2-оксо-1,3-оксазолидин-5-ил]метил водород фосфат.
[0069] Специалисты в данной области определят, что различные замещенные изотопами варианты (например, через замещение водорода дейтерием, углерода - 13С, азота - 15N, или фосфора - 32Р) также могут быть легко получены. Все такие варианты включены в объем притязаний по изобретению.
[0070] В различных вариантах осуществления изобретения очищенная кристаллическая свободная кислота, описанная здесь, может быть использована отдельно, в комбинации с другими соединениями, описанными здесь, или в комбинации с одним или более другими агентами, активными в терапевтической области, описанной здесь.
[0071] В другом аспекте настоящее описание относится к фармацевтической композиции, содержащей один или несколько физиологически приемлемых поверхностно-активных агентов, дополнительных носителей, дилюентов, эксципиентов, разглаживающих компонентов, суспензионных агентов, агентов, образующих пленку и вспомогательных веществ, для образования оболочки или их комбинации и композиции, описанной здесь. Дополнительные приемлемые носители или дилюенты для терапевтического использования хорошо известны в фармацевтической области, и описаны, например, в Remington's Pharmaceutical Sciences, 18th Ed., Mack Publishing Co., Easton, PA (1990), который приводится здесь для ссылки во всей его целостности. Консерванты, стабилизаторы, красители, подсластители, отдушки, ароматизаторы и тому подобное могут быть представлены в фармацевтической композиции. Например, бензоат натрия, аскорбиновая кислота и эфиры п-гидроксибензойной кислоты могут быть добавлены в качестве консервантов. Дополнительно, антиоксиданты и суспендирующие агенты могут быть использованы. В различных вариантах осуществления изобретения спирты, эфиры, сульфурированные алифатические спирты и тому подобное могут быть использованы в качестве поверхностно-активных агентов; сахароза, глюкоза, лактоза, крахмал, микрокристаллическая целлюлоза, кристаллическая целлюлоза, маннитол, светлый безводный силикат, алюминат магния, метасиликат алюминат магния, синтетический силикат алюминия, карбонат кальция, гидрокарбнат натрия, гидрофосфат кальция, кальций карбоксиметил целлюлоза, и тому подобное могут быть использованы в качестве экципиентов; стеарат магния, тальк, закаленное масло и тому подобное могут быть использованы в качестве разглаживающих агентов; кокосовое масло, оливковое масло, кунжутное масло, арахисовое масло, соевое масло могут быть использованы в каче