Антитело или его антигенсвязывающий фрагмент, способный связываться с рецептором интерлейкина-6 человека
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению антител против интерлейкина-6, и может быть использовано в медицине. Полученное антитело или его антигенсвязывающий фрагмент используют в составе фармацевтической композиции, а также для приготовления лекарственных средств для лечения или диагностики заболеваний или для облегчения симптомов, опосредованных интерлейкином-6. Также рассмотрена молекула нуклеиновой кислоты, экспрессионный вектор и клеточная линия. Кроме того, описан способ получения антитела и его антигенсвязывающего фрагмента. Изобретение позволяет получить анти-IL6 антитело, способное специфически связываться с человеческим рецептором интерлейкина-6 и оказывать значительное ингибирующее влияние на функционирование интерлейкина-6. 7 н. и 12 з.п. ф-лы, 18 ил., 8 табл., 21 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к медицине.
Изобретение относится к созданию антител или их фрагментов, обладающих способностью специфически связываться с человеческим рецептором интерлейкина-6, которые были бы применимы в качестве лекарственных средств для лечения или диагностики заболеваний или для облегчения симптомов, опосредованных интерлейкином-6. Изобретение также относится к способам получения указанных антител и способу лечения заболеваний человека с помощью данных антител.
УРОВЕНЬ ТЕХНИКИ
Интерлейкин-6 (IL-6, ИЛ-6) является одним из главных посредников воспалительных реакций, продуцируемый широким рядом антигенпрезентирующих клеток, включая В- и Т-клетки. IL-6 продуцируется активированными моноцитами или макрофагами, эндотелиальными клетками, фибробластами, активированными Т-клетками, а также рядом клеток, не являющихся иммуноцитами. Наряду со многими другими цитокинами он участвует в процессах иммунного ответа, ангиогенеза, воспаления, костного метаболизма. Основное действие IL-6 связано с его участием в качестве кофактора при дифференцировке В-лимфоцитов, их созревании и преобразовании в плазматические клетки, секретирующие иммуноглобулины. Помимо этого, IL-6 способствует экспрессии рецептора IL-6 на активированных иммуноцитах, а также индуцирует производство IL-2 Т-клетками. Этот цитокин стимулирует пролиферацию Т-лимфоцитов и реакции гемопоэза. По многообразию клеточных источников продукции и мишеней биологического действия IL-6 является одним из наиболее активных цитокинов, участвующих в реализации иммунного ответа и воспалительной реакции. Было показано, что дисбаланс между про- и антивоспалительными действиями IL-6 приводит к различным аутоиммунным заболеваниям, хроническому воспалению и остеопорозу, псориазу, а избыточная продукция приводит к различным формам рака.
В этой связи, блокирование действия IL-6 является привлекательной целью для исследований и лечения перечисленных заболеваний (PeterC. HeinrichBiochem. J. (2003) 374:1).
Проведение сигнала цитокина внутрь клетки возможно 2 способами. Первый - к клеткам, имеющим мембрансвязанную альфа-субъединицу рецептора, присоединяется интерлейкин-6 к уже собранному рецептору из альфа-субъединицы и молекул gp130. Второй - к клеткам, имеющим на мембране только молекулы gp130, присоединяется комплекс интерлейкина-6 с растворимой формой альфа-субъединицы. На мембране клетки происходит сборка полного комплекса и последующий запуск каскада реакций в клетке. Блокирования действия цитокина и, следовательно, воспалительной реакции можно добиться, помешав сборке полного комплекса рецептора, состоящего из альфа-субъединицы, молекул gp130 и интерлейкина 6. Специфические антитела, связываясь с одной из молекул, способны препятствовать сборке полного комплекса и, соответственно, блокируют проведение сигнала внутрь клетки.
Полипептиды, специфически связывающиеся с IL-6 (см. патент РФ №2550262), IL-6R или gp130 показали значительное ингибирующее влияние на функционирование IL-6. А препараты на основе антитела (тоцилизумаб) связывающегося с IL-6R и блокирующего взаимодействие с IL-6 широко применяются при лечении ревматоидного артрита и системного ювенильного идиопатического артрита, как в виде монотерапии, так и в комбинации с метотрексатом и/или с другими базисными противовоспалительными препаратами.
Приведенные данные позволяют предположить, что разработка препарата на основе антитела анти-IL-6R позволит охватить лечением всех пациентов с данными заболеваниями.
Рецептор IL-6 (IL-6R, IL6R, CD126) является комплексом молекул, при активации вызывающий каскад реакций в клетке, приводящих к активному синтезу белков, участвующих в дальнейших реакциях воспалительного ответа. Рецептор активируется при связывании IL-6 с альфа-субъединицей рецептора массой 80 кДа, не передающей сигнала, и 2-ух молекул gp130 массой 130 кДа, передающих сигнал внутрь клетки (SimonA.JonesTheFASEBJournal 15(1): 43-58). Существуют 2 формы альфа-рецептора: связанного с мембраной (mIL-6R) и растворимого (sIL-6R 38 кДа). Растворимая форма образуется в результате протеолиза трансмембранной части или в процессе альтернативного сплайсинга мРНК mIL-6R. Растворимая форма IL-6sR позволяет давать ответ на цитокин клеткам, не имеющим mIL-6R на поверхности мембраны.
Блокирование сигнала IL-6 с помощью полипептидов, связывающихся с рецептором, имеет ряд преимуществ перед блокированием связывающихся непосредственно с IL-6. Так, антитела против IL-6 связываются как с целевым внутрисуставным лигандом, так и с циркулирующим в крови IL-6. В то время как антитела, связывающиеся с IL-6R действуют и на клетки, содержащие mIL-6R на поверхности, и на клетки, содержащие только gp130.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
1. Определения
Если иное не определено в настоящем документе, научные и технические термины, используемые в связи с настоящим изобретением, будут иметь значения, которые обычно понятны специалистам в данной области. Примерные способы и материалы описаны ниже, хотя на практике или при тестировании настоящего изобретения могут также использоваться способы и материалы, подобные или эквивалентные тем, что описаны в настоящем документе. Все публикации и другие ссылочные материалы, упомянутые в настоящем документе, включены во всей их полноте путем отсылки. В случае противоречий настоящее описание, включая определения, будет превалировать. Хотя в настоящем документе цитируется ряд документов, такое цитирование не является признанием того, что любой из этих документов образует часть общеизвестных знаний в данной области.
Кроме того, если по контексту не требуется иное, термины в единственном числе включают в себя термины во множественном числе, и термины во множественном числе включают в себя термины в единственном числе. Как правило, используемая классификация и методы клеточной и тканевой культуры, молекулярной биологии, иммунологии, микробиологии, генетики, аналитической химии, химии органического синтеза, медицинской и фармацевтической химии, а также гибридизации и химии белка и нуклеиновых кислот, описанные в настоящем документе, хорошо известны специалистам и широко применяются в данной области. Ферментные реакции и способы очистки осуществляют в соответствии с инструкциями производителя, как это обычно осуществляется в данной области, или как описано в настоящем документе.
В этом описании и вариантах осуществления изобретения слова «иметь» и «содержать» или их вариации, такие как «имеет», «имеющий», «содержит» или «содержащий», следует понимать как включение указанного целого или группы целых, но не исключение любого другого целого или группы целых.
Если не указано иное, в настоящем тексте применяются общепринятые однобуквенные обозначения аминокислот.
Термины «интерлейкин-6», «ИЛ-6», «ИЛ6», «IL6» и «IL-6» в настоящем тексте используются взаимозаменяемо.
Термин «IL-6R», «IL6R» или CD126 обозначает рецептор интерлейкина-6.
Термин «sIL-6R» обозначает растворимую форму рецептора интерлейкина-6.
Термин «mIL-6R» обозначает связанный с мембраной рецептор интерлейкина-6.
Термин «антитело» и «иммуноглобулин» являются взаимозаменяемыми и относятся к полноразмерному антителу в том виде, в каком они синтезируются клетками иммунной системы или иными организмами, модифицированными средствами генной инженерии.
Полноразмерные антитела состоят из четырех полипептидных цепей:
двух тяжелых цепей (Н) (приблизительно 50-70 кД при полной длине) и
двух легких цепей (L) (приблизительно 25 кД при полной длине), связанных между собой дисульфидными мостиками.
N-концевая (аминоконцевая) часть каждой цепи включает вариабельный участок из приблизительно 100-110 или более аминокислот, которые в основном отвечают за распознавание антигенов.
С-концевая (карбоксиконцевая) часть каждой цепи определяет константный участок, главным образом, отвечающий за функцию эффектора.
Вариабельные участки тяжелых и легких цепей образуют антигенсвязывающий центр (или участок).
Легкие цепи антител классифицируют как каппа или лямбда, каждая из которых имеет конкретный константный участок. Каждая легкая цепь состоит из вариабельного участка N-концевой части легкой цепи («LCVR» или «VL») и константного участка легкой цепи, состоящего из одного домена CL.
Тяжелые цепи классифицируют как гамма, мю, альфа, дельта или эпсилон, и они определяют изотип антитела, такой как IgG, IgM, IgA, IgD и IgE, соответственно, и несколько из них могут быть дополнительно разделены на подклассы (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Каждый тип тяжелой цепи характеризуется конкретным константным участком, Fc. Каждая тяжелая цепь состоит из вариабельного участка N-концевой тяжелой цепи («HCVR» или «VH») и константного участка тяжелой цепи СH. Константный участок тяжелой цепи состоит из трех доменов (CH1, СН2 и СН3) для IgG, IgD и IgA и 4 доменов (CH1, СН2, СН3 и СН4) для IgM и IgE.
Участки HCVR и LCVR могут быть дополнительно разделены на участки гипервариабельности, называемые Rf-гипервариабельными участками (CDR), перемежающиеся с более консервативными участками, называемыми каркасными участками (FR).
Каждый HCVR и LCVR состоит из трех CDR и четырех FR, расположенных в следующем порядке от аминоконца к карбоксиконцу: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
CDR содержат большинство остатков, которые образуют специфические взаимодействия с антигеном.
Вариабельные участки каждой из пар легкая/тяжелая цепь образуют антигенсвязывающие сайты антитела. Как используется в данной заявке, «антигенсвязывающая часть», или «антигенсвязывающий участок», или «антигенсвязывающий домен» или «антигенсвязывающий центр» относятся, взаимозаменяемо, к такой части молекулы антитела, которая содержит аминокислотные остатки, взаимодействующие с антигеном и придающие антителу его специфичность и аффинность по отношению к антигену. Эта часть антитела включает «каркасные» аминокислотные остатки, необходимые для поддержания надлежащей конформации антигенсвязывающих остатков.
Под «антителом» в настоящей заявке не обязательно понимается антитело человека, это может быть антитело грызуна, антитело животного семейства приматов или Camelidae, предпочтительно антитело мыши, макаки, антитело верблюда или ламы, химерное антитело, гуманизированное антитело или полностью человеческое антитело.
Термин «антитело» в настоящем тексте также охватывает искусственно сконструированные одноцепочечные антитела, имеющие структуру, близкую к структуре натуральных антител.
Антитела, упоминаемые в настоящем тексте, могут быть гликолизированными или свободными от полисахаридных остатков.
Под антителом по изобретению может пониматься моноклональное антитело. Под «моноклональным антителом» понимается гомогенная или по существу гомогенная популяции антител (т.е. по крайней мере приблизительно 89, 90, 91, 92, 93, 94, 95, 96%, более предпочтительно по крайней мере приблизительно 97 или 98% или еще более предпочтительно по крайней мере 99% антител в популяции будут конкурировать в анализе ELISA за тот же антиген или эпитоп, или более предпочтительно антитела являются идентичными в аминокислотной последовательности).
Также под моноклональными антителами понимаются антитела, имеющие идентичную или по существу идентичную аминокислотную последовательность, хотя они могут отличаться по посттрансляционной модификации, например паттернгликолизации.
Моноклональные антитела по изобретению могут быть получены с использованием, например, гибридомных методик, хорошо известных из уровня техники, а также рекомбинантных технологий, технологий фагового дисплея, синтетических технологий или комбинаций таких технологий или других технологий, хорошо известных из уровня техники.
Однако, термин «моноклональное антитело» не ограничивается антителами, полученными только с помощью гибридомной технологии. Этот термин может относиться к антителу, полученому из единой копии или клона, включая, например, любой эукариотический, прокариотический или фаговый клон.
Нумерацию аминокислотных остатков в настоящем тексте осуществляют со ссылкой на референсное антитело, под которым понимается антитело, тяжелые цепи которого имеют последовательность SEQ ID NO: 10, а легкие цепи - последовательность SEQ ID NO: 9. Во всех остальных случаях нумерацию и позиционирование CDR-аминокислотных остатков в пределах HCVR и LCVR участков антител осуществляют в соответствии с номенклатурой Kabat et al. Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991), если не указано иное.
Антитела согласно изобретению могут быть получены различными методиками конструирования, в том числе, с использованием рекомбинантных способов, включая шаффлинг ДНК, полученной из различных источников.
Антитела настоящего изобретения могут быть моноспецифическими, биспецифическими или мультиспецифическими. Мультиспецифические антитела могут быть специфичны по отношению к различным эпитопам одного целевого полипептида или могут содержать антиген-связывающие домены, специфические по отношению к иному одному или нескольким антигенам, помимо IL-6R или к разным эпитопам IL-6R (см., например, Tuttetal. (1991) J. Immunol. 147:60-69).
Связи между антигенсвязывающими частями моно-, би- и мультиспецифичных антител могут быть различными. В частности, связи между антигенсвязывающими частями могут быть химическими, либо разные антигенсвязывающие части могут быть объединены через общую полипептидную цепь, либо путем нековалентной ассоциации разных цепей друг с другом, либо антигенсвязывающие части могут быть объединены друг с другом посредством другого антитела или фрагмента антитела.
Термин «анти-sIL-6R-антитело», «антитело к sIL-6R», «антитело, специфически связывающееся с рецептором интерлейкина-6» и т.п. являются взаимозаменяемы в контексте настоящей заявки и относятся к антителу, которое специфически связывается с рецептором IL-6. Термин «mIL-6R» обозначает связанный с мембраной рецептор интерлейкина-6.
Термин «sIL-6R» обозначает растворимую форму рецептора интерлейкина-6.
Под «фрагментом антитела» понимается любой фрагмент натурального и искусственно сконструированного антитела, содержащий три или менее CDR тяжелой и три или менее CDR легкой цепи. Под фрагментом антитела может подразумеваться, в частности, по существу полноразмерное антитело, с укороченным каркасным участком тяжелой цепи, полный или полноразмерный Fc-участок, часть или фрагмент антитела, содержащий антигенсвязующую часть, например, Fab-фрагмент, Fab'-фрагмент или Р(ab')2-фрагмент антитела, scFv, (scFv)2, dsFv, одноцепочечный Fv-фрагмент, который может быть получен путем связывания ДНК, кодирующей LCVR и HCVR, с линкерной последовательностью (см. Pluckthun, The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, p. 269-315, 1994).
Термин «фрагмент антитела» не должен пониматься, как указывающий на происхождение от полноразмерного антитела. «Фрагмент антитела» может быть получен совершенно независимо от полноразмерных антител любым известным способом.
Под «фрагментом антитела» также подразумевается искусственно сконструированный полипептид или продукт, содержащий пептидные и непептидные части, если в его состав входят упомянутые три или менее CDR тяжелой и три или менее CDR легкой цепи, расположенные таким образом, что полипептид или упомянутый продукт сохраняют способность специфического или предпочтительного связывания своей мишени (например, эпитопа или антигена).
Все остальное, сказанное выше применительно к антителам, в том числе, то, что касается гликозилирования, также применимо и к фрагментам антител, если это не противоречит здравому смыслу.
Термин «специфически связывает», что используется в данной заявке, относится к той ситуации, при которой один участник пары специфического связывания не связывает в значительной степени молекулы, отличные от его партнера (партнеров) по специфическому связыванию. Термин также применим, когда, например, антигенсвязывающий домен антитела по изобретению является специфическим для конкретного эпитопа, который переносится рядом антигенов, в таком случае специфическое антитело, имеющее антигенсвязывающий домен, будет способно к специфическому связыванию различных антигенов, несущих эпитоп. Соответственно, антитело по изобретению или его фрагмент специфически связывает sIL-6R человека, в то время как оно практически не связывается с человеческими белками IL12, IL23, EGFR, CD3, IGFR, CTGF, FGF2, PD1, PSCK9, CD38, GCSF, интерферон альфа 2b.
Термин «эпитоп» относится к той части молекулы, которая способна распознаваться и связываться с антителом в одном или более антигенсвязывающих участках антитела. Эпитопы часто состоят из химически активных поверхностных групп молекул, таких как аминокислоты или сахарные боковые цепи, и обладают специфическими трехмерными структурными характеристиками, а также специфическими зарядовыми характеристиками. Под «ингибирующим эпитопом» и/или «нейтрализующим эпитопом» подразумевается эпитоп, который в контексте интактной антигенной молекулы и при связывании антителом, специфическим к эпитопу, приводит к утрате или к уменьшению биологической активности молекулы или организма, который содержит молекулу, invivo или invitro. Термин «эпитоп», как используется в данной заявке, кроме того, относится к части полипептида, которая обладает антигенной и/или иммуногенной активностью у животного, предпочтительно млекопитающего, например мыши или человека. Термин «антигенный эпитоп», как используется в данной заявке, определяется как часть полипептида, с которой может специфически связываться антитело, определенная любым способом, хорошо известным из уровня техники, например при помощи традиционного иммунного анализа. Антигенные эпитопы не обязательно должны быть иммуногенными, но могут также быть имуногенными. «Иммуногенный эпитоп», как используется в данной заявке, определяется как часть полипептида, который вызывает отклик антитела у животного, что устанавливается любым способом, известным из уровня техники. «Нелинейный эпитоп» или «конформационный эпитоп» содержат несмежные полипептиды (или аминокислоты) в пределах антигенного протеина, с которым антитело, специфическое к эпитопу, связывается.
Выражения «биологическое свойство» или «биологическая характеристика» или термины «активность» или «биоактивность» по отношению к антителу по изобретению используются в данной заявке как взаимозаменяемые и включают, но не ограничиваются приведенными, эпитоп/антигенную аффинность и специфичность к sIL-6R, способность быть антагонистом IL-6, стабильность антитела и иммуногенные свойства антитела invivo. Остальные идентифицируемые из уровня техники биологические свойства или характеристики антитела включают, например, перекрестную реактивность (т.е. с нечеловеческими гомологами пептида-мишени или с остальными протеинами или мишенями, в общем), и способность сохранять высокие уровни экспрессии протеина в клетках млекопитающих. Вышеуказанные свойства или характеристики могут наблюдаться, измеряться или оцениваться с использованием методик, признанных в уровне техники, включая, но не ограничиваясь приведенными, анализ ELISA, конкурентный анализ ELISA, или анализ поверхностного плазмонного резонанса KINEXA, анализы нейтрализации invitro или invivo без ограничений, рецепторного связывания, продуцирования и/или секреции цитокина или фактора роста, сигнальную трансдукцию и иммуногистохимию срезов тканей, полученных из различных источников, включая человека, примата или любой другой источник.
Термин «ингибировать» или «нейтрализовать», как используется в данной заявке, по отношению к активности антитела по изобретению, означает способность в значительной степени противодействовать, препятствовать, предотвращать, ограничивать, замедлять, прерывать, уничтожать, прекращать, уменьшать или обращать, например, развитие или тяжесть того, что ингибируют, включая, но не ограничиваясь вышеприведенными, биологическую активность (например, активность IL-6) или свойство, заболевание или состояние. Ингибирование или нейтрализация активности IL-6 в результате связывания антитела по изобретению с sIL-6R составляет предпочтительно по крайней мере приблизительно 20, 30, 40, 50, 60, 70, 80, 90, 95% или выше.
Термин «пациент» в данной заявке относится к млекопитающему, включая, но не ограничиваясь приведенными, мышей, обезьян, людей, млекопитающих сельскохозяйственных животных, млекопитающих спортивных животных и млекопитающих комнатных животных; предпочтительно термин относится к людям. В определенном из вариантов осуществления пациент, предпочтительно млекопитающее, предпочтительно человек, дополнительно характеризуется заболеванием или расстройством, или состоянием, опосредованными IL-6, которые могут быть улучшены путем уменьшения биоактивности IL-6.
Термин «вектор» включает молекулу нуклеиновой кислоты, способную транспортировать другую нуклеиновую кислоту, с которой она связана, включая плазмиды и вирусные векторы, но не ограничиваясь ими. Определенные векторы способны к автономной репликации в клетке-хозяине, в которую они введены, в то время как остальные векторы могут быть интегрированы в геном клетки-хозяина и, таким образом, реплицированы наряду с геномом-хозяином. Более того, определенные векторы способны направлять экспрессию генов, с которыми они функционально связаны. Такие векторы имеют в данной заявке название «векторы рекомбинантной экспрессии» (или, упрощенно, «векторы экспрессии»), а иллюстративные векторы хорошо известны из уровня техники.
Как используется в данной заявке, выражения «клетка», «клетка-хозяин», «линия клеток» и «клеточная культура», «клеточная линия как продуцент» используются как взаимозаменяемые и включают индивидуальную клетку или клеточную культуру, являющиеся реципиентом любого выделенного полинуклеотида по изобретению или любого рекомбинантного вектора (любых рекомбинантных векторов), которые содержат последовательность, кодирующую HCVR, LCVR или моноклональное антитело по изобретению. Клетки-хозяева включают потомство индивидуальной клетки-хозяина, и потомство не обязательном должно быть полностью идентичным (по морфологии или полному ДНК комплементу) оригинальной родительской клетке из-за природных, случайных или преднамеренных мутаций и/или изменений. Клетка-хозяин включает клетки, трансформированные, трансдуцированные или инфицированные рекомбинантным вектором, или моноклональное антитело, которое экспрессирует полинуклеотид по изобретению или его легкую или тяжелую цепь. Клетка-хозяин, которая содержит рекомбинантный вектор по изобретению (как стабильно включенный в хромосом-хозяин, так и не включенный), также может называться «рекомбинантной клеткой-хозяином». Предпочтительными клетками-хозяевами для использования в изобретении являются СНО клетки (например, АТСС CRL-9096), NS0 клетки, SP2/0 клетки, COS клетки (АТСС, например, CRL-1650, CRL-1651) и HeLa (АТСС CCL-2). Дополнительные клетки-хозяева для использования в изобретении включают растительные клетки, дрожжевые клетки, другие клетки млекопитающих и прокариотные клетки.
Термин «аффинность» относится к измерению притяжения между антигеном и связывающей молекулой, например, антителом. Внутренняя способность к притяжению связывающей молекулы по отношению к антигену, как правило, выражается как константа равновесия аффинности связывания (KD) конкретного взаимодействия связывающей молекулы и антигена. Считается, что связывающая молекула специфически связываться с антигеном, когда KD составляет ≤1 мМ, предпочтительно ≤100 нМ. AKD константа связывания аффинности может быть измерена, например, с помощью поверхностного плазменного резонанса (BIAcoreTM) или биослойной интерферометрии, например, с использованием системы ProteOnTM XPR36 SPR от Bio-Rad или системы OctetTM.
Термин «Ka», как использовано в данном описании, относится к скорости ассоциации конкретного взаимодействия антитело-антиген, тогда как термин «Kd» относится к скорости диссоциации конкретного взаимодействия антитело-антиген. Термин «KD» в данном описании относится к константе афинности, которую получают из отношения Kd к Ka (т.е. Kd/Ka), и ее выражают в виде молярной концентрации (М). Величины KD для антител могут быть определены с использованием способов, хорошо установленных в данной области.
Предпочтительным способом определения KD антитела является способ с использованием резонанса поверхностных плазмонов, предпочтительно с использованием биосенсорной системы, такой как система Biacore®.
Как использовано в данном описании, термин «высокая аффинность» в отношении IgG-антитела относится к антителу, имеющему KD - Е-10 - Е-08 М, более предпочтительно Е-10 - Е-09 М или менее и, даже более предпочтительно, Е-10 М или менее в отношении антигена-мишени. Однако «высокая аффинность» связывания может варьироваться для других изотипов антигена. Например, «высокая аффинность» связывания для изотипа IgM относится к антителу, имеющему KD Е-10 - Е-07 М или менее, более предпочтительно Е-10 - Е-08 М или менее, даже более предпочтительно Е-10 - Е-09 М или менее.
Термин «Koff» относится к константе скорости диссоциации конкретного взаимодействия связывающей молекулы и антигена. Константу скорости диссоциации koff + можно измерить посредством биослойной интерферометрии, например, с помощью системы Octet™.
Термин «эпитоп» при использовании в данном документе относится к части (детерминанте) антигена, который специфически связывается со связывающей молекулой (например, антитело или родственная молекула, такие как биспецифичная связывающая молекула). Эпитопные детерминанты обычно состоят из молекул, таких как аминокислоты или углеводы, или боковые цепи сахаров, и, как правило, имеют специфические трехмерные структурные характеристики, а также специфические характеристики зарядов. Эпитоп может быть «линейным» или «конформационным». В линейном эпитопе все точки взаимодействия между белком (например, антиген) и взаимодействующей молекулой (такой как антитело) происходит линейно вдоль первичной аминокислотной последовательности белка. В конформационном эпитопе, точки взаимодействия происходят через аминокислотные остатки на белке, отделенные друг от друга в первичной аминокислотной последовательности. Когда желаемый эпитоп антигена определен, можно генерировать антитела к этому эпитопу с использованием методик, хорошо известных в данной области техники. Кроме того, генерация и характеристика антител или других связывающих молекул могут пролить свет на информацию о желательных эпитопах. Основываясь на этой информации, можно затем конкурентно скринировать связывающие молекулы для связывания с теми же или аналогичными эпитопами, например, путем проведения исследований конкуренции, чтобы найти связывающие молекулы, которые конкурируют за связывание с антигеном. Термин «эпитоп», как используется в данной заявке, кроме того, относится к части полипептида, которая обладает антигенной и/или иммуногенной активностью у животного, предпочтительно млекопитающего, например мыши или человека. Термин «антигенный эпитоп», как используется в данной заявке, определяется как часть полипептида, с которой может специфически связываться антитело, определенная любым способом, хорошо известным из уровня техники, например, при помощи традиционного иммунного анализа.
Можно определить, связывается ли антитело или другая связывающая молекула с тем же эпитопом или перекрестно конкурирует за связывание с IL-6 связывающей молекулой по данному изобретению, используя хорошо известные в данной области техники методы. В одном варианте осуществления изобретения возможно связывание молекулы, предложенной в данном изобретении, с IL-6 в условиях насыщения с последующим измерением способности испытуемого антитела связываться с указанным антигеном-мишенью. Если испытуемое антитело способно связываться с антигеном-мишенью в одно время с референсной связывающей молекулой, то испытуемое антитело связывается с эпитопом, отличным от эпитопа референсной связывающей молекулы. Тем не менее, если испытуемое антитело не способно связываться с антигеном-мишенью одновременно, то испытуемое антитело связывается с тем же эпитопом, перекрывающимся эпитопом или эпитопом, который находится в непосредственной близости от эпитопа, связанного с связывающей молекулой. Этот эксперимент может быть выполнен с использованием ИФА, РИА, анализа межмолекулярных взаимодействий на BIACORETM, биослойной интерферометрии или проточной цитометрии. Для того, чтобы проверить, кросс конкурирует ли связывающая молекула по данному изобретению с другой связывающей молекулой, можно использовать описанный выше способ конкурентного анализа в двух направлениях, то есть определить, блокирует ли известная связывающая молекула испытуемую связывающую молекулу, и наоборот. Такие эксперименты по перекрестной конкуренции могут быть выполнены, например, с помощью прибора IBIS МХ96 SPR или системы OctetTM.
В одном варианте осуществления изобретения связывающая молекула, предложенная в данном изобретении, представляет собой моноклональное антитело. Используемое в данном документе сокращение «mAb» относится к моноклональному антителу, то есть антителу, которые синтезировано и выделено отдельной клональной популяцией клеток. Клональная популяция может быть клональной популяцией иммортализованных клеток. В некоторых вариантах осуществления изобретения иммортализованные клетки в клональной популяции являются гибридными клетками, гибридомами, которые обычно получают путем слияния отдельных В-лимфоцитов от иммунизированных животных с отдельными клетками лимфоцитарной опухоли. Гибридомы представляют собой тип сконструированных клеток и не встречаются в природе.
Класс (изотип) и подкласс антител может быть определен любым способом, известным в данной области техники. В целом, класс и подкласс антитела может быть определен с помощью антител, специфичных к конкретному классу и подклассу антител. Такие антитела коммерчески доступны. Класс и подкласс может быть определен с помощью ИФА, вестерн-блот анализа, а также другими методами. В другом варианте класс и подкласс может быть определен посредством секвенирования всех или части константных доменов тяжелой и/или легкой цепей антител, сравнения их аминокислотных последовательностей с известными аминокислотными последовательностями различных классов и подклассов иммуноглобулинов и определения класса и подкласса антител.
Термин «идентичность» или «гомологичность» в контексте последовательностей нуклеиновых кислот, относится к остаткам в двух последовательностях, которые являются одинаковыми при выравнивании для максимального соответствия. Сравнение идентичности последовательности может проходить на участке длиной по меньшей мере около девяти нуклеотидов, обычно по меньшей мере около 18 нуклеотидов, чаще по меньшей мере около 24 нуклеотида, типично по меньшей мере около 28 нуклеотидов, более типично по меньшей мере около 32 нуклеотидов, и предпочтительно по меньшей мере около 36, 48 или более нуклеотидов. Существует целый ряд различных алгоритмов, известных в данной области, которые могут быть использованы для измерения идентичности нуклеотидной последовательности. Например, полинуклеотидные последовательности можно сравнить с использованием FASTA, Gap или BESTFIT, которые являются программами в Wisconsin Package версии 10.0, Genetics Computer Group (GCG), Мэдисон, штат Висконсин. FASTA, которая включает, например, программы FASTA2 и FASTA3, обеспечивает выравнивание и процентную идентичность последовательности в областях наилучшего покрытия между запрашиваемой и искомой последовательностями (Pearson, Methods Enzymol. 183:63 98 (1990); Pearson, Methods Mol. Biol. 132: 185-219 (2000); Pearson, Methods Enzymol. 266: 227-258 (1996); Pearson, J. Mol. Biol. 276: 71-84 (1998)). Если не указано иное, используются параметры по умолчанию для конкретной программы или алгоритма. Например, процент идентичности последовательности между последовательностями нуклеиновых кислот может быть определен с использованием FASTA с параметрами по умолчанию (размер слова 6 и фактора NOPAM для балльной матрицы) или с использованием Gap с параметрами по умолчанию, как это предусмотрено в GCG версии 6.1.
Термин «гомологичный», что касается полипептидной последовательности антитела, следует толковать как антитело, проявляющее по крайней мере, 70%-ную, предпочтительно 80%-ную, более предпочтительно 90%-ную и наиболее предпочтительно 95%-ную идентичность последовательности относительно полипептидной последовательности. Термин в отношении последовательности нуклеиновой кислоты следует толковать как последовательность нуклеотидов, проявляющих, по крайней мере, 85%-ную, предпочтительно 90%-ную, более предпочтительно 95%-ную и наиболее предпочтительно 97%-ную идентичность последовательности относительно последовательности нуклеиновой кислоты.
Выражение «биспецифическое антитело» или «мультиспецифическое антитело» включает антитело, способное селективно связывать два или более эпитопа. Биспецифические антитела, например, могут включать две различных антиген-связывающих части, где указанные антиген-связывающие части специфически связывают разные эпитопы или на различных молекулах (например, антигенах), или на одной и той же молекуле (например, на одном и том же антигене). Если биспецифическое антитело способно селективно связывать два различных эпитопа (первый эпитоп и второй эпитоп), аффинность первой антиген-связывающих части для первого эпитопа, как правило будет по меньшей мере от одного до двух, или трех, или четырех порядков ниже, чем аффинность первой антиген-связывающих части для второго эпитопа, и наоборот. Эпитопы, распознаваемые биспецифическим антителом, могут представлять собой одну и ту же или различную мишень (например, на одном и том же или различном белке). Биспецифические антитела можно получать, например, комбинированием тяжелых цепей, которые распознают различные эпитопы на одном и том же антигене. Например, последовательности нуклеиновой кислоты, кодирующие вариабельные последовательности тяжелых цепей, которые распознают различные эпитопы, могут быть слиты с последовательностями нуклеиновой кислоты, кодирующими различные константные области тяжелой цепи, и такие последовательности можно экспрессировать в клетке, которая экспрессирует легкую цепь иммуноглобулина. Типичное биспецифическое антитело имеет две тяжелые цепи, где каждая имеет три CDR тяжелой цепи, с последующим (от N-конца до С-конца) доменом СН1, шарнирной областью, доменом СН2 и доменом СН3, и легкой цепью иммуноглобулина, которая или не наделена антигенсвязывающей специфичностью, но может объединяться с каждой из тяжелой цепей, или может объединяться с каждой из тяжелых цепей и может связывать один или несколько эпигонов, ограниченных антигенсвязывающими областями тяжелой цепи, или может объединяться с каждой из тяжелых цепей и способствует связыванию или одной или обеих тяжелых цепей с одним или обоими эпигонами.
2. Задача
Задача настоящего изобретения состоит в создании антител или их фрагментов, обладающих способностью специфически связываться с человеческим рецептором интерлейкина-6, которые были бы применимы в качестве лекарственных средств для лечения или диагностики заболеваний или для облегчения симптомов, опосредованных интерлейкином-6.
3. Антитела по изобретению и их фрагменты
В соответствии с настоящим изобретением предлагается антитело или его антигенсвязывающий фрагмент, в которых способность связываться с рецептором интерлейкина-6 (IL-6) человека обеспечивается за счет того, что оно содержит в себя аминокислотную последовательность, по меньшей мере, на 75% гомологичную последовательности SEQ ID NO: 3.
В одном варианте осуществления настоящее изобретение относиться к антителу или его фрагменту, которые содержат аминокислотную последовательность SEQ ID NO: 3.
В некоторых вариантах осуществления настоящее изобретение относиться к антителу или его фрагменту, которые содержат в себе:
- последовательность вариабельного домена тяжелой цепи, которая по меньшей мере на 75% гомологичную последовательности SEQ ID NO: 9, и
- последовательность вариабельного домена легкой цепи, по меньшей мере на 75% гомологичную последовательности SEQ ID NO: 10.
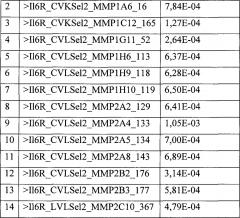
В одном варианте осуществления настояще