Хиназолиновые ингибиторы активирующих мутированных форм рецептора эпидермального фактора роста
Иллюстрации
Показать всеИзобретение относится к области органической химии, а именно к гетероциклическому соединению формулы (I) или его фармацевтически приемлемой соли. Также изобретение относится к фармацевтической композиции на основе соединения формулы (I) или его фармацевтически приемлемой соли, их применению и способу лечения рака. Технический результат: получены новое соединение формулы (I) и его фармацевтически приемлемые соли, которые обладают ингибиторной активностью в отношении активирующих мутированных форм EGFR и полезны при лечении рака. 6 н. и 10 з.п. ф-лы, 10 табл., 12 ил., 7 пр.
Реферат
Настоящее изобретение относится к некоторым 4-(замещенным анилино)-6-O-(замещенным пиперазин-карбонил)хиназолиновым соединениям и их фармацевтическим солям, которые могут быть полезны в лечении или предупреждении заболевания или медицинского состояния, опосредованного активирующими мутированными формами рецептора эпидермального фактора роста (EGFR), например L858R активирующим мутантом и/или активирующими мутантами с делецией в экзоне 19. Такие соединения и их соли могут быть полезны в лечении или предупреждении ряда различных злокачественных новообразований. Изобретение также относится к фармацевтическим композициям, содержащим указанные соединения или их фармацевтически приемлемую соль, кристаллическим формам этих соединений или их фармацевтически приемлемой соли, промежуточным соединениям, полезным при производстве указанных соединений или их фармацевтически приемлемой соли, и к способам лечения заболеваний, опосредованных активирующими мутированными формами EGFR, с использованием указанных соединений или их фармацевтически приемлемой соли.
EGFR (также известный как ErbB1 или HER1) представляет собой трансмембранный белок тирозинкиназу, являющуюся членом семейства erbB рецептора. При связывании лиганда фактора роста, такого как эпидермальный фактор роста (EGF), рецептор может гомодимеризоваться с другой молекулой EGFR или гетеродимеризоваться с другим членом семейства, таким как erbB2 (HER2), erbB3 (HER3) или erbB4 (HER4).
Гомо- и/или гетеро-димеризация erbB рецепторов приводит в результате к фосфорилированию ключевых тирозиновых остатков во внутриклеточном домене и ведет к стимуляции огромного количества внутриклеточных путей передачи сигнала, вовлеченных в клеточную пролиферацию и выживание. Нарушение регуляции передачи сигнала erbB семейства вызывает пролиферацию, инвазию, метастаз, ангиогенез и выживание опухолевых клеток и было описано для многих злокачественных новообразований у человека, в том числе легкого, головы и шеи, и груди.
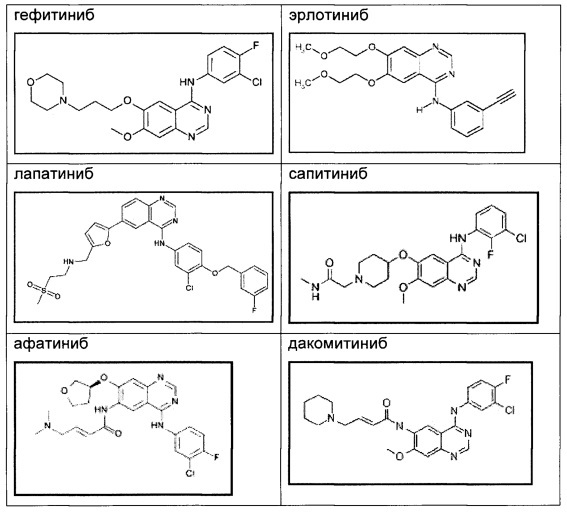
Таким образом, erbB семейство представляет рациональную мишень для разработки противораковых лекарственных средств, и в настоящее время в клинической практике доступен ряд агентов, направленных на EGFR или erbB2, включая гефитиниб (IRESSA™), эрлотиниб (TARCEVA™) и лапатиниб (TYKERB™, TYVERB™). Подробное описание передачи сигнала erbB рецептора и его вовлеченности в онкогенез представлено в New England Journal of Medicine [2008] Vol. 358; 1160-74, и Biochemical and Biophysical Research Communications [2004] Vol. 319: 1-11.
В 2004 году сообщалось (Science [2004] Vol. 304: 1497-500, и New England Journal of Medicine [2004] Vol. 350; 2129-39), что активирующие мутации в EGFR коррелировали с ответом на терапию гефитинибом при немелкоклеточном раке легкого (NSCLC). Приблизительно 90% связанных с NSCLC мутаций EGFR включают две основных мутации EGFR (делеция Е746-А750 в экзоне 19 и мутация с заменой L858R в экзоне 21) (Pao et al. Proceedings of the National Academy of Sciences of the United States of America [2004], Vol. 13: 306-11, и Kosada et al. Cancer Research [2004], Vol. 64: 8919-23). Эти активирующие мутации приводят в результате к увеличению сродства к низкомолекулярным ингибиторам тирозинкиназы, таким как гефитиниб и эрлотиниб, и снижению сродства к аденозинтрифосфату (АТР) по сравнению с EGFR дикого типа (WT).
Однако, о побочных действиях, таких как кожная сыпь и диарея, которые, как считают, связаны с подавлением сигнальных путей EGFR WT в нормальных клетках кожи и кишечника, сообщалось более чем у 60% пациентов с NSCLC, подвергаемых лечению гефитинибом или эрлотинибом (Zhou СС et al. Journal of Clinical Oncology [2011], Vol. 12: 735-42; Mok TS et al. New England Journal of Medicine [2009], Vol. 361: 947-57). Кроме того, и гефитиниб, и эрлотиниб демонстрировали ограниченное воздействие при лечении пациентов с NSCLC с метастазами в головной мозг, поскольку ни один из них эффективно не проникает через гематоэнцефалический барьер (ВВВ) (McKillop D et al. Xenobiotica [2004], Vol. 34: 983-1000; Jackman DM et al. Journal of Clinical Oncology [2006], Vol. 24: 4517-20 Grommes С et al. Neuro-Oncology [2011], Vol. 13: 1364-9), тогда как по некоторым данным видно, что решение проблемы метастазов в головной мозг при раке легкого становится нереализованной потребностью медицины (Gavrilovic et al, Journal of Neurooncology [2005], Vol. 75: 5-14; Barnholtz-Sloan JS et al. Journal of Clinical Oncology [2004], 22: 2865-72; Schouten LJ et al, Cancer [2002], Vol. 94: 2698-705).
Лептоменингеальные метастазы встречаются, когда злокачественная опухоль распространяется на мозговые оболочки, слои ткани, которые покрывают головной и спинной мозг. Метастазы могут распространяться на мозговые оболочки через кровь или они могут перемещаться из метастазов головного мозга, переносимые спинномозговой жидкостью (CSF), которая протекает через мозговые оболочки. Если клетки опухоли проникают в CSF и выживают, они могут перемещаться по центральной нервной системе, вызывая неврологические проблемы (Le Rhun et al. Surg Neurol Int. [2013], Vol. 4: S265-88). Частота возникновения лептоменингеальных метастазов возрастает, отчасти вследствие того, что продолжительность жизни онкологических больных увеличивается, но также потому, что многие виды препаратов для химиотерапии и молекулярной целевой терапии не способны достичь достаточной концентрации в спинномозговой жидкости, чтобы уничтожить клетки опухоли. Лечение обычно неэффективно, а продолжительность жизни измеряется неделями. В компании AstraZeneca исследовали сапитиниб (AZD8931), равноэффективный ингибитор рецепторов EGFR, HER2 и HER3, для применения при раке молочной железы. На сегодняшний день сапитиниб изучается в трех клинических исследованиях стадии II; во-первых, в комбинации с паклитакселом в сравнении с паклитакселом, взятым отдельно, у пациентов с распространенным раком молочной железы, демонстрирующих низкий уровень HER2; во-вторых, в комбинации с анастрозолом в сравнении с анастрозолом, взятым отдельно, при гормон-рецептор положительном распространенном раке молочной железы; и в-третьих, в комбинации с паклитакселом в сравнении с паклитакселом, взятым отдельно, при метастатическом раке желудка или гастроэзофагеального перехода, прогрессирующем после терапии первой линии и не подлежащем лечению трастузумабом из-за HER2 статуса. Соединение по настоящему изобретению структурно отличается от сапитиниба и обладает повышенной способностью проникать в головной мозг, что делает его потенциально полезным в лечении злокачественных новообразований, которые метастазируют в центральную нервную систему [CNS], в частности тех, которые метастазируют в головной мозг, и тех, которые приводят к лептоменингеальным метастазам.
В настоящее время некоторые необратимые хиназолиновые ингибиторы EGFR, такие как афатиниб и дакомитиниб, находятся на стадии клинической разработки. Хотя эти соединения показывали сравнимые с гефитинибом и эрлотинибом воздействия на активирующие мутации в EGFR у пациентов с NSCLC, они демонстрировали более тяжелые побочные действия, такие как кожная сыпь (в более чем 90% - случаи кожной сыпи и диареи) (Zhou СС et al. Journal of Clinical Oncology [2011], Vol. 12: 735-42; Mok TS et al. New England Journal of Medicine [2009], Vol. 361: 947-57; Miller VA et al. Lancet Oncology [2012], Vol. 13: 528-38; Ramalingam SS et al. Journal of Clinical Oncology [2012], Vol. 30: 3337-44). Соединения по настоящему изобретению являются обратимыми ингибиторами, и поэтому ожидается, что они обладают менее выраженными побочными действиями, связанными с EGFR, чем афатиниб и дакомитиниб.
Некоторые хиназолиновые соединения были раскрыты, смотри, например "Получение хиназолиновых производных для лечения опухолей" (US 20080177068 А1), "Получение хиназолиновых производных для лечения опухолей" (US 20080167328 А1), "Получение сахаридных производных хиназолинов в качестве ингибиторов белка тирозинкиназы" (CN 101857618 А), "Получение хлорфторанилинометокси-N-метилкарбамоилметил-пиперидинилоксихиназолиновых производных для применения в качестве противоопухолевых агентов" (WO 2010061208 А2), "Получение 4-аминохиназолиновых производных в качестве антинеопластических агентов (CN 101367793 А)", "Получение пролин-хиназолиновых производных в качестве антипролиферативных агентов (BR 2006002275 А)", "Получение хиназолиновых производных в качестве ингибиторов протеинкиназы" (WO 2005097137 А2), "Получение хиназолиновых производных в качестве ингибиторов протеинкиназы" (WO 2005097134 А2), "Получение хиназолиновых производных в качестве ингибиторов тирозинкиназы EGFR" (WO 2005028469 А1), "Получение фениламино-замещенных хиназолинов в качестве ингибиторов EGF и ErbB-2 киназ" (WO 2005028470 А1), "Получение хиназолиновых производных в качестве ингибиторов тирозинкиназы EGFR" (WO 2005026156 А1), "Получение пиперидил-хиназолиновых производных в качестве ингибиторов тирозинкиназы для лечения опухолей" (WO 2005012290 А1), "Получение 4-анилинохиназолинов в качестве антипролиферативных агентов" (WO 2003082831 А1), "Получение аминохиназолинов в качестве ингибиторов сигнальной трансдукции через рецепторы эпидермального фактора роста" (WO 2002018351 А1), "Получение хиназолинов в качестве ингибиторов Аврора-2 киназы" (WO 2001021594 А1), "Хиназолины и другие бициклические гетероциклы, фармацевтические композиции, содержащие эти соединения, в качестве ингибиторов тирозинкиназ и способы их получения" (WO 2000055141 А1), "Получение хиназолиновых производных и их ингибиторные свойства в отношении рецепторных тирозинкиназ" (WO 9738994 А1), "Хиназолиновые производные в качестве противоопухолевых агентов" (WO 9730034 А1), "Получение галогеноанилинохиназолинов в качестве ингибиторов тирозинкиназы рецептора I класса" (WO 9633980 А1) и "Хиназолиновые производные, полезные при лечении неопластического заболевания" (US 5457105).
Соединения по изобретению или их фармацевтически приемлемая соль при сравнении с другими клинически приемлемыми ингибиторами EGFR проявляют некоторые улучшенные свойства, например более высокий уровень проникновения через ВВВ (что делает их потенциально полезными для лечения злокачественных новообразований, которые метастазируют в CNS, в частности метастазов в головной мозг и лептоменингеальных метастазов); показывают лучшую селективность между EGFR WT и мутированным EGFR (что может приводить к меньшим побочным эффектам от лечения, кожной сыпи и диарее); поддерживая аналогичную или улучшенную активность в отношении активирующего мутированного EGFR (например L858R активирующий мутант EGFR и/или активирующие мутанты с делецией в экзоне 19). Поэтому такие соединения или их фармацевтически приемлемая соль могут быть особенно полезны в лечении болезненных состояний, в которые вовлечены эти активирующие мутации EGFR, например в лечении злокачественного новообразования.
Таким образом, согласно настоящему изобретению предложено соединение формулы (I):
или его фармацевтически приемлемая соль.
Структуры клинических соединений, упомянутых выше, являются следующими:
Подходящая фармацевтически приемлемая соль соединения по изобретению представляет собой, например соль присоединения кислоты, например неорганической или органической кислоты, например соляной, бромистоводородной, серной, фосфорной, лимонной, L-винной, гликолевой, фумаровой, янтарной или малеиновой кислоты, в особенности соляной, бромистоводородной, серной, фосфорной, лимонной, L-винной, гликолевой, фумаровой или малеиновой кислоты. Конкретная фармацевтически приемлемая соль соединения по изобретению представляет собой соль соляной кислоты. Еще одна конкретная фармацевтически приемлемая соль соединения по изобретению представляет собой соль янтарной кислоты. Специалисту будет понятно, что также могут быть приемлемы дополнительные соли присоединения кислот, например те, которые показаны в примерах, но не ограничиваются ими.
Соли соединений формулы (I) могут быть образованы, например, посредством взаимодействия соединения формулы (I) с определенным количеством кислоты в среде, такой как среда, в которой соль выпадает в осадок, или в водной среде с последующей лиофилизацией.
Соединения формулы (I) или их фармацевтически приемлемая соль обладают хиральным центром. Следует понимать, что изобретением охватываются все стереоизомеры (энантиомеры и диастереоизомеры) соединений формулы (I) или их фармацевтически приемлемой соли, которые обладают ингибиторной активностью в отношении активирующего мутированного EGFR. Изобретение также относится к любым возможным таутомерным формам соединений формулы (I) или их фармацевтически приемлемой соли, которые обладают ингибиторной активностью в отношении активирующего мутированного EGFR. В дополнительном аспекте изобретения предложен энантиомер формулы (I) или его фармацевтически приемлемая соль, по существу не содержащие каких-либо других энантиомеров. В дополнительном аспекте изобретения предложен (R)-энантиомер формулы (I) или его фармацевтически приемлемая соль, по существу не содержащие каких-либо других энантиомеров. В дополнительном аспекте изобретения предложен (S)-энантиомер формулы (I) или его фармацевтически приемлемая соль, по существу не содержащие каких-либо других энантиомеров.
В одном воплощении изобретения, когда смесь содержит неравные молярные доли энантиомеров, смесь может иметь энантиомерный избыток, выбранный из более чем 50%, более чем 70%, более чем 90% и более чем 95%. Предпочтительно смесь может иметь энантиомерный избыток более 98%. Более предпочтительно смесь может иметь энантиомерный избыток более 99%. Более предпочтительно смесь может иметь энантиомерный избыток более 99,5%.
Также следует понимать, что некоторые соединения формулы (I) или их фармацевтически приемлемая соль могут существовать в сольватированных, а также несольватированных формах, таких как, например, гидратные формы. Следует понимать, что изобретением охватываются все такие сольватированные формы, которые обладают ингибиторной активностью в отношении активирующего мутированного EGFR.
Также следует понимать, что изобретением охватываются все изотопные формы соединений, описанных в данном описании. Например, водород включает дейтерий, а углерод включает 12С и 13С.
В другом аспекте изобретения конкретные соединения по изобретению представляют собой любое соединение согласно примерам или его фармацевтически приемлемую соль.
В другом аспекте изобретения конкретные соединения по изобретению выбраны из:
4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилата;
4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2S)-2,4-диметилпиперазин-1-карбоксилата; и
4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(±)-2,4-диметилпиперазин-1-карбоксилата;
или их фармацевтически приемлемой соли.
В другом аспекте изобретения конкретные соединения по изобретению выбраны из:
4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилата;
4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2S)-2,4-диметилпиперазин-1-карбоксилата; и
4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(±)-2,4-диметилпиперазин-1-карбоксилата.
В другом аспекте изобретения конкретное соединение по изобретению выбрано из фармацевтически приемлемой соли 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилата.
В другом аспекте изобретения конкретное соединение по изобретению выбрано из гидрохлорида 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилата.
В другом аспекте изобретения конкретное соединение по изобретению выбрано из сукцината 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилата.
В другом аспекте изобретения конкретное соединение по изобретению выбрано из 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилата.
В другом аспекте изобретения конкретное соединение по изобретению выбрано из фармацевтически приемлемой соли 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2S)-2,4-диметилпиперазин-1-карбоксилата.
В другом аспекте изобретения конкретное соединение по изобретению выбрано из 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2S)-2,4-диметилпиперазин-1-карбоксилата.
В другом аспекте изобретения конкретное соединение по изобретению выбрано из фармацевтически приемлемой соли 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(-)-2,4-диметилпиперазин-1-карбоксилата.
В другом аспекте изобретения конкретное соединение по изобретению выбрано из 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(-)-2,4-диметилпиперазин-1-карбоксилата.
В другом аспекте изобретения конкретное соединение по изобретению выбрано из фармацевтически приемлемой соли 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(+)-2,4-диметилпиперазин-1-карбоксилата.
В другом аспекте изобретения конкретное соединение по изобретению выбрано из 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(+)-2,4-диметилпиперазин-1-карбоксилата.
В другом аспекте изобретения конкретное соединение по изобретению выбрано из фармацевтически приемлемой соли 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(±)-2,4-диметилпиперазин-1-карбоксилата.
В другом аспекте изобретения конкретное соединение по изобретению выбрано из 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(±)-2,4-диметилпиперазин-1-карбоксилата.
В тех случаях, когда здесь приведены величины оптического вращения (+) или (-), они конкретно измерены при с10, где с представляет собой концентрацию, выраженную в г/мл, в DMSO (диметилсульфоксиде) при 25°C. Также следует понимать, что некоторые соединения по изобретению или их фармацевтически приемлемая соль могут существовать в определенных кристаллических формах. В частности, 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилат идентифицирован как имеющий несколько кристаллических форм - а конкретно форму А, форму Е, форму I и форму J. Кроме того, гидрохлорид 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилата также может существовать в кристаллической форме - а конкретно в форме Α1 моногидрохлорида, и сукцинат 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилата также может существовать в кристаллической форме - а конкретно в форме А8 сукцината. Следует понимать, что настоящим изобретением охватываются все такие кристаллические формы соединений формулы (I) или их фармацевтически приемлемой соли, которые обладают ингибиторной активностью в отношении активирующего мутированного EGFR.
4-[(3-Хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилат в кристаллической форме, форма А
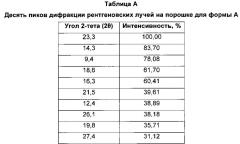
Форма А характеризуется тем, что дает по меньшей мере одно из следующих значений 2θ, измеренных с использованием CuKa излучения: 23,3 и 14,3°. Форма А характеризуется картиной дифракции рентгеновских лучей на порошке по существу такой, как показано на фиг. 1. Десять пиков дифракции рентгеновских лучей на порошке показаны в таблице А.
Согласно настоящему изобретению предложена кристаллическая форма, форма А, которая имеет картину дифракции рентгеновских лучей на порошке с по меньшей мере двумя характеристическими пиками при значениях 2-тета, равных примерно 23,3° и 14,3°.
Согласно настоящему изобретению предложена кристаллическая форма, форма А, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2-тета, равных примерно 23,3; 14,3; 9,4; 18,6; 16,3; 21,5; 12,4; 26,1; 19,8; 27,4°.
Согласно настоящему изобретению предложена кристаллическая форма, форма А, которая имеет картину дифракции рентгеновских лучей на порошке по существу такую же, как картина дифракции рентгеновских лучей на порошке, показанная на фиг. 1.
Согласно настоящему изобретению предложена кристаллическая форма, форма А, которая имеет картину дифракции рентгеновских лучей на порошке с по меньшей мере двумя характеристическими пиками при значениях 2-тета, равных 23,3° и 14,3°, где указанные значения могут составлять плюс или минус 0,2° 2-тета.
Согласно настоящему изобретению предложена кристаллическая форма, форма А, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2-тета, равных 23,3; 14,3; 9,4; 18,6; 16,3; 21,5; 12,4; 26,1; 19,8; 27,4°, где указанные значения могут составлять плюс или минус 0,2° 2-тета.
Анализ формы А посредством DSC (дифференциальной сканирующей калориметрии) показывает эндотерму плавления с началом при 192,4°С и пиком при 195,8°С (фиг. 2).
4-[(3-Хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилат в кристаллической форме, форма Ε
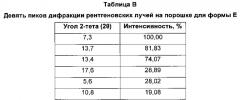
Форма Ε характеризуется тем, что дает по меньшей мере одно из следующих значений 2θ, измеренных с использованием CuKa излучения: 7,3 и 13,7°. Форма Ε характеризуется картиной дифракции рентгеновских лучей на порошке по существу такой, как показано на фиг. 3. Девять пиков дифракции рентгеновских лучей на порошке показаны в таблице В.
Согласно настоящему изобретению предложена кристаллическая форма, форма Е, которая имеет картину дифракции рентгеновских лучей на порошке с по меньшей мере двумя характеристическими пиками при значениях 2-тета, равных примерно 7,3° и 13,7°.
Согласно настоящему изобретению предложена кристаллическая форма, форма Е, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2-тета, равных примерно 7,3; 13,7; 13,4; 17,6; 5,6; 10,8; 21,7; 26,5; 28,4°.
Согласно настоящему изобретению предложена кристаллическая форма, форма Е, которая имеет картину дифракции рентгеновских лучей на порошке по существу такую же, как картина дифракции рентгеновских лучей на порошке, показанная на фиг. 3.
Согласно настоящему изобретению предложена кристаллическая форма, форма Е, которая имеет картину дифракции рентгеновских лучей на порошке с по меньшей мере двумя характеристическими пиками при значениях 2-тета, равных 7,3° и 13,7°, где указанные значения могут составлять плюс или минус 0,2° 2-тета.
Согласно настоящему изобретению предложена кристаллическая форма, форма Е, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2-тета, равных 7,3; 13,7; 13,4; 17,6; 5,6; 10,8; 21,7; 26,5; 28,4°, где указанные значения могут составлять плюс или минус 0,2° 2-тета.
Анализ формы Ε посредством DSC показывает эндотерму плавления с началом при 194,2°С и пиком при 196,3°С (фиг. 4).
4-[(3-Хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилат в кристаллической форме, форма I
Форма I характеризуется тем, что дает по меньшей мере одно из следующих значений 2θ, измеренных с использованием CuKa излучения: 3,5 и 7,0°. Форма Ε характеризуется картиной дифракции рентгеновских лучей на порошке по существу такой, как показано на фиг. 5. Десять пиков дифракции рентгеновских лучей на порошке показаны в таблице С.
Согласно настоящему изобретению предложена кристаллическая форма, форма I, которая имеет картину дифракции рентгеновских лучей на порошке с по меньшей мере тремя характеристическими пиками при значениях 2-тета примерно 3,5°, 7,0° и 9,5°.
Согласно настоящему изобретению предложена кристаллическая форма, форма I, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2-тета, равных примерно 3,5; 7,80; 9,5; 6,4; 14,3; 18,0; 16,4; 15,3; 4,7; 21,3°.
Согласно настоящему изобретению предложена кристаллическая форма, форма I, которая имеет картину дифракции рентгеновских лучей на порошке по существу такую же, как картина дифракции рентгеновских лучей на порошке, показанная на фиг. 5.
Согласно настоящему изобретению предложена кристаллическая форма, форма I, которая имеет картину дифракции рентгеновских лучей на порошке с по меньшей мере тремя характеристическими пиками при значениях 2-тета, равных 3,5°, 7,0° и 9,5°, где указанные значения могут составлять плюс или минус 0,2° 2-тета.
Согласно настоящему изобретению предложена кристаллическая форма, форма I, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2-тета, равных 3,5; 7,0; 9,5; 6,4; 14,3; 18,0; 16,4; 15,3; 4,7; 21,3°, где указанные значения могут составлять плюс или минус 0,2° 2-тета.
Анализ формы I посредством DSC показывает эндотерму плавления с началом при 193,3°С и пиком при 195,9°С (фиг. 6).
4-[(3-Хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилат в кристаллической форме, Форма J
Форма J характеризуется тем, что дает по меньшей мере одно из следующих значений 2θ, измеренных с использованием CuKa излучения: 7,8 и 7,0°. Form J характеризуется картиной дифракции рентгеновских лучей на порошке по существу такой, как показано на фиг. 7. Десять пиков дифракции рентгеновских лучей на порошке показаны в таблице D.
Согласно настоящему изобретению предложена кристаллическая форма, форма J, которая имеет картину дифракции рентгеновских лучей на порошке с по меньшей мере двумя характеристическими пиками при значениях 2-тета, равных примерно 7,8° и 7,0°.
Согласно настоящему изобретению предложена кристаллическая форма, форма J, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2-тета, равных примерно 7,8; 7,0; 4,9; 15,9; 17,7; 3,4; 20,7; 9,8; 13,9; 12,7°
Согласно настоящему изобретению предложена кристаллическая форма, форма J, которая имеет картину дифракции рентгеновских лучей на порошке по существу такую же, как картина дифракции рентгеновских лучей на порошке, показанная на фиг. 7.
Согласно настоящему изобретению предложена кристаллическая форма, форма J, которая имеет картину дифракции рентгеновских лучей на порошке с по меньшей мере двумя характеристическими пиками при значениях 2-тета, равных 7,8° и 7,0°, где указанные значения могут составлять плюс или минус 0,2° 2-тета.
Согласно настоящему изобретению предложена кристаллическая форма, форма J, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2-тета, равных 7,8; 7,0; 4,9; 15,9; 17,7; 3,4; 20,7; 9,8; 13,9; 12,7°, где указанные значения могут составлять плюс или минус 0,2° 2-тета.
Анализ формы J посредством DSC показывает эндотерму плавления с началом при 193,3°С и пиком при 195,8°С (фиг. 8).
Соль гидрохлорид 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилата в кристаллической форме, соль моногидрохлорид, форма A1
Соль моногидрохлорид, Форма Α1, характеризуется тем, что дает по меньшей мере одно из следующих значений 2θ, измеренных с использованием CuKa излучения: 12,3 и 13,9°. Соль моногидрохлорид, Форма А1, характеризуется картиной дифракции рентгеновских лучей на порошке по существу такой, как показано на фиг. 9. Девять пиков дифракции рентгеновских лучей на порошке показаны в таблице Е.
Согласно настоящему изобретению предложена кристаллическая форма, соль моногидрохлорид, Форма А1, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характеристическими пиками при значениях 2-тета, равных примерно 12,3° и 13,9°
Согласно настоящему изобретению предложена кристаллическая форма, соль моногидрохлорид, Форма А1, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2-тета, равных примерно 12,3; 13,9; 9,3; 23,3; 18,7; 16,0; 24,6; 26,8; 28,0°.
Согласно настоящему изобретению предложена кристаллическая форма, соль моногидрохлорид, Форма А1, которая имеет картину дифракции рентгеновских лучей на порошке по существу такую же, как картина дифракции рентгеновских лучей на порошке, показанная на фиг. 9.
Согласно настоящему изобретению предложена кристаллическая форма, соль моногидрохлорид, Форма А1, которая имеет картину дифракции рентгеновских лучей на порошке с по меньшей мере двумя характеристическими пиками при значениях 2-тета, равных 12,3° и 13,9°, где указанные значения могут составлять плюс или минус 0,2° 2-тета.
Согласно настоящему изобретению предложена кристаллическая форма, соль моногидрохлорид, Форма А1, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2-тета, равных 12,3; 13,9; 9,3; 23,3; 18,7; 16,0; 24,6; 26,8; 28,0°, где указанные значения могут составлять плюс или минус 0,2° 2-тета.
Анализ соли моногидрохлорид, Форма А1, посредством DSC показывает эндотерму плавления с началом при 259,6°С и пиком при 261,4°С (фиг. 10).
Соль сукцинат 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилата в кристаллической форме, соль сукцинат, Форма А8
Соль сукцинат, Форма А8, характеризуется тем, что дает по меньшей мере одно из следующих значений 2θ, измеренных с использованием CuKa излучения: 6,5 и 17,7. Соль сукцинат, Форма A8, характеризуется картиной дифракции рентгеновских лучей на порошке, по существу такой, как показано на фиг. 11. Девять пиков дифракции рентгеновских лучей на порошке показаны в таблице F.
Согласно настоящему изобретению предложена кристаллическая форма, соль сукцинат, Форма А8, которая имеет картину дифракции рентгеновских лучей на порошке с по меньшей мере тремя характеристическими пиками при значениях 2-тета, равных примерно 6,5°, 17,7° и 14,7°.
Согласно настоящему изобретению предложена кристаллическая форма, соль сукцинат, Форма А8, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2-тета, равных примерно 6,5; 17,7; 14,7; 9,2; 26,5; 20,2; 13,1; 27,3; 24,0°.
Согласно настоящему изобретению предложена кристаллическая форма, соль сукцинат, Форма А8, которая имеет картину дифракции рентгеновских лучей на порошке по существу такую же, как картина дифракции рентгеновских лучей на порошке, показанная на фиг. 11.
Согласно настоящему изобретению предложена кристаллическая форма, соль сукцинат, Форма А8, которая имеет картину дифракции рентгеновских лучей на порошке с по меньшей мере тремя характеристическими пиками при значениях 2-тета, равных 6,5°, 17,7° и 14,7°, где указанные значения могут составлять плюс или минус 0,2° 2-тета.
Согласно настоящему изобретению предложена кристаллическая форма, соль сукцинат, Форма А8, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2-тета, равных 6,5; 17,7; 14,7; 9,2; 26,5; 20,2; 13,1; 27,3; 24,0°, где указанные значения могут составлять плюс или минус 0,2° 2-тета.
Анализ соли сукцинат, Формы А8, посредством DSC показывает эндотермы плавления с началом при 191,8°С и пиком при 194,2°С (фиг. 12).
Краткое описание графических материалов
Фиг. 1: картина дифракции рентгеновских лучей на порошке формы А.
Фиг. 2: термограмма DSC формы А.
Фиг. 3: картина дифракции рентгеновских лучей на порошке формы Е.
Фиг. 4: термограмма DSC формы Е.
Фиг. 5: картина дифракции рентгеновских лучей на порошке формы I.
Фиг. 6: термограмма DSC формы I.
Фиг. 7: картина дифракции рентгеновских лучей на порошке формы J.
Фиг. 8: термограмма DSC формы J.
Фиг. 9: картина дифракции рентгеновских лучей на порошке формы A1 гидрохлорида.
Фиг. 10: термограмма DSC формы Α1 гидрохлорида.
Фиг. 11: картина дифракции рентгеновских лучей на порошке формы А8 сукцината.
Фиг. 12: термограмма DSC формы А8 сукцината.
Когда говорят, что настоящее изобретение относится к кристаллической форме, степень кристалличности составляет предпочтительно более чем примерно 60%, более предпочтительно более чем примерно 80%, предпочтительно более чем примерно 90% и более предпочтительно более чем примерно 95%. Наиболее предпочтительно степень кристалличности составляет более чем примерно 98%.
Следует понимать, что значения 2-тета картины дифракции рентгеновских лучей на порошке могут слегка варьировать в зависимости от оборудования или от образца к образцу, и такие зарегистрированные значения не следует интерпретировать как абсолютные. Известно, что может быть получена картина дифракции рентгеновских лучей на порошке, имеющая одну или более чем одну ошибку измерения в зависимости от условий измерения (таких как используемое оборудование или аппаратура). В частности, в целом известно, что интенсивности в картине дифракции рентгеновских лучей на порошке могут колебаться в зависимости от условий измерения. Таким образом, следует понимать, что полиморфные формы по настоящему изобретению не ограничены кристаллами, которые дают картины дифракции рентгеновских лучей на порошке, идентичные картине дифракции рентгеновских лучей на порошке, показанной на фигурах, и любые кристаллы, дающие картины дифракции рентгеновских лучей на порошке по существу такие же, как те, которые показаны на фигурах, входят в объем настоящего изобретения. Специалист в области рентгеновской порошковой дифракции способен оценить по существу идентичность картин дифракции рентгеновских лучей на порошке.
Специалисты в области рентгеновской порошковой дифракции понимают, что на относительную интенсивность пиков может влиять, например, размер зерен выше 30 мкм и неунитарные аспектные отношения, которые могут влиять на анализ образцов. Специалисты также понимают, что на положение отражений может влиять точная высота, на которую образец устанавливают в дифрактометре, и калибровка нуля дифрактометра. Плоскостность поверхности образца также может оказывать небольшое влияние. Поэтому представляемые данные картин дифракции не следует воспринимать как абсолютные значения (Jenkins, R & Snyder, R.L. 'Introduction to X-Ray Powder Diffractometry' John Wiley & Sons 1996; Bunn, C.W. (1948), Chemical Crystallography, Clarendon Press, London; Klug, H.P. & Alexander, L. E. (1974), X-Ray Diffraction Procedures).
Как правило, ошибка измерений угла дифракции в рентгеновской порошковой дифрактограмме равна приблизительно плюс или минус 0,2° 2-тета, и такую степень ошибки измерений следует принимать во внимание при рассмотрении картин дифракции рентгеновских лучей на порошке, показанных на фигурах и в таблицах. Более того, следует понимать, что интенсивности могут колебаться в зависимости от экспериментальных условий и приготовления образца (предпочтительной ориентации).
Поэтому в дополнительном аспекте изобретения предложен 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилат в кристаллической форме.
В дополнительном аспекте изобретения предложена фармацевтически приемлемая соль 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилата в кристаллической форме.
В дополнительном аспекте изобретения предложена соль гидрохлорид 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметил-пиперазин-1-карбоксилата в кристаллической форме.
В одном аспекте изобретения 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилат в кристаллической форме находится в виде Формы А.
В одном аспекте изобретения 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилат в кристаллической форме находится в виде Формы Е.
В одном аспекте изобретения 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилат в кристаллической форме находится в виде Формы I.
В одном аспекте изобретения 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилат в кристаллической форме находится в виде Формы J.
В одном аспекте изобретения гидрохлорид 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилата в кристаллической форме находится в виде соли моногидрохлорид, Форма Α1
В одном аспекте изобретения сукцинат 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилата в кристаллической форме находится в виде соли сукцинат, Форма А8.
В одном аспекте изобретения 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилат в кристаллической форме находится в виде Формы А и по существу не содержит никаких других форм.
В одном аспекте изобретения 4-[(3-хлор-2-фторфенил)амино]-7-метоксихиназолин-6-ил-(2R)-2,4-диметилпиперазин-1-карбоксилат в кристаллической форме находится в виде Формы Ε и по сущест