Твердофазная композиция, обладающая антибактериальным и детоксикационным действием
Иллюстрации
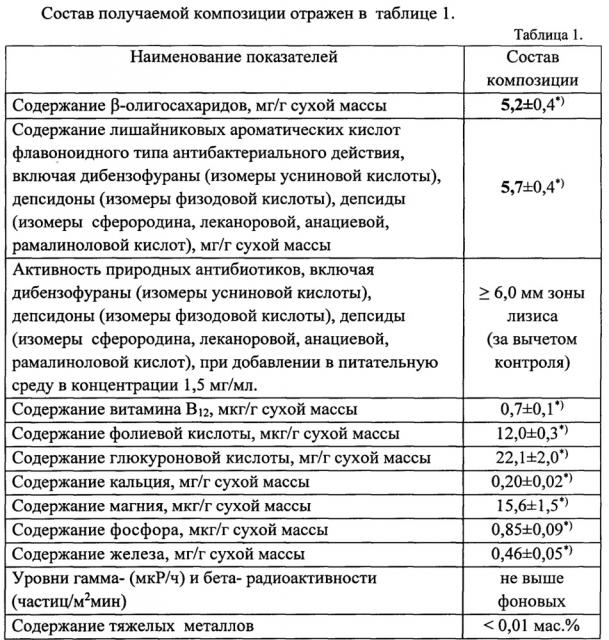
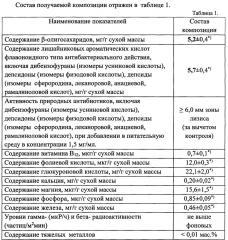
Показать всеИзобретение относится к химико-фармацевтической промышленности, а именно к твердофазной композиции, обладающей комплексным детоксикационным и антибактериальным действием. Твердофазная композиция, обладающая комплексным детоксикационным и антибактериальным действием, представляет собой ультрадисперсный порошок слоевищ лишайников рода Cladonia, механохимически активированных в присутствии 0,7-0,9 мас.% от массы лишайникового сырья бикарбоната натрия, которая содержит лишайниковые β-олигосахариды в концентрации 5,2±0,4 мг/г и лишайниковые ароматические кислоты флавоноидного типа в концентрации 5,7±0,4 мг/г. Вышеописанная композиция обладает повышенным комплексным детоксикационным и антибактериальным действием. 1 ил., 4 табл.
Реферат
Изобретение относится к химико-фармацевтической промышленности, а именно к производству лекарственных средств и биологически активных добавок к пище из растительного сырья, комплексного антибактериального и детоксикационного действия в отношении внутренних сред организма человека и животных.
Целью заявляемого изобретения является создание комплексного твердофазного (ультрадисперсного порошкового) биопрепарата из природного растительного сырья с повышенной антибактериальной и детоксикационной активностью в отношении внутренних сред организма.
Известен препарат антибактериального действия «Бинан» [1], полученный из лишайников рода цетрария Cetraria [2], включенный в Фармакопею СССР. Активное вещество - натриевая соль усниновой кислоты отличается высокими антибактериальными свойствами, очень термоустойчива, хорошо сохраняется на протяжении нескольких лет, эффективна против большого разнообразия грамположительных (G+) и некоторых грамотрицательных, кислоустойчивых бактерий и отдельных грибов, включая мультирезистентные (устойчивые) к антибиотикам штаммы золотистого стафилококка, энтерококка и микобактерий. Причем усниновая кислота оказывает избирательное действие против стрептококка мутирующего, не вызывая побочных эффектов, отрицательно воздействующих на оральную сапрофитную микрофлору [3-7].
Усниновая кислота обладает также следующими направлениями действия:
- противовоспалительным [8];
- обезболивающим и жаропонижающим [9];
- противораковым [10];
- гастропротективным и антиоксидантным [11]. Последнее приводит и к защите от ультрафиолетового излучения, что ценно не только с медицинской, но и с косметологической позиции [12];
- противовирусной, антипротозойной, антипролиферативной, противовоспалительной и обезболивающей активностью [1];
- способствует заживлению ран [13];
- может использоваться для профилактики и лечения десен и патологий парадонта [14];
- используется при лечении туберкулеза [15].
Известно также, что слоевища лишайников другого рода (Cladonia), произрастающих в высоких широтах, содержат большее количество и более широкий спектр структур вторичных лишайниковых веществ из числа лишайниковых ароматических кислот флавоноидного типа: дибензофуранов (изомеры усниновой кислоты), депсидонов (изомеры физодовой кислоты), депсидов (изомеры сферородина, леканоровой, анациевой, рамалиноловой кислот) более выраженного антибактериального действия [16, 17].
Однако, несмотря на вышеуказанную эффективность, препарат Бинан и другие вышеприведенные аналоги, получаемые из слоевищ лишайников, так и не были введены в клиническую практику и не применяются в медицине. Причины этого, по-видимому, следующие:
- большинство вторичных лишайниковых метаболитов, включая усниновую кислоту, во-первых, нерастворимы в воде. Во-вторых, находятся в слоевищах лишайников в иммобилизованном виде, будучи включенными в ячейки трехмерной матрицы очень прочных лишайниковых β-полисахаридов. Поэтому при биотехнологическом переделе более 80% их количества не переходит в биоусвояемую форму.
Известно также, что при любом патологическом процессе, в том числе при бактериальных и вирусных инфекциях, в организме идет накопление эндогенных токсинов, включая медиаторы воспаления - эндотоксины малой и средней молекулярной массы и др. А при их лечении - продукты превращения синтетических и полусинтетических антибиотиков, обладающие цитостатическим эффектом по отношению к быстро делящимся клеткам, в том числе лейкоцитам и кроветворным клеткам. Поэтому обязательной компонентой комплекса лечебного мероприятий должна быть детоксикация не только желудочно-кишечного тракта, но и внутренних сред организма (кровь, лимфа, межклеточные жидкости). Известны медицинские приемы (гемодиализ) и биопрепараты (БАДы) для очистки крови: «Детокс+», «Куркумин» и др. К их недостаткам, относительно заявленной цели, относится отсутствие антибактериального эффекта.
Ранее было показано, что предэкстракционная биотехнологическая обработка слоевищ лишайника диоксидом углерода в состоянии сверхкритической жидкости приводит к частичному разрушению трехмерной β-полисахаридной матрицы с образованием β-олигосахаридов [18, 19], которые обладают следующими отличительными свойствами:
- не гидролизуются в желудочно-кишечном тракте (ЖКТ) и во внутренних средах организма, т.к. содержат прочные β-гликозидные связи, не расщепляемые в кислой среде желудка, а кишечная микрофлора и внутренние среды организма не содержат соответствующие β-гликозидазы;
- содержат большое количество гидрофильных функциональных групп (-ОН, -NH2, =СО и др.) и гидрофобных фрагментов, что обеспечивает образование супрамолекулярных комплексов (СМК) с контактирующими с ними низкомолекулярными соединениями как гидрофильной, так и гидрофобной природы, в которых β-олигосахариды выступают в качестве «активного носителя», а низкомолекулярные соединения - «фармаконов»;
- СМК, благодаря бифильной природе лишайниковых β-олигосахаридов, близких по строению с олигогликозидными фрагментами гликокаликса клеточных мембран и их небольшим размерам, хорошо всасываются из желудочно-кишечного тракта в кровь и легко транспортируются через клеточные мембраны;
- после распада СМК во внутренних средах организма (цитоплазма, межклеточные жидкости, кровь, лимфа) β-олигосахариды связывают конечные продукты метаболизма - эндотоксины (молочная и мочевая кислота, мочевина, медиаторы воспаления - эндотоксины малой и средней молекулярной массы и др.), а также экзотоксины (катионы тяжелых металлов, радионуклиды, оксиды углерода и серы, органические токсические соединения, включая фенолы, алкогольные токсины (ацетальдегид, ацетон), бактериальные и вирусные токсины и др.) и выводят их из организма.
Благодаря этим свойствам лишайниковых β-олигосахаридов достигается, во-первых, повышенная усвояемость и биоактивность «фармакона» независимо от степени его гидрофобности/гидрофильности. Во-вторых, обеспечивается проявление детоксикационной активности в отношении внутренних сред организма.
Повышение биоусвояемости и биоактивности «фармакона» актопротекторного действия при комплексообразовании с лишайниковыми β-олигосахаридами и проявление их детоксикационной активности в отношении эндотоксинов: молочной кислоты, мочевины, было установлено, например, при испытаниях биопрепарата «Кладород», состоящего из лишайниковых β-олигосахаридов и флавогликозидов, выделяемых из корней и корневищ родиолы розовой (салидрозида и др.) [20-22].
Детоксикационная активность лишайниковых β-олигосахаридов была установлена в экспериментах по связыванию in vitro тяжелых металлов и модельных органических веществ на примере метиленового синего [23], а также in vivo на примере алкогольных токсинов [18, 24].
Близкой к заявляемому изобретению, в отношении антибактериального действия, является композиция, получаемая из слоевищ лишайников рода Cladonia с помощью механохимической активации на мельнице-активаторе планетарного типа, в присутствии 0,5 мас.% (от массы лишайникового сырья) бикарбоната натрия [25, 26].
Однако в этих аналогах не указано на детоксикационное действие композиции.
Наиболее близкой к заявляемому изобретению, в отношении комплексного детоксикационного и, в меньшей степени, антибактериального действия, является композиция, получаемая из слоевищ лишайников рода Cladonia с помощью технологии их механохимической активации в воздушной среде на мельнице-активаторе планетарного типа [23] - прототип. Композиция, получаемая в соответствии с прототипом, характеризуется содержанием β-олигосахаридов в количестве 2,1±0,2 мг/г и лишайниковых ароматических кислот флавоноидного типа - в количестве 0,20±0,02 мг/г.
К недостаткам прототипа можно отнести недостаточно высокую детоксикационную и существенно сниженную антибактериальную активность, по сравнению с заявляемой композицией. Это обусловлено меньшей степенью разрушения прочной трехмерной матрицы лишайниковых β-полисахаридов и, соответственно, более низкой концентрацией образующихся лишайниковых β-олигосахаридов и деиммобилизуемых лишайниковых кислот антибактериального действия.
Технический эффект (сущность) заявляемого изобретения заключается в расширении спектра биологической активности созданной композиции природных биоактивных веществ из слоевищ лишайников, а именно в наличии, наряду с повышенной антибактериальной активностью за счет высокого содержания деиммобилизованных природных лишайниковых кислот, детоксикационной активности по отношению к внутренним средам организма, благодаря более глубокому механохимическому расщеплению непосредственно в твердой фазе трехмерной матрицы лишайниковых β-полисахаридов в присутствии 0,7-0,9 мас.% (от массы лишайникового сырья) бикарбоната натрия и, соответственно, повышенному содержанию лишайниковых β-олигосахаридов, образующихся в биотехнологическом процессе получения данной композиции из лишайниковых β-полисахаридов.
Технический эффект (сущность) заявляемого изобретения достигается благодаря тому, что механохимическая обработка лишайникового сырья рода Cladonia в присутствии 0,7-0,9 мас.% (от массы лишайникового сырья) бикарбоната натрия в одну технологическую стадию приводит, во-первых, к более глубокому расщеплению части β-гликозидных связей в лишайниковых β-полисахаридах с образованием больших количеств β-олигосахаридов (активного носителя), обладающих также свойством детоксикации внутренних сред организма. Во-вторых, происходит более полная деиммобилизация лишайниковых кислот антибактериального действия (фармакона), содержащихся in vivo в прочных, не подвергающихся перевариванию в желудочно-кишечном тракте организма человека и животных (кроме северного оленя), а также во внутренних средах организма, ячейках трехмерной матрицы лишайниковых β-полисахаридов. В-третьих, деиммобилизованные лишайниковые кислоты образуют большее количество супрамолекулярных комплексов с образующимися лишайниковыми β-олигосахаридами, за счет чего в 8-10 раз повышается их биодоступность и биоактивность, в целом.
Изобретение может быть реализовано следующим образом.
(1) Слоевища лишайника рода Cladonia подвергаются предварительному грубому помолу на мельнице до размеров частиц 0,6÷0,8 мм. (2) Порошок помещается в камеру шаровой мельницы (например, АГО-2, АГО-3 или ЦЭМ-7-80) и подвергается механохимической активации в присутствии 0,7-0,9 мас.% (от массы порошка слоевищ лишайника грубого помола) бикарбоната натрия в течение 3 минут при 1500 об/мин. Образуется ультрадисперсный порошок с размером частиц 20-60 нм. В этих условиях часть лишайниковых β-полисахаридов расщепляется до легко усваиваемых в организме человека и животных β-олигосахаридов. Свидетельством этого является увеличение концентрации «восстанавливающих концов» (свободных концевых альдегидных групп β-олигосахаридов) в 17 раз, с 4,6 (в порошке грубого помола) до 78,0 мг⋅экв глюкозы/ г порошка (в прототипе - в 7,3 раза, с 4,6 до 33,5 мг⋅экв глюкозы/ г порошка). Происходит также более полная деиммобилизация лишайниковых кислот антибактериального действия.
*) p<0,05
Полученная композиция обладает следующими основными повышенными, по сравнению с прототипом, свойствами.
(1) Антибактериальное действие.
Антибактериальные свойства заявляемой композиции определяли in vitro на культурах десяти бактериальных штаммов условно-патогенных и патогенных микроорганизмов по стандартным и модифицированным методикам по стандартам мутности культур на 5 и 10 единиц, по сравнению с ультрадисперсным порошком слоевищ лишайников, механохимически активированных в отсутствие бикарбоната натрия (размеры частиц 40-90 нм; прототип, контроль): Staphylococcus aureus - 6538-р; Enterofiacter cloacae; Pseudomonas aeruginosa - 33105; Klebsiella pneumoniae; Salmonella enteritidis; гемолитическая E.coli; E.coli M-17; лактозо-негативная E.coli; Escherichia coli -H-257; Proteus vulgaris. Использовались стандартные питательные среды: среда Эндо, молочно-желточно- солевой агар, среда Плоскирева, мясо-пептонный агар (МПА), которые были приготовлены по стандартной прописи [27], с добавлением в питательную среду контрольного (в количестве 5,0 мг/мл) и исследуемого образца (в количестве 1,5 мг/мл). Газонным методом был произведен посев культур микроорганизмов и после культивации в термостате при 37,0°С оценивалась интенсивность их роста. Результаты приведены в таблице 2.
Условные обозначения: +слабый лизис; ++частичное лизирование; +++почти полный лизис; ++++полный лизис.
Анализ полученных результатов показывает, что благодаря деиммобилизации лишайниковых кислот антибактериального действия, за счет частичного гидролиза лишайниковых β-полисахаридов при механохимической активации в присутствии 0,7-0,9 мас.% бикарбоната натрия, более глубокого, чем в прототипе (механохимическая активация в отсутствие бикарбоната натрия), а также повышения их растворимости и биодоступности в бактериальные клетки (в ситуации in vivo - также лучшей всасываемости в желудочно-кишечном тракте) за счет образования супрамолекулярных комплексов между ними и образующимися лишайниковыми β-олигосахаридами, в 8-10 раз повышается антибактериальная активность заявляемой композиции в отношении патогенных и условно-патогенных микроорганизмов, по сравнению с прототипом.
(2) Детоксикационное действие.
Детоксикационные свойства заявляемой композиции определяли, во-первых, in vitro, изучая адсорбционную активность лишайниковых β-олигосахаридов по катионам тяжелых металлов (на примере ионов Рb+, раствор соли ацетата свинца) и по метиленовому синему (как аналогу органических эндотоксинов малой и средней молекулярной массы - медиаторов воспалительного процесса) (фиг. 1). В раствор адсорбируемого вещества добавляли ультрадисперсный порошок заявляемой композиции или прототипа, инкубировали 20 мин или 24 часа. Центрифугированием отделяли нерастворимую фракцию порошков с адсорбированным веществом, затем фильтрацией через нанофильтр с диаметром пор 10 нм фирмы «Amicon» (США) отделяли растворимые комплексы адсорбированного вещества с β-олигосахаридами (они остаются на нанофильтре) и определяли остаточную концентрацию адсорбируемого вещества в растворе. В таблице 3 приведены полученные результаты, расчет проводили в мкмолях адсорбированного вещества на г порошка ягеля грубого помола, исходно взятого для получения заявляемой композиции или для получения прототипа.
*) р<0,05
Следует отметить, что по метиленовому синему даже у прототипа - это очень высокая адсорбционная емкость по сравнению с такими известными адсорбентами, как полифепан или глина белая, у которых она составляет всего 31,3 и 35,6 мкмоль/г, соответственно. Заявляемая же композиция обладает адсорбционной емкостью в 2,0-2,1 раза большей, чем прототип. По катионам тяжелых металлов у заявляемой композиции также было отмечено повышение в 1,8-2,0 раза адсорбционной емкости in vitro по сравнению с прототипом. По-видимому, это объясняется более высокой концентрацией лишайниковых β-олигосахаридов в заявляемой композиции по сравнению с прототипом за счет проведения процесса механохимической активации в присутствии 0,7-0,9 мас.% бикарбоната натрия.
Во-вторых, детоксикационная активность была зарегистрирована in vivo по изменению в крови концентрации «токсина усталости» (молочной кислоты) и мочевины крови в результате ежедневного введения в корм белым лабораторным мышам линии CD-1 заявленной композиции в дозе 50 мг/кг (в контроле - адекватной дозы прототипа), на фоне ежедневной повышенной нагрузки в виде 4-минутного плавания, в течение 10 дней. Показано, что при потреблении животными заявляемой композиции на фоне вышеуказанной физической нагрузки снижение уровня молочной кислоты достигало 56-72% (прототипа - 28-43%) по сравнению с контролем (отсутствие добавок); мочевины - 49 и 32%, соответственно.
(3) Сочетанное детоксикационное и антибактериальное действие in vivo при использовании во фтизиатрии.
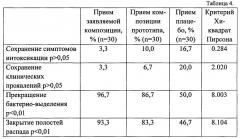
На базе НПО «Фтизиатрия» Минздрава Республики Саха (Якутия) было проведено изучение влияния заявляемой композиции, по сравнению с прототипом, в отношении повышения антибактериальной эффективности лечения больных инфицированных микобактериями туберкулеза с множественной лекарственной устойчивостью (МБТ с МЛУ), а также для снижения побочного токсического действия антибактериальных препаратов при массивной химиотерапии. Пациенты наблюдаемых групп сопоставимы по возрастно-половому и социальному составу. Отмечались умеренные признаки туберкулезной интоксикации (потеря в весе, слабость, потливость) и клинических проявлений (кашель, одышка, хрипы в легких, боли в груди). У большинства в клинической структуре преобладает инфильтративный туберкулез, сопровождающийся в половине случаев обильным бактериовыделением. Все пациенты (3 группы по 30 человек) получали IV режим химиотерапии с учетом чувствительности к противотуберкулезным препаратам, в период интенсивной фазы в основном по схеме капреомицин/ канамицин, фторхинолоны, пиразинамид, циклосерин/теризидон, протионамид/этионамид, аминосалициловая кислота не менее 8 мес. В комплексное лечение больных туберкулезом с МЛУ к МБТ, на фоне схемы химиотерапии, вводили: в группе №1 - заявляемую композицию; в группе №2 - композицию прототипа; в группе №3 - плацебо. Препараты использовались в виде желатиновых капсул, содержащих 450 мг соответствующего состава. Назначение проводили через месяц после начала химиотерапии в соответствии с весом больного: до 60 кг - по 1 капсуле, свыше 60 кг - по 2 капсулы, с 0,5 л питьевой воды. Прием - дважды в день (утром в 11 ч и вечером в 20 ч), в течение 2 месяцев. При сравнении качественных показателей с целью изучения сопоставимости, а также для сравнения эффективности лечения в группах больных использовали критерий Хи-квадрат Пирсона.
Результаты приведены в таблице 4.
Через 8 месяцев химиотерапии у большинства больных всех трех групп ликвидированы симптомы интоксикации и клинические проявления. При этом:
- в группе принимающих заявленную композицию симптомы интоксикации исчезли и отмечено прекращение бактериовыделения (по данным посевов мокроты) у 29 больных, закрытие полостей распада по данным рентгено-томографических исследований - у 28 человек;
- в группе принимающих композицию прототипа симптомы интоксикации исчезли у 27 больных, прекращение бактериовыделения отмечалось у 26 больных, закрытие полостей распада - у 25 человек;
- в группе принимающих плацебо симптомы интоксикации исчезли у 25 больных, прекращение бактериовыделения отмечалось только у 15 больных, закрытие полостей распада - только у 14 человек.
Эффективность применения заявленной композиции по сравнению с прототипом подтверждается показателями функционального состояния гепатобилиарной прооксидантно-антиоксидантной системы, иммунного статуса. Следовательно, применение заявленной композиции в качестве средства для лечения туберкулеза с множественной лекарственной устойчивостью продемонстрировало высокую эффективность препарата в снижении побочного токсического действия антибактериальных препаратов при химиотерапии больных данной патологией, а также повышение эффективности антибактериального лечения по критериям прекращения бактериовыделения и закрытия полостей распада в 1,12 раза по сравнению с прототипом.
Таким образом, предложенная твердофазная композиция, получаемая механохимической активацией слоевищ лишайников рода Cladonia в присутствии 0,7-0,9 мас.% (от массы порошка слоевищ лишайника грубого помола) бикарбоната натрия и содержащая лишайниковые β-олигосахариды в концентрации 5,2±0,4 мг/г и лишайниковые ароматические кислоты флавоноидного типа в концентрации 5,7±0,4 мг/г, обеспечивает повышение детоксикационной (в 1,8-2,1 раз) и антибактериальной (в 8-10 раз) активности по сравнению с прототипом.
Литература
1. Машковский М.Д. Лекарственные средства: в 2 т. Т. 2. - 14-е изд., перераб, испр. и доп. М.: Изд-во «Новая Волна», 2000. 608 с.
2. Рассадина, 1957; Атлас лекарственных растений, 1962; фармакопейная статья ФС 42-766-73.
3. Брызгалова В.А. Материалы по изучению антибактериальных свойств препарата Бинан/ в Кн. «Новый антибиотик бинан или натриевая соль усниновой кислоты» // под ред. Лазарев Н.В., Савич В.П. М. - Л.: Изд-во АН СССР. 1957. стр. 85-89.
4. Гофрен А. Г. Отчет о местном применении Бинана в хирургической амбулаторной практике. / в Кн. «Новый антибиотик бинан или натриевая соль усниновой кислоты» // под ред. Лазарев Н.В., Савич В.П. М.-Л.: Изд-во АН СССР. 1957. - стр. 123-128.
5. Капацинский Е.В. К вопросу о применении препарата Бинан в хирургической практике. / в Кн. «Новый антибиотик бинан или натриевая соль усниновой кислоты» // под ред. Лазарев Н.В., Савич B.П. М.-Л.: Изд-во АН СССР. 1957. - стр. 134-139.
6. Заугольников С.Д. Экспериментальное изучение противотрихомонадной активности Бинана. / в Кн. «Новый антибиотик бинан или натриевая соль усниновой кислоты» // под ред. Лазарев Н.В., Савич В.П. М.-Л.: Изд-во АН СССР. 1957. - стр. 177-180.
7. Бутомо В.Г. Наблюдения над терапевтическим применением Бинана при лечении трихомонадного кольпита и эрозий шейки матки./ в Кн. «Новый антибиотик бинан или натриевая соль усниновой кислоты» // под ред. Лазарев Н.В., Савич В.П. М.-Л. Изд-во АН СССР. 1957. - стр. 181-190.
8. , K. (2002) Usnic acid. - Phytochemistry 61 (7), p. 729-736.
9. Okuyama E, Umeyama K, Yamazaki M, Kinoshita Y, Yamamoto Y (1995). Usnic acid and diffractic acid as analgesic and antipyretic components of Usnea diffracta. - Planta Medica. 61: p. 113-115.
10. E, Groeneweg J, GG, G, S, K, HM. Cellular mechanisms of the anticancer effects of the lichen compound usnic acid. - Planta Medica, 2010 Jul; 76(10): p. 969-974.
11. Odabasoglu F, Cakir A, Suleyman H, Aslan A, Bayir Y, Halici M, Kazaz C. Gastroprotective and antioxidant effects of usnic acid on indomethacin-induced gastric ulcer in rats. - J. Ethnopharmacol., 2006 Jan 3; 103(1): p. 59-65.
12. Kohlhardt-Floehr, C. Boehm F, Troppens S, Lademann J, Truscott TG. (2010) Pro-oxiant and antioxidant behaviour of usnic acid from lichens under UVB irradiation studies on human cells. - J. Photochem Photobiol. B. 101 (1): p. 97-102.
13. Nunes, P. et al. Collagen-based films containing liposome-loaded usnic acid as dressing for dermal burn healing/ Journal of Biomedicine and Biotechnology, Volume 2011, Article ID 761593, 9 pages.
14. Chifiriuc MC, LM, Oprea E, S, Bucur M, L, Enache G, Saviuc С, M, T, G, V. In vitro study of the inhibitory activity of usnic acid on dental plaque biofilm/ Roum Arch Microbiol Immunol. 2009 Oct-Dec;68(4): p. 215-222.
15. Еникеев A.X., Еникеева P.А. Экстракт cetraria islandica (l.) ach. сухой, таблетированная форма // патент РФ Патент РФ 2321419 от 10.04.2008, приоритет от 02.06.2006
16. Прокопьев И.А., Порядина Л.Н., Филиппова Г.В., Шеин А.А. Содержание вторичных метаболитов в лишайниках сосновых лесов Центральной Якутии // Химия растительного сырья. - №3. - 2016. - С. 73-78.
17. Ахременко Я.А., Прокопьев И.А., Поляниченко А.А., Федоров А.А. Антибактериальная активность вторичных метаболитов лишайников в отношении условно-патогенных и патогенных микроорганизмов // Тезисы доклада на XI молодежной школе-конференции с международным участием. М., 01-02 ноября 2016 г. М.: Изд-во ООО «МАКС Пресс». - С. 110-112.
18. Кершенгольц Б.М., Журавская А.Н., Ремигайло П.А., Филиппова Г.В., Шеин А.А., Шашурин М.М., Кершенгольц Е.Б. Способ получения водки, обладающей пониженным токсическим и наркотическим эффектом // Патент РФ №2318407 от 10.03.2008, приоритет от 10.01.2006.
19. Кершенгольц Б.М., Кершенгольц Е.Б., Шеин А.А. Комплекс биологически активных веществ, выделенных из лишайников методом СO2 флюидной сверхкритической экстракции, оценка его влияния на состояние крыс при их алкоголизации // Наука и образование. - №2. - 2005. - С. 74-80.
20. Аньшакова В.В., Степанова А.В., Уваров Д.М., Смагулова А.Ш., Наумова К.Н., Васильев П.П., Кершенгольц Б.М. Актопротекторная активность комплексного битопрепарата на основе таллома лишайников и родиолы розовой // Экология человека. 2015. №5. С. 46-51.
21. K.N. Naumova, V.V. Anshakova, B.M. Kershengolts Nonspecific adaptive reactions of athletes: evaluation and correction // Journal of Biopharmaceuticals. - 2015. - №4. P. 238-239.
22. Анынакова B.B. Повышение активности действующего вещества лишайниковыми β-олигосахаридами // Биофармацевтический журнал. - 2012. - Т. 4. №4. - С. 42-46.
23. Аныпакова В.В., Шарина А.С., Каратаева Е.В., Кершенгольц Б.М. Способ получения сорбционного материала из слоевищ лишайников // Патент РФ №2464997 от 27.10.2012, приоритет от 20.07.2011.
24. Кершенгольц Б.М., Кунгурцев С.В., Шашурин М.М. Способ профилактики и купирования похмелья с помощью питьевой воды // Патент РФ №2608657 от 23.01.2017, приоритет от 05.06.2015.
25. Аныиакова В.В., Кершенгольц Б.М. Способ получения высокоактивного твердофазного биопрепарата антибиотического действия ЯГЕЛЬ из слоевищ лишайников // Патент RU №2467063 О от 20.11.2012, приоритет 05.05.2011.
26.В.В. Аньшакова, Б.М. Кершенгольц, В.И. Аныпаков Интенсификация процессов получения природных веществ антибиотического действия из лишайникового сырья с использованием механохимической технологии // Химия растительного сырья. 2011. №2. С. 133-136.
27. МУК 4.2.1890-04. Определение чувствительности микроорганизмов к антибактериальным препаратам проводили в соответствии с методическими указаниями, утвержденными главным государственным санитарным врачом РФ 04.03.2004.
Твердофазная композиция, обладающая комплексным детоксикационным и антибактериальным действием, представляющая собой ультрадисперсный порошок слоевищ лишайников рода Cladonia, механохимически активированных в присутствии 0,7-0,9 мас.% от массы лишайникового сырья бикарбоната натрия, характеризующаяся тем, что содержит лишайниковые β-олигосахариды в концентрации 5,2±0,4 мг/г и лишайниковые ароматические кислоты флавоноидного типа в концентрации 5,7±0,4 мг/г.