Антитела против человеческого csf-1r и их применения
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к антителу, которое связывается с человеческим CSF-1R, и фармацевтической композиции, содержащей вышеуказанное антитело. Кроме того, раскрыты нуклеиновая кислота, кодирующая тяжелую и легкую цепи вышеуказанного антитела, экспрессирующий вектор и клетка-хозяин, содержащие вышеуказанную нуклеиновую кислоту, и способ получения рекомбинантного антитела, которое связывается с человеческим CSF-1R, с ее использованием. Кроме того, раскрыто применение вышеуказанного антитела для изготовления лекарственных препаратов для лечения рака, лечения потери костной ткани, предупреждения или лечения метастазов и ингибирования клеточной пролиферации CSF-1 лиганд-зависимых и/или лиганд-независимых клеток. Изобретение позволяет эффективно получать и применять антитела против человеческого CSF-1R, в том числе для изготовления лекарственных препаратов для лечения рака и ингибирования клеточной пролиферации CSF-1 клеток. 10 н. и 9 з.п. ф-лы, 7 табл., 1 ил., 8 пр.
Реферат
Настоящее изобретение относится к антителам против человеческого CSF-1R (антитело к CSF-1R), способам их получения, фармацевтическим композициям, содержащим указанные антитела и их применению.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Рецептор CSF-1 (CSF-1R; синонимы: рецептор M-CSF; рецептор макрофагального колониестимулирующего фактора 1, ЕС 2.7.10.1, протоонкоген Fms, c-fms, CD115, код в базе данных Swiss Prot Р07333 (SEQ ID NO: 23)) был открыт в 1986 (Coussens, L., et al., Nature 320 (1986) 277-280). CSF-1R представляет собой фактор роста и кодируется протоонкогеном c-fms (см., например, обзор Roth, P. and Stanley, E.R., Curr. Top. Microbiol. Immunol. 181 (1992) 141-67).
CSF-1R представляет собой рецептор M-CSF (макрофагального колониестимулирующего фактора, также обозначаемого CSF-1) и опосредует биологические эффекты данного цитокина (Sherr, C.J., et al., Cell 41 (1985) 665-676). Клонирование рецептора колониестимулирующего фактора 1 (также обозначаемого c-fms) было впервые описано Roussel, M.F., et al., Nature 325 (1987) 549-552. В данной публикации было продемонстрировано, что трансформирующий потенциал CSF-1R зависит от модификаций С-концевой части белка, таких как потеря ингибиторного сайта фосфорилирования по тирозину 969, с которым связывается Cbl и таким образом опосредует отрицательную регуляцию рецептора (Lee, P.S., et al., Embo J. 18 (1999) 3616-3628).
CSF-1R представляет собой одноцепочечный трансмембранный тирозинкиназный рецептор (RTK, от англ. receptor tyrosine kinase) и является представителем семейства RTK, содержащих иммуноглобулиновый (Ig) мотив, имеющих повторяющиеся Ig домены во внеклеточной части рецептора. Внутриклеточный тирозинкиназный домен белка имеет уникальный вставочный домен, который также имеется у других родственных представителей семейства III класса RTK, например, рецепторов к тромбоцитарному фактору роста (PDGFR, от англ. platelet derived growth factor receptors), рецептора фактора роста стволовых клеток c-Kit и рецептора цитокина FLT3 (от англ. fins-like tyrosine kinase, fins-подобная тирозиновая киназа). Несмотря на структурную гомологию между рецепторами данного семейства факторов роста, они выполняют различные тканеспецифические функции. CSF-1R преимущественно экспрессируется на клетках моноцитарного ряда, репродуктивных органов женщины и плаценты. Кроме того, была описана экспрессия CSF-1R на кожных клетках Лангерганса, разновидности гладкомышечных клеток (Inaba, Т., et al., J. Biol. Chem. 267 (1992) 5693-5699), В cells (Baker, А.Н., et al., Oncogene 8 (1993) 371-378) и клетках микроглии (Sawada, Μ., et al., Brain Res. 509 (1990) 119-124).
Основными биологическими эффектами активации сигнального пути CSF-1R являются пролиферация, миграция, выживаемость и дифференцировка гемопоэтических клеток-предшественников в макрофагальном направлении (включая остеокласты). Активация CSF-1R опосредуется его лигандом, M-CSF. Связывание M-CSF и CSF-1R индуцирует образование гомодимеров и активацию киназы за счет фосфорилирования тирозина (Stanley, E.R., et al., Mol. Reprod. Dev. 46 (1997) 4-10). Дальнейшая передача сигнала опосредуется субъединицей р85 PI3K и Grb2, обеспечивающими связь с сигнальными путями PI3K/AKT и Ras/MAPK, соответственно. Эти два важных сигнальных пути участвуют в регуляции пролиферации, выживаемости и апоптоза. Другими сигнальными молекулами, которые присоединяются к фосфорилированному внутриклеточному домену CSF-1R, являются STAT1, STAT3, PLCy и Cbl (Bourette, R.P. and Rohrschneider, L.R., Growth Factors 17 (2000) 155-166).
Сигнальный путь CSF-1R имеет важное физиологическое значение для иммунного ответа, ремоделирования костной ткани, а также для репродуктивной системы. Было продемонстрировано, что у животных с нок-аутом M-CSF-1 (Pollard, J.W., Mol. Reprod. Dev. 46 (1997) 54-61) или CSF-1R (Dai, X.M., etal., Blood 99 (2002) 111-120) наблюдаются остеопетроз, нарушения гемопоэза, функций тканевых макрофагов и репродуктивной функции, что согласуется с ролью CSF-1R в соответствующих типах клеток.
В публикации Sherr, C.J. et al., Blood 73 (1989) 1786-1793 описаны некоторые антитела, направленные против CSF-1R, ингибирующие активность CSF-1 (см. Sherr, C.J., et al., Blood 73 (1989) 1786-1793). В публикации Ashum, R.A., et al., Blood 73 (1989) 827-837 описаны антитела CSF-1R. В публикации Lenda, D., et al., Journal of immunology 170 (2003) 3254-3262 описаны нарушенная мобилизация, пролиферация и активация макрофагов у мышей с недостаточностью CSF-1, что в результате приводит к снижению интенсивности апоптоза в канальцах при воспалении в почках. В публикации Kitaura, Η., et al., Journal of dental research 87 (2008) 396-400 описано антитело к CSF-1, подавляющее перемещение зубов при ортодонтическом лечении. WO 2001/030381 относится к ингибиторам активности CSF-1, таким как антисмысловые нуклеотиды и антитела, при этом раскрывая только антисмысловые нуклеотиды CSF-1. WO 2004/045532 относится к предупреждению метастазирования и потере костной ткани и лечению метастатического рака антагонистами M-CSF, раскрывая в качестве антагонистов только антитела к CSF-1. WO 2005/046657 относится к лечению воспалительных заболеваний кишечника антителами к CSF-1. US 2002/0141994 относится к ингибиторам колониестимулирующих факторов. WO 2006/096489 относится к лечению ревматоидного артрита антителами к CSF-1.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Один аспект изобретения относится к антителу, связывающемуся с человеческим CSF-1R, которое отличается тем, что оно присоединяется к тому же эпитопу, что и депонированное антитело DSM АСС2920, для применения с целью ингибирования клеточной пролиферации CSF-1 лиганд-зависимых и/или CSF-1 лиганд-независимых клеток, экспрессирующих CSF-1-R.
В одном воплощении клетки, экспрессирующие CSF-1-R, представляют собой опухолевые клетки.
В одном воплощении антитело отличается тем, что содержит в качестве участка CDR3 вариабельного домена тяжелой цепи участок CDR3 с последовательностью SEQ ID NO: 1 или SEQ ID NO: 9.
В одном воплощении антитело отличается тем, что
a) вариабельный домен тяжелой цепи содержит участок CDR3 с последовательностью SEQ ID NO: 1, участок CDR2 с последовательностью SEQ ID NO: 2 и участок CDR1 с последовательностью SEQ ID NO: 3, а вариабельный домен легкой цепи содержит участок CDR3 с последовательностью SEQ ID NO: 4, участок CDR2 с последовательностью SEQ ID NO: 5 и участок CDR1 с последовательностью SEQ ID NO: 6, или
b) вариабельный домен тяжелой цепи содержит участок CDR3 с последовательностью SEQ ID NO: 9, участок CDR2 с последовательностью SEQ ID NO: 10 и участок CDR1 с последовательностью SEQ ID NO: 11, а вариабельный домен легкой цепи содержит участок CDR3 с последовательностью SEQ ID NO: 12, участок CDR2 с последовательностью SEQ ID NO: 13 и участок CDR1 с последовательностью SEQ ID NO: 14; или
с) вариант антител согласно а) или b) имеет пересаженный участок CDR, является гуманизированным или у него элиминирован Т-клеточный эпитоп.
Таким образом, антитела по изобретению, связывающиеся с тем же эпитопом, способны ингибировать клеточную пролиферацию CSF-1 лиганд-зависимых и CSF-1 лиганд-независимых клеток.
Другой аспект изобретения относится к антителу, связывающемуся с человеческим CSF-1R, которое отличается тем, что оно связывается с тем же эпитопом, что и депонированное антитело DSM АСС2920.
Другой аспект изобретения относится к антителу, связывающемуся с человеческим CSF-1R, которое отличается тем, что оно связывается с тем же эпитопом, что и депонированное антитело DSM АСС2920; причем связывание с тем же эпитопом определяют при исследовании конкуренции антител in vitro при 25°С методом поверхностного плазмонного резонанса (SPR, от англ. Surface Plasmon Resonance); и
причем антитело обладает следующими свойствами:
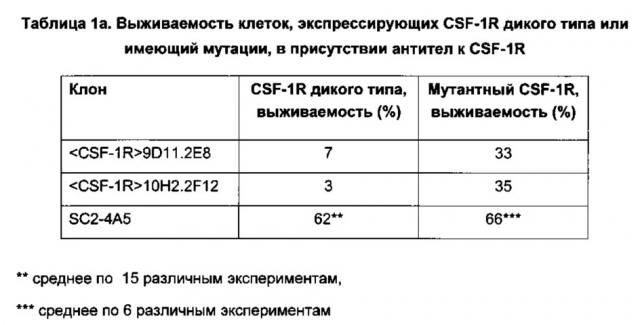
a) ингибирует рост клеток NIH3T3, экспрессирующих рекомбинантный CSF-1R дикого типа, на 90% или более при концентрации антитела 10 мкг/мл; и
b) ингибирует рост клеток NIH3T3, экспрессирующих рекомбинантный CSF-1R с мутациями L301S и Y969F, на 60% или более при концентрации антитела 10 мкг/мл.
В одном воплощении антитело отличается тем, что содержит в качестве участка CDR3 вариабельного домена тяжелой цепи участок CDR3 с последовательностью SEQ ID NO: 1 или SEQ ID NO: 9.
В одном воплощении антитело отличается тем, что
а) вариабельный домен тяжелой цепи содержит участок CDR3 с последовательностью SEQ ID NO: 1, участок CDR2 с последовательностью SEQ ID NO: 2 и участок CDR1 с последовательностью SEQ ID NO: 3, а вариабельный домен легкой цепи содержит участок CDR3 с последовательностью SEQ ID NO: 4, участок CDR2 с последовательностью SEQ ID NO: 5 и участок CDR1 с последовательностью SEQ ID NO: 6, или
b) вариабельный домен тяжелой цепи содержит участок CDR3 с последовательностью SEQ ID NO: 9, участок CDR2 с последовательностью SEQ ID NO: 10 и участок CDR1 с последовательностью SEQ ID NO: 11, а вариабельный домен легкой цепи содержит участок CDR3 с последовательностью SEQ ID NO: 12, участок CDR2 с последовательностью SEQ ID NO: 13 и участок CDR1 с последовательностью SEQ ID NO: 14; или
c) вариант антител согласно а) или b) имеет пересаженный участок CDR, является гуманизированным или у него элиминирован Т-клеточный эпитоп.
В одном воплощении антитело, связывающееся с человеческим CSF-1R и отличающееся вышеупомянутыми аминокислотными последовательностями и фрагментами аминокислотных последовательностей, относится к подклассу IgG1 человека или к подклассу IgG4 человека.
Следующее воплощение изобретения представляет собой фармацевтическую композицию, содержащую антитело по изобретению.
Изобретение также относится к фармацевтической композиции, которая отличается тем, что она содержит антитело, связывающееся с человеческим CSF-1R, отличающееся способностью связываться с вышеупомянутыми эпитопами или, в альтернативном случае, вышеупомянутыми аминокислотными последовательностями или фрагментами аминокислотных последовательностей.
Изобретение также относится к применению антитела, причем такие антитела охватывают антитела, связывающиеся с человеческим CSF-1R, отличающиеся способностью связываться с вышеупомянутыми эпитопами или, в альтернативном случае, отличающиеся вышеупомянутыми аминокислотными последовательностями или фрагментами аминокислотных последовательностей, для применения в изготовлении фармацевтической композиции.
Изобретение также относится к применению антитела, причем такие антитела охватывают антитела, связывающиеся с человеческим CSF-1R, отличающиеся способностью связываться с вышеупомянутыми эпитопами или, в альтернативном случае, отличающиеся вышеупомянутыми аминокислотными последовательностями или фрагментами аминокислотных последовательностей, для лечения заболеваний, опосредованных CSF-1R.
Изобретение также относится к применению антитела, причем такие антитела охватывают антитела, связывающиеся с человеческим CSF-1R, отличающиеся способностью связываться с вышеупомянутыми эпитопами или, в альтернативном случае, отличающиеся вышеупомянутыми аминокислотными последовательностями или фрагментами аминокислотных последовательностей, для лечения рака.
Изобретение также относится к применению антитела, причем такие антитела охватывают антитела, связывающиеся с человеческим CSF-1R, отличающиеся способностью связываться с вышеупомянутыми эпитопами или, в альтернативном случае, отличающиеся вышеупомянутыми аминокислотными последовательностями или фрагментами аминокислотных последовательностей, для лечения потери костной ткани.
Изобретение также относится к применению антитела, причем такие антитела охватывают антитела, связывающиеся с человеческим CSF-1R, отличающиеся способностью связываться с вышеупомянутыми эпитопами или, в альтернативном случае, отличающиеся вышеупомянутыми аминокислотными последовательностями или фрагментами аминокислотных последовательностей, для предупреждения или лечения метастазов.
Изобретение также относится к применению антитела, причем такие антитела охватывают антитела, связывающиеся с человеческим CSF-1R, отличающиеся способностью связываться с вышеупомянутыми эпитопами или, в альтернативном случае, отличающиеся вышеупомянутыми аминокислотными последовательностями или фрагментами аминокислотных последовательностей, для лечения воспалительных заболеваний.
Предпочтительно, антитело связывается с человеческим CSF-1R с аффинностью по меньшей мере от 10-8 моль/л до 10-12 моль/л.
Предпочтительно, антитело представляет собой гуманизированное или человеческое антитело.
Следующее воплощение изобретения представляет собой нуклеиновую кислоту, кодирующую вариабельный домен тяжелой цепи и/или вариабельный домен легкой цепи антитела по изобретению. Предпочтительно, нуклеиновая кислота кодирует тяжелую цепь антитела, связывающегося с человеческим CSF-1R, отличающегося тем, что оно содержит в качестве участка CDR3 тяжелой цепи участок CDR3 с последовательностью SEQ ID NO: 1, SEQ ID NO: 9 или SEQ ID NO: 17.
Следующее воплощение изобретения представляет собой нуклеиновую кислоту, кодирующую антитело по изобретению, отличающееся тем, что
a) вариабельный домен тяжелой цепи содержит участок CDR3 с последовательностью SEQ ID NO: 1, участок CDR2 с последовательностью SEQ ID NO: 2 и участок CDR1 с последовательностью SEQ ID NO: 3, а вариабельный домен легкой цепи содержит участок CDR3 с последовательностью SEQ ID NO: 4, участок CDR2 с последовательностью SEQ ID NO: 5 и участок CDR1 с последовательностью SEQ ID NO: 6, или
b) вариабельный домен тяжелой цепи содержит участок CDR3 с последовательностью SEQ ID NO: 9, участок CDR2 с последовательностью SEQ ID NO: 10 и участок CDR1 с последовательностью SEQ ID NO: 11, а вариабельный домен легкой цепи содержит участок CDR3 с последовательностью SEQ ID NO: 12, участок CDR2 с последовательностью SEQ ID NO: 13 и участок CDR1 с последовательностью SEQ ID NO: 14; или
c) вариант антител согласно a) или b) имеет пересаженный участок CDR, является гуманизированным или у него элиминирован Т-клеточный эпитоп.
В изобретении также предложены экспрессирующие векторы, содержащие нуклеиновую кислоту по изобретению, способные экспрессировать указанную нуклеиновую кислоту в прокариотических или эукариотических клетках-хозяевах, а также клетки-хозяева, содержащие данные векторы для рекомбинантной продукции данного антитела.
Изобретение также относится к прокариотическим или эукариотическим клеткам-хозяевам, включающим векторы по изобретению.
Изобретение также относится к способу получения рекомбинантного человеческого или гуманизированного антитела по изобретению, отличающемуся экспрессией нуклеиновой кислоты по изобретению в прокариотической или эукариотической клетке-хозяине и выделением указанного антитела из указанной клетки или надосадочной культуральной жидкости. Изобретение также относится к антителу, которое можно получить указанным рекомбинантным способом.
Антитела по изобретению оказывают положительный эффект на пациентов, нуждающихся в терапии, мишенью которой является CSF-1R. Антитела по изобретению являются новыми и обладают изобретательским уровнем, оказывая положительный эффект на пациентов, страдающих опухолевыми заболеваниями, в частности, страдающих раком.
В изобретении также предложен способ лечения пациента, страдающего раком, включающий введение пациенту, у которого диагностировано данное заболевание (и, следовательно, нуждающегося в такой терапии), эффективного количества антитела, связывающегося с человеческим CSF-1R согласно изобретению. Предпочтительно, антитело вводят в составе фармацевтической композиции.
Следующее воплощение изобретения представляет собой способ лечения пациента, страдающего раком, отличающийся введением пациенту антитела по изобретению.
Изобретение также относится к применению антитела по изобретению для лечения пациента, страдающего раком, и для изготовления фармацевтической композиции согласно изобретению. Кроме того, изобретение относится к способу изготовления фармацевтической композиции согласно изобретению.
Изобретение также относится к фармацевтической композиции, содержащей антитело по изобретению, возможно в сочетании с буфером и/или адъювантом, обеспечивающими удобство применения антител для фармацевтических целей.
В изобретении также предложены фармацевтические композиции, содержащие антитело по изобретению на фармацевтически приемлемом носителе. В одном воплощении фармацевтическая композиция может входить в состав изделия или набора.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1. Подавление роста опухолевых клеток BeWo в 3D культуре в присутствии различных моноклональных антител к CSF-1R в концентрации 10 мкг/мл.
Ось X: средние значения жизнеспособности, выраженной в относительных световых единицах (RLU, от англ. relative light units), соответствующих содержанию АТФ в клетках (CellTiterGlo assay).
Ось Υ: исследованные образцы: минимальная среда (0,5% эмбриональной телячьей сыворотки), IgG1 мыши (mIgG1, 10 мкг/мл), IgG2a мыши (mIgG2a, 10 мкг/мл), только CSF-1, <CSF-1R>9D11.2Е8, <CSF-1R>10H2.2F12 и SC-02 клон 2-4А5.
Максимальное ингибирование CSF-1-индуцированного роста наблюдалось в присутствии антитела к CSF-1R, предложенного в изобретении.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Изобретение также относится к антителу, связывающемуся с человеческим CSF-1R, которое отличается тем, что содержит в качестве участка CDR3 вариабельного домена тяжелой цепи участок CDR3 с последовательностью SEQ ID NO: 1 или SEQ ID NO: 9.
Изобретение также относится к указанному антителу, которое отличается тем, что
a) вариабельный домен тяжелой цепи содержит участок CDR3 с последовательностью SEQ ID NO: 1, участок CDR2 с последовательностью SEQ ID NO: 2 и участок CDR1 с последовательностью SEQ ID NO: 3, а вариабельный домен легкой цепи содержит участок CDR3 с последовательностью SEQ ID NO: 4, участок CDR2 с последовательностью SEQ ID NO: 5 и участок CDR1 с последовательностью SEQ ID NO: 6, или
b) вариабельный домен тяжелой цепи содержит участок CDR3 с последовательностью SEQ ID NO: 9, участок CDR2 с последовательностью SEQ ID NO: 10 и участок CDR1 с последовательностью SEQ ID NO: 11, а вариабельный домен легкой цепи содержит участок CDR3 с последовательностью SEQ ID NO: 12, участок CDR2 с последовательностью SEQ ID NO: 13 и участок CDR1 с последовательностью SEQ ID NO: 14; или
c) вариант антител согласно a) или b) имеет пересаженный участок CDR, является гуманизированным или у него элиминирован Т-клеточный эпитоп.
Термин «антитело» охватывает различные формы антител, в том числе целые антитела, фрагменты антител, гуманизированные антитела, химерные антитела, антитела, у которых элиминирован Т-клеточный эпитоп, и антитела, созданные методами генетической инженерии, при условии, что они сохраняют характерные свойства согласно изобретению, но не ограничиваются ими.
"Фрагменты антитела" содержат часть полноразмерного антитела, предпочтительно его вариабельный домен, или по меньшей мере его антиген-связывающий сайт. Примеры фрагментов антител включают диатела, одноцепочечные молекулы антител и мультиспецифические антитела, образованные из фрагментов антител. Антитела scFv описаны, например, Houston, J.S., Methods in Enzymol. 203 (1991) 46-88). Кроме того, фрагменты антител охватывают одноцепочечные полипептиды, которые имеют характеристики VH домена, связывающегося с CSF-1R, а именно способного объединяться с VL доменом, или характеристики VL домена, связывающегося с CSF-1R, а именно способного объединяться с VH доменом с образованием функционального антиген-связывающего сайта, обеспечивающего данное свойство.
Термины «моноклональное антитело» или «композиция моноклонального антитела» в данном документе обозначают препарат молекул антитела единого аминокислотного состава.
Термин «химерное антитело» обозначает моноклональное антитело, содержащее вариабельный домен, т.е., связывающий домен мыши и, по меньшей мере, часть константного домена, происходящего из другого источника или вида, как правило, созданного при помощи технологий рекомбинантной ДНК. Химерные антитела, содержащие мышиный вариабельный домен и человеческий константный домен, являются наиболее предпочтительными. Такие химерные антитела крысы/человека представляют собой продукт экспрессируемых генов иммуноглобулинов, содержащих сегменты ДНК, кодирующие вариабельные домены иммуноглобулинов крысы, и сегменты ДНК, кодирующие константные домены иммуноглобулинов человека. Другие виды «химерных антител», охватываемых настоящим изобретением, представляют собой антитела, в которых класс или подкласс был модифицирован или изменен по сравнению с исходным антителом. Такие «химерные» антитела также обозначаются «антитела с переключением класса». Способы получения химерных антител включают традиционные технологии рекомбинантной ДНК и генной трансфекции, хорошо известные в данной области техники. См., например, Morrison, S.L., et al., Proc. Natl. Acad Sci. USA 81 (1984) 6851-6855; US 5,202,238 и US 5,204,244.
Термин "вариант с пересаженными участками CDR" в данном описании означает вариабельный домен антитела, включающий участки, определяющие комплементарность (CDR, от англ. complementary determining regions, или гипервариабельные участки) из одного источника или вида и каркасные участки (FR, от англ. framework regions) из другого источника или вида, как правило, полученные при помощи технологий рекомбинантной ДНК. Предпочтительными являются варианты вариабельных доменов с пересаженными областями CDR, представляющими собой мышиные CDR, и человеческими FR.
Термин "вариант с элиминированным Т-клеточным эпитопом" в данном описании обозначает вариабельный домен антитела, который подвергли модификации для устранения или снижения иммуногенности за счет удаления человеческих Т-клеточных эпитопов (последовательностей пептидов в составе вариабельных доменов, способных связывать молекулы главного комплекса гистосовместимости (МНС, от англ. major histocompatibility complex) II класса). С помощью этого метода идентифицируют взаимодействия между боковыми цепями аминокислот вариабельного домена и специфическими «карманами» и связывающими желобками молекул МНС II класса. Идентифицированные иммуногенные участки подвергают мутации для устранения иммуногенности. Данные способы описаны, например, в WO 98/52976.
Термин "гуманизированный вариант" в данном описании обозначает вариабельный домен антитела, сконструированный на основе участков, определяющих комплементарность (CDR), не являющихся человеческими, например, происходящими от видов, отличных от человека, и каркасных участков (FR) человеческого происхождения, которые подвергли дальнейшей модификации для восстановления или улучшения аффинности и специфичности связывания исходного вариабельного домена, не являющегося человеческим. Такие гуманизированные варианты, как правило, получают при помощи технологий рекомбинантной ДНК. Восстановление аффинности и специфичности родительского вариабельного домена, не являющегося человеческим, является решающим этапом, и в настоящее время для этого применяют различные способы. При одном способе устанавливают целесообразность введения мутаций, т.н. обратных мутаций, в не являющиеся человеческими CDR, а также в человеческие FR. Подходящие позиции для таких обратных мутаций можно идентифицировать, например, при помощи анализа последовательности или гомологии, выбирая человеческую каркасную последовательность (подход с заданной каркасной последовательностью; установление гомологии или метод наилучшего соответствия), используя консенсусные последовательности, выбирая FR из нескольких различных человеческих моноклональных антител (mAbs) или замещая поверхностные остатки, не являющиеся человеческими, остатками, которые чаще всего встречаются в человеческих моноклональных антителах ("изменение поверхности" или "венирование").
Кроме того, антитела по изобретению охватывают антитела, имеющие "консервативные модификации последовательности", нуклеотидные и аминокислотные модификации, которые не влияют или не изменяют указанные выше свойства антитела по изобретению. Модификации можно осуществлять при помощи стандартных методик, известных в области техники, таких как сайт-специфический мутагенез и мутагенез при помощи ПЦР. Консервативные аминокислотные замены представляют собой замены, при которых аминокислотный остаток замещается аминокислотным остатком, имеющим схожую боковую цепь. В области техники известны семейства аминокислотных остатков, имеющих схожие боковые цепи. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, аминокислотный остаток человеческого антитела к CSF-1R, который предположительно является несущественным, можно заменить на другой аминокислотный остаток с боковой цепью из того же семейства.
Аминокислотные замены можно осуществлять при помощи мутагенеза, основанного на молекулярном моделировании, как описано Riechmann, L., et al., Nature 332 (1988) 323-327 и Queen, С., et al., Proc. Natl. Acad. Sci. USA 86 (1989) 10029-10033.
Рецептор CSF-1 (CSF-1R; синонимы: рецептор M-CSF; рецептор макрофагального колониестимулирующего фактора 1, ЕС 2.7.10.1, протоонкоген Fms, c-fms, CD115, код в базе данных Swiss Prot Р07333, (SEQ ID NO: 23)) был открыт в 1986 (Coussens, L., et al., Nature 320 (1986) 277-280). CSF-1R представляет собой фактор роста, кодируемый протоонкогеном c-fms (например, см. обзор Roth, P., and Stanley, E.R., Curr. Top. Microbiol. Immunol. 181 (1992) 141-67).
CSF-1R является рецептором M-CSF (макрофагального колониестимулирующего фактора, также обозначаемого CSF-1) и опосредует биологические эффекты этого цитокина (Sherr, C.J., et al., Cell 41 (1985) 665-676). Клонирование рецептора колониестимулирующего фактора 1 (также обозначаемого c-fms) впервые описано Roussel, M.F., et al., Nature 325 (1987) 549-552. В этой публикации было продемонстрировано, что трансформирующий потенциал CSF-1R зависит от модификаций C-концевой части белка, таких как потеря ингибиторного сайта фосфорилирования по тирозину 969, с которым связывается Cbl и таким образом опосредует отрицательную регуляцию рецептора (Lee, P.S., et al., Embo J. 18(1999) 3616-3628).
В данном документе "связывание с человеческим CSF-1R" обозначает специфическое связывание антитела с человеческим антигеном CSF-1R. Аффинность связывания характеризуется значением KD, равным 1,0×10-8 моль/л или менее при 35°С, предпочтительно значением KD, равным 1,0×10-9 моль/л или менее при 35°С. Аффинность связывания определяют при помощи стандартного исследования связывания при 35°С, например, с помощью метода поверхностного плазмонного резонанса (Biacore®) (см. Пример 4).
Термин "эпитоп" обозначает белковую детерминанту, способную специфически связываться с антителом. Эпитопы обычно имеют в своем составе химически активные поверхностные группировки молекул, таких как аминокислоты или углеводные боковые цепочки и, как правило, эпитопы обладают определенной трехмерной структурой, а также определенным зарядом. Конформационные и линейные эпитопы различаются тем, что в отличие от последних, связывание с первыми нарушается в присутствии денатурирующих растворителей. Предпочтительно, антитело по изобретению специфически связывается с нативным, но не с денатурированным CSF-1R.
Термин "связывание с тем же эпитопом, что и у депонированного антитела DSM АСС2920" в данном описании обозначает, что анти-CSF-1R антитело по изобретению связывается с тем же эпитопом CSF-1R, с которым связывается антитело <CSF-1R>9D11.2E8 (депонированное под номером DSM АСС2920). Способность антитела к CSF-1R по данному изобретению связываться с эпитопами можно определить при помощи методов, известных в области техники. Антитело к CSF-1R исследуют при 25°С методом поверхностного плазмонного резонанса (SPR, от англ. Surface Plasmon Resonance), анализируя конкуренцию антител in vitro для определения способности исследуемого антитела ингибировать связывание антитела <CSF-1R>9D11.2E8 (депонированного под номером DSM АСС2920) с CSF-1R. Исследование можно проводить с использованием прибора BIAcore (Pharmacia Biosensor АВ, Uppsala, Sweden), например, как описано в Примере 5. В Примере 5 выраженный в % уровень предполагаемого связывания предложенного в изобретении антитела к CSF-1R, конкурирующего со связанным антителом <CSF-1R>9D11.2E8 (депонированным под номером DSM АСС2920), рассчитывают по формуле: "100 × относительный ответ (в начале фазы диссоциации) / гМах", где гМах рассчитывают по формуле: "относительный ответ (в конце фазы диссоциации) × молекулярный вес антитела / молекулярный вес антигена", согласно описанию в инструкциях к прибору BIAcore для картирования эпитопов. Минимальный уровень связывания также рассчитывают для пар идентичных антител 1 и 2 (см. Пример 5). Полученное при этом максимальное значение + 50% принимают за пороговый уровень, выше которого конкуренцию и, следовательно, связывание с этим же эпитопом считают значимыми (см. Пример 5, где рассчитанный пороговый уровень для антитела <CSF-1R>9D11.2E8 составляет 8+4=12). Таким образом, у антитела, связывающегося с человеческим CSF-1R, отличающегося тем, что оно "связывается с тем же эпитопом, что и <CSF-1R>9D11.2E8 (депонированное под номером DSM АСС2920)", уровень предполагаемого связывания, выраженный в %, составляет менее 12% (уровень предполагаемого связывания в % <12).
«Вариабельный домен» (вариабельный домен легкой цепи (VL), вариабельный домен тяжелой цепи (VH)) в данном документе обозначают домен каждой из двух легких и тяжелых цепей, непосредственно участвующий в связывании антитела с антигеном. Вариабельные домены легкой цепи и тяжелой цепи имеют схожую общую структуру, и каждый домен содержит четыре каркасных участка (FR), последовательности которых являются высоко консервативными, связанных с тремя «гипервариабельными участками» (или участками, определяющими комплементарность, CDR, от англ. complementary determining regions). Каркасные участки имеют конформацию β-слоя, а CDR могут формировать петли, соединяющие β-слои. Трехмерная структура CDR каждой цепи поддерживается при помощи каркасных участков, а вместе с CDR другой цепи они формируют антиген-связывающий сайт. Участки CDR3 тяжелой и легкой цепей антитела имеют особенно важную роль для специфичности/аффинности связывания антитела по изобретению и, таким образом, представляют собой следующий объект изобретения.
Термин "антиген-связывающая часть антитела" в данном документе обозначает аминокислотные остатки антитела, отвечающие за связывание антигена. Антиген-связывающая часть антитела содержит аминокислотные остатки «участков, определяющих комплементарность», или «CDR». «Каркасные участки», или «FR» согласно данному описанию представляют собой участки вариабельных доменов, отличные от остатков гипервариабельных участков. Таким образом, легкая и тяжелая цепи антитела содержат в направлении от N-конца к С-концу следующие домены: FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. В частности, CDR3 тяжелой цепи является участком, который вносит наибольший вклад в связывание антигена и определяет свойства антитела. Участки CDR и FR определяют в соответствии со стандартной системой определения Kabat et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991) и/или по остаткам в составе «гипервариабельных петель".
Термины "нуклеиновая кислота" или "молекула нуклеиновой кислоты" в данном документе охватывают молекулы ДНК и молекулы РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двуцепочечной, но предпочтительно является двуцепочечной молекулой ДНК.
Термин "аминокислота" в данном описании обозначает группу карбокси-альфа-аминокислот естественного происхождения, включая аланин (трехбуквенный код: ala, однобуквенный код: А), аргинин (arg, R), аспарагин (asn, Ν), аспарагиновую кислоту (asp, D), цистеин (cys, С), глутамин (gln, Q), глутаминовую кислоту (glu, Ε), глицин (gly, G), гистидин (his, Η), изолейцин (ile, I), лейцин (leu, L), лизин (lys, K), метионин (met, M), фенилаланин (phe, F), пролин (pro, P), серии (ser, S), треонин (thr, T), триптофан (trp, W), тирозин (tyr, Y) и валин (val, V).
Следующее воплощение изобретения представляет собой способ получения предложенного в данном изобретении антитела, направленного против человеческого CSF-1R, отличающийся тем, что последовательность нуклеиновой кислоты, кодирующей тяжелую цепь человеческого антитела класса IgG1, связывающегося с человеческим CSF-1R, и нуклеиновой кислоты, кодирующей легкую цепь человеческого антитела, встраивают в экспрессирующий вектор, указанный вектор встраивают в эукариотическую клетку-хозяина, кодируемый белок экспрессируют и выделяют из клетки-хозяина или из надосадочной жидкости.
Антитела по изобретению предпочтительно получают рекомбинантными способами. Такие способы хорошо известны в области техники и включают экспрессию белков в прокариотических и эукариотических клетках с последующим выделением полипептида антитела и, как правило, с очисткой до фармацевтически приемлемой степени чистоты. Для экспрессии белка нуклеиновые кислоты, кодирующие легкую и тяжелую цепи или их фрагменты, встраивают в экспрессирующие векторы при помощи стандартных способов. Экспрессию осуществляют в соответствующих прокариотических или эукариотических клетках-хозяевах, таких как клетки СНО, клетки NS0, клетки SP2/0, клетки HEK293, клетки COS, клетки дрожжей или клетки Е. coli, а антитело выделяют из клеток (из надосадочной жидкости или из клеток после лизиса).
Молекулы нуклеиновых кислот, кодирующих аминокислотные последовательности вариантов антител к CSF-1R, получают при помощи различных способов, известных в области техники. Данные способы включают, но не ограничиваются выделением из природных источников (в случае вариантов аминокислотных последовательностей естественного происхождения) или проведением олигонуклеотид-направленного (или сайт-специфического) мутагенеза, мутагенеза при помощи ПЦР и кассетного мутагенеза полученной ранее вариантной или нонвариантной версии гуманизированного антитела к CSF-1R.
Вариабельные домены тяжелой и легкой цепей согласно изобретению объединяют с последовательностями промотора, инициации трансляции, константного участка, 3ʹ нетранслируемого участка, полиаденилирования и терминации транскрипции с получением конструкций экспрессирующего вектора. Конструкции, экспрессирующие тяжелую и легкую цепи, можно объединять в составе одного вектора, трансфецировать совместно, трансфецировать последовательно или трансфецировать по-отдельности клетки-хозяева, которые затем подвергают слиянию с получением одной клетки-хозяина, экспрессирующей обе цепи.
Рекомбинантная продукция антител хорошо известна в области техники и описана, например, в обзорных статьях Makrides, S.C., Protein Expr. Purif. 17 (1999) 183-202; Geisse, S., et al., Protein Expr. Purif. 8 (1996) 271-282; Kaufman, R.J., Mol. Biotechnol. 16 (2000) 151-161; Werner, R.G., Drug Res. 48 (1998) 870-880.
Антитела могут находиться в целых клетках, в клеточном лизате, в частично очищенном или по существу чистом виде. Очистку проводят для удаления других клеточных компонентов или других примесей, например, других нуклеиновых кислот или белков клетки, при помощи стандартных методик, таких как обработка щелочами/ДСН, центрифугирование в градиенте CsCl, колоночная хроматография, электрофорез в агарозном геле и других методик, хорошо известных в области техники. См. Ausubel, F., et al., eds. Current Protocols in Molecular Biology, Greene Publishing and Wiley Interscience, New York (1987).
Экспрессия в клетках NS0 описана, например, Barnes, L.M., et al., Cytotechnology 32 (2000) 109-123 и Barnes, L.M., et al., Biotech. Bioeng. 73 (2001) 261-270. Транзиторная экспрессия описана, например, Durocher, Y., et al., Nucl. Acids. Res. 30 (2002) E9. Клонирование вариабельных доменов описано Orlandi, R., et al., Proc. Natl. Acad. Sci. USA 86 (1989) 3833-3837; Carter, P., et al., Proc. Natl. Acad. Sci. USA 89 (1992) 4285-4289 и Norderhaug, L., et al., J. Immunol. Methods 204 (1997) 77-87. Предпочтительная система для транзиторной экспрессии (HEK 293) описана Schlaeger, E.-J., and Christensen, K., in Cytotechnology 30 (1999) 71-83 и by Schlaeger, E.-J., in J. Immunol. Methods 194 (1996) 191-199.
Контролирующие последовательности, которые можно применять для прокариот, включают, например, последовательность промотора, возможно последовательность оператора и сайт связывания рибосом. Известно, что эукариотические клетки используют промоторы, энхансеры и сигналы полиаденилирования.
Нуклеиновая кислота является "функционально связанной", когда она находится в функциональной связи с другой нуклеотидной последовательностью. Например, ДНК пре-последовательности или лидерной последовательности секретируемого пептида функционально связана с ДНК полипептида, если при ее экспрессии образуется пре-белок, участвующий в секреции полипептида; промотор или энхансер функционально связаны с кодирующей последовательностью, если они влияют на транскрипцию последовательности; или сайт связывания рибосом функционально связан с кодирующей последовательностью, если он располагается таким образом, что способствует трансляции. Как правило, понятие "функционально связаны" о