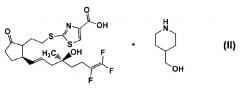
Аминовая соль и ее кристаллы
Иллюстрации
Показать всеНастоящее изобретение относится к соли соединения, представленного формулой (I), где представляет собой α-конфигурацию,представляет собой β-конфигурацию ипредставляет собой α-конфигурацию, β-конфигурацию или их смесь в произвольном соотношении, и 4-пиперидинметанола; ее кристаллу; или ее циклодекстриновому клатрату. Соединение по изобретению может быть представлено общей формулой (II). Соединение представляет собой агент для сокращения детрузора мочевого пузыря и расслабления сфинктера мочеиспускательного канала, а также для предотвращения, лечения и/или облегчения гипоактивного мочевого пузыря. 5 н. и 18 з.п. ф-лы, табл. 6, 20 пр.
,
Реферат
Область техники, к которой относится настоящее изобретение
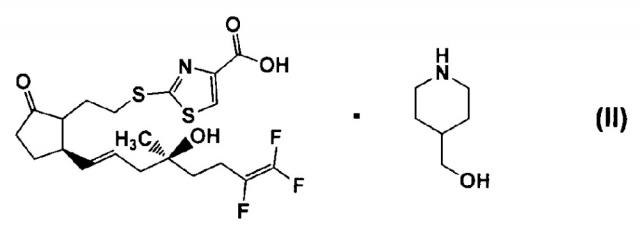
Настоящее изобретение относится к соли 2-[(2-{(1R,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоновой кислоты или ее диастереомерной смеси и 4-пиперидинметанола; ее кристаллу; или ее циклодекстриновому клатрату (в настоящем изобретении иногда называют соединением настоящего изобретения) и относится к содержащей их фармацевтической композиции.
Недавно предложена новая терминология гипоактивного мочевого пузыря, касающаяся симптома, при котором мочевой пузырь не может быть опорожнен (неполное опорожнение мочевого пузыря) вследствие недостаточного сокращения мышц при мочеиспускании.
Гипоактивный мочевой пузырь вызван нарушением сокращения мышц мочевого пузыря, т.е. клиническим заболеванием, при котором снижается сокращаемость детрузора мочевого пузыря (недостаточная активность детрузора) или комбинацией нарушения уретральной релаксации (нарушение прохождения через нижние мочевыводящие пути), т.е. клинического заболевания с недостаточным расслаблением сфинктера мочеиспускательного канала и нарушения сокращения мышц мочевого пузыря, который разделяют на нейрогенный гипоактивный мочевой пузырь, миогенный гипоактивный мочевой пузырь, гипоактивный мочевой пузырь, вызванный приемом лекарственных средств, возрастной гипоактивный мочевой пузырь и гипоактивный мочевой пузырь, вызванный другими факторами (например, гипоактивный мочевой пузырь в результате блокады, инфекции и стресса нижних мочевыводящих путей и т.д.), в зависимости от причин.
В качестве соединения, способного лечить гипоактивный мочевой пузырь, известна 2-[(2-{(1R,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоновая кислота, которая влияет на сокращение детрузора мочевого пузыря и расслабление сфинктера мочеиспускательного канала (см. патентную литературу 1).
Однако к настоящему времени ни один документ не описывает соли 2-[(2-{(1R,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоновой кислоты и 4-пиперидинметанола, ее кристаллов и полиморфизм.
Патентная литература 1 WO 2010/143661
Сущность настоящего изобретения
Проблема, которую будет решать настоящее изобретение
2-[(2-{(1R,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоновая кислота оказывает сильное влияние на сокращение детрузора мочевого пузыря и расслабление сфинктера мочеиспускательного канала и является очень полезной в качестве терапевтического агента для гипоактивного мочевого пузыря. Однако 2-[(2-{(1R,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоновая кислота представляет собой аморфное маслянистое вещество и, таким образом, ее очень сложно транспортировать, и она является нестабильной в качестве лекарственного вещества в процессе получения лекарственного вещества для получения перорального препарата.
Поскольку хронические заболевания, такие как гипоактивный мочевой пузырь, требуют длительного введения лекарственного средства, требуется терапевтический агент, который оказывает, само собой разумеется, сильный эффект, обладает низким риском побочных эффектов и который можно вводить перорально, принимая во внимание безопасность и удобность для пациентов.
При получении перорального препарата для продолжительного введения, в частности, его лекарственное вещество должно быть стабильным к нагреванию, влажности или подобным и должно быть безопасным. При получении лекарственного вещества в стабильной форме, такой как кристаллическая форма, она является весьма удобной с точки зрения стабильности, продолжительного хранения, удобства обращения, простоты получения лекарственного средства или подобных. Соответственно, обеспечение кристаллического лекарственного вещества, которое является химически стабильным и безопасным, является критической проблемой для получения лекарственных препаратов.
Способы решения проблемы
Изобретатели настоящего изобретения сделали попытку кристаллизовать соли 2-[(2-{(1R,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоновой кислоты и 25 безопасных оснований, которые одобрены в качестве лекарственных средств, включая соли с щелочными металлами (калием, натрием и подобными), соли с щелочноземельными металлами (кальцием, магнием и подобными) и соли с фармацевтически приемлемыми органическими аминами, такими как триэтиламин, диэтаноламин, дициклогексиламин, лизин и аргинин. Однако ни одна из данных солей не кристаллизовалась. Изобретатели настоящего изобретения дополнительно исследовали большое количество оснований приблизительно 100 видов в различных условиях кристаллизации, и как результат обнаружили, что соль 2-[(2-{(1R,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоновой кислоты и 4-пиперидинметанола может представлять собой химически стабильный и безопасный кристалл. Таким образом, настоящее изобретение было завершено.
А именно, настоящее изобретение относится к:
1. соли соединения, представленного формулой (I)
в которой
представляет собой α-конфигурацию,
представляет собой β-конфигурацию, и
представляет собой α-конфигурацию, β-конфигурацию или их смесь в произвольном соотношении) или его диастереомерной смеси и 4-пиперидинметанола, ее кристаллу или ее циклодекстриновому клатрату;
2. соли, ее кристаллу или ее циклодекстриновому клатрату, описанным в п.1 выше, где соединение, представленное формулой (I), представляет собой 2-[(2-{(1R,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоновую кислоту;
3. соли, ее кристаллу или ее циклодекстриновому клатрату, описанным в п.1 выше, где соединение, представленное формулой (I), представляет собой диастереомерную смесь 2-[(2-{(1R,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоновой кислоты;
4. соли, ее кристаллу или ее циклодекстриновому клатрату, описанным в п.3 выше, где диастереомер 2-[(2-{(1R,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоновой кислоты представляет собой 2-[(2-{(1S,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоновую кислоту;
5. пиперидин-4-илметанол 2-[(2-{(1R,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоксилату, его диастереомерной смеси, его кристаллу или его циклодекстриновому клатрату;
6. пиперидин-4-илметанол 2-[(2-{(1S,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоксилату, его кристаллу или его циклодекстриновому клатрату;
7. смеси пиперидин-4-илметанол 2-[(2-{(1R,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоксилата и его диастереомера: пиперидин-4-илметанол 2-[(2-{(1S,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоксилата, его кристалла или его циклодекстринового клатрата;
8. соединению, представленному формулой (II)
(в которой
представляет собой α-конфигурацию,
представляет собой β-конфигурацию, и
представляет собой α-конфигурацию, β-конфигурацию или их смесь в произвольном соотношении), его кристаллу или его циклодекстриновому клатрату;
9. кристаллу или его циклодекстриновому клатрату, описанным в одном из пп. 1-8 выше, который имеет кристаллическую форму, имеющую 2θ пики, по меньшей мере, при приблизительно 9,05, 9,44, 12,61, 13,96 и 18,09° в спектре порошковой рентгеновской дифракции;
10. кристаллу или его циклодекстриновому клатрату, описанным в п. 9 выше, который имеет кристаллическую форму, имеющую 2θ пики, по меньшей мере, при приблизительно 9,05, 9,44, 12,61, 13,96, 18,09, 18,91, 19,42, 20,53, 21,77, 22,60, 23,38 и 24,59° в спектре порошковой рентгеновской дифракции;
11. кристаллу или его циклодекстриновому клатрату, описанному в одном из пп. 1-8 выше, который имеет кристаллическую форму, имеющую по существу аналогичный спектр порошковой рентгеновской дифракции, как спектр порошковой рентгеновской дифракции, показанный на фигуре 1;
12. кристаллу или его циклодекстриновому клатрату, описанному в одном из пп. 9-11 выше, который имеет кристаллическую форму, имеющую начало эндотермического пика при приблизительно 118°C в дифференциальной сканирующей калориметрии;
13. кристаллу или его циклодекстриновому клатрату, описанному в одном из пп. 9-11 выше, который имеет кристаллическую форму, имеющую график дифференциальной сканирующей калориметрии, показанный на фигуре 2;
14. кристаллу или его циклодекстриновому клатрату, описанному в одном из пп. 1-8 выше, который имеет кристаллическую форму, имеющую 2θ пики, по меньшей мере, при приблизительно 8,91, 9,71, 11,97, 13,23 и 15,88° в спектре порошковой рентгеновской дифракции;
15. кристаллу или его циклодекстриновому клатрату, описанному в п. 14 выше, который имеет кристаллическую форму, имеющую 2θ пики, по меньшей мере, при приблизительно 8,91, 9,71, 11,97, 13,23, 15,88, 18,63, 19,02, 21,02, 22,91 и 23,85° в спектре порошковой рентгеновской дифракции;
16. кристаллу или его циклодекстриновому клатрату, описанному в одном из пп. 1-8 выше, который имеет кристаллическую форму, имеющую по существу аналогичный спектр порошковой рентгеновской дифракции, как спектр порошковой рентгеновской дифракции, показанный на фигуре 3;
17. кристаллу или его циклодекстриновому клатрату описанному в одном из пп.14-16 выше, который имеет кристаллическую форму, имеющую начало эндотермического пика при приблизительно 113°C в дифференциальной сканирующей калориметрии;
18. кристаллу или его циклодекстриновому клатрату описанному в одном из пп.14-16 выше, который имеет кристаллическую форму, имеющую график дифференциальной сканирующей калориметрии, показанный на фигуре 4;
19. кристаллу или его циклодекстриновому клатрату описанному в одном из пп.1-8 выше, который имеет кристаллическую форму, имеющую 2θ пики, по меньшей мере, при приблизительно 9,11, 13,43, 16,16, 17,77 и 18,69° в спектре порошковой рентгеновской дифракции;
20. кристаллу или его циклодекстриновому клатрату, описанному в п. 19 выше, который имеет кристаллическую форму, имеющую 2θ пики, по меньшей мере, при приблизительно 9,11, 13,43, 16,16, 17,77, 18,69, 19,24, 19,86, 21,19, 22,72 и 24,20° в спектре порошковой рентгеновской дифракции;
21. кристаллу или его циклодекстриновому клатрату, описанному в одном из пп. 1-8 выше, который имеет кристаллическую форму, имеющую по существу аналогичный спектр порошковой рентгеновской дифракции, как спектр порошковой рентгеновской дифракции, показанный на фигуре 5;
22. кристаллу или его циклодекстриновому клатрату, описанному в одном из пп. 19-21 выше, который имеет кристаллическую форму, имеющую начало эндотермического пика при приблизительно 118°C в дифференциальной сканирующей калориметрии;
23. кристаллу или его циклодекстриновому клатрату, описанному в одном из пп. 19-21 выше, который имеет кристаллическую форму, имеющую график дифференциальной сканирующей калориметрии, показанный на фигуре 6;
24. фармацевтической композиции, содержащей в качестве активного ингредиента соль соединения, представленного формулой (I)
(в которой
представляет собой α-конфигурацию,
представляет собой β-конфигурацию, и
представляет собой α-конфигурацию, β-конфигурацию или их смесь в произвольном соотношении) или его диастереомерной смеси и 4-пиперидинметанола; ее кристалл; или ее циклодекстриновый клатрат;
25. фармацевтической композиции, содержащей кристалл или его циклодекстриновый клатрат, описанный в одном из пп. 9-23 выше;
26. фармацевтической композиции, описанной в п. 24 или 25 выше, которая представляет собой агент для сокращения детрузора мочевого пузыря и расслабления сфинктера мочеиспускательного канала;
27. фармацевтической композиции, описанной в п. 26 выше, которая представляет собой агент для предотвращения, лечения и/или облегчения нарушения сокращения мышц мочевого пузыря и/или нарушения уретрального расслабления; и
28. фармацевтической композиции, описанной в п. 27 выше, где нарушение сокращения мышц мочевого пузыря и/или нарушение уретрального расслабления представляет собой гипоактивный мочевой пузырь.
ЭФФЕКТЫ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Поскольку соединение настоящего изобретения представляет собой химически очень стабильный кристалл, соединение можно хранить в течение длительного периода времени, и оно является очень пригодным в качестве лекарственного вещества лекарственных средств.
Кроме того, поскольку соединение настоящего изобретения оказывает влияние на сокращение детрузора мочевого пузыря и расслабление сфинктера мочеиспускательного канала, соединение облегчает нарушение сокращения мышц мочевого пузыря и/или нарушение уретрального расслабления и является эффективным в качестве агента для предотвращения и/или лечения гипоактивного мочевого пузыря. Кроме того, соединение также является эффективным в качестве агента для облегчения различных симптомов гипоактивного мочевого пузыря. Таким образом, когда соединение настоящего изобретения, которое представляет собой стабильный кристалл, применяют в качестве лекарственного вещества и получают пероральный препарат для продолжительного введения, препарат может представлять собой весьма эффективный терапевтический агент для гипоактивного мочевого пузыря.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 показывает спектр порошковой рентгеновской дифракции кристаллической формы A пиперидин-4-илметанол 2-[(2-{(1R,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоксилата (в настоящем изобретении ниже иногда сокращают до соединения 18). Термин “интенсивность” на фигуре обозначает интенсивность дифракции.
Фигура 2 показывает график дифференциальной сканирующей калориметрии кристаллической формы A соединения 18.
Фигура 3 показывает спектр порошковой рентгеновской дифракции кристаллической формы B соединения 18. Термин “интенсивность” на фигуре обозначает интенсивность дифракции.
Фигура 4 показывает график дифференциальной сканирующей калориметрии кристаллической формы B соединения 18.
Фигура 5 показывает спектр порошковой рентгеновской дифракции кристаллической формы C соединения 18. Термин “интенсивность” на фигуре обозначает интенсивность дифракции.
Фигура 6 показывает график дифференциальной сканирующей калориметрии кристаллической формы C соединения 18.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Настоящее изобретение относится к
(1) соли 2-[(2-{(1R,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоновой кислоты (в настоящем изобретении ниже иногда сокращают до соединения 17) и 4-пиперидинметанола,
(2) соли диастереомера соединения 17 и 4-пиперидинметанола,
(3) соли диастереомерной смеси соединения 17 в произвольном соотношении и 4-пиперидинметанола,
(4) кристаллам (1)-(3) выше,
(5) циклодекстриновым клатратам (1)-(4) выше, и
(6) фармацевтическим композициям, содержащим (1)-(5) выше.
Соединение 17 представляет собой соединение, представленное следующей формулой
и описанное в примере 17 WO2010/143661.
Если иначе специально не указано в настоящем изобретении, специалисту в данной области техники ясно, что
символ
представляет собой связь с задней стороной бумаги (т.е. α-конфигурацию);
символ
представляет собой связь с передней стороной бумаги (т.е. β-конфигурацию); и
символ
представляет собой α-конфигурацию, β-конфигурацию или их смесь.
Различные соли соединения 17 получали и исследовали для кристаллизации следующим способом.
А именно, соединение 17 (10 мг) растворяли в метаноле (200 мкл) и добавляли к нему различные основания. Затем, смесь концентрировали при пониженном давлении, и проводили растирание, применяя различные растворители. Для данного исследования в качестве растворителей применяли этилацетат, метил трет-бутиловый эфир, н-гексан и подобные.
Хотя исследование кристаллизации проводили, применяя 100 солей или более, нельзя было получить кристаллические твердые вещества, за исключением соли с 4-пиперидинметанолом. Например, соли со щелочными металлами (калием, натрием и подобными) и соли с щелочноземельными металлами (кальцием, магнием и подобными), которые одобрены в качестве лекарственных средств, и соли соединения 17 с фармацевтически приемлемыми органическими аминами, такими как триэтиламин, диэтаноламин, дициклогексиламин, лизин и аргинин, и с 4-пиперидинэтанолом, 4-метилпиперидином и 4-гидроксипиперидином, которые имеют структуры, аналогичные структуре 4-пиперидинметанола, представляли собой аморфные маслянистые вещества.
Некоторые из результатов показаны ниже.
| Таблица 1 | |||||||
| Основание | Состояние | Основание | Состояние | Основание | Состояние | ||
| Натрий | Маслянистый | Маслянистый | Маслянистый | ||||
| Калий | Маслянистый | Маслянистый | Маслянистый | ||||
| Кальций | Маслянистый | Маслянистый | Маслянистый | ||||
| Магний | Маслянистый | Маслянистый | Маслянистый | ||||
| Триэтиламин | Маслянистый | Маслянистый | Маслянистый | ||||
| Диэтаноламин | Маслянистый | Маслянистый | Маслянистый | ||||
| Дициклогексиламин | Маслянистый | Маслянистый | Кристаллический твердый | ||||
| Трет-Бутиламин | Маслянистый | Маслянистый | Маслянистый | ||||
| Лизин | Маслянистый | Маслянистый | Маслянистый | ||||
| Аргинин | Маслянистый | Маслянистый | Маслянистый |
Кроме того, исследовали полиморфизм соли соединения 17 и 4-пиперидинметанола. Полиморфизм подтверждали анализом порошковой рентгеновской дифракцией, дифференциальной сканирующей калориметрией и термогравиметрией. Анализ порошковой рентгеновской дифракцией, дифференциальную сканирующую калориметрию и термогравиметрию можно осуществлять, например, в условиях, описанных в нижеследующих примерах.
Как результат масштабного исследования изобретателями настоящего изобретения, было показано, что существует более одного полиморфизма для соединения 18, которое представляет собой соль соединения 17 и 4-пиперидинметанола. Хотя все кристаллы являются стабильными и предпочтительными, кристаллическую форму C (кристаллическая форма, полученная в примере 18(3) в настоящем описании) является предпочтительной среди других.
Соединение настоящего изобретения можно перевести в циклодекстриновый клатрат, используя α-, β- или γ-циклодекстрин или их смесь любыми способами, описанными в описаниях японских патентных заявок № JP-B-S50-3362, JP-B-S52-31404 и JP-B-S61-52146. Превратив в циклодекстриновый клатрат, поскольку повышаются стабильность и растворимость в воде, соединение становится удобным в случае применения в качестве лекарственного средства. Включение соединения настоящего изобретения в циклодекстрин можно определить дифференциальной сканирующей калориметрией или анализом порошковой рентгеновской дифракцией.
Соединение 17 и соединение 18 могут находиться в виде диастереомеров. Таким образом, настоящее изобретение также включает соль диастереомера соединения 17 и 4-пиперидинметанола, соль диастереомерной смеси соединения 17 в произвольном соотношении и 4-пиперидинметанола, диастереомеры соединения 18 и диастереомерную смесь соединения 18 в произвольном соотношении.
Существует семь возможных диастереомеров для соединения 17. Одним примером диастереомеров соединения 17 является следующее соединение, которое может существовать в равновесии с соединением 17:
2-[(2-{(1S,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоновой кислотой (соединением, описанным в примере 20 WO 2010/143661). Диастереомерная смесь соединения 17 обозначает смесь любых двух или более видов, выбранных из соединения 17 и семи его диастереомеров. В настоящем изобретении диастереомерная смесь соединения 17, все диастереомерные смеси, содержащие соединение 17, являются предпочтительными. Однако диастереомерная смесь, содержащая соединение 17 и 2-[(2-{(1S,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоновую кислоту, является более предпочтительной, и смесь соединения 17 и 2-[(2-{(1S,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоновой кислоты является особенно предпочтительной.
Соединение 17, 2-[(2-{(1S,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоновую кислоту, или его смесь иногда представляют нижеследующей формулой (I).
(в формуле
представляет собой α-конфигурацию,
представляет собой β-конфигурацию, и
представляет собой α-конфигурацию, β-конфигурацию или их смесь в произвольном соотношении.)
Существуют семь возможных диастереомеров для соединения 18. Одним примером диастереомеров соединения 18 является пиперидин-4-илметанол 2-[(2-{(1S,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоксилат, который может существовать в равновесии с соединением 18. Диастереомерная смесь соединения 18 обозначает смесь любых двух или более видов, выбранных из соединения 18 и семи его диастереомеров. В настоящем изобретении в качестве диастереомерной смеси соединения 18, все диастереомерные смеси, содержащие соединение 18, являются предпочтительными. Однако диастереомерная смесь, содержащая соединение 18 и пиперидин-4-илметанол 2-[(2-{(1S,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоксилат, является более предпочтительной, и смесь соединения 18 и пиперидин-4-илметанол 2-[(2-{(1S,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоксилата являются особенно предпочтительной.
Соединение 18, пиперидин-4-илметанол 2-[(2-{(1S,5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метил-1,7-октадиен-1-ил]циклопентил}этил)тио]-1,3-тиазол-4-карбоксилат, или его смесь иногда представляют нижеследующей формулой (II).
(В формуле
представляет собой α-конфигурацию,
представляет собой β-конфигурацию, и
представляет собой α-конфигурацию, β-конфигурацию или их смесь в произвольном соотношении.)
Кроме того, соединение, представленное формулой (II), иногда описывают как пиперидин-4-илметанол 2-[(2-{1-ambo-(5R)-2-оксо-5-[(1E,4S)-7,8,8-трифтор-4-гидрокси-4-метилокта-1,7-диен-1-ил]циклопентил}этил)сульфанил]-1,3-тиазол-4-карбоксилат.
В настоящем изобретении, хотя процент диастереомерного избытка соединения 17 или соединения 18 конкретно не ограничен, процент предпочтительно составляет 60-100% диастереомерный избыток, более предпочтительно 60-99,9% диастереомерный избыток и особенно предпочтительно 80-99% диастереомерный избыток
Кроме того, диастереомерная смесь соединения 17 или соединения 18 в произвольном соотношении предпочтительно представляет собой смесь, в которой процент соединения 17 или соединения 18 составляет 80% или более и 99,9% или меньше от всей смеси, и более предпочтительно смесь, в которой процент соединения 17 или соединения 18 составляет 90% или более и 99% или меньше от всей смеси.
Кроме того, смесь, в которой соотношение соединения 17:диастереомер составляет приблизительно 9:1, является предпочтительной. Кроме того, смесь, в которой соотношение соединения 18:диастереомер, составляет приблизительно 9:1, является предпочтительной.
Соль диастереомерной смеси соединения 17 и 4-пиперидинметанола может образовывать кристалл. Более того, соединение 18 может образовывать кристалл с его диастереомерами.
СПОСОБЫ ПОЛУЧЕНИЯ СОЕДИНЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Соединения настоящего изобретения можно получить подходящим образом модифицируя и комбинируя способы, известные в данной области техники, например, способы, описанные в документах международных публикаций No. WO 2010/143661, Synlett 2002, No. 1, 239-242 или Comprehensive Organic Transformations: A Guide to Functional Group Preparations, 2nd Edition (Richard C. Larock, John Wiley & Sons Inc, 1999), нижеследующие способы или способы, показанные в примерах.
Токсичность
Соединение настоящего изобретения вызывает незначительные побочные эффекты и, таким образом, является достаточно безопасным для применения в качестве лекарственного средства.
Применения для лекарственных средств
Поскольку соединение настоящего изобретения воздействуют на гладкие мышцы, в частности детрузор мочевого пузыря и сфинктер уретры, способствуя сокращению детрузора мочевого пузыря и расслаблению сфинктера уретры, оно может облегчать нарушение сокращения мышц мочевого пузыря и нарушение уретрального расслабления и, таким образом, являться эффективным в качестве агента для предотвращения и/или лечения гипоактивного мочевого пузыря. Кроме того, соединение настоящего изобретения является эффективным в качестве агента для облегчения различных симптомов, связанных с гипоактивным мочевым пузырем, например, медленной струи мочи, расщепленной струи мочи, блокировки струи мочи, задержки мочеиспускания, повышенного внутрибрюшинного давления для выделения мочи, ощущения остаточной мочи, недержания мочи вследствие переполнения мочевого пузыря, анурии и/или падения капель мочи после мочеиспускания. Соединение настоящего изобретения являются особенно эффективным в качестве агента для облегчения расщепленной струи мочи, блокировки струи мочи, повышенного внутрибрюшинного давления для выделения мочи, ощущения остаточной мочи, недержания мочи вследствие переполнения мочевого пузыря, анурии и/или падения капель мочи после мочеиспускания.
Соединение настоящего изобретения являются также эффективным для предотвращения и/или лечения стеноза позвоночного канала, шейного спондилеза, заболевания периферической нервной системы, иммунных заболеваний (бокового амиотрофического склероза (БАС), рассеянного склероза, синдрома Шегрена, хронического суставного ревматизма, аутоиммунных заболеваний, таких как системная волчанка, реакция отторжения после трансплантации органов и т.д.), аллергических заболеваний (например, бронхиальной астмы, аллергического воспаления носа, аллергического конъюнктивного воспаления, атопического дерматита, пищевой аллергии и т.д.), некроза нервных клеток, дисменореи, преждевременных родов, выкидыша, облысения, нейронных заболеваний сетчатки, таких как глаукома, эректильной дисфункции, артрита, повреждения легких, пневмосклероза, эмфиземы, бронхита, хронического обструктивного заболевания дыхательных путей, повреждения печени, острого гепатита, цирроза печени, шока, нефрита (например, острого нефрита, хронического нефрита и т.д.), дисфункции почек, панкреатита, синдрома системной воспалительной реакции, сепсиса, гемофагоцитарного синдрома, синдрома активации макрофагов, болезни Стилла, болезни Кавасаки, ожогов, системной гранулематозной болезни, язвенного колита, болезни Крона, гиперцитокинемии на диализе, полиорганной недостаточности, заболеваний костей (перелома костей, повторного перелома, хронического перелома, дисфункции адгезии костей, псевдоартроза, остеомаляции, заболевания костей Педжета, ригидного спондилита, метастазов рака костей, деформирующего артроза, поломки хрящевой кости при подобных их заболеваниях и т.д.).
Соединение настоящего изобретения можно вводить в комбинации с другими лекарственными средствами в виде комбинированного агента для целей 1) поддержания и/или усиления профилактических и/или терапевтических эффектов соединения, 2) улучшения фармакокинетических параметров и поглощения соединения, снижения дозы соединения и/или 3) облегчения побочных эффектов соединения.
Что касается комбинированного агента соединения настоящего изобретения и других лекарственных средств, его можно вводить в комбинации с другими лекарственными средствами в виде смеси, в которой два ингредиента смешаны в одном препарате или в различных препаратах. Введение двух ингредиентов в различных препаратах включает одновременное введение и введение через определенные интервалы времени. При введении через определенные интервалы времени, можно, чтобы соединение настоящего изобретения вводили заранее, и другие лекарственные средства вводили позднее, или можно, чтобы другие лекарственные средства вводили заранее, и соединение настоящего изобретения вводили позднее, где способы введения двух ингредиентов могут быть одинаковыми или отличными друг от друга.
Примеры лекарственных средств, пригодных для поддержания и/или усиления эффектов соединения настоящего изобретения включают ингибиторы ацетилхолинэстеразы (например, дистигмин и неостигмин и т.д.) и антагонисты α1 рецептора (например, тамзулозин, празозин, алфузозин, нафтопидил, урапидил и т.д.).
Отсутствуют конкретные ограничения весового соотношения соединения настоящего изобретения к другим лекарственным средствам.
Другие лекарственные средства могут представлять собой комбинацию лекарственных средств одного вида или двух или более различных видов.
Другие лекарственные средства для поддержания и/или усиления эффектов соединения настоящего изобретения включают не только обнаруженные к настоящему времени лекарственные средства, но и лекарственные средства, которые будут обнаружены, исходя из приведенного выше механизма.
В случае, когда комбинированный агент соединения настоящего изобретения с другими лекарственными средствами применяют для приведенных выше целей, его обычно вводят системно или местно, или перорально или парентерально.
Хотя доза может изменяться в зависимости от типа лекарственного средства и может зависеть от возраста, веса, симптомов, предполагаемых терапевтических эффектов, способов введения, продолжительности лечения и т.д., соединение настоящего изобретения можно обычно вводить перорально при дозе в диапазоне 1 нг - 100 мг за один раз для взрослого один или несколько раз в день, или его можно вводить парентерально при дозе в диапазоне 0,1 нг - 10 мг за один раз для взрослого один или несколько раз в день, или альтернативно его можно вводить непрерывно внутривенно в течение периода времени 1-24 часа в день.
Поскольку доза может изменяться в зависимости от различных условий, как описано выше, есть случай, когда доза является достаточной с меньшим количеством, чем доза, описанная выше, тогда как есть случай, где требуется введение в большем объеме, чем объем, описанный выше.
В случае, когда вводят соединение настоящего изобретения или комбинационный агент соединения настоящего изобретения и другого лекарственного средства, его можно применять в виде твердых препаратов для внутреннего применения или жидких препаратов для внутреннего применения для перорального введения и инъекций, препаратов для внешнего применения, су