Биологические маркеры для идентификации пациентов для лечения антагонистами vegf
Иллюстрации
Показать всеПредложенная группа изобретений относится к области медицины. Предложены способ определения, с какой вероятностью пациент с раком реагирует на лечение антагонистом VEGF, и способ выбора терапии для конкретного пациента с раком в популяции пациентов с раком, для которых предполагают проведение терапии. Способы включают детекцию экспрессии по меньшей мере трех генов, выбранных из группы, состоящей из Alk1, CD34, CD105, CD144, Col4a1, Col4a2, Dll4, EFNB2, EGFL7, ESM1, LAMA4, NG2, Nid2, Notch1, NRP1, NRP2, RGS5, Sema3f, TSP1, VEGFR1, VEGFR2, VEGFR3 и VIM в биологическом образце, получаемом у пациента до какого-либо введения антагониста VEGF пациенту. Предложенная группа изобретений обеспечивает эффективные средства и методы определения, какие пациенты будут отвечать на лечение, и введение эффективных схем лечения для таких пациентов. 2 н. и 34 з.п. ф-лы, 25 ил., 4 табл., 7 пр.
Реферат
Область изобретения
Настоящее изобретение относится к способам идентификации пациентов, которые получают положительный результат от лечения антагонистом VEGF, например, антителом против VEGF.
Уровень техники
Измерение уровней экспрессии биомаркеров (например, секретируемых белков в плазме) может представлять собой эффективное средство для идентификации пациентов и популяций пациентов, которые будут отвечать на конкретные виды терапии, включая, например, лечение антагонистами VEGF, такими как антитела против VEGF.
Существует необходимость в эффективных средствах для определения, какие пациенты будут отвечать на лечение, и в введении таких определений в эффективные схемы лечения для пациентов с терапией антагонистами VEGF, независимо от того, используют их в качестве единственных средств или объединяют с другими средствами.
Сущность изобретения
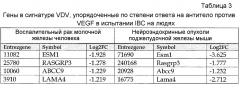
Настоящее изобретение относится к способам идентификации пациентов, которые получат положительный результат от лечения антагонистом VEGF, таким как антитело против VEGF. Таких пациентов идентифицируют на основании уровней экспрессии генов, указанных в таблице 1 или 2.
Таким образом, один из вариантов осуществления изобретения относится к способам определения пациента, который с большой вероятностью реагирует на лечение антагонистом VEGF, где способы включают (a) детекцию экспрессии по меньшей мере одного гена, указанного в таблице 1 или 2, в биологическом образце, получаемом у пациента до какого-либо введения антагониста VEGF пациенту, и (b) сравнения уровня экспрессии по меньшей мере одного гена с эталонным уровнем экспрессии по меньшей мере одного гена, где по изменению уровня экспрессии по меньшей мере одного гена в образце у пациента относительно эталонного уровня определяют пациента, который с большой вероятностью реагирует на лечение антагонистом VEGF.
Дополнительный вариант осуществления изобретения относится к способам оптимизации терапевтической эффективности антагониста VEGF для пациента, где способы включают (a) детекцию экспрессии по меньшей мере одного гена, указанного в таблице 1 или 2, в биологическом образце, получаемом у пациента до какого-либо введения антагониста VEGF пациенту, и (b) сравнение уровня экспрессии по меньшей мере одного гена с эталонным уровнем экспрессии по меньшей мере одного гена, где по изменению уровня экспрессии по меньшей мере одного гена в образце у пациента относительно эталонного уровня определяют пациента, который с большой вероятностью реагирует на лечение антагонистом VEGF.
Со ссылкой на указанные выше варианты осуществления в некоторых дополнительных вариантах осуществления пациент входит в популяцию пациентов, подлежащих тестированию на восприимчивость к антагонисту VEGF, и эталонный уровень представляет собой средний уровень экспрессии по меньшей мере одного гена в популяции пациентов. В некоторых вариантах осуществления изменение уровня экспрессии по меньшей мере одного гена в образце у пациента представляет собой повышение относительно эталонного уровня. В некоторых вариантах осуществления изменение уровня экспрессии по меньшей мере одного гена в образце у пациента представляет собой снижение относительно эталонного уровня. В некоторых вариантах осуществления по меньшей мере один ген в биологическом образце, получаемом у пациента, детектируют посредством измерения мРНК. В некоторых вариантах осуществления экспрессию по меньшей мере одного гена в биологическом образце, получаемом у пациента, детектируют посредством измерения уровней белка в плазме. В некоторых вариантах осуществления биологический образец представляет собой опухолевую ткань. В некоторых вариантах осуществления способы дополнительно включают детекцию экспрессии по меньшей мере второго, третьего, четвертого или более гена, указанного в таблице 1 или 2, в биологическом образце у пациента. В некоторых вариантах осуществления по меньшей мере один ген выбран из группы, состоящей из: Alk1, CD34, CD105, CD144, Col4a1, Col4a2, Dll4, EFNB2, EGFL7, ESM1, LAMA4, NG2, Nid2, Notch1, NRP1, NRP2, RGS5, Sema3f, TSP1, VEGFR1, VEGFR2, VEGFR3 и VIM. В некоторых вариантах осуществления антагонист VEGF представляет собой антитело против VEGF, такое как бевацизумаб. В некоторых вариантах осуществления пациент страдает ангиогенным нарушением. В некоторых вариантах осуществления пациент страдает злокачественной опухолью, выбранной из группы, состоящей из колоректального рака, рака молочной железы, рака легких, глиобластомы и их сочетаний.
Также со ссылкой на указанные выше варианты осуществления способы могут дополнительно включать (c) выбор антагониста VEGF для лечения пациента, когда детектируют изменение уровня экспрессии по меньшей мере одного гена в образце у пациента относительно эталонного уровня. Кроме того, способы могут включать (d) введение антагониста VEGF (например, антитела против VEGF, такого как бевацизумаб) пациенту.
Другой вариант осуществления изобретения относится к способам выбора терапии для конкретного пациента в популяции пациентов, рассматриваемых для проведения терапии, где способы включают: (a) детекцию экспрессии по меньшей мере одного гена, указанного в таблице 1 или 2, в биологическом образце, получаемом у пациента до какого-либо введения антагониста VEGF пациенту, (b) сравнение уровня экспрессии по меньшей мере одного гена с эталонным уровнем экспрессии по меньшей мере одного гена, где по изменению уровня экспрессии по меньшей мере одного гена в образце у пациента относительно эталонного уровня идентифицируют пациента, который с большой вероятностью реагирует на лечение антагонистом VEGF, и (c) выбор антагониста VEGF в качестве терапии, если пациента идентифицировали, как с большой вероятностью реагирующего на лечение антагонистом VEGF, или (d) выбор терапии, которая не представляет собой антагонист VEGF, если пациента не идентифицировали, как с большой вероятностью реагирующего на лечение антагонистом VEGF.
В некоторых вариантах осуществления эталонный уровень представляет собой средний уровень экспрессии по меньшей мере одного гена в популяции пациентов. В некоторых вариантах осуществления изменение уровня экспрессии по меньшей мере одного гена в образце у пациента представляет собой повышение относительно эталонного уровня. В некоторых вариантах осуществления изменение уровня экспрессии по меньшей мере одного гена в образце у пациента представляет собой снижение относительно эталонного уровня. В некоторых вариантах осуществления способы дополнительно включают детекцию экспрессии по меньшей мере второго, третьего, четвертого или более гена, указанного в таблице 1 или 2, в биологическом образце у пациента. В некоторых вариантах осуществления терапия (d) представляет собой средство, выбранное из группы, состоящей из антинеопластического средства, химиотерапевтического средства, ингибирующего рост средства, цитотоксического средства и их сочетаний. В некоторых вариантах осуществления способы дополнительно включают (e) введение эффективного количества антагониста VEGF пациенту, если пациента идентифицируют, как с большой вероятностью реагирующего на лечение антагонистом VEGF. В некоторых вариантах осуществления антагонист VEGF представляет собой антитело против VEGF, такое как бевацизумаб. В некоторых вариантах осуществления способы дополнительно включают введение эффективного количества по меньшей мере второго средства. В некоторых вариантах осуществления второе средство выбрано из группы, состоящей из антинеопластического средства, химиотерапевтического средства, ингибирующего рост средства, цитотоксического средства и их сочетаний.
Дополнительный вариант осуществления изобретения относится к способам идентификации биомаркера для определения восприимчивости к антагонисту VEGF, где способы включают: (a) детекцию экспрессии биомаркера-кандидата в биологическом образце, получаемом у пациента до введения антагониста VEGF пациенту, и (b) сравнение экспрессии биомаркера-кандидата с эталонным уровнем экспрессии биомаркера-кандидата, где по изменению уровня экспрессии биомаркера-кандидата в образце у пациента относительно эталонного уровня идентифицируют биомаркер-кандидат как биомаркер пациента, который с большой вероятностью реагирует на лечение антагонистом VEGF. В некоторых вариантах осуществления эталонный уровень представляет собой средний уровень экспрессии по меньшей мере одного гена в популяции пациентов, тестируемых на вероятность того, что они реагируют на лечение антагонистом VEGF. В некоторых вариантах осуществления эталонный уровень представляет собой уровень экспрессии по меньшей мере одного гена в образце, ранее получаемом у пациента. В некоторых вариантах осуществления пациент ранее получал лечение антагонистом VEGF, и у него в настоящее время развиваются метастазы. В некоторых вариантах осуществления антагонист VEGF представляет собой антитело против VEGF, такое как бевацизумаб. Кроме того, способы могут дополнительно включать (c) выбор биомаркера-кандидата с изменением уровня экспрессии относительно эталона для применения в качестве биомаркера для определения восприимчивости к лечению антагонистом VEGF.
В другом варианте осуществления изобретение относится к способам диагностики ангиогенного нарушения у пациента, где способы включают этапы: (a) детекции уровня экспрессии по меньшей мере одного гена, указанного в таблице 1 или 2, или биомаркера, идентифицированного способами, такими как описанные выше способы, в образце, получаемом у пациента до какого-либо введения антагониста VEGF пациенту, и (b) сравнения уровня экспрессии по меньшей мере одного гена или биомаркера с эталонным уровнем по меньшей мере одного гена, где по изменению уровня экспрессии по меньшей мере одного гена в образце у пациента относительно эталонного уровня идентифицируют пациента, страдающего ангиогенным нарушением. Эти способы могут дополнительно включать (c) выбор антагониста VEGF для лечения пациента, когда в образце у пациента детектируют изменение уровня экспрессии по меньшей мере одного гена относительно эталонного уровня. Кроме того, способы могут дополнительно включать (d) введение антагониста VEGF пациенту. Кроме того, способы, описываемые в настоящем описании, могут дополнительно включать этап получения образца у пациента, как описано в настоящем описании. Кроме того, способы, описываемые в настоящем описании, можно проводить у пациентов, у которых диагностировали злокачественную опухоль, как описано в настоящем описании, для определения оптимальной схемы лечения.
В любом из указанных выше вариантов осуществления изменение уровня экспрессии по меньшей мере одного гена или биомаркера в образце у пациента относительно эталонного уровня можно определять путем вычисления сигнатурной оценки VDV (VDVi) для образца пациента в соответствии с алгоритмом
в котором Zg=1,i, Zg=2,i,… Zg=n,i представляют собой стандартизованные z-оценки значений экспрессии для каждого гена или биомаркера g, от g=1 до g=n, образца i, и в котором VDVi ниже первого определяемого порогового уровня указывает на снижение относительно эталонного уровня, и VDVi выше второго определяемого порогового уровня указывает на повышение относительно эталонного уровня. В некоторых вариантах осуществления значения экспрессии для каждого гена или биомаркера g, от g=1 до g=n, представляют собой значения кПЦР в реальном времени для каждого гена g от g=1 до g=n. В некоторых вариантах осуществления первый определяемый пороговый уровень составляет от -4 до -0,5 (например, -4, -3,5, -3, -2,5, -2, -1,5, -1 или -0,5), и второй определяемый пороговый уровень составляет от 0,5 до 4 (например, 0,5, 1, 1,5, 2, 2,5, 3, 3,5 или 4). В некоторых вариантах осуществления первый определяемый пороговый уровень составляет от -4 до -1 (например, -4, -3,5, -3, -2,5, -2, -1,5 или -1), и второй определяемый пороговый уровень составляет от 1 до 4 (например, 1, 1,5, 2, 2,5, 3, 3,5 или 4). В некоторых вариантах осуществления первый определяемый пороговый уровень составляет от -4 до -1,5 (например, -4, -3,5, -3, -2,5, -2 или -1,5), и второй определяемый пороговый уровень составляет от 1,5 до 4 (например, 1,5, 2, 2,5, 3, 3,5 или 4). В других вариантах осуществления первый определяемый пороговый уровень составляет от -4 до -2 (например, -4, -3,5, -3, -2,5 или -2), и второй определяемый пороговый уровень составляет от 2 до 4 (например, 2, 2,5, 3, 3,5 или 4).
Эти и другие варианты осуществления дополнительно описаны в подробном описании, которое следует ниже.
Краткое описание чертежей
На фиг. 1A представлен гистологический и графический анализ плотности микрососудов (MVD) и определение индекса пролиферации клеток нейроэндокринной опухоли поджелудочной железы (PNET) мышей через 72 часа, 7 суток и 14 суток после обработки mAb против VEGF. Характерные изображения из гистологического анализа плотности сосудов опухоли посредством окрашивания MECA-32 (слева) и индекса пролиферации посредством Ki67 (справа) в различные моменты времени после обработки антителом против VEGF (20X увеличение). Количественное определение из 4-6 опухолей в каждом случае представлено в виде столбчатых диаграмм ниже в виде среднего значения +/- SEM. *P<0,05, NS=незначимое.
Фиг. 1B представляет собой график, демонстрирующий кинетику эффектов антитела против VEGF на опухолевую нагрузку на модели RIP-TβAg. Опухолевая нагрузка у мышей, обрабатываемых антителом против VEGF, (красные столбцы) является значительно ниже, чем у обрабатываемых контролем мышей (черные столбцы) на 21 сутки, но не на 14 сутки исследования. *=p<0,05 (t-критерий), n=5-8 мышей/группа/момент времени.
Фиг. 1C представляет собой график, демонстрирующий изменения уровней экспрессии генов VDV в ответ на лечение антагонистом VEGF. Уровни экспрессии генов (показанный в виде красных линий) значительно снижаются относительно всех генов (серая гистограмма). Пунктирная красная линия означает изменение среднего значения для этих выбранных генов. Черная пунктирная линия означает среднее кратное изменение для оставшихся генов.
Фиг. 1D представляет собой график, демонстрирующий изменения уровней экспрессии генов в подгруппе генов в ответ на лечение антагонистом VEGF, как оценивают кПЦР. Столбцы представляют собой среднюю экспрессию из трех независимых биологических повторений. Величины ошибок=log2 стандартное отклонение.
Фиг. 2A представляет собой набор графиков, демонстрирующих изменения ответа генов VDV на блокаду VEGF на модели опухоли установленной подкожно карциномы молочной железы (MDA-MB-231). Образцы опухоли собирали через 24 часа после обработки антителом против VEGF или контролем. Гены в сигнатуре VDV (красные линии) значительно снижаются относительно всех генов (показанных в виде серой гистограммы) в строме (верхний график, микрочип мыши, p<0,0001), но не в опухолевых клетках (нижний график, микрочип человека, не значимые отличия). Кратные изменения индивидуальных транскриптов proxVDV помечены черными буквами на графике плотности микропанели, n=5-10 образцов для каждой когорты обработки.
Фиг. 2B представляет собой набор графиков, демонстрирующих изменения ответа генов VDV на блокаду VEGF на ортотопической (внутричерепной) модели глиобластомы U87. Образцы опухоли собирали через 13-42 суток после обработки антителом против VEGF или контролем. Гены в сигнатуре VDV (красные линии) значительно снижаются относительно всех генов (показанных в виде серой гистограммы) в строме (верхний график, микрочип мыши, p<0,0105), но не в опухолевых клетках (нижний график, микрочип человека, не значимые отличия). Кратные изменения индивидуальных транскриптов proxVDV помечены черными буквами на графике плотности микропанели, n=5-10 образцов для каждой когорты обработки.
Фиг. 2C представляет собой набор графиков, демонстрирующих подавление, наблюдаемое после местного нанесения антитела против VEGF на рану кожи (верхний график, p=0,0125), и в противоположность активацию, когда рекомбинантный VEGF наносят в течение 12 часов (p<0,0001). Кратные изменения индивидуальных транскриптов proxVDV помечены черными буквами.
Фиг. 2D представляет собой гистологические данные и графики, демонстрирующие, что активация сигнального пути VEGF индуцирует экспрессию генов VDV. В отличие от антитела против VEGF снижение экспрессии сигнатуры генов VDV (правый верхний график, p<0,0001) обработкой антителом против Dll4 вызывает повышение экспрессии большинства генов VDV (правый нижний график, p<0,0001) через 48 часов на модели MDA-MB-231, что согласуется с гиперваскуляризацией, выявляемой иммунофлуоресцентным окрашиванием на CD31/PECAM по сравнению с обработкой контролем (левый). Кратные изменения индивидуальных транскриптов proxVDV помечены черными буквами, n=5-10 образцов для каждой когорты обработки.
Фиг. 3 представляет собой теплокарту, демонстрирующую, что большая часть генов proxVDV очевидно не активируется rVEGF in vitro. Анализы экспрессии генов стимуляции rVEGF HUVEC.
Фиг. 3 представляет собой теплокарту, демонстрирующую, что большая часть генов proxVDV явно не активируется rVEGF in vitro. Анализы экспрессии генов стимуляции rVEGF HUVEC. H (часы) означают продолжительность стимуляции rVEGF. Теплокарта, представленная в настоящем описании, показывает результаты анализа экспрессии на микропанели для выбранных зондов VDV. Темно-синий означает максимальное относительное снижение экспрессии, и темно-красный - максимальную степень повышения экспрессии транскриптов. Гены proxVDV заметно не регулируются rVEGF in vitro. Однако вероятно, что еще не охарактеризованная небольшая группа генов VDV (EHD3, PCHD17 и THBD) в значительной степени активируется стимуляцией rVEGF HUVEC. Данные экспрессии для каждой временной точки предоставлены из трех независимых повторений.
Фиг. 4A представляет собой изображения гибридизации in situ (ISH), демонстрирующие, что ESM1 ген proxVDV представляет собой мишень VEGF in vivo, специфически экспрессируемую в ассоциированной с опухолью сосудистой сети. На верхних изображениях (левое и правое): отрицательные контроли ISH со смысловыми олигонуклеотидами, продемонстрирован незначительный фоновый уровень (неспецифическое окрашивание). На нижних изображениях продемонстрирована экспрессия мРНК ESM1 (посредством ISH с антисмысловыми олигонуклеотидами) на срезах опухоли HM7 от животных, обрабатываемых антителом против VEGF или контролем. Черные стрелки указывают на несколько областей значительной экспрессии мРНК ESM1 сосудов (коричневое окрашивание) в препаратах опухолей, обрабатываемых контролем (нижнее изображение, левый слайд). В противоположность этому, ESM1 является практически не детектируемым в препаратах опухолей животных, обрабатываемых антителом против VEGF (нижнее изображение, справа). Все препараты также контрастно окрашивали гематоксилинэозином (H&E).
Фиг. 4B представляет собой график, демонстрирующий количественное определение окрашивания ESM1 (ISH) в препаратах опухолей животных, обрабатываемых контролем и антителом против VEGF. n=10.
Фиг. 4C представляет собой график, демонстрирующий количественное определение окрашивания MECA32 (PLVAP) в препаратах опухолей животных, обрабатываемых контролем и антителом против VEGF. n=10.
Фиг. 4D представляет собой набор гистологических изображений и соответствующий количественный график, демонстрирующие подтверждение активности in vivo ингибиторов пути VEGF в опухолях MDA-MB-231. Обработка in vivo mAb против VEGF сунитинибом или акситинибом эффективно снижала MVD в опухолях через 72 часа после обработки. Животных, несущих опухоли MDA-MB-231, обрабатывали, как указано в материалах и методах, в течение 72 часов, а затем собирали опухоли для гистологических анализов и анализов экспрессии генов. Верхние изображения: плотность сосудов опухоли посредством окрашивания на MECA-32 (PLVAP) и CD31 (красное). Ядра контрастно окрашивали DAPI (синие). Изображения получали при 20X увеличении. На нижнем графике представлено количественное определение (в виде среднего значения +/- SEM) из 8 опухолей в каждой группе обработки. *P<0,05.
Фиг. 4E представляет собой набор графиков, демонстрирующих, что блокада VEGF или ингибирование последующего сигнального пути VEGFR-2 in vivo индуцирует согласующееся снижение экспрессии генов proxVDV. Анализ кПЦР в реальном времени экспрессии генов в 400 мм3 ксенотрансплантатах опухолей MDA-MB-231, собранных через 8 (нижняя панель), 16 (средняя панель) или 72 часа (верхняя панель) после обработки ингибиторами VEGF и VEGFR-2 (сунитинибом и акситинибом). Значения представляют собой среднее значение log2 кратного изменения относительной экспрессии генов, индуцируемого ингибитором VEGF/VEGFR-2 по сравнению со средней экспрессией генов при обработке контролем. Не относящиеся к сосудам маркеры, такие как E-cadh и CD45, значительно не изменяются в ответ на эти ингибиторы. На нижней панели (через 8 часов после обработки) продемонстрирована обработка только антителом против VEGF, т.к. акситиниб и сунитиниб не обладали выраженной активностью в этот конкретный момент времени. Данные экспрессии генов представляют собой среднее значение 8 биологических повторений от каждой обработки. Величины ошибок представляют собой стандартное отклонение.
Фиг. 5A представляет собой графики, демонстрирующие согласующееся снижение экспрессии proxVDV многими ингибиторами пути VEGF. Анализ экспрессии генов в ксенотрансплантатах опухолей MDA-MB-231, собираемых через 8, 1 или 72 часа после обработки ингибиторами VEGF и VEGFR-2 (сунитинибом и акситинибом). Значения представляют собой среднее значение log2 кратного изменения относительной экспрессии генов, индуцированного ингибиторами VEGF/VEGFR-2, по сравнению с обработкой контролем. Данные экспрессии генов представляют собой log2 среднего значения 8 биологических повторений для каждой обработки. Величины ошибок представляют собой стандартное отклонение.
Фиг. 5B представляет собой график, демонстрирующий количественное определение экспрессии генов proxVDV кПЦР в реальном времени в эндотелиальных клетках, отобранных из ксенотрансплантатов опухолей MDA-MB-231, обрабатываемых mAb против амброзии или против VEGF. Значения представляют собой среднее значение log2 кратного изменения 3 повторений. Величины ошибок представляют собой стандартное отклонение.
Фиг. 6 представляет собой график, демонстрирующий увеличение маркеров VDV в ассоциированных с опухолью эндотелиальных клетках (TAEC) анализами увеличения экспрессии транскриптов VDV ex vivo в только что выделенных FACS TAEC в сравнении с опухолевыми клетками GFP-MDA-MB-231. Относительную экспрессию генов в TAEC в сравнении с опухолевыми клетками измеряли кПЦР в реальном времени выбранных генов. Все тестируемые гены VDV значительно повышались (в 25-200 раз) в TAEC. В отличие от этого экспрессия мРНК Zeb1 (эпителиального маркера) снижалась в TAEC и увеличивалась в опухолевых клетках. Значения представляют собой среднее значение относительного log2 кратного повышения гена при сравнении TAEC с опухолевыми клетками. Клетки TAEC сортировали как CD31-положительные, CD45-отрицательные и GFP-отрицательные клетки. Опухолевые клетки сортировали по положительному показателю в отношении GFP. Данные экспрессии генов представляют собой среднее значение шести опухолей, которые объединяли для каждого эксперимента сортировки FACS. кПЦР в реальном времени проводили в трех повторениях. Величины ошибок представляют собой стандартное отклонение.
Фиг. 7 представляет собой график, демонстрирующий изменение экспрессии генов (после обработки в сравнении с перед обработкой) в образцах биопсии у 19 пациентов с воспалительным раком молочной железы. Гены в сигнатуре VDV (красные линии) значительно снижаются относительно всех генов (серая гистограмма), p=0,0275.
Фиг. 8A представляет собой набор графиков, демонстрирующих выживаемость без прогрессирования заболевания (верхний) и общую выживаемость (нижний) 103 пациентов с колоректальным раком с доступной мРНК перед лечением в испытании NO16966.
Фиг. 8B представляет собой схему обзора эксперимента для количественной оценки экспрессии 22 генов VDV с использованием микрочипа Fluidigm для кПЦР в реальном времени ангиогенеза.
Фиг. 8C представляет собой график, демонстрирующий корреляцию уровней экспрессии 22 генов VDV в образцах рака толстого кишечника.
Фиг. 8D представляет собой набор графиков, демонстрирующих, что сигнатуры из 22 генов VDV стратифицирует эффект лечения бевацизумабом (bev) для пациентов с колоректальным раком на поздней стадии. Представлена выживаемость без прогрессирования заболевания (верхний) или общая выживаемость (нижний) пациентов с "VDV-высоким" (сплошные линии) в сравнении с пациентами с "VDV-низким" (пунктирные линии), которые получали лечение XELOX (черные) или XELOX+бевацизумаб (Mullen et al., Cell, 147(3):565-576, 2011). PFS (верхний) эффект выборки генов VDV, стартифицированный по уровням экспрессии (взаимосвязь p=0,036), и OS (нижний) эффект выборки генов VDV, стартифицированный по уровням экспрессии (взаимосвязь p=0,37).
Фиг. 9A представляет собой набор графиков, подтверждающих соответствие между полной сигнатурой VDV "VDV" (ось x) и репрезентативной подгруппой из 22 генов "VDV-22" (ось у), используемой для запроса архивного клинического материала. Набор распространенных образцов представлен с архивными образцами у пациентов, которые подходят для условий исследования терапии первой линии метастазов (сравнимых с NO16966). Архивные образцы оценивали в отношении экспрессии полногеномной РНК на микропанелях на основе гранул Illumina DASL; NSCLC=немелкоклеточная карцинома легких, BR=молочная железа, CRC=колоректальная карцинома.
Фиг. 9B представляет собой набор графиков, демонстрирующих стратификацию пациентов NO16966 по уровням экспрессии VEGF-A, PFS (верхний), взаимосвязь p=0,76 и OS (нижний), взаимосвязь p=0,33.
Фиг. 9C представляет собой набор графиков, демонстрирующих стратификацию пациентов NO16966 по уровням экспрессии CD31, PFS (верхний) взаимосвязь p=0,15 и OS (нижний), взаимосвязь p=0,99.
Подробное описание предпочтительных вариантов осуществления
1. Введение
Настоящее изобретение относится к способам и композициям для мониторинга за и/или идентификации пациентов, чувствительных или восприимчивых к лечению антагонистами VEGF, например, антителом против VEGF. Изобретение основано на открытии, что определение уровней экспрессии по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18,19, 20, 21, 22, 23 или более генов, указанных в таблице 1 или 2, перед лечением антагонистом VEGF (таким как антитело против VEGF) является пригодным для идентификации пациентов, чувствительных или восприимчивых к лечению антагонистом VEGF, например, антителом против VEGF. Необязательно для пациентов затем можно выбирать терапию антагонистом VEGF и, кроме того, у пациентов необязательно можно проводить терапию антагонистом VEGF.
II. Определения
Термины "биомаркер" и "маркер" в настоящем описании используют взаимозаменяемо для обозначения молекулярного маркера на основе ДНК, РНК, белка, углевода или гликолипида, экспрессию или наличие которого в образце у индивидуума или пациента можно детектировать стандартными способами (или способами, описываемыми в настоящем описании), и экспрессия или наличие которого является пригодным для мониторинга восприимчивости или чувствительности являющегося млекопитающим индивидуума к антагонисту VEGF. Такие биомаркеры включают, но не ограничиваются ими, гены, указанные в таблицах 1 и 2. Можно определять, что экспрессия такого биомаркера является выше или ниже в образце, получаемом у пациента, чувствительного или восприимчивого к антагонисту VEGF, по сравнению с эталонным уровнем (включая, например, средний уровень экспрессии биомаркера в образцах от группы/популяции пациентов, тестируемых на восприимчивость к антагонисту VEGF; уровнем в образце, ранее получаемом у индивидуума в предшествующие моменты времени, или уровнем в образце у пациента, который получал ранее лечение антагонистом VEGF (таким как антитело против VEGF) в случае первичной опухоли, и у которого в настоящее время могут развиваться метастазы). Индивидуумов с уровнем экспрессии, который является больше или меньше эталонного уровня экспрессии по меньшей мере одного гена, такого как гены, указанные в таблицах 1 и 2, можно идентифицировать как индивидуумов/пациентов, с большой вероятностью реагирующих на лечение антагонистом VEGF. Например, таких индивидуумов/пациентов, у которых выявляют уровни экспрессии генов не более 50%, 45%, 40%, 35%, 30%, 25%, 20%, 15%, 10% или 5% относительно (т.е. выше или ниже) эталонного уровня (такого как средний уровень, указанный выше), можно идентифицировать как индивидуумов/пациентов, с большой вероятностью реагирующих на лечение антагонистом VEGF, таким как антитело против VEGF.
Термины "образец" и "биологические образец" используют взаимозаменяемо для обозначения любого биологического образца, получаемого у индивидуума, включая жидкости организма, ткани организма (например, опухолевую ткань), клетки или другие источники. Жидкости организма представляют собой, например, лимфу, сыворотку, свежую цельную кровь, мононуклеарные клетки периферической крови, замороженную цельную кровь, плазму (включая свежую или замороженную), мочу, слюну, семенную жидкость, синовиальную жидкость и цереброспинальную жидкость. Образцы также включают ткань молочной железы, почечную ткань, ткань толстой кишки, ткань головного мозга, ткань слизистой оболочки, синовиальную ткань, кожу, волосяной фолликул, костный мозг и опухолевую ткань. Способы получения биопсий ткани и жидкостей организма у млекопитающих хорошо известны в данной области.
"Эффективный ответ" пациента или "восприимчивость" или "чувствительность" пациента к лечению антагонистом VEGF относится к клиническому или терапевтическому положительному воздействию, сообщаемому пациенту, подвергающемуся риску или страдающему ангиогенным нарушением, благодаря или в результате лечения антагонистом VEGF, таким как антитело против VEGF. Такое положительное воздействие включает клеточные или биологические ответы, полный ответ, a частичный ответ, стабильное заболевание (без прогрессирования или рецидива) или ответ с поздним рецидивом у пациента благодаря или в результате лечения антагонистом. Например, эффективный ответ может представлять собой уменьшение размера опухоли или выживаемость без прогрессирования у пациента, у которого диагностировали экспрессию одного или более биомаркеров, указанных в таблице 1 или 2, в сравнении с пациентом без экспрессии одного или более биомаркеров. По экспрессии генетического биомаркера(ов) эффективно прогнозируют или прогнозируют с высокой чувствительностью такой эффективный ответ.
"Антагонисты", как используют в настоящем описании, относятся к соединениям или средствам, которые ингибируют или снижают биологическую активность молекулы, с которой они связываются. Антагонисты включают антитела, синтетические пептиды или пептиды с нативной последовательностью, иммуноадгезины и низкомолекулярные антагонисты, которые связываются с VEGF, необязательно конъюгированные или слитые с другой молекулой. "Блокирующее" антитело или антитело-"антагонист" представляет собой антитело, которое ингибирует или снижает биологическую активность антигена, с которым оно связывается.
"Антитело-агонист", как используют в настоящем описании, представляет собой антитело, которое частично или полностью имитирует по меньшей мере один вид функциональной активности представляющего интерес полипептида.
Термин "антитело" в настоящем описании используют в самом широком смысле, и в частности он включает моноклональные антитела, поликлональные антитела, полиспецифические антитела (например, биспецифические антитела), образованные по меньшей мере из двух интактных антител, и фрагменты антител при условии, что они проявляют желательную биологическую активность.
"Выделенное" антитело представляет собой антитело, которое идентифицировали и отделили и/или извлекли из компонента его природного окружения. Загрязняющие компоненты его природного окружения представляют собой вещества, которые препятствуют исследовательскому, диагностическому или терапевтическому применению антитела, и могут включать ферменты, гормоны и другие белки или небелковые растворенные вещества. В некоторых вариантах осуществления антитело очищают (1) до более 95% по массе антитела, как определяют, например, способом Лоури, и в некоторых вариантах осуществления до более 99% по массе; (2) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием, например, секвенатора с вращающимся стаканом, или (3) до гомогенности посредством SDS-PAGE в восстановительных или невосстановительных условиях с использованием, например, окрашивания кумасси синим или серебром. Выделенное антитело включает антитело in situ в рекомбинантных клетках, вследствие того, что по меньшей мере один компонент природного окружения антитела не содержится. Однако, как правило, выделенное антитело получают посредством по меньшей мере одного этапа очистки.
"Нативные антитела", как правило, представляют собой гетеротетрамерные гликопротеины приблизительно 150000 Дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, при этом число дисульфидных связей изменяется в тяжелых цепях различных изотипов иммуноглобулина. Каждая тяжелая и легкая цепь также содержит расположенные с равными интервалами внутрицепочечные дисульфидные мостики. Каждая тяжелая цепь содержит на одном конце вариабельный домен (VH), за которым следует ряд константных доменов. Каждая легкая цепь содержит вариабельный домен на одном конце (VL) и константный домен на своем другом конце; константный домен легкой цепи выровнен с первым константным доменом тяжелой цепи, и вариабельный домен легкой цепи выровнен с вариабельным доменом тяжелой цепи. Предполагают, что конкретные аминокислотные остатки образуют поверхность раздела между вариабельными доменами легких цепей и тяжелых цепей.
"Вариабельная область" или "вариабельный домен" антитела относится к аминоконцевым доменам тяжелой или легкой цепи антитела. Вариабельный домен тяжелой цепи можно обозначать как "VH". Вариабельный домен легкой цепи можно обозначать как "VL". Эти домены, как правило, являются наиболее вариабельными частями антитела и содержит антигенсвязывающие участки.
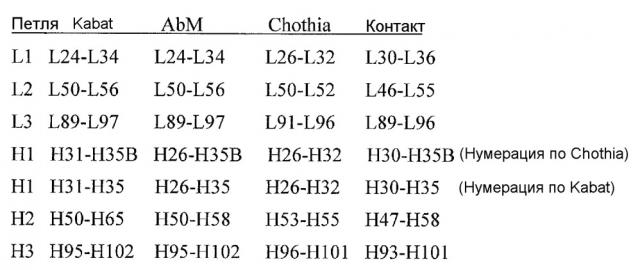
Термин "вариабельный" относится к тому факту, что последовательности определенных участков вариабельных доменов в антителах значительно различаются и используются в связывании и специфичности каждого конкретного антитела по отношению к его конкретному антигену. Однако вариабельность не распределена равномерно на всем протяжении вариабельных доменов антител. Она сконцентрирована в трех сегментах, называемых гипервариабельными областями (HVR), в вариабельных доменах легкой цепи и тяжелой цепи. Наиболее высококонсервативные участки вариабельных доменов называются каркасными областями (FR). Каждый из вариабельных доменов нативных тяжелых и легких цепей содержат четыре области FR, преимущественно принимающие конфигурацию бета-слоя, соединенные тремя FIVR, которые, образуют петли, соединяющие структуры бета-слоя и в некоторых случаях образующие ее часть. HVR в каждой цепи удерживаются вместе в непосредственной близости за счет областей FR и совместно с HVR из другой цепи способствуют образованию антигенсвязывающего участка антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, National Institute of Health, Bethesda, MD (1991)). Константные домены непосредственно не участвуют в связывании антитела с антигеном, но обладают различными эффекторными функциями, такими как участие антитела в антителозависимой клеточной токсичности.
"Легкие цепи" антител (иммуноглобулинов) у любого вида позвоночных можно отнести к одному из двух четко различающихся типов, называемых каппа (κ) и лямбда (λ) на основании аминокислотных последовательностей их константных доменов.
В зависимости от аминокислотных последовательностей константных доменов их тяжелых цепей антитела (иммуноглобулины) можно относить к различным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них можно дополнительно разделять на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобул