Комбинированные продукты, содержащие ингибиторы тирозинкиназ, и их применение
Иллюстрации
Показать всеГруппа изобретений относится к лечению пролиферативных заболеваний. Предложены: фармацевтическая комбинация для лечения злокачественной опухоли лёгких, содержащая (i) ингибитор тирозинкиназы МЕТ 2-фтор-N-метил-4-[(7-хинолин-6-илметил)имидазо[1,2-b]триазин-2-ил]бензамид или его фармацевтически приемлемую соль и (ii) ингибитор тирозинкиназы EGFR гефитиниб, и, по меньшей мере, один фармацевтически приемлемый носитель; её применение для лечения злокачественной опухоли лёгких, способ лечения злокачественной опухоли лёгких данной фармацевтической комбинацией (варианты) и применение ингибитора EGFR гефитиниба и ингибитора МЕТ 2-фтор-N-метил-4-[(7-хинолин-6-илметил)имидазо[1,2-b]триазин-2-ил]бензамида или его фармацевтически приемлемой соли, для приготовления фармацевтической комбинации для лечения злокачественной опухоли лёгких. Технический результат состоит в синергизме действия против злокачественной опухоли лёгких заявленной комбинации. 5 н.п. ф-лы, 5 ил., 3 табл., 5 пр.
Реферат
Краткое описание сущности изобретения
Настоящее изобретение относится к фармацевтическим комбинациям, например, продуктам, содержащим комбинацию (i) ингибитора MET и (ii) ингибитора EGFR (ErbB-1), или их фармацевтически приемлемую соль, соответственно, или их пролекарство, которые совместно эффективны при лечении пролиферативных заболеваний, к соответствующим фармацевтическим препаратам, применениям, способам, процессам, коммерческим упаковкам и связанным с этим вариантам осуществления изобретения.
Предпосылки создания изобретения
Лекарственные средства, которые были разработаны для действия в отношении отдельных молекулярных мишеней, часто не подходят для борьбы с заболеваниями, характеризующимися более чем одной мишенью в качестве причины возникновения (многофакторные заболевания), такими как злокачественная опухоль или другие пролиферативные заболевания.
С целью борьбы с такими заболеваниями, один подход заключается в применении единых направленных на множество мишеней лекарственных средств - однако в данном случае требуется, чтобы все мишени, являющиеся причиной проявления заболевания, поражались рассматриваемым лекарственным средством. С другой стороны, направленные на множество мишеней лекарственные средства могут приводить к нежелательным побочным эффектам, поскольку они могут также оказывать воздействие на мишени, не вовлеченные в проявление заболевания.
Другой подход заключается в использовании комбинации лекарственных средств в качестве направленных на множество мишеней лекарственных средств. В лучшем случае, это может приводить к сочетанной эффективности, например, синергизму, даже позволяя тем самым снизить побочные эффекты, вызываемые используемыми по отдельности лекарственными средствами.
Иногда компоненты (участники комбинации) таких лекарственных средств могут воздействовать на отдельные мишени с получением комбинированного эффекта, а потому могут вызывать комбинированный эффект, выходящий за пределы достижимого при использовании отдельных соединений и/или при рассмотрении их отдельных эффектов, соответственно, либо одним и тем же путем или отдельными путями, в отдельной клетке или в отдельных клетках в отдельных тканях. В качестве альтернативы, один компонент может изменять способность другого компонента достигать его мишень, например, путем ингибировании эффлюксных насосов, и т.п. В качестве еще одной альтернативы, участники комбинации могут связываться с разными участками одной и той же мишени. Данные варианты возможности взаимосвязи мишеней препятствуют поиску подходящих комбинаций, чрезвычайно увеличивая возможные типы взаимодействий, которые могли бы или не могли бы быть применимы для комбинации.
Однако при использовании таких лекарственных средств во множестве случаев невозможно обнаружить желаемое совместное действие или даже синергизм. Поскольку число попарных (r=2) комбинаций лекарственных средств увеличивается согласно формуле n!/(r!(n-r)!) с количеством подвергаемых тестированию агентов n (например, тестирование 2000 агентов уже бы привело к появлению 1999000 уникальных попарных комбинаций), необходим подходящий способ скрининга, позволяющий добиваться высокой эффективности.
Кроме того, перед рассмотрением какой-либо комбинации существует принципиальное требование определить пути, ферменты, метаболические состояния, и т.п., которые вовлечены в качестве причины в проявление заболевания или способствуют ему.
Во многих случаях, даже совершенно не известно, что данное заболевание является многофакторным.
Поэтому, поиск подходящих комбинаций и количеств, как можно, в сущности, описать, соответствует нахождению иголки в стоге сена.
Протоонкоген cMET (MET) кодирует белок рецептор фактора роста гепатоцитов (HGFR), который обладает тирозинкиназной активностью и необходим для эмбрионального развития и заживления ран. При стимуляции фактором роста гепатоцитов (HGF) MET индуцирует несколько биологических реакций, приводящих к инвазивному росту. Аномальная активация MET запускает рост опухоли, образование новых кровеносных сосудов (ангиогенез) и метастазирование при различных типах злокачественных заболеваний, включая злокачественные опухоли почек, печени, желудка, молочной железы и головного мозга. Известно большое количество ингибиторов киназы MET и, в качестве альтернативы, ингибиторов индуцируемой HGF активации MET (= HGFR). Биологические функции c-MET (или пути передачи сигнала c-MET) в нормальных тканях и при злокачественных заболеваниях человека, таких как злокачественная опухоль, были хорошо описаны (Christensen, J.G. et al., Cancer Lett. 2005, 225(1):1-26; Corso, S. et al., Trends in Mol. Med. 2005, 11(6):284-292).
Путь c-Met (c-MET) с нарушенной регуляцией играет важные и иногда причинные (в случае генетических изменений) роли при образовании, росте, поддержании жизнеспособности и прогрессировании опухоли (Birchmeier, C. et al., Nat. Rev. Mol. Cell. Biol. 2003, 4(12):915-925; Boccaccio, C. et al., Nat. Rev. Cancer 2006, 6(8):637-645; Christensen, J.G. et al., Cancer Lett. 2005, 225(1):1-26). HGF и/или c-Met повышенно экспрессируются в значительной части большинства злокачественных опухолей человека и часто ассоциированы с неблагоприятными клиническими исходами, такими как более агрессивное течение заболевания, прогрессирование заболевания, метастазирование опухоли и сокращенная продолжительность жизни пациента. Кроме того, пациенты с высокими уровнями белков HGF/c-Met более устойчивы к химиотерапии и радиационной терапии. В дополнение к аномальной экспрессии HGF/c-Met, рецептор c-Met может быть также активирован у пациентов со злокачественными опухолями посредством генетических мутаций (как генеративных, так и соматических) и амплификации гена. Хотя амплификация гена и мутации представляют собой наиболее распространенные генетические изменения, о которых сообщалось у пациентов, рецептор может быть также активирован делециями, укорочениями, перестройкой гена.
Различные злокачественные опухоли, в развитие которых вовлечен c-MET, включают в качестве неограничивающих примеров: карциномы (например, мочевого пузыря, молочной железы, шейки матки, холангиокарциному, толстой и прямой кишки, пищевода, желудка, головы и шеи, почек, печени, легких, носоглотки, яичников, поджелудочной железы, предстательной железы, щитовидной железы); костно-мышечные саркомы (например, остеосаркому, синовиальную саркому, рабдомиосаркому); саркомы мягких тканей (например, MFH/фибросаркому, лейомиосаркому, саркому Капоши); злокачественные заболевания кроветворной системы (например, множественную миелому, лимфомы, T-клеточный лейкоз взрослых, острый миелогенный лейкоз, хронический миелолейкоз); и другие неоплазии (например, глиобластомы, астроцитомы, меланому, мезотелиому и опухоль Вильма (www.vai.org/met/; Christensen, J.G. et al., Cancer Lett. 2005, 225(1):1-26).
Представление о том, что активированный путь c-MET является одной из причин образования и прогрессирования опухоли и мог бы быть хорошей мишенью для эффективной терапии злокачественной опухоли, было дополнительно подкреплено многочисленными доклиническими исследованиями (Birchmeier, C. et al., Nat. Rev. Mol. Cell Biol. 2003, 4(12):915-925; Christensen, J.G. et al., Cancer Lett. 2005, 225(1):1-26; Corso, S. et al., Trends in Mol. Med. 2005, 11(6): 284-292). Например, исследования показали, что гибридный ген tpr-met, повышенная экспрессия c-met и мутации, активирующие c-met (совокупно обозначаемые в настоящем документе как MET) вместе вызывают онкогенную трансформацию различных модельных клеточных линий и приводят к образованию и метастазированию опухоли у мышей. Что гораздо более важно, при использовании средств, которые специфически нарушают и/или блокирую передачу сигнала HGF/c-MET, были продемонстрированы значительные противоопухолевые (иногда регрессия опухоли) и антиметастазирующие эффекты in vitro и in vivo. Такие средства включают в себя анти-HGF-антитела и анти-c-Met-антитела, пептидные антагонисты HGF, рецептор-ловушка c-Met, пептидные антагонисты c-Met, доминантно-негативные мутации c-Met, специфические к c-Met антисмысловые олигонуклеотиды и рибозимы и селективные низкомолекулярные ингибиторы киназы c-Met (Christensen, J.G. et al., Cancer Lett. 2005, 225(1):1-26).
В дополнение к установленной роли при злокачественной опухоли, аномальная передача сигнала HGF/MET также вовлечена в атеросклероз, легочный фиброз, почечный фиброз и регенерацию, заболевания печени, аллергические нарушения, воспалительные и аутоиммунные нарушения, цереброваскулярные заболевания, сердечно-сосудистые заболевания, условия, ассоциированные с трансплантацией органов (Ma, H. et al., Atherosclerosis. 2002, 164(1):79-87; Crestani, B. et al., Lab. Invest. 2002, 82(8):1015-1022; Sequra-Flores, A.A. et al., Rev. Gastroenterol. Mex. 2004, 69(4)243-250; Morishita, R. et al., Curr. Gene Ther. 2004, 4(2)199-206; Morishita, R. et al., Endocr. J. 2002, 49(3)273-284; Liu, Y., Curr. Opin. Nephrol. Hypertens. 2002, 11(1):23-30; Matsumoto, K. et al., Kidney Int. 2001, 59(6):2023-2038; Balkovetz, D.F. et al., Int. Rev. Cytol. 1999, 186:225-250; Miyazawa, T. et al., J. Cereb. Blood Flow Metab. 1998, 18(4)345-348; Koch, A.E. et al., Arthritis Rheum. 1996, 39(9):1566-1575; Futamatsu, H. et al., Circ. Res. 2005, 96(8)823-830; Eguchi, S. et al., Clin. Transplant. 1999, 13(6)536-544).
Рецептор эпидермального фактора роста (EGFR, также известный как ErbB-1; HER1 у людей) представляет собой рецептор для лигандов семейства эпидермального фактора роста. Как известно, от повышенной активности или повышенной экспрессии EGFR, зависят несколько типов злокачественных опухолей, таких как злокачественная опухоль легких, злокачественная опухоль анального канала, мультиформная глиобластома и многие другие, в основном, эпителиальные злокачественные опухоли.
Злокачественная опухоль часто зависит от генетического изменения рецепторных тирозинкиназ (RTK), например, посредством точечной мутации, амплификация гена или хромосомной транслокации, которая приводит к неконтролируемой активности данных RTK, которые тем самым становятся онкогенными. Клеточная пролиферация злокачественных клеток зависит от активности таких аберрантных RTK.
При лечении возникающих пролиферативных заболеваний часто применяют ингибиторы онкогенной RTK, вовлеченной в патологический процесс. Однако часто, через определенное время лечения наблюдается устойчивость к используемому лекарственному средству. Один механизм устойчивости может вовлекать в процесс RTK-мишень, снижая связывание или активность терапевтического средства. Другой механизм представляет собой компенсаторную активацию альтернативной киназы, которая остается двигателем роста злокачественной опухоли, ингибируя основную киназу. Хорошо охарактеризованным примером, охватывающим оба типа механизмов, является приобретенная устойчивость рецептора эпидермального фактора роста (EGFR) к гефитинибу и эрлотинибу при немелкоклеточном раке (NSCLC) с активирующими EGFR мутациями (см. Lynch, T. J., et al., N Engl J Med, 350: 2129-2139, 2004; или Paez, J. G., et al., Science, 304: 1497-1500, 2004). Например, активация MET может компенсировать потерю активности EGFR (при ингибировании) посредством активации сигнальных молекул, расположенных ниже в пути передачи сигнала, таких как HER3, так, амплификация MET компенсировать может, или его лиганд - фактор роста гепатоцитов - может активировать MET (см. Engelman, J. A., et al., Science, 316: 1039-1043, 2007; Yano, S., et al., Cancer Res, 68: 9479-9487, 2008; и Turke, A. B., et al., Cancer Cell, 17: 77-88, 2010). Также хорошо известно, что зависимые от MET линии злокачественных клеток (пролиферация которых зависит от активности MET) могут избегать воздействия ингибиторов MET при индуцированной лигандом активации EGFR (см. Bachleitner-Hofmann, T., et al.,. Mol Cancer Ther, 7: 3499-3508, 2008).
Общее описание изобретения
Используя злокачественные клетки, изначально зависимые от MET и/или EGFR (то есть, от их активности), наблюдали обходной путь преодоления зависимости через опосредованную лигандом активацию альтернативных рецепторных тирозинкиназ (RTK). Механизмы обходного пути были обнаружены при обработке зависимых от MET или EGFR линий соответствующим селективным ингибитором (то есть, ингибитором MET зависимых от MET линий и ингибитором EGFR зависимых от EGFR линии) с одновременным добавлением надосадочных жидкостей от клеток, трансфицированных кДНК, кодирующей различные секретируемые белки. Может быть показано, что RTK MET и EGFR могут компенсировать отсутствие друг друга, приводя тем самым к «спасению» пролиферирующих клеток в случае, если лишь одна из данных RTK ингибируется соответствующим лекарственным средством.
К удивлению было обнаружено, что сочетанное ингибирование указанных RTK может приводить к синергической противоопухолевой активности, в особенности в том случае, когда обе RTK MET и EGFR активны и могут быть впоследствии заингибированы согласно настоящему изобретению одновременно или совместно последовательно.
Конкретное описание настоящего изобретения
Согласно первому варианту осуществления, настоящее изобретение относится к фармацевтической комбинации (например, комбинированному продукту), содержащей (i) ингибитор MET и (ii) ингибитор EGFR, или их фармацевтически приемлемую соль, соответственно, или их пролекарство, соответственно, и, по меньшей мере, один фармацевтически приемлемый носитель.
Согласно дополнительному варианту осуществления, в настоящем изобретении представлена комбинация (например, комбинированный продукт), содержащая количество, которое совместно терапевтически эффективно в отношении заболевания, опосредованного тирозинкиназной активностью EGFR и/или тирозинкиназной активностью MET, в особенности, злокачественной опухоли, содержащая в качестве участников комбинации (i) ингибитор тирозинкиназы EGFR и (ii) ингибитор тирозинкиназы MET, или, соответственно, их фармацевтически приемлемую соль, и, по меньшей мере, одно фармацевтически приемлемое вещество-носитель.
Дополнительный вариант осуществления относится к применению комбинации согласно настоящему изобретению (например, комбинированного продукта) для лечения заболевания, опосредованного тирозинкиназной активностью EGFR и/или тирозинкиназной активностью MET, в особенности, злокачественной опухоли.
Дополнительный вариант осуществления относится к применению комбинации (i) ингибитора тирозинкиназы EGFR и (ii) ингибитора тирозинкиназы MET, или, соответственно, их фармацевтически приемлемой соли, для промышленного производства лекарственного препарата или фармацевтического продукта для лечения заболевания, опосредованного тирозинкиназной активностью EGFR и/или тирозинкиназной активностью MET, в особенности, злокачественной опухоли.
Дополнительный вариант осуществления относится к способу лечения заболевания, опосредованного тирозинкиназной активностью EGFR и/или тирозинкиназной активностью MET, в особенности, злокачественной опухоли, комбинацией (i) ингибитора тирозинкиназы EGFR и (ii) ингибитора тирозинкиназы MET, или, соответственно, их фармацевтически приемлемой соли.
Дополнительный вариант осуществления относится к способу лечения заболевания, опосредованного тирозинкиназной активностью EGFR и/или тирозинкиназной активностью MET, в особенности, злокачественной опухоли, причем указанный способ включает в себя введение эффективного количества комбинации или комбинированного продукта, содержащего (i) ингибитор тирозинкиназы EGFR и (ii) ингибитор тирозинкиназы MET, нуждающемуся в этом субъекту, такому как теплокровное животное, в частности, человеку.
Еще один дополнительный вариант осуществления настоящего изобретения относится к фармацевтическому продукту или коммерческой упаковке, содержащей комбинированный продукт согласно настоящему изобретению, описанный в настоящем документе, в частности, вместе с инструкциями по его одновременному, раздельному или последовательному применению (в особенности, для являющихся совместно активными) при лечении заболевания, опосредованного тирозинкиназной активностью EGFR и/или тирозинкиназной активностью MET, в особенности, злокачественной опухоли, в частности, по применению при лечении заболевания, опосредованного тирозинкиназной активностью EGFR и/или тирозинкиназной активностью MET, в особенности, злокачественной опухоли.
Дополнительный вариант осуществления настоящего изобретения относится к применению (i) ингибитора тирозинкиназы EGFR и (ii) ингибитора тирозинкиназы MET, или, соответственно, их фармацевтически приемлемой соли, для получения комбинации (например, комбинированного продукта) согласно настоящему изобретению.
Последующие определения отражают более конкретные варианты осуществления общих характерных черт и выражений, которые могут быть использованы для замены одного, более чем одного или всех общих характерных черт и выражений в вариантах осуществления настоящего изобретения, описанных выше и ниже в настоящем документе, приводя тем самым к более конкретным вариантам осуществления настоящего изобретения.
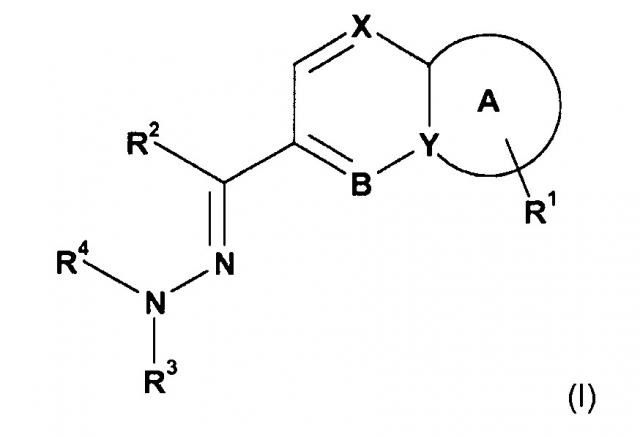
Среди ингибиторов тирозинкиназы MET, применимых согласно настоящему изобретению, конкретным вариантом осуществления являются ингибиторы, раскрытые в WO 2011/018454 (включены в настоящий документ посредством ссылки, в частности, применительно к классам соединений и соединениям, раскрытым в настоящем изобретении), в особенности, ингибиторы формулы (I):
,
где
Y представляет собой C или N;
X представляет собой CН или N;
B представляет собой CН или N;
A представляет собой кольцо;
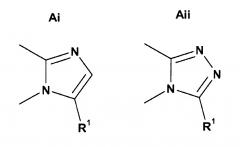
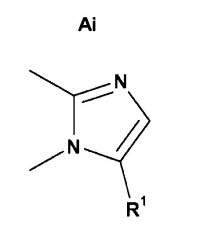
в результате чего если X представляет собой CH, и B представляет собой N, то кольцо A представляет собой кольцо Ai или кольцо Aii;
,
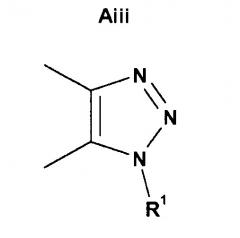
если X представляет собой N, и B представляет собой N, то кольцо A представляет собой Aiii;
и если X представляет собой N, и B представляет собой N, или X представляет собой N, и B представляет собой CH, то кольцо A представляет собой Ai;
,
R1 представляет собой группу, выбранную из i, ii и iii:
,
где R5 представляет собой гетероарил;
R6 представляет собой водород, дейтерий, OH, метил или галоген;
R7 представляет собой водород, дейтерий, галоген или (C1-C3)алкил, где упомянутый (C1-C3)алкил необязательно замещен одним или несколькими заместителями, независимо выбранными из OH и галогена;
или R6 и R7 образуют вместе с атомом углерода, к которому они присоединены, циклопропил, где упомянутый циклопропил необязательно замещен метилом;
n равно 0, 1 или 2;
R2 представляет собой водород, NH2 или (C1-C4)алкил, где упомянутый (C1-C4)алкил необязательно замещен одним или несколькими заместителями, независимо выбранными из OH, NH2 и галогена;
R3 представляет собой водород, -CONH2, -CONH(C1-C4)алкил, -CONHфенил, где фенил в упомянутом CONHфениле необязательно замещен одним или несколькими галогенами, -(C1-C4)алкилами, -CO(C1-C4)алкилами, -CO2(C1-C4)алкилами, фенилами, гетероарилами, -COгетероарилами, -CSNH2, -CSNH(C1-C4)алкилами, -CSNHбензилами, -SO2(C1-C4)алкилами или -COCH2гетероциклилами, где упомянутый гетероциклил необязательно замещен (C1-C3)алкилом;
R4 представляет собой водород или (C1-C3)алкил;
или R3 и R4 образуют вместе с атомом азота, к которому они присоединены, 5- или 6-членную насыщенную или частично ненасыщенную моноциклическую группу, содержащую 1 кольцевой атом N, к которому присоединены R3 и R4, и необязательно 1 дополнительный кольцевой гетероатом, независимо выбранный из N, O и S, где упомянутая моноциклическая группа замещена одним или двумя =O заместителями;
или их фармацевтически приемлемая соль.
Особенно предпочтительным из группы соединений формулы I, которые представляют собой ингибиторы тирозинкиназы MET, является соединение с названием (E)-2-(1-(3-((7-фторхинолин-6-ил)метил)имидазо[1,2-b]пиридазин-6-ил)этилиден)гидразинкарбоксамид (также называемое далее соединением A), характеризующееся следующей формулой:
(см. WO 11/018454, пример 1).
Среди ингибиторов тирозинкиназы MET, применимых согласно настоящему изобретению, в качестве конкретного варианта осуществления также следует упомянуть ингибиторы, которые раскрыты вместе со способами их получения в WO 2008/064157 (включены в настоящий документ посредством ссылки, в частности, применительно к раскрытым соединениям и классам соединений), в особенности соединения, характеризующиеся формулой III:
или их фармацевтически приемлемые соли или пролекарства, где:
A представляет собой N или CR3;
Cy1 представляет собой арил, гетероарил, циклоалкил или гетероциклоалкил, каждый из которых необязательно замещен 1, 2, 3, 4 или 5 -W-X-Y-Z;
Cy2 представляет собой арил, гетероарил, циклоалкил или гетероциклоалкил, каждый из которых необязательно замещен 1, 2, 3, 4 или 5 -W'-X'-Y'-Z';
L1 представляет собой (CR4R5)m, (CR4R5)p-(циклоалкилен)-(CR4R5)q, (CR4R5)p-(арилен)-(CR4R5)q, (CR4R5)p-(гетероциклоалкилен)-(CR4R5)q, (CR4R5)p-(гетероарилен)-(CR4R5)q, (CR4R5)pO(CR4R5)q, (CR4R5)pS(CR4R5)q, (CR4R5)pC(O)(CR4R5)q, (CR4R5)pC(O)NR6(CR4R5)q, (CR4R5)pC(O)O(CR4R5)q, (CR4R5)pOC(O)(CR4R5)q, (CR4R5)pOC(O)NR6(CR4R5)q, (CR4R5)pNR6(CR4R5)q, (CR4R5)pNR6C(O)NR6(CR4R5)q, (CR4R5)pS(O)(CR4R5)q, (CR4R5)pS(O)NR6(CR4R5)q, (CR4R5)pS(O)2(CR4R5)q или (CR4R5)pS(O)2NR6(CR4R5)q, где упомянутый циклоалкилен, арилен, гетероциклоалкилен или гетероарилен необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из Cy3, галогена, C1-6алкила, C2-6алкенила, C2-6алкинила, C1-6галогеналкила, галогенсульфанила, CN, NO2, N3, ORa, SRa, C(O)Rb, C(O)NRcRd, C(O)ORa, OC(O)Rb, OC(O)NRcRd, NRcRd, NRcC(O)Rb, NRcC(O)NRcRd, NRcC(O)ORa, C(=NRg)NRcRd, NRcC(=NRg)NRcRd, P(Rf)2, P(ORe)2, P(O)ReRf, P(O)OReORf, S(O)Rb, S(O)NRcRd, S(O)2Rb, NRcS(O)2Rb и S(O)2NRcRd;
L2 представляет собой (CR7R8)r, (CR7R8)s-(циклоалкилен)-(CR7R8)t, (CR7R8)s-(арилен)-(CR7R8)t, (CR7R8)s-(гетероциклоалкилен)-(CR7R8)t, (CR7R8)s-(гетероарилен)-(CR7R8)t, (CR7R8)sO(CR7R8)t, (CR7R8)sS(CR7R8)t, (CR7R8)sC(O)(CR7R8)t, (CR7R8)sC(O)NR9(CR7R8)t, (CR7R8)sC(O)O(CR7R8)t, (CR7R8)sOC(O)(CR7R8)t, (CR7R8)sOC(O)NR9(CR7R8)t, (CR7R8)sNR9(CR7R8)t, (CR7R8)sNR9C(O)NR9(CR7R8)t, (CR7R8)sS(O)(CR7R8)t, (CR7R8)sS(O)NR7(CR8R9)t, (CR7R8)sS(O)2(CR7R8)t или (CR7R8)sS(O)2NR9(CR7R8)t, где упомянутый циклоалкилен, арилен, гетероциклоалкилен или гетероарилен необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из Cy4, галогена, C1-6алкила, C2-6алкенила, C2-6алкинила, C1-6галогеналкила, галогенсульфанила, CN, NO2, N3, ORa1, SRa1, C(O)Rb1, C(O)NRc1Rd1, C(O)ORa1, OC(O)Rb1, OC(O)NRc1Rd1, NRc1Rd1, NRc1C(O)Rb1, NRc1C(O)NRc1Rd1, NRc1C(O)ORa1, C(=NRg)NRc1Rd1, NRc1C(=NRg)NRc1Rd1, P(Rf1)2, P(ORe1)2, P(O)Re1Rf1, P(O)ORe1ORf1, S(O)Rb1, S(O)NRc1Rd1, S(O)2Rb1, NRc1S(O)2Rb1 и S(O)2NRc1Rd1;
R1 представляет собой H или -W''-X''-Y''-Z'';
R2 представляет собой H, галоген, C1-6алкил, C2-6алкенил, C2-6алкинил, C1-6галогеналкил, CN, NO2, ORA, SRA, C(O)RB, C(O)NRCRD, C(O)ORA, OC(O)RB, OC(O)NRCRD, NRCRD, NRCC(O)RB, NRCC(O)NRCRD, NRCC(O)ORA, S(O)RB, S(O)NRCRD, S(O)2RB, NRCS(O)2RB или S(O)2NRCRD;
R3 представляет собой H, циклоалкил, арил, гетероциклоалкил, гетероарил, галоген, C1-6алкил, C2-6алкенил, C2-6алкинил, C1-6галогеналкил, CN, NO2, ORA, SRA, C(O)RB, C(O)NRCRD, C(O)ORA, OC(O)RB, OC(O)NRCRD, NRCRD, NRCC(O)RB, NRCC(O)NRCRD, NRCC(O)ORA, S(O)RB, S(O)NRCRD, S(O)2RB, NRCS(O)2RB и S(O)2NRCRD; где упомянутый циклоалкил, арил, гетероциклоалкил, гетероарил или C1-6алкил необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из Cy5, галогена, C1-6алкила, C2-6алкенила, C2-6алкинила, C1-6галогеналкила, галогенсульфанила, CN, NO2, N3, ORa1, SRa1, C(O)Rb1, C(O)NRc1Rd1, C(O)ORa1, OC(O)Rb1, OC(O)NRc1Rd1, NRc1Rd1, NRc1C(O)Rb1, NRc1C(O)NRc1Rd1, NRc1C(O)ORa1, C(=NRg)NRc1Rd1, NRc1C(=NRg)NRc1Rd1, P(Rf1)2, P(ORe1)2, P(O)Re1Rf1, P(O)ORe1ORf1, S(O)Rb1, S(O)NRc1Rd1, S(O)2Rb1, NRc1S(O)2Rb1 и S(O)2NRc1Rd1;
или R2 и -L2-Cy2 соединены вместе с образованием группы формулы:
,
где кольцо B представляет собой конденсированное арильное или конденсированное гетероарильное кольцо, каждое из которых необязательно замещено 1, 2 или 3 -W'-X'-Y'-Z';
R4 и R5 независимо выбирают из H, галогена, OH, C1-6алкила, C2-6алкенила, C2-6алкинила, C1-6алкокси, алкоксиалкила, цианоалкила, гетероциклоалкила, циклоалкила, C1-6галогеналкила, CN и NO2;
или R4 и R5 образуют вместе с атомом C, к которому они присоединены, 3-, 4-, 5-, 6- или 7-членное циклоалкильное или гетероциклоалкильное кольцо, каждое из которых необязательно замещено 1, 2 или 3 заместителями, независимо выбранными из галогена, OH, C1-6алкила, C2-6алкенила, C2-6алкинила, C1-6алкокси, алкоксиалкила, цианоалкила, гетероциклоалкила, циклоалкила, C1-6галогеналкила, CN и NO2;
R6 представляет собой H, C1-6алкил, C2-6алкенил или C2-6алкинил;
R7 и R8 независимо выбирают из H, галогена, OH, C1-6алкила, C2-6алкенила, C2-6алкинила, C1-6алкокси, C1-6галогеналкила, CN и NO2;
или R7 и R8 образуют вместе с атомом C, к которому они присоединены, 3-, 4-, 5-, 6- или 7-членное циклоалкильное или гетероциклоалкильное кольцо, каждое из которых необязательно замещено 1, 2 или 3 заместителями, независимо выбранными из галогена, OH, C1-6алкила, C2-6алкенила, C2-6алкинила, C1-6алкокси, C1-6галогеналкила, CN и NO2;
R9 представляет собой H, C1-6алкил, C2-6алкенил или C2-6алкинил;
W, W' и W'' независимо отсутствуют или независимо выбирают из C1-6алкилена, C2-6алкенилена, C2-6алкинилена, O, S, NRh, CO, COO, CONRh, SO, SO2, SONRh и NRhCONRi, где каждый из C1-6алкилена, C2-6алкенилена и C2-6алкинилена необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из галогена, C1-6алкила, C1-6галогеналкила, OH, C1-6алкокси, C1-6галогеналкокси, амино, C1-6алкиламино и C2-8диалкиламино;
X, X' и X'' независимо отсутствуют или независимо выбирают из C1-6алкилена, C2-6алкенилена, C2-6алкинилена, арилена, циклоалкилена, гетероарилена и гетероциклоалкилена, где каждый из C1-6алкилена, C2-6алкенилена, C2-6алкинилена, арилена, циклоалкилена, гетероарилена и гетероциклоалкилена необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из галогена, CN, NO2, OH, C1-6алкила, C1-6галогеналкила, C2-8алкоксиалкила, C1-6алкокси, C1-6галогеналкокси, C2-8алкоксиалкокси, циклоалкила, гетероциклоалкила, C(O)ORj, C(O)NRhRi, амино, C1-6алкиламино и C2-8диалкиламино;
Y, Y' и Y'' независимо отсутствуют или независимо выбирают из C1-6алкилена, C2-6алкенилена, C2-6алкинилена, O, S, NRh, CO, COO, CONRh, SO, SO2, SONRh и NRhCONRi, где каждый из C1-6алкилена, C2-6алкенилена и C2-6алкинилена необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из галогена, C1-6алкила, C1-6галогеналкила, OH, C1-6алкокси, C1-6галогеналкокси, амино, C1-6алкиламино и C2-8диалкиламино;
Z, Z' и Z'' независимо выбирают из H, галогена, C1-6алкила, C2-6алкенила, C2-6алкинила, C1-6галогеналкила, галогенсульфанила, CN, NO2, N3, ORa2, SRa2, C(O)Rb2, C(O)NRc2Rd2, C(O)ORa2, OC(O)Rb2, OC(O)NRc2Rd2, NRc2Rd2, NRc2C(O)Rb2, NRc2C(O)NRc2Rd2, NRc2C(O)ORa2, C(=NRg)NRc2Rd2, NRc2C(=NRg)NRc2Rd2, P(Rf2)2, P(ORe2)2, P(O)Re2Rf2, P(O)ORe2ORf2, S(O)Rb2, S(O)NRc2Rd2, S(O)2Rb2, NRc2S(O)2Rb2, S(O)2NRc2Rd2, арила, циклоалкила, гетероарила и гетероциклоалкила, где упомянутый C1-6алкил, C2-6алкенил, C2-6алкинил, арил, циклоалкил, гетероарил и гетероциклоалкил необязательно замещен 1, 2, 3, 4 или 5 заместителями, независимо выбранными из галогена, C1-6алкила, C2-6алкенила, C2-6алкинила, C1-6галогеналкила, галогенсульфанила, CN, NO2, N3, ORa2, SRa2, C(O)Rb2, C(O)NRc2Rd2, C(O)ORa2, OC(O)Rb2, OC(O)NRc2Rd2, NRc2Rd2, NRc2C(O)Rb2, NRc2C(O)NRc2Rd2, NRc2C(O)ORa2, C(=NRg)NRc2Rd2, NRc2C(=NRg)NRc2Rd2, P(Rf2)2, P(ORe2)2, P(O)Re2Rf2, P(O)ORe2ORf2, S(O)Rb2, S(O)NRc2Rd2, S(O)2Rb2, NRc2S(O)2Rb2 и S(O)2NRc2Rd2;
где два прилежащих -W-X-Y-Z необязательно образуют вместе с атомами, к которым они присоединены, конденсированное 4-20-членное циклоалкильное кольцо или конденсированное 4-20-членное гетероциклоалкильное кольцо, каждое из которых необязательно замещено 1, 2 или 3 заместителями, независимо выбранными из галогена, C1-6алкила, C2-6алкенила, C2-6алкинила, C1-6галогеналкила, галогенсульфанила, CN, NO2, ORa3, SRa3, C(O)Rb3, C(O)NRc3Rd3, C(O)ORa3, OC(O)Rb3, OC(O)NRc3Rd3, NRc3Rd3, NRc3C(O)Rb3, NRc3C(O)NRc3Rd3, NRc3C(O)ORa3, C(=NRg)NRc3Rd3, NRc3C(=NRg)NRc3Rd3, S(O)Rb3, S(O)NRc3Rd3, S(O)2Rb3, NRc3S(O)2Rb3, S(O)2NRc3Rd3, арила, циклоалкила, гетероарила и гетероциклоалкила;
где два прилежащих -W'-X'-Y'-Z' необязательно образуют вместе с атомами, к которым они присоединены, конденсированное 4-20-членное циклоалкильное кольцо или конденсированное 4-20-членное гетероциклоалкильное кольцо, каждое из которых необязательно замещено 1, 2 или 3 заместителями, независимо выбранными из галогена, C1-6алкила, C2-6алкенила, C2-6алкинила, C1-6галогеналкила, галогенсульфанила, CN, NO2, ORa3, SRa3, C(O)Rb3, C(O)NRc3Rd3, C(O)ORa3, OC(O)Rb3, OC(O)NRc3Rd3, NRc3Rd3, NRc3C(O)Rb3, NRc3C(O)NRc3Rd3, NRc3C(O)ORa3, C(=NRg)NRc3Rd3, NRc3C(=NRg)NRc3Rd3, S(O)Rb3, S(O)NRc3Rd3, S(O)2Rb3, NRc3S(O)2Rb3, S(O)2NRc3Rd3, арила, циклоалкила, гетероарила и гетероциклоалкила;
Cy3, Cy4 и Cy5 независимо выбирают из арила, циклоалкила, гетероарила и гетероциклоалкила, каждый из которых необязательно замещен 1, 2, 3, 4 или 5 заместителями, независимо выбранными из галогена, C1-6алкила, C2-6алкенила, C2-6алкинила, C1-6галогеналкила, галогенсульфанила, CN, NO2, N3, ORa4, SRa4, C(O)Rb4, C(O)NRc4Rd4, C(O)ORa4, OC(O)Rb4, OC(O)NRc4Rd4, NRc4Rd4, NRc4C(O)Rb4, NRc4C(O)NRc4Rd4, NRc4C(O)ORa4, C(=NRg)NRc4Rd4, NRc4C(=NRg)NRc4Rd4, P(Rf4)2, P(OR4)2, P(O)Re4Rf4, P(O)ORe4ORf4, S(O)Rb4, S(O)NRc4Rd4, S(O)2Rb4, NRc4S(O)2Rb4 и S(O)2NRc4Rd4;
RA представляет собой H, C1-4алкил, C2-4алкенил, C2-4алкинил, циклоалкил, гетероциклоалкил, арил или гетероарил, где упомянутый C1-4алкил, C2-4алкенил, C2-4алкинил, циклоалкил, гетероциклоалкил, арил или гетероарил необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из OH, CN, амино, галогена и C1-4алкила;
RB представляет собой H, C1-4алкил, C2-4алкенил, C2-4алкинил, циклоалкил, гетероциклоалкил, арил или гетероарил, где упомянутый C1-4алкил, C2-4алкенил или C2-4алкинил, циклоалкил, гетероциклоалкил, арил или гетероарил необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из OH, CN, амино, галогена и C1-4алкила;
RC и RD независимо выбирают из H, C1-4алкила, C2-4алкенила или C2-4алкинила, где упомянутый C1-4алкил, C2-4алкенил или C2-4алкинил необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из OH, CN, амино, галогена и C1-4алкила;
или RC и RD образуют вместе с атомом N, к которому они присоединены, 4-, 5-, 6- или 7-членную гетероциклоалкильную группу или гетероарильную группу, каждая из которых необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из OH, CN, амино, галогена и C1-4алкила;
Ra, Ra1, Ra2, Ra3 и Ra4 независимо выбирают из H, C1-6алкила, C1-6галогеналкила, C2-6алкенила, C2-6алкинила, арила, циклоалкила, гетероарила, гетероциклоалкила, арилалкила, гетероарилалкила, циклоалкилалкила и гетероциклоалкилалкила, где упомянутый C1-6алкил, C1-6галогеналкил, C2-6алкенил, C2-6алкинил, арил, циклоалкил, гетероарил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкилалкил необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из OH, CN, амино, галогена, C1-6алкила, C1-6алкокси, C1-6галогеналкила и C1-6галогеналкокси;
Rb, Rb1, Rb2, Rb3 и Rb4 независимо выбирают из H, C1-6алкила, C1-6галогеналкила, C2-6алкенила, C2-6алкинила, арила, циклоалкила, гетероарила, гетероциклоалкила, арилалкила, гетероарилалкила, циклоалкилалкила и гетероциклоалкилалкила, где упомянутый C1-6алкил, C1-6галогеналкил, C2-6алкенил, C2-6алкинил, арил, циклоалкил, гетероарил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкилалкил необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из OH, CN, амино, галогена, C1-6алкила, C1-6алкокси, C1-6галогеналкила и C1-6галогеналкокси;
Rc и Rd независимо выбирают из H, C1-10алкила, C1-6галогеналкила, C2-6алкенила, C2-6алкинила, арила, гетероарила, циклоалкила, гетероциклоалкила, арилалкила, гетероарилалкила, циклоалкилалкила или гетероциклоалкилалкила, где упомянутый C1-10алкил, C1-6галогеналкил, C2-6алкенил, C2-6алкинил, арил, гетероарил, циклоалкил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкилалкил необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из OH, CN, амино, галогена, C1-6алкила, C1-6алкокси, C1-6галогеналкила и C1-6галогеналкокси;
или Rc и Rd образуют вместе с атомом N, к которому они присоединены, 4-, 5-, 6- или 7-членную гетероциклоалкильную группу или гетероарильную группу, каждая из которых необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из OH, CN, амино, галогена, C1-6алкила, C1-6алкокси, C1-6галогенал