Новые соединения, обладающие тройной активностью, тромболизисной, антитромботической и захвата радикалов, и их синтез, наноструктуры и применение
Иллюстрации
Показать всеИзобретение относится к соединению формулы I, где АА выбирается из группы, состоящей из L-Ala, L-Val, L-Trp, L-Tyr, L-Pro, L-Phe, Gly, L-Ser, L-Ile, L-Thr, L-Lys, L-Leu, L-Gln, L-Asn, L-Asp и L-Glu, одновременно обладающему тройной активностью в виде тромболизиса, антитромбоза и захвата свободных радикалов, а также к способу получения, композиции. Соединения предназначены для лечения инсульта или церебрального инфаркта. 4 н. и 3 з.п. ф-лы, 9 ил., 13 табл., 68 пр.
Реферат
УРОВЕНЬ ТЕХНИКИ
Область Техники
Настоящее изобретение относится к новому соединению одновременно обладающему тромболитической активностью, способностью захвата свободных радикалов и тромб-таргетной/антитромботической функциями, а также к способу его получения и применению. Настоящее изобретение дополнительно относится к новому бинарному конъюгату, образованному путем связывания тромболитического олигопептида и тетрагидроизохинолинового соединения, имеющего две C1-4 алкильные группы, через линкер. Настоящее изобретение также относится к фармацевтической композиции, содержащей соединение, способу получения и наноструктуре соединения.
Описание Предшествующего Уровня Техники
Частота заболеваемостью тромботическими заболеваниями, такими как инсульт/инфаркт, занимает первое место среди различных заболеваний. Существует тенденция к увеличению частоты заболеваемости этими заболеваниями в последние годы, и эти заболевания становятся серьезной угрозой для здоровья человека. Медикаментозное лечение тромботических заболеваний находится в центре повышенного внимания при лечении тромбоза. В настоящее время существует множество ограничений на клинически применяемые тромботические препараты, и поиск безопасного и эффективного нового тромботического препарата является одним из ведущих научно-исследовательских направлений.
Согласно настоящему исследованию в дополнение к антиагрегантной и антитромботической активностям 3 S-1,1-диметил-6,7-дигидрокси-1,2,3,4-тетрагидроизохинолин-3-карбоновая кислота также обладает активностью в отношении захвата свободных радикалов. Кроме того, в Китайской Патентной Публикации CN 101497651 B, поданной 30 января 2008, раскрыты 10 тетрагидроизохинолиновых соединений, обладающих тромболитической активностью. Эти тетрагидроизохинолиновые соединения включают 3S-6,7-1,2,3,4-тетрагидро-6,7-дигидрокси-изохинолин-3-ацил-Pro-Ala-Lys, 3S-6,7-1,2,3,4-тетрагидро-6,7-дигидроксиизохинолин-3-ацил-Arg-Pro-Ala-Lys, 3S-6,7-1,2,3,4-тетрагидро-6,7-дигидроксиизохинолин-3-ацил-Ala-Arg-Pro-Ala-Lys, 3S-6,7-1,2,3,4-тетрагидро-6,7-дигидроксиизохинолин-3-ацил-Gly-Arg-Pro-Ala-Lys, 3S-6,7-1,2,3,4-тетрагидро-6,7-дигидроксиизохинолин-3-ацил-Gln-Arg-Pro-Ala-Lys, 3S-2-[Pro-Ala-Lys]-1,2,3,4-тетрагидро-6,7-дигидроксиизохинолин-3-карбоновую кислоту, 3S-2-[Arg-Pro-Ala-Lys]-1,2,3,4-тетрагидро-6,7-дигидроксиизохинолин-3-карбоновую кислоту, 3S-2-[Ala-Arg-Pro-Ala-Lys]-1,2,3,4-тетрагидро-6,7-дигидроксиизохинолин-3-карбоновую кислоту, 3S-2-[Gly-Arg-Pro-Ala-Lys]-1,2,3,4-тетрагидро-6,7-дигидроксиизохинолин-3-карбоновую кислоту и 3S-2-[Gln-Arg-Pro-Ala-Lys]-1,2,3,4-тетрагидро-6,7-дигидроксиизохинолин-3-карбоновую кислоту. Соединения, указанные выше, сокращенно называют “6,7-дигидроксиизохинолинами, обладающими тромболитической активностью”. Тем не менее, эффективные дозы этих 6,7-дигидроксиизохинолинов, имеющих тромболитическую активность, выше, и антитромботическая активность и активность в отношении захвата свободных радикалов не были раскрыты или подтверждены. Более того, эффективность в лечении инсульта была продемонстрирована только как эффективность в момент начала инсульта. Что касается лечения инсульта через 30 минут после начала синдрома, то эффективность не была раскрыта или подтверждена.
Таким образом, для эффективного и безопасного лечения тромботических заболеваний в клинической практике существует потребность в новом соединении, которое одновременно обладает тромболитической, антитромботической активностью и активностью в отношении захвата свободных радикалов, может эффективно пересекать гематоэнцефалический барьер (ГЭБ) и может обеспечивать достижение описанных эффектов при низкой дозе.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В первом аспекте настоящее изобретение относится к соединению, имеющему формулу I:
где T представляет собой линкер, имеющий по меньшей мере две группы для связывания, Q представляет собой пептид, имеющий тромболитическую активность, R1 и R2 представляют собой C1-4 алкильные группы, где R1 и R2 могут быть одинаковыми или различными.
В одном варианте выполнения настоящего изобретения по меньшей мере одна из групп для связывания линкера Т представляет собой аминогруппу, а остальные группы для связывания представляют собой карбоксильную группу или аминогруппу.
В предпочтительном варианте выполнения настоящего изобретения линкер Т может быть природной аминокислотой, такой как L-Lys, L-Asp или L-Glu.
В более предпочтительном варианте выполнения настоящего изобретения линкер может быть L-Lys.
В предпочтительном варианте выполнения настоящего изобретения пептид, обладающий тромботической активностью, используемый в настоящем изобретении, выбирается из группы, состоящей из олигопептида, имеющего последовательность РА (Pro-Ala), последовательность РАК (Pro-Ala-Lys), последовательность AKP (Ala-Lys-Pro) или последовательность KAP (Lys-Ala-Pro), или пептида, содержащего повторяющиеся звенья последовательности PAK, последовательности AKP или последовательности КАР.
В одном варианте выполнения настоящего изобретения олигопептид, обладающий тромболитической активностью, может быть от трипептида до октапептида, содержащих последовательность PA (Pro-Ala), последовательность PAK, последовательность AKP или последовательность KAP, предпочтительно трипептидом, содержащим последовательность РА. В более предпочтительном варианте выполнения изобретения трипептид имеет химическую формулу Q1 или Q2, показанную ниже:
где АА выбирается из группы, состоящей из L-Ala, L-Val, L-Trp, L-Tyr, L-Pro, L-Phe, Gly, L-Ser, L-Ile, L-Thr, L-Lys, L-Leu, L-Gln, L-Asn, L-Asp и L-Glu.
В предпочтительном варианте выполнения изобретения R1 и R2 оба представляют собой метальную группу.
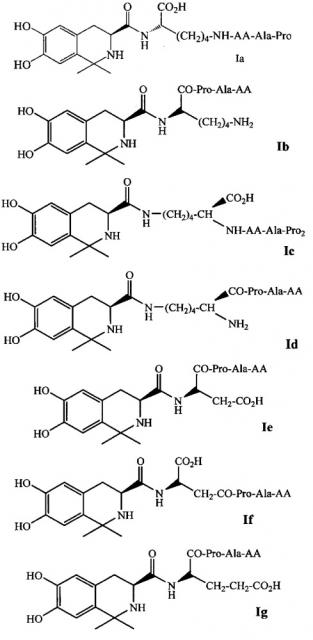
В предпочтительном варианте выполнения изобретения R1 и R2 в формуле I представляют собой метальные группы, линкер представляет собой L-Lys, L-Asp или L-Glu и пептид, обладающий тромболитической активностью, представляет собой трипептид, содержащий последовательность PA (Pro-Ala). Например, соединение может иметь формулу Ia (такую как соединение 5Аа-р на Фиг. 1), Ib (такую как соединение 5 Ва-p р на Фиг. 2), 1с (такую как соединение 5Са-р на Фиг. 3), Id (такую как соединение 5Da-p на Фиг. 4), 1е (такую как соединение 5Еа-р на Фиг. 5), If (такую как соединение 5Fa-p на рис. 6), Ig (такую как соединение 5Ga-p на Фиг. 7) или Ih (такую как соединение 5На-р на Фиг. 8):
где AA выбирается из группы, состоящей из L-Ala, L-Val, L-Trp, L-Tyr, L-Pro, L-Phe, Gly, L-Ser, L-Ile, L-Thr, L-Lys, L-Leu, L-Gln, L-Asn, L-Asp и L-Glu.
Во втором аспекте настоящее изобретение относится к фармацевтической композиции, содержащей соединение по настоящему изобретению, описанное выше, и фармацевтически приемлемый носитель.
В предпочтительном варианте выполнения настоящего изобретения соединения могут быть в форме наносферической структуры.
В предпочтительном варианте выполнения настоящего изобретения фармацевтическая композиция может быть использована в качестве тромболитического препарата, препарата для захвата свободных радикалов NO или тромб-таргетного/антитромботического препарата.
В другом предпочтительном варианте выполнения настоящего изобретения фармацевтическая композиция может быть использована в качестве препарата для лечения инсульта или церебрального инфаркта, более предпочтительно для лечения инсульта или церебрального инфаркта через 4 часа, 6 часов и 24 часа после начала синдрома, и лечения с помощью последующего введения.
В третьем аспекте настоящее изобретение относится к способу получения соединений, имеющих формулу I. Способ включает в себя следующие стадии:
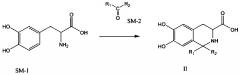
(1) предоставление соединения, имеющего формулу II:
где R1 и R2 представляют собой С1-4 алкильные группы, и R1 и R2 могут быть одинаковыми или разными.
(2) предоставление линкера Т, имеющего по меньшей мере две группы для связывания, и пептида Q, обладающего тромболитической активностью, где линкер имеет первую группу для связывания и вторую группу для связывания.
(3) связывание карбоксильной группы соединения, имеющего формулу II, с первой группой для связывания линкера Т с образованием соединения, имеющего формулу IM-1:
при соответствующих условиях реакции; и
(4) связывание пептида Q, обладающего тромболитической активностью, с соединением, имеющим формулу IM-1, при соответствующих условиях реакции, где один конец пептида Q, обладающего тромболитической активностью, связывается со второй группой для связывания линкера Т с образованием соединения, имеющего формулу I.
В одном варианте выполнения настоящего изобретения первая группа для связывания линкера Т представляет собой аминогруппу, используемую для связывания с карбоксильной группой соединения формулы II по реакции конденсации. Кроме того, вторая группа для связывания является карбоксильной группой или аминогруппой, используемой для связывания с N-концом или С-концом пептида Q, обладающего тромболитической активностью. Определения линкера Т и пептида Q, обладающего тромболитической активностью, используемые в способе получения по настоящему изобретению, являются такими же, как определения соединения, имеющего формулу I выше.
В предпочтительном варианте выполнения настоящего изобретения линкер в настоящем способе получения может быть L-Lys, L-Asp или L-Glu и более предпочтительно L-Lys. Пептид, обладающий тромболитической активностью, может быть трипептидом, содержащим последовательность PA (Pro-Ala), олигопептидом, содержащим последовательность PAK (Pro-Ala-Lys), последовательность AKP (Ala-Lys-Pro) или последовательность КАР (Lys-Ala-Pro), или пептидом, имеющим повторяющуюся последовательность, содержащую последовательность PAK, последовательность AKP или последовательность KAP, и более предпочтительно трипептидом, имеющим формулу Q1 или Q2, показанные ниже:
где АА выбирается из группы, состоящей из L-Ala, L-Val, L-Trp, L-Tyr, L-Pro, L-Phe, Gly, L-Ser, L-Ile, L-Thr, L-Lys, L-Leu, L-Gln, L-Asn, L-Asp и L-Glu.
В другом варианте выполнения настоящего изобретения R1 и R2 соединения, имеющего формулу II, оба представляют собой метальные группы, линкер представляет собой L-Lys, L-Asp или L-Glu и пептид, обладающий тромболитической активностью, представляет собой трипептид, содержащий последовательность PA (Pro-Ala). В более предпочтительном варианте выполнения настоящего изобретения способ получения настоящего изобретения может использоваться для получения соединений, имеющих приведенные выше формулы Ia-h.
Испытания in vivo на крысах показали, что соединения или фармацевтические композиции по настоящему изобретению имеют превосходные тромболитические и антитромботические активности при низкой дозе, и могут эффективно защитить неврологические функции крыс с инсультом, таким образом могут, эффективно и безопасно лечить тромботические заболевания в клинической практике.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 представляет собой схему синтеза соединения Ia согласно одному из вариантов выполнения настоящего изобретения;
Фиг. 2 представляет собой схему синтеза соединения Ib согласно одному из вариантов выполнения настоящего изобретения;
Фиг. 3 представляет собой схему синтеза соединения Ic согласно одному из вариантов выполнения настоящего изобретения;
Фиг. 4 представляет собой схему синтеза соединения Id согласно одному из вариантов выполнения настоящего изобретения;
Фиг. 5 представляет собой схему синтеза соединения Ie согласно одному из вариантов выполнения настоящего изобретения;
Фиг. 6 представляет собой схему синтеза соединения If согласно одному из вариантов выполнения настоящего изобретения;
Фиг. 7 представляет собой схему синтеза соединения Ig согласно одному из вариантов выполнения настоящего изобретения;
Фиг. 8 представляет собой схему синтеза соединения Ih согласно одному из вариантов выполнения настоящего изобретения; и
Фиг. 9 показывает ТЕМ-снимки наноструктур соединений 5Аа-р согласно одному из вариантов выполнения настоящего изобретения.
ПОДРОБНОЕ ОПИСАНИЕ
Подробное описание, приведенное ниже вместе с прилагаемыми чертежами и вариантами выполнения изобретения, используется для иллюстрации технического решения по настоящему изобретению. Тем не менее, объем настоящего изобретения следует рассматривать как включающий их, но не ограничивающийся ими.
В настоящем изобретении тетрагидроизохинолиновые соединения, имеющие две С1-4 алкильные группы (т.е., соединения формулы II), и пептид, обладающий тромболитической активностью, связаны через линкер с образованием нового бинарного конъюгата, одновременно обладающего тройными функциями тромболитической активности, активностью в захвате свободных радикалов и тромб-таргетинга/антитромботической активностью. Конъюгат, указанный выше, ниже сокращенно называют “новым бинарным конъюгатом по настоящему изобретению”.
Поскольку две С1-4 алкильные группы были введены в положение 1 и линкер был введен в положение 3 соединения, имеющего формулу II, “новый бинарный конъюгат по настоящему изобретению” имеет следующие четыре преимущества по сравнению с “6,7-дигидроксиизохинолином, обладающим тромболитической активностью”. 1) Эффект пространственного затруднения двух С1-4 алкильных групп, введенных в положение 1 соединения, имеющего формулу II, может блокировать приближение карбоксипептидазы и аминопептидазы, таким образом тромболитический олигопептид “нового бинарного конъюгата по настоящему изобретению” не будет легко гидролизоваться; 2) гидрофобный вклад двух С1-4 алкильных групп, введенных в положении 1 соединения, имеющего формулу II, может позволить “новому бинарному конъюгату по настоящему изобретению” пересекать гематоэнцефалический барьер с большей эффективностью; 3) эффект донорства электронов двух С1-4 алкильных групп, введенных в положение 1 соединения, имеющего формулу II, может обеспечить восстанавливающую способность “новому бинарному конъюгату по настоящему изобретению” для удовлетворения потребности в захвате свободных радикалов; 4) линкер, введенный в положение 3 соединения, имеющего формулу II, может позволить “новому бинарному конъюгату по настоящему изобретению” эффективно агрегироваться с образованием наносферических структур, имеющих диаметр 20-210 нм, предпочтительно в диапазоне 20-100 нм. Эта устойчивая наноструктура может помочь “новому бинарному конъюгату по настоящему изобретению” избежать поглощения макрофагами в кровообращении, таким образом оно может быть безопасно транспортировано к области формирования тромба и, в конечном итоге, пересечь гематоэнцефалический барьер. Таким образом, “новый бинарный конъюгат по настоящему изобретению” может образовывать наноструктуру для достижения функции пересечения гематоэнцефалического барьера. В дополнение к тромболитической и антитромботической функциям “новый бинарный конъюгат по настоящему изобретению” может также эффективно захватывать свободные радикалы OH, NO, и супероксиданионов и может достигать эффективного тромболизиса при низкой дозе, тем самым предоставляя хорошие перспективы для клинического применения.
Как используется в настоящем документе, “группа для связывания” означает функциональную группу, такую как карбоксильная группа или аминогруппа, способную вступать в реакцию конденсации.
Как используется в настоящем документе, “линкер” означает молекулу, имеющую группы для связывания, способные связывать соединение, имеющее формулу II, с олигопептидом Q, обладающим тромболитической активностью. По меньшей мере одна группа линкера для связывания представляет собой аминогруппу, а остальные группы для связывания являются карбоксильными группами или аминогруппами. В соответствии с изобретением линкер может быть природной аминокислотой, такой как L-Lys, L-Asp, or L-Glu.
Введение линкера позволяет “новому бинарному конъюгату по настоящему изобретению” формировать стабильную наносферическую структуру, позволяющую избежать поглощения макрофагами. Наносферическая структура может быть безопасно транспортирована к области формироввания тромба и, в конечном итоге, пересечь гематоэнцефалический барьер. В особенности, если линкер представляет собой L-Lys, “новый бинарный конъюгат по настоящему изобретению” может эффективно агрегироваться с формированием наносферических структур, имеющих диаметр 20-210 нм, предпочтительно в диапазоне 20-100 нм. Устойчивая наноструктура может помочь “новому бинарному конъюгату по настоящему изобретению” избежать поглощения макрофагами в кровообращении, таким образом позволяя ему безопасно транспортироваться к области формирования тромба и, в конечном итоге, пересечь гематоэнцефалический барьер.
Как используется в настоящем документе, “олигопептид” означает небольшую пептидную молекулу, имеющую молекулярную массу ниже 1000 Дальтон (D) и, обычно, состоящую из 3-8 аминокислот.
Как используется в настоящем документе, “пептид, обладающий тромболитической активностью” означает олигопептидный тромболитический агент, имеющий функции повышения проницаемости сосудов и тромболизиса, включая Р6А (ARPAK), метаболиты Р6А и родственные производные. В предыдущем исследовании было раскрыто, что Pro-Ala-Lys был самой короткой последовательностью с хорошей активностью, а также самой стабильной последовательностью среди нескольких тромболитических олигопептидов, включая Ala-Arg-Pro-Ala-Lys, Gly-Arg-Pro-Ala-Lys, Gln-Arg-Arg-Pro-Ala-Lys и Pro-Ala-Lys. Введение трипептида, имеющего последовательность Pro-Ala-AA в положении 3 соединения, имеющего формулу II, через линкер может позволить “новому бинарному конъюгату по настоящему изобретению” получить улучшенную стабильность и более сильную тромболитическую активность.
Например, олигопептид, содержащий последовательность PAK, AKP или КАР, используемый в настоящем изобретении, может быть PAK, RPAK (Arg-Pro-Ala-Lys), ARPAK (Ala-Arg-Pro-Ala-Lys), GRPAK (Gly-Arg-Pro-Ala-Lys), QRPAK (Gln-Arg-Pro-Ala-Lys), АКР, КАР, KPAK (Lys-Pro-Ala-Lys), PAKP (Pro-Ala-Lys-Pro), AKPAK (Ala-Lys-Pro-Ala-Lys) или PAKPA (Pro-Ala-Lys-Pro-Ala).
Например, пептид, имеющий повторяющиеся звенья последовательности PAK, последовательности AKP или последовательности KAP, используемый в настоящем изобретении, может быть любым из пептидов, описанных в Китайской Патентной Публикации CN 101190941, как пептидом, обладающим тромболитической активностью, включая пептид, имеющий повторяющиеся звенья последовательности PAK, такие как (PAK)2, (PAK)3, (PAK)4, (PAK)5 и (PAK)6; и пептид, имеющий повторяющиеся звенья последовательности AKP, такие как (AKP)2, (AKP)3, (AKP)4, (AKP)5 и (AKP)6; и пептид, имеющий повторяющиеся звенья последовательности КРА, такие как (KPA)2, (KPA)3, (KPA)4, (KPA)5 и (KPA)6.
Как используется в настоящем документе, “С1-4 алкильная группа” означает алкильную группу, имеющую 1-4 атомов углерода, такую как метил, этил, н-пропил, изопропил, бутил, изобутил или втор-бутил, трет-бутил. Когда R1 и R2 в соединении, имеющем формулу I, оба являются метальными группами, соединение, имеющее формулу II, используемое в качестве исходного вещества, может быть получено конденсацией Пикте-Шпенглера 3,4-дигидрокси-L-фенилаланина и ацетона в присутствии трифторацетата (TFA) и безводного сульфата магния. Преимущество заключается в более легком получении.
В настоящем изобретении фармацевтическая композиция может быть любыми клинически приемлемыми и подходящими составами. Предпочтительно, состав является инъекционными формами (порошок для инъекций, лиофилизированный порошок для инъекций, жидкость для инъекций, инфузионный раствор и т.д.). Фармацевтически приемлемый носитель может быть маннитом, водой, раствором Рингера или изотоническим раствором хлорида натрия и т.д.
Наносферическая структура соединений в соответствии с настоящим изобретением имеет диаметр 20-210 нм и более предпочтительно 20-100 нм, с помощью которой эти соединения могут более эффективно пересекать гематоэнцефалический барьер.
Стабильная наноструктура может помочь соединениям по настоящему изобретению не быть поглощенными макрофагами, в связи с чем соединения могут безопасно транспортироваться к области формирования тромбоза и в конечном итоге пересечь гематоэнцефалический барьер. Фармацевтическая композиция по настоящему изобретению может быть использована в качестве тромболитических препаратов для лечения инфаркта миокарда, ишемического инсульта, тромбоза глубоких вен, легочной эмболии, окклюзионной болезни периферических артерий, закупоренных центральных магистралей сосудистого доступа, сгустков в артериовенозных фистулах и шунтах, стеноза сонной артерии и т.д. Фармацевтическая композиция этого изобретения может быть также использована в качестве препарата для захвата свободных радикалов NO в лечении нейродегенеративных заболеваний, сердечно-сосудистых заболеваний, психических заболеваний, болезни высоты, сахарного диабета, ревматоидногго артрита, травматического повреждения головного мозга, рака, синдрома фрагильной X-хромосомы, серповидно-клеточной анемии, красного плоского лишая, витилиго, синдрома хронической усталости и т.д. Фармацевтическая композиция по настоящему изобретению также может быть использована в качестве тромб-таргетингового/антитромботического препарата для лечения тромбоцитоза, миелопролиферативного заболевания, истинной полицитемии, синдрома Бадда-Киари и т.д.
Фармацевтические композиции/соединения по настоящему изобретению одновременно обладают способностью захвата ОН, NO и супероксиданионных свободных радикалов, тромболитической активностью, а также тромб-таргетной/антитромботической функциями. Соответственно, они могут оставаться терапевтически эффективными у пациентов более 4 часов от начала симптомов инсульта, т.е. их использование не ограничивается 3-часовым окном лечения tPA. Кроме того, применение фармацевтических композиций/соединений по настоящему изобретению не вызывает системных реакций в виде кровотечения, которые вызывает tPA, и может способствовать захвату огромного количества свободных радикалов ОН, NO и супероксиданионов в процессе ишемии-реперфузии, таким образом предотвращая повреждения тканей головного мозга у пациентов, которых лечат. Поскольку две С1-4 алкильные группы и линкер соответственно введены в положения 1 и 3 соединений, имеющих формулу II, по сравнению с “6,7-дигидроксиизохинолином, имеющим тромболитическую активность”, “новый бинарный конъюгат по настоящему изобретению “демонстрирует лучшую тромболитическую активностью, уникальную способность к захвату свободных радикалов и антитромботическую активность в низкой дозе, а также превосходный терапевтический эффект при лечении инсульта через 4 часа от начала инсульта в более высокой дозе.
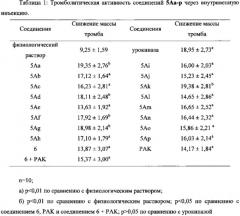
В выданном Китайском Патенте No. CN 101497651 B было показано, что “6,7-дигидроксиизохинолин, обладающий тромболитической активностью” имеет тромболитическую активность в дозе 10 нмоль/кг. Однако соединения по настоящему изобретению имеют хорошую тромболитическую и антитромботическую активность в дозе 0,1 нмоль/кг. Кроме того, соединения по настоящему изобретению имеют значительный терапевтический эффект при лечении инсульта через 4, 6 и 24 часа после начала инсульта в дозе 1, 2,5 и 5 мкмоль/кг, соответственно.
В способе получения соединений по настоящему изобретению пептид Q, обладающего тромболитической активностью, может быть получен первым, а затем связан со второй группой для связывания линкера Т, в качестве альтернативы, одна или более аминокислот пептида Q, обладающих тромболитической активностью, может быть последовательно соединена с линкером Т в заданном порядке. Например, первая аминокислота на одном конце тромболитического пептида Q связывается со второй группой для связывания линкера Т, и одна или более из остальных аминокислот затем последовательно соединяются с ней.
Способ получения по настоящему изобретению описан более подробно ниже для дальнейшего понимания.
Соединение формулы II может быть получено следующим путем синтеза:
где R1 и R2 оба представляют собой С1-4 алкильную группу и могут быть одинаковыми или различными. Например, 3,4-дигидрокси-L-фенилаланин (SM-1) и соединение SM-2 растворяют в TFA и 3,4-дигидрокси-L-фенилаланин и SM-2 подвергают конденсации Пикте-Шпенглера для получения соединения, имеющего формулу II, в присутствии безводного сульфата магния.
В предпочтительном варианте выполнения изобретения линкером в способе получения по настоящему изобретению является L-Lys, и пептид, обладающий тромболитической активностью, является трипептидом, имеющим последовательность РА (Pro-Ala). Например, карбоксильная группа соединения II соединяется с N-концом L-Lys, а затем трипептид, содержащий последовательность РА, соединяется с остальным N-концом или C-концом линкера L-Lys. В некоторых вариантах выполнения изобретения, когда R1 и R2 оба представляют собой метальную группу (т.е. 3S-6,7-дигидрокси-1,1-диметил-1,2,3,4-тетрагидроизохинолин-3-ацил-карбоновая кислота), линкером является L-Lys, и пептид, обладающий тромболитической активностью, является трипептидом, содержащим последовательность PA (Pro-Ala), соединение Ia, Ib, Ic или Id может быть получено в соответствии со способом получения по настоящему изобретению.
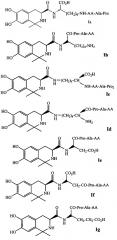
Когда соединение Ia получают в соответствии со способом получения по настоящему изобретению, может быть выполнена схема синтеза, раскрытая на Фиг. 1.
В варианте выполнения изобретения, показанном на Фиг. 1, сначала синтезируют трипептид, содержащий последовательность РА, а затем связывают с линкером L-Lys, в котором АА выбирается из остатка L-Ala, L-Val, L-Trp, L-Tyr, L-Pro, L-Phe, Gly, L-Ser, L-Ile, L-Thr, L-Lys, L-Leu, L-Gln, L-Asn, L-Asp и L-Glu (соответственно подходящим соединениям 5Aa-p). Условия реакции перечислены ниже: i) Ацетон, TFA, MgSO4; ii) HCl, Lys(Boc)-OBzl, DCC, HOBt, NMM; iii) 4 M HCl/EA, ледяная баня; iv) DCC, HOBt, NMM, v) EtOH, Pd/C; 4 M HCl/EA, ледяная баня; vi) EtOH, Pd/C; vii) 2 M NaOH. В другом варианте выполнения изобретения одна аминокислота трипептида, содержащего последовательность РА (такую как АА), связывается с линкером L-Lys, а остальные две аминокислоты (такие как Pro-Ala) трипептида, содержащего последовательность РА, затем присоединяются к АА.
Например, в одном варианте формирования соединения Ia способ получения по настоящему изобретению может включать следующие стадии:
1) В присутствии TFA и безводного сульфата магния 3,4-дигидрокси-L-фенилаланин и ацетон подвергаются конденсации Пикте-Шпенглера с получением 3S-6,7-дигидрокси-1,1-диметил-1,2,3,4-тетрагидроизохинолин-3-ацил-карбоновой кислоты;
2) В присутствии дициклогексилкарбодиимида (DCC) и N-гидроксибензотриазолтриазола (HOBt), 3s-6,7-дигидрокси-1,1-диметил-1,2,3,4-тетрагидроизохинолин-3-ацил-карбоновая кислота конденсировалась с HCl⋅Lys(Boc)-OBzl в безводном N,N-диметилформамиде (DMF) с образованием 3S-6,7-дигидрокси-1,1-диметил-1,2,3,4-тетрагидроизохинолин-3-ацил-Lys(Вос)-OBzl. В реакции конденсации N-метилморфолин (NMM) использовался для постоянной регулировки смеси до pH=9;
3) Удаление Boc из 3S-6,7-дигидрокси-1,1-диметил-1,2,3,4-тетрагидроизохинолин-3-ацил-Lys(Boc)-OBzl в этилацетатном растворе HCl с получением 3S-6,7-дигидрокси-1,1-диметил-1,2,3,4-тетрагидроизохинолин-3-ацил-Lys-OBzl;
4) В присутствии DCC и HOBt Boc-Pro конденсировался с Tos⋅Ala-OBzl в безводном THF с образованием Boc-Pro-Ala-OBzl;
5) В EtOH Boc-Pro-Ala-OBzl гидрогенолизуется с образованием Boc-Pro-Ala;
6) В присутствии DCC и HOBt Boc-Pro-Ala конденсировался с AA-Obzl в безводном THF с образованием Boc-Pro-Ala-AA-OBzl (АА выбирается из остатков L-Ala, Gly, L-Phe, L-Val, L-Leu, L-Ile, L-Trp, L-Ser, L-Thr, L-Tyr, L-Lys(Z), L-Pro, L-Asn и L-Gln);
7) В EtOH Boc-Pro-Ala-AA-OBzl со стадии 6 гидрогенолизуется с образованием Boc-Pro-Ala-АА;
8) В присутствии DCC и HOBt 3S-6,7-дигидрокси-1,1-диметил-1,2,3,4-тетрагидроизохинолин-3-ацил-Lys-OBzl конденсировался с Boc-Pro-Ala-AA со стадии 6 в безводном DMF с образованием 3S-6,7-дигидрокси-1,1-диметил-1,2,3,4-тетрагидроизохинолин-3-ацил-Lys(Boc-Pro-Ala-AA)-OBzl (определение АА является таким же, как на стадии 6);
9) В присутствии DCC и HOBt 3S-6,7-дигидрокси-1,1-диметил-1,2,3,4-тетрагидроизохинолин-3-ацил-Lys-OBzl конденсировался с Boc-AA(OBzl) в безводном DMF с образованием 3S-6,7-дигидрокси-1,1-диметил-1,2,3,4-тетрагидроизохинолин-3-ацил-Lys[Boc-AA(OBzl)]-OBzl (АА выбирается из остатка L-Asp, L-Glu);
10) В этилацетатном растворе HCl Boc удаляли из 3S-6,7-дигидрокси-1,1-диметил-1,2,3,4-тетрагидроизохинолин-3-ацил-Lys[Boc-AA(OBzl)]-OBzl с получением 3S-6,7-дигидрокси-1,1-диметил-1,2,3,4-тетрагидроизохинолин-3-ацил-Lys[AA(OBzl)]-OBzl (определение АА является таким же, как на стадии 9);
11) В присутствии DCC и HOBt 3S-6,7-дигидрокси-1,1-диметил-1,2,3,4-тетрагидроизохинолин-3-ацил-Lys[AA(OBzl)]-OBzl конденсировали с Boc-Pro-Ala в безводном DMF с образованием 3S-6,7-дигидрокси-1,1-диметил-1,2,3,4-тетрагидроизохинолин-3-ацил-Lys[Boc-Pro-Ala-AA(OBzl)]-OBzl (определение AA является таким же, как на стадии 9);
12) После гидрогенолиза и удаления Boc как с 3S-6,7-дигидрокси-1,1-диметил-1,2,3,4-тетрагидроизохинолин-3-ацил-Lys(Boc-Pro-Ala-AA)-OBzl (определение АА является таким же, как на стадии 6), так и с 3S-6,7-дигидрокси-1,1-диметил-1,2,3,4-тетрагидроизохинолин-3-ацил-Lys[Boc-Pro-Ala-AA(OBzl)]-OBzl (определение АА является таким же, как на стадии 9) снимали защиту с получением 3S-6,7-дигидрокси-1,1-диметил-1,2,3,4-тетрагидроизохинолин-3-ацил-Lys(Pro-Ala-АА).
Когда соединение Ib по настоящему изобретению получают в соответствии со способом получения по настоящему изобретению, может быть использована схема синтеза, показанная на Фиг. 2, где АА выбирается из остатков L-Ala, L-Val, L-Trp, L-Tyr, L-Pro, L-Phe, Gly, L-Ser, L-Ile, L-Thr, L-Lys, L-Leu, L-Gln, L-Asn, L-Asp и L-Glu (соответственно, соответствующих соединениям 5Ba-p). Условия реакции перечислены ниже: i) Ацетон, TFA, MgSO4; ii) HCl, Lys(Boc)-OBzl, DCC, HOBt, NMM; iii) EtOH, Pd/C; iv) DCC, HOBt, NMM, v) EtOH, Pd/C; 4 M HCl/EA, ледяная баня; vi) EtOH, Pd/C; vii) 4 M HCl/EA, ледяная баня.
Когда соединение Ic по настоящему изобретению получают в соответствии со способом получения по настоящему изобретению, может быть использована схема синтеза, показанная на Фиг. 3, где АА выбирается из остатков L-Ala, L-Val, L-Trp, L-Tyr, L-Pro, L-Phe, Gly, L-Ser, L-Ile, L-Thr, L-Lys, L-Leu, L-Gln, L-Asn, L-Asp и L-Glu (соответственно, соответствующих соединениям 5Ca-p). Условия реакции перечислены ниже: i) Ацетон, TFA, MgSO4; ii) HCl, Boc-Lys-OBzl, DCC, HOBt, NMM; iii) 4 M HCl/EA, ледяная баня; iv) DCC, HOBt, NMM, v) EtOH, Pd/C; 4 M HCl/EA, ледяная баня; vi) EtOH, Pd/C; vii) EtOH, Pd/C.
Когда соединение Id по настоящему изобретению получают в соответствии со способом получения по настоящему изобретению, может быть использована схема синтеза, показанная на Фиг. 4, где АА выбирается из остатков L-Ala, L-Val, L-Trp, L-Tyr, L-Pro, L-Phe, Gly, L-Ser, L-Ile, L-Thr, L-Lys, L-Leu, L-Gln, L-Asn, L-Asp и L-Glu (соответственно, соответствующих соединениям 5Da-p). Условия реакции перечислены ниже: i) Ацетон, TFA, MgSO4; ii) HCl, Boc-Lys-OBzl, DCC, HOBt, NMM; iii) EtOH, Pd/C; iv) DCC, HOBt, NMM, v) EtOH, Pd/C; 4 M HCl/EA, ледяная баня; vi) EtOH, Pd/C; vii) EtOH, Pd/C.
В другом предпочтительном варианте выполнения изобретения линкер представляет собой L-Asp и пептид, обладающий тромболитической активностью, является трипептидом, содержащим последовательность PA (Pro-Ala). Например, карбоксильная группа соединения, имеющего формулу II, связывается с N-концом L-Asp, а затем трипептид, содержащий последовательность РА, связывается с одним из остальных С-концов линкера L-Asp. В некоторых вариантах выполнения изобретения когда R1 и R2 соединения, имеющего формулу II, оба представляют собой метальную группу (т.е. 3S-6,7-дигидрокси-1,1-диметил-1,2,3,4-тетрагидроизохинолин-3-ацилкарбоновую кислоту), линкером является L-Asp, и пептид, обладающий тромболитической активностью, является трипептидом, содержащим последовательность PA (Pro-Ala), способ получения по настоящему изобретению может приводить к соединениям Ie или If выше.
Когда соединение Ie по настоящему изобретению получают в соответствии со способом получения по настоящему изобретению, может быть использована схема синтеза, показанная на Фиг. 5, где АА выбирается из остатков L-Ala, L-Val, L-Trp, L-Tyr, L-Pro, L-Phe, Gly, L-Ser, L-Ile, L-Thr, L-Lys, L-Leu, L-Gln, L-Asn, L-Asp и L-Glu (соответственно, соответствующих соединениям 5Ea-p). Условия реакции перечислены ниже: i) Ацетон, TFA, MgSO4; ii) HCl, Asp(OCH3)-OBzl, DCC, HOBt, NMM; iii) EtOH, Pd/C; iv) DCC, HOBt, NMM, v) EtOH, Pd/C; 2 M NaOH, ледяная баня; vi) EtOH, Pd/C; vii) 4 M HCl/EA, ледяная баня.
Когда соединение If по настоящему изобретению получают в соответствии со способом получения по настоящему изобретению, может быть использована схема синтеза, показанная на Фиг. 6, где АА выбирается из остатков L-Ala, L-Val, L-Trp, L-Tyr, L-Pro, L-Phe, Gly, L-Ser, L-Ile, L-Thr, L-Lys, L-Leu, L-Gln, L-Asn, L-Asp и L-Glu (соответственно, соответствующих соединениям 5Fa-p). Условия реакции перечислены ниже: i) Ацетон, TFA, MgSO4; ii) HCl, Asp(OBzl)-OCH3, DCC, HOBt, NMM; iii) 2 M NaOH; iv) DCC, HOBt, NMM, v) EtOH, Pd/C; 2 M NaOH, ледяная баня; vi) EtOH, Pd/C; vii) 4 M HCl/EA, ледяная баня.
В другом предпочтительном варианте выполнения изобретения линкер представляет собой L-Glu, и пептид, обладающий тромболитической активностью, является трипептидом, содержащим последовательность PA (Pro-Ala). Например, карбоксильная группа соединения, имеющего формулу II, связывается с N-концом L-Glu, а затем трипептид, содержащий последовательность РА, связывается с одним из остальных С-концов линкера L-Glu. В некоторых вариантах выполнения изобретения когда R1 и R2 соединения, имеющего формулу II, оба представляют собой метальную группу (т.е. 3S-6,7-дигидрокси-1,1-диметил-1,2,3,4-тетрагидроизохинолин-3-ацилкарбоновую кислоту), линкером является L-Glu, и пептид, обладающий тромболитической активностью, является трипептидом, содержащим последовательность PA (Pro-Ala), способ получения по настоящему изобретению может приводить к соединениям Ig или Ih выше.
Когда соединение Ig по настоящему изобретению получают в соответствии со способом получения по настоящему изобретению, может быть использована схема синтеза, показанная на Фиг. 7, где АА выбирается из остатков L-Ala, L-Val, L-Trp, L-Tyr, L-Pro, L-Phe, Gly, L-Ser, L-Ile, L-Thr, L-Lys, L-Leu, L-Gln, L-Asn, L-Asp и L-Glu (соответственно, соответствующих соединениям 5Ga-p). Условия реакции перечислены ниже: i) Ацетон, TFA, MgSO4; ii) HCl, Glu(OCH3)-OBzl, DCC, HOBt, NMM; iii) EtOH, Pd/C; iv) DCC, HOBt, NMM, v) EtOH, Pd/C; 2 M NaOH, ледяная баня; vi) EtOH, Pd/C; vii) 4 M HCl/EA, ледяная баня.
Когда соединение Ih по настоящему изобретению получают в соответствии со способом получения по настоящему изобретению, может быть использована схема синтеза, показанная на Фиг. 8, где АА выбирается из остатков L-Ala, L-Val, L-Trp, L-Tyr, L-Pro, L-Phe, Gly, L-Ser, L-Ile, L-Thr, L-Lys, L-Leu, L-Gln, L-Asn, L-Asp и L-Glu (соответственно, соответствующих соединениям 5Ha-p). Условия реакции перечислены ниже: i) Ацетон, TFA, MgSO4; ii) HCl, Glu(OBzl)-OCH3, DCC, HOBt, NMM; iii) EtOH, Pd/C; iv) DCC, HOBt, NMM, v) EtOH, Pd/C; 2 M NaOH, ледяная баня; vi) EtOH, Pd/C; vii) 4 M HCl/EA, ледяная баня.
Исследования in vivo на крысах соединений и фармацевтических композиций по настоящему изобретению показывают, что соединения и фармацевтические композиции по настоящему изобретению обладают превосходной тромболитической и антитромботической активностью при низкой дозе, и могут эффективно защитить неврологические функции у крыс с инсультом. Таким образом, соединения и фармацевтические композиции по настоящему изобретению могут эффективно и безопасно лечить тромботические заболевания в клинической практике.
Настоящее изобретение теперь будет описано следующими конкретными примерами, и преимущества и особенности станут понятными в свете описания. Эти примеры являются только иллюстративными и никоим образом не ограничивают объем настоящего изобретения. Специалисту в данной области техники может быть понятно, что модификация или замена могут быть сделаны в деталях и формально для технических решений по настоящему изобретению, не отклоняясь от сущности и объема настоящего изобретения, и эти модификации или замены предназначены находиться в пределах объема охраны настоящего изобретения.
Примеры 1-68 иллюстрируют способы получения с Фиг. 1 для получения соединений 5Аа-р по настоящему изобретению.
Пример 1: Общая методика синтеза пептида в жидкой фазе
Аминокислоту, имеющую защищенный N-конец, растворяли в безводном тетрагидрофуране (THF) и в полученный раствор добавляли N-гидроксибензотриазолтриазол (HOBt). Охлаждают раствор на ледяной бане. N,N-дициклогексилкарбодиимид (DCC) растворяли в безводном THF, медленным добавлением к нему, а затем перемешивали при 0°C в течение 15 минут с получением реак