Ангиотензин в лечении состояний головного мозга
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к способу лечения инсульта или травматического повреждения головного мозга, и может быть использовано в медицине. Изобретение предполагает предоставление пациенту, страдающему инсультом, линейной или 4,7-циклизованной формы пептида ангиотензина (1-7) в эффективной дозе с помощью внутривенного или подкожного пути введения. В отличие от известных аналогов предоставляемый в соответствии с настоящим изобретением препарат способен преодолевать гематоэнцефалический барьер без использования ICV и иных более сложных в реализации методов. 21 з.п. ф-лы, 13 ил., 3 табл., 3 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ПАТЕНТНЫЕ ЗАЯВКИ
[001] Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США №61/708793, поданной 2 октября 2012, предварительной заявке на патент США №61/720299, поданной 30 октября 2012, содержание которых полостью включено в настоящую заявку посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[002] Правильное функционирование центральной нервной системы имеет ключевое значение для любого животного. Повреждение головного мозга, в частности, такое как при ишемическом или геморрагическом инсульте, может иметь критические и, возможно, смертельные последствия. Одним из препятствий для лечения или профилактики повреждений головного мозга является гематоэнцефалический барьер, который представляет собой совокупность плотных контактов между соседними эндотелиальными клетками капилляров головного мозга. Такие контакты предотвращают транспорт большинства веществ через гематоэнцефалический барьер, за исключением случаев, когда они являются очень липофильными или транспортируются специфичным образом. Вследствие этого чрезвычайно сложно вводить лекарственные средства с помощью обычно предпочтительных путей, таких как внутривенное или подкожное введение, и наблюдать терапевтический эффект в головном мозге.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[003] В настоящем изобретении предложены, помимо прочего, способы и композиции для лечения состояний головного мозга, включая, но не ограничиваясь ими: инсульт, сосудистую деменцию и черепно-мозговую травму. Как описано в разделе «Примеры» ниже, настоящее изобретение, в частности, основано на неожиданном обнаружении того факта, что системное введение, такое как подкожное введение, пептида ангиотензина (1-7) (например, PanCyte), приводит к улучшению неврологической и моторной функции в модели ишемического инсульта на крысах. До того как было сделано настоящее изобретение, считалось, что ангиотензин (1-7) не может пересекать гематоэнцефалический барьер и, следовательно, его необходимо вводить интрацеребровентрикулярным путем (ICV) или с использованием сложных методов, таких как инфицирование гемопоэтических стволовых клеток, которые способны пересекать гематоэнцефалический барьер, лентивирусом, который вызывает гиперэкспрессию Анг-(1-7). Месса et al., Cerebroprotection by Angiotensin-(1-7) in Endothelin-1-Induced Ischaemic Stroke, (2011) Exp Physiol. 2011 96(10):1084-1096. Никто не показал, что введение пептида ангиотензина (1-7) или непептидного агониста ангиотензина (1-7) с использованием системного (например, подкожного или внутривенного) пути введения может привести к получению терапевтических уровней, которые достигают головного мозга, и, в частности, поврежденной ткани головного мозга.
[004] Согласно некоторым вариантам реализации настоящего изобретения предложены способы лечения состояния головного мозга, включающие введение субъекту, который страдает или восприимчив к такому состоянию головного мозга, пептида ангиотензина (1-7) путем системного введения. В некоторых вариантах реализации настоящего изобретения указанное системное введение, пригодное для настоящего изобретения, представляет собой внутривенное введение. В некоторых вариантах реализации настоящего изобретения указанное системное введение, пригодное для настоящего изобретения, представляет собой подкожное введение. В некоторых вариантах реализации настоящего изобретения указанное системное введение, пригодное для настоящего изобретения, представляет собой пероральное введение. В некоторых вариантах реализации настоящего изобретения указанное системное введение, пригодное для настоящего изобретения, не включает интрацеребровентрикулярное введение. Согласно некоторым вариантам реализации настоящего изобретения состояние головного мозга выбрано из инсульта, сосудистой деменции и травматического повреждения мозга. Согласно некоторым вариантам реализации настоящего изобретения указанный инсульт представляет собой ишемический инсульт. Согласно некоторым вариантам реализации настоящего изобретения указанный инсульт представляет собой геморрагический инсульт.
[005] Согласно некоторым вариантам реализации настоящего изобретения пептид ангиотензина (1-7) вводят посредством непрерывной инфузии. Согласно некоторым вариантам реализации настоящего изобретения пептид ангиотензина (1-7) вводят с каким-либо интервалом введения. Например, пептид ангиотензина (1-7) может быть введен три раза в сутки, два раза в сутки, один раз в сутки, два раза в неделю, один раз в неделю, три раза в месяц, два раза в месяц, один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в месяц, один раз в два месяца, один раз в три месяца, один раз в четыре месяца, один раз в пять месяцев, один раз в шесть месяцев, с нерегулярным интервалом.
[006] Согласно настоящему изобретению подразумевается, что в различных вариантах реализации изобретения могут быть использованы различные количества пептида ангиотензина (1-7). Согласно некоторым вариантам реализации настоящего изобретения пептид ангиотензина (1-7) вводят в эффективной дозе, находящейся в пределах от приблизительно 1 до 1000 мкг/кг/сутки (например, находящейся в диапазоне приблизительно 1-900 мкг/кг/сутки, 1-800 мкг/кг/сутки, 1-700 мкг/кг/сутки, 1-600 мкг/кг/сутки, 1-500 мкг/кг/сутки, 1-400 мкг/кг/сутки, 1-300 мкг/кг/сутки, 1-200 мкг/кг/сутки, 1-100 мкг/кг/сутки, 1-90 мкг/кг/сутки, 1-80 мкг/кг/сутки, 1-70 мкг/кг/сутки, 1-60 мкг/кг/сутки, 1-50 мкг/кг/сутки, 1-40 мкг/кг/сутки, 1-30 мкг/кг/сутки, 1-20 мкг/кг/сутки, 1-10 мкг/кг/сутки). Согласно некоторым вариантам реализации настоящего изобретения пептид ангиотензина (1-7) вводят в эффективной дозе, находящейся в пределах от приблизительно 1 до 500 мкг/кг/сутки. Согласно некоторым вариантам реализации настоящего изобретения пептид ангиотензина (1-7) вводят в эффективной дозе, находящейся в пределах от приблизительно 1 до 100 мкг/кг/сутки. Согласно некоторым вариантам реализации настоящего изобретения пептид ангиотензина (1-7) вводят в эффективной дозе, находящейся в пределах от приблизительно 1 до 60 мкг/кг/сутки. Согласно некоторым вариантам реализации настоящего изобретения пептид ангиотензина (1-7) вводят в эффективной дозе, выбранной из приблизительно 1, 2, 4, 6, 8, 10, 15, 20, 25, 30, 35, 40, 45, 50, 75, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950 или 1000 мкг/кг/сутки.
[007] Также предусмотрено, что в различных вариантах реализации могут применяться различные пептиды ангиотензина (1-7). Согласно некоторым вариантам реализации настоящего изобретения пептид ангиотензина (1-7) содержит природную аминокислотную последовательность ангиотензина (1-7): Aspl-Arg2-Val3-Tyr4-Ile5-His6-Pro7 (SEQ ID NO: 1).
[008] Согласно некоторым вариантам реализации пептид ангиотензина (1-7) представляет собой функциональный эквивалент SEQ ID NO: 1. Согласно некоторым вариантам реализации указанный функциональный эквивалент представляет собой линейный пептид. Согласно некоторым вариантам реализации указанный линейный пептид содержит последовательность, которая содержит по меньшей мере четыре, по меньшей мере пять, или по меньшей мере шесть аминокислот из семи аминокислот, которые присутствуют в природном ангиотензине (1-7), причем по меньшей мере четыре, пять или шесть аминокислот сохраняют свои относительные положения, в которых они присутствуют в природном ангиотензине (1-7). Согласно некоторым вариантам реализации линейный пептид содержит 4-25 аминокислот. Согласно некоторым вариантам реализации линейный пептид представляет собой фрагмент природного ангиотензина (1-7). Согласно некоторым вариантам реализации линейный пептид содержит аминокислотные замены, удаления и/или вставки в последовательности природного ангиотензина (1-7). Согласно некоторым вариантам реализации линейный пептид имеет аминокислотную последовательность Asp1-Arg2-Val3-Ser4-Ile5-His6-Cys7 (SEQ ID NO: 6).
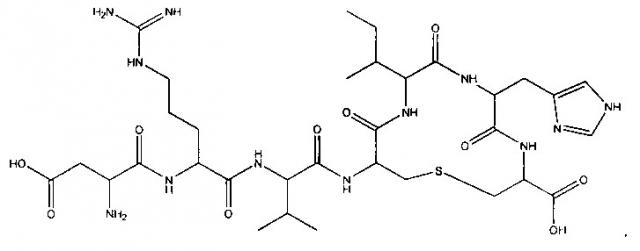
[009] Согласно некоторым вариантам реализации функциональный эквивалент представляет собой циклический пептид. Согласно некоторым вариантам реализации циклический пептид содержит связи между аминокислотами. Согласно некоторым вариантам реализации связи расположены в остатках, соответствующих положениям Tyr4 и Pro7 в природном ангиотензине (1-7). Согласно некоторым вариантам реализации связь представляет собой тиоэфирный мостик. Согласно некоторым вариантам реализации циклический пептид содержит аминокислотную последовательность, которая в остальном идентична природной аминокислотной последовательности ангиотензина (1-7): Asp1-Arg2-Val3-Tyr4-Ile5-His6-Pro7 (SEQ ID NO: 1). Согласно некоторым вариантам реализации циклический пептид содержит норлейцин (Nle), замещающий положение Val3 в природном ангиотензине (1-7). Согласно некоторым вариантам реализации циклический пептид представляет собой 4,7-циклизованный ангиотензин (1-7), имеющий следующую формулу Asp1-Arg2-Val3-Ser4-Ile5-His6-Cys7 (SEQ ID NO: 22). Согласно некоторым вариантам реализации циклический пептид представляет собой 4,7-циклизованный ангиотензин (1-7), имеющий следующую формулу:
[0010] Согласно некоторым вариантам реализации пептид ангиотензина (1-7) содержит одну или более химических модификаций для повышения устойчивости к действию протеаз, стабильности в сыворотке крови и/или биодоступности. Согласно некоторым вариантам реализации одна или более химических модификаций включают пегилирование.
[0011] Согласно некоторым вариантам реализации в настоящем изобретении предложены способы лечения состояний головного мозга, включая, но не ограничиваясь ими, инсульт, сосудистую деменцию и черепно-мозговую травму, включающие введение субъекту, который страдает или восприимчив к одному или большему числу состояний головного мозга, агониста рецептора ангиотензина (1-7). Согласно некоторым вариантам реализации агонист рецептора ангиотензина (1-7) представляет собой непептидный агонист. Согласно некоторым вариантам реализации непептидный агонист представляет собой соединение со следующей структурой:
[0012] или его фармацевтически приемлемую соль.
[0013] В настоящей заявке термины «примерно» и «приблизительно» используются как эквивалентные. Любые числа, используемые в настоящей заявке с или без примерно/приблизительно, подразумевают включение любых нормальных колебаний, определенных специалистом в данной области техники.
[0014] Другие признаки, задачи и преимущества настоящего изобретения очевидны на основании подробного описания, приведенного ниже. Следует понимать, однако, что подробное описание, несмотря на то, что в нем описаны варианты реализации настоящего изобретения, приведено только в качестве иллюстрации и не ограничивает объем настоящего изобретения. Различные изменения и модификации в пределах объема настоящего изобретения будут очевидны для специалистов в данной области техники на основании подробного описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0015] На ФИГ. 1 показан пример столбчатой диаграммы сравнения результатов шагового теста у крыс с кратковременной окклюзией средней мозговой артерии, которые также получали некоторое количество PanCyte в течение 14 или 49 дней.
[0016] На ФИГ. 2 показан пример столбчатой диаграммы сравнения результатов испытания реакции передних конечностей на стимуляцию у крыс с кратковременной окклюзией средней мозговой артерии, которые также получали некоторое количество PanCyte в течение 14 или 49 дней.
[0017] На ФИГ. 3 показан пример столбчатой диаграммы сравнения результатов испытания с раскачиванием тела у крыс с кратковременной окклюзией средней мозговой артерии, которые также получали некоторое количество PanCyte в течение 14 или 49 дней.
[0018] На ФИГ. 4 показан пример столбчатой диаграммы сравнения результатов неврологического исследования (модифицированная оценочная шкала Neuroscore) у крыс с кратковременной окклюзией средней мозговой артерии, которые также получали некоторое количество PanCyte в течение 14 или 49 дней.
[0019] На ФИГ. 5 показан пример столбчатой диаграммы сравнения результатов шагового теста у крыс с кратковременной окклюзией средней мозговой артерии и которые также получали ТХА127, PanCyte или линейный PanCyte подкожно в течение 28 дней.
[0020] На ФИГ. 6 показан пример столбчатой диаграммы сравнения результатов испытания реакции передних конечностей на стимуляцию у крыс с кратковременной окклюзией средней мозговой артерии, которые также получали ТХА127, PanCyte или линейный PanCyte подкожно в течение 28 дней.
[0021] На ФИГ. 7 показан пример столбчатой диаграммы сравнения результатов испытания с раскачиванием тела у крыс с кратковременной окклюзией средней мозговой артерии, которые также получали ТХА127, PanCyte или линейный PanCyte подкожно в течение 28 дней.
[0022] На ФИГ. 8 показан пример столбчатой диаграммы сравнения результатов неврологического исследования (модифицированная оценочная шкала Neuroscore) у крыс с кратковременной окклюзией средней мозговой артерии, которые также получали ТХА127, PanCyte или линейный PanCyte подкожно в течение 28 дней.
[0023] На ФИГ. 9 показан пример столбчатой диаграммы, в котором приведены результаты сравнения показателей перфузии крови между ипсилатеральной и контралатеральной сторонами, а также диаметра кровеносных сосудов у животных, которым вводили ТХА127, PanCyte или линейный PanCyte путем подкожных инъекций в течение 28 дней.
[0024] На ФИГ. 10 показан пример столбчатой диаграммы сравнения результатов шагового теста у крыс с кратковременной окклюзией средней мозговой артерии, которые также получали PanCyte или AVE0991 подкожно в течение 28 дней.
[0025] На ФИГ. 11 показан пример столбчатой диаграммы сравнения результатов испытания реакции передних конечностей на стимуляцию у крыс с кратковременной окклюзией средней мозговой артерии, которые также получали PanCyte или AVE0991 подкожно в течение 28 дней.
[0026] На ФИГ. 12 показан пример столбчатой диаграммы сравнения результатов испытания с раскачиванием тела у крыс с кратковременной окклюзией средней мозговой артерии, которые также получали PanCyte или AVE0991 подкожно в течение 28 дней.
[0027] На ФИГ. 13 показан пример столбчатой диаграммы сравнения результатов неврологического исследования (модифицированная оценочная шкала Neuroscore) у крыс с кратковременной окклюзией средней мозговой артерии, которые также получали PanCyte или AVE0991 подкожно в течение 28 дней.
ОПРЕДЕЛЕНИЯ
[0028] Для более ясного понимания настоящего изобретения некоторые термины сначала будут определены ниже. Дополнительные определения для нижеследующих терминов и других терминов приведены по тексту настоящего описания.
[0029] Животные: В настоящей заявке термин «животное» относится к любому члену царства животных. Согласно некоторым вариантам реализации «животное» относится к человеку, на любой стадии развития. Согласно некоторым вариантам реализации «животное» относится к животным, не относящимся к человеку, на любой стадии развития. Согласно некоторым вариантам реализации животное, не относящееся к человеку, является млекопитающим (например, грызун, мышь, крыса, кролик, обезьяна, собака, кошка, овца, крупный рогатый скот, примат и/или свинья). Согласно некоторым вариантам реализации животные включают, но не ограничиваются следующими: млекопитающих, птиц, рептилий, амфибий, рыб, насекомых и/или червей. Согласно некоторым вариантам реализации животное может быть трансгенным животным, модифицированным животным и/или клоном.
[0030] Приблизительно или примерно: В настоящей заявке термин «примерно» или «приблизительно», применительно к одному или большему числу значений, представляющих интерес, относится к значению, которое аналогично приведенному ориентировочному значению. Согласно некоторым вариантам реализации термин «примерно» или «приблизительно» относится к диапазону значений, которые находятся в пределах 25%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или менее в любом направлении (более чем или менее чем) относительно приведенного ориентировочного значения, если не указано иное или иное не очевидно из контекста (кроме случаев, когда такое число превышало 100% от возможного значения).
[0031] Биологически активный: В настоящей заявке выражение «биологически активный» относится к характеристике любого агента, который обладает активностью в биологической системе, и, в частности, в организме. Например, агент, который, при введении в организм, оказывает биологическое воздействие на организм, рассматривается как биологически активный. В конкретных вариантах реализации, в том случае, если пептид является биологически активным, часть этого пептида, которая также обладает по меньшей мере одним видом биологической активности указанного пептида, как правило, называется «биологически активной» частью. Согласно некоторым вариантам реализации пептид, который не имеет природной биологической активности, но который ингибирует действие одного или более природных соединений ангиотензина, считается биологически активным.
[0032] Состояние головного мозга - в настоящей заявке «состояние головного мозга» представляет собой любое состояние, расстройство или явление, которое приводит к повреждению и/или дисфункции по меньшей мере части головного мозга субъекта. Неограничивающие примеры состояний головного мозга включают: инсульт (оба типа, ишемический и геморрагический), сосудистую деменцию и черепно-мозговую травму.
[0033] Носитель или разбавитель: В настоящей заявке термины «носитель» и «разбавитель» относятся к фармацевтически приемлемому (например, безопасному и нетоксичному для введения человеку) носителю или разбавляющему веществу, пригодному для получения фармацевтического состава. Примеры разбавителей включают стерильную воду, бактериостатическую воду для инъекций (BWFI), раствор с фиксированным значением рН (например, забуференный фосфатом физиологический раствор), стерильный физиологический раствор, раствор Рингера или раствор декстрозы.
[0034] Лекарственная форма: В настоящей заявке термины «лекарственная форма» и «стандартная лекарственная форма» относятся к физически дискретной единице терапевтического агента для пациента, подлежащего лечению. Каждая единица содержит заранее определенное количество активного материала, рассчитанное для получения желаемого терапевтического эффекта. Следует понимать, однако, что общая доза композиции будет определяться лечащим врачом на основании обоснованного медицинского заключения.
[0035] Схема дозирования: в настоящей заявке «схема дозирования» (или «терапевтическая схема») представляет собой множество отдельных доз (обычно более одной), которые вводят по отдельности субъекту, обычно, с некоторыми временными интервалами между введениями. Согласно некоторым вариантам реализации данный терапевтический агент имеет рекомендованную схему дозирования, которая может включать одну или более доз. Согласно некоторым вариантам реализации схема дозирования включает множество доз, введение каждой из которых разделено одинаковым периодом времени; согласно некоторым вариантам реализации схема дозирования включает множество доз и по меньшей мере два разных периода времени, разделяющих введение отдельных доз. Согласно некоторым вариантам реализации терапевтический агент вводят непрерывно в течение заранее определенного периода времени. Согласно некоторым вариантам реализации терапевтический агент вводят один раз в сутки (QD) или два раза в сутки (BID).
[0036] Функциональный эквивалент или производное: В настоящей заявке термин «функциональный эквивалент» или «функциональное производное» обозначает, применительно к функциональному производному аминокислотной последовательности, молекулу, сохраняющую биологическую активность (функциональную или структурную), которая по существу аналогична активности для исходной последовательности. Функциональное производное или эквивалент может представлять собой природное производное или может быть получено синтетическим способом. Примеры функциональных производных включают аминокислотные последовательности, имеющие замены, удаления или добавления одного или более аминокислотных остатков при условии, что биологическая активность белка сохраняется. Замещающие аминокислоты предпочтительно имеют физико-химические свойства, которые аналогичны свойствам замещенной аминокислоты. В предпочтительном варианте аналогичные физико-химические свойства включают близость по величине заряда, объему молекулы, гидрофобности, гидрофильное™ и тому подобное.
[0037] Улучшать, увеличивать или снижать: в настоящей заявке термины «улучшать», «увеличивать» или «снижать», или их грамматические эквиваленты, указывают значения, которые являются относительными по сравнению с исходным уровнем, таким как значение, измеренное у того же индивидуума перед началом лечения, описанного в настоящей заявке, или значение, измеренное у контрольного субъекта (или нескольких контрольных субъектов) в отсутствие лечения, описанного в настоящей заявке. «Контрольный субъект» представляет собой субъекта, пораженного той же формой заболевания, что и субъект, которого лечат, который имеет приблизительно тот же возраст, что и субъект, подлежащий лечению.
[0038] Условия in vitro: в настоящей заявке термин «in vitro» обозначает события, которые происходят в искусственном микроокружении, например, в пробирке или реакционном сосуде, в клеточной культуре и т.д., а не в многоклеточном организме.
[0039] Условия in vivo: в настоящей заявке термин «w vivo» обозначает события, которые происходят в многоклеточном организме, таком как человек и животное, не являющегося человеком. Применительно к клеточным системам термин может быть использован для обозначения событий, которые происходят в живой клетке (в отличие от, например, систем in vitro).
[0040] Выделенный: в настоящей заявке термин «выделенный» относится к веществу и/или фрагменту, который был (1) отделен по меньшей мере от некоторых из компонентов, с которыми он был связан при первоначальном образовании (независимо от того, происходило это в природных и/или экспериментальных условиях), и/или (2), полученному, приготовленному и/или изготовленному вручную. Выделенные вещества и/или фрагменты могут быть отделены по меньшей мере от приблизительно 10%, приблизительно 20%, приблизительно 30%», приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90%, приблизительно 95%, приблизительно 98%, приблизительно 99%, по существу 100% или 100% других компонентов, с которыми они были первоначально связаны. Согласно некоторым вариантам реализации выделенные агенты являются чистыми более чем приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 91%, приблизительно на 92%, приблизительно на 93%, приблизительно на 94%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99%, по существу на 100% или на 100%. В настоящей заявке вещество является «чистым», если оно по существу не содержит других компонентов. В настоящей заявке термин «выделенная клетка» относится к клетке, которая не содержится в многоклеточном организме.
[0041] Предотвращать: в настоящей заявке термин «предотвращать» или «предотвращение» применительно к возникновению заболевания, нарушения и/или состояния, относится к снижению риска развития заболевания, расстройства и/или состояния. См. определение термина «риск».
[0042] Полипептид: в настоящей заявке термин «полипептид» относится к последовательной цепи аминокислот, соединенных между собой пептидными связями. Термин используется для обозначения аминокислотной цепи любой длины, однако специалист в данной области поймет, что этот термин не ограничен очень длинными цепями и может относиться к минимальной цепи, содержащей две аминокислоты, связанные друг с другом пептидной связью. Как известно специалистам в данной области техники, полипептиды могут подвергаться протеолитическому расщеплению и/или модификации.
[0043] Белок: в настоящей заявке термин «белок» относится к одному или большему числу полипептидов, которые функционируют в качестве отдельной единицы. Если отдельный полипептид представляет собой отдельную функционирующую единицу и не требует постоянной или временной физической связи с другими полипептидами для образования отдельной функциональной единицы, то термины «полипептид» и «белок» могут быть использоваться взаимозаменяемо. Если отдельная функциональная единица содержит более одного полипептида, которые физически связаны друг с другом, то термин «белок» относится к нескольким полипептидам, которые физически соединены и функционируют совместно в качестве отдельной единицы.
[0044] Риск: как будет понятно из контекста, «риск» заболевания, нарушения и/или состояния включает вероятность того, что у конкретного индивидуума разовьется заболевание, нарушение и/или состояние (например, инсульт). Согласно некоторым вариантам реализации величину риска выражают в процентах. Согласно некоторым вариантам реализации величина риска составляет от 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90 до 100%. Согласно некоторым вариантам реализации величину риска выражают как величину риска по отношению к таковой для риска, связанного с референсным образцом или группой референсных образцов. В некоторых вариантах реализации референсный образец или группа референсных образцов имеет известный риск развития состояния, расстройства, состояния и/или явления (например, инсульта). Согласно некоторым вариантам реализации референсный образец или группа референсных образцов получены от индивидуумов, показатели которых сопоставимы с таковыми у конкретного индивидуума. Согласно некоторым вариантам реализации относительный риск составляет 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более.
[0045] Стабильность: в настоящей заявке термин «стабильный» относится к способности терапевтического агента поддерживать свою терапевтическую эффективность (например, все или большую часть видов его предполагаемой биологической активности и/или физико-химическую целостность) в течение длительных периодов времени. Стабильность терапевтического агента и способность фармацевтической композиции поддерживать стабильность такого терапевтического агента можно оценивать в течение длительных периодов времени (например, по меньшей мере 1, 3, 6, 12, 18, 24, 30, 36 месяцев и более). Согласно некоторым вариантам реализации фармацевтические композиции, описанные в настоящей заявке, приготовлены таким образом, что они способны обеспечивать стабилизацию, или другим способом замедлять или предотвращать разрушение одного или более терапевтических агентов, которые входят в состав указанных композиций. Применительно к составу, стабильный состав представляет собой состав, в котором терапевтический агент, содержащийся в нем, по существу сохраняет свою физическую и/или химическую целостность и биологическую активность при хранении и в ходе ряда процессов (например, замораживания/оттаивания, механического перемешивания и лиофилизации).
[0046] Субъект: в настоящей заявке термин «субъект» относится к человеку или любому животному, не относящемуся к человеку (например, мыши, крысе, кролику, собаке, кошке, крупному рогатому скоту, свинье, овце, лошади или примату). Человек включает пре- и постнатальные формы. Согласно многим вариантам реализации субъектом является человек. Субъект может быть пациентом, что обозначает человека, поступившего в медицинское учреждение для диагностики или лечения состояния. В настоящей заявке термин «субъект» используется взаимозаменяемо с терминами «индивидуум» или «пациент». Субъект может быть поражен заболеванием или нарушением или восприимчив к ним, при этом симптомы этого заболевания или нарушения у него могут проявляться или отсутствовать.
[0047] По существу: в настоящей заявке термин «по существу» относится к качественному условию, относящемуся к проявлению конечной или почти конечной величины или степени признака или свойства, представляющего интерес. Для специалиста в области биологии будет понятно, что биологические и химические явления редко, почти никогда, протекают до завершения и/или продолжаются до достижения завершенности, или достигают, или исключают какой-либо абсолютный результат. Соответственно, в настоящей заявке термин «по существу» используется для того чтобы учесть потенциальное отсутствие завершенности, присущее многим биологическим и химическим явлениям.
[0048] Страдающий от: индивидуум, «страдающий от» заболевания, нарушения и/или состояния, представляет собой индивидуума, у которого было диагностировано заболевание, нарушение и/или состояние или который проявляет один или более симптомов заболевания, нарушения и/или состояния.
[0049] Восприимчивый к: индивидуум, «восприимчивый к» состоянию, расстройству и/или состоянию, представляет собой индивидуума, у которого не было диагностировано состояние, расстройство и/или состояние. В некоторых вариантах реализации индивидуум, который восприимчив к заболеванию, нарушению и/или состоянию, может не проявлять симптомов заболевания, нарушения и/или состояния. Согласно некоторым вариантам реализации индивидуум, который является восприимчивым к заболеванию, нарушению, состоянию или событию (например, ишемическому инсульту), может быть охарактеризован с использованием одного или более из следующих признаков: (1) генетическая мутация, связанная с развитием заболевания, нарушения и/или состояния; (2) генетический полиморфизм, связанный с развитием заболевания, нарушения и/или состояния; (3) увеличение и/или снижение экспрессии и/или активности белка, связанного с заболеванием, нарушением и/или состоянием; (4) привычки и/или образ жизни, связанные с развитием заболевания, нарушения, состояния и/или события; (5) перенесенная или планируемая трансплантация либо потребность в трансплантате. Согласно некоторым вариантам реализации у индивидуума, который восприимчив к заболеванию, нарушению и/или состоянию, разовьется состояние, расстройство и/или состояние. Согласно некоторым вариантам реализации у индивидуума, который восприимчив к состоянию, расстройству и/или состоянию, не разовьется состояние, расстройство и/или состояние.
[0050] Терапевтически эффективное количество: в настоящей заявке термин «терапевтически эффективное количество» терапевтического агента означает количество, которое является достаточным, при введении субъекту, страдающему или восприимчивому к заболеванию, нарушению и/или состоянию, для лечения, диагностики, предотвращения и/или задержки начала развития симптома(ов) заболевания, нарушения и/или состояния. Для специалистов в данной области техники будет понятно, что терапевтически эффективное количество обычно вводят с использованием схемы дозирования, включающей по меньшей мере одну стандартную дозу.
[0051] Лечение: в настоящей заявке термин «лечить», «лечение» или «процесс лечения» относится к любому способу, используемому для того чтобы частично или полностью снять, ослабить, облегчить, ингибировать, предотвратить, задержать начало развития, уменьшить степень тяжести и/или уменьшить частоту одного или более симптомов или признаков конкретного заболевания, нарушения и/или состояния. Лечение можно применять к субъекту, который не проявляет признаков состояния и/или проявляет только ранние признаки состояния, для снижения риска развития патологии, связанной с состоянием.
ПОДРОБНОЕ ОПИСАНИЕ НЕКОТОРЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ
[0052] В настоящем изобретении предложены, помимо прочего, улучшенные композиции и способы лечения или снижения риска развития состояний головного мозга, вызванных повреждением или нарушением тканей головного мозга.
[0053] Различные аспекты настоящего изобретения будут подробно описаны в следующих разделах. Использование разделов не предназначено для ограничения настоящего изобретения. Каждый раздел может относиться к любому аспекту настоящего изобретения. В настоящей заявке использование «или» означает «и/или», если не указано иное.
Состояния головного мозга
Инсульт
[0054] Головной мозг чрезвычайно чувствителен к нарушению поступления в него кислорода. Аноксия и ишемия продолжительностью всего в несколько секунд, могут вызвать симптомы и, если такое состояние сохраняется в течение минут, они могут вызвать необратимое повреждение нейронов. Соответственно, инсульт является одной из основных причин тяжелой, долгосрочной инвалидности и ведущей причиной смерти в Соединенных Штатах Америки. Инсульт также налагает ощутимое бремя на медицинскую отрасль, при этом общие расходы на здравоохранение по инвалидности в результате инсульта, согласно оценкам, составляют приблизительно 53 млрд. долларов США в год.
[0055] Существует два типа инсультов: ишемический и геморрагический инсульты. Ишемический инсульт включает закупорку одного или более сосудов, которые снабжают кровью ткани головного мозга, например, окклюзию, вызванную атеросклеротическими тромбами, или эмболию. Ишемический инсульт (церебральная ишемия) составляет приблизительно 88% от всех инсультов, что делает ишемический инсульт одним из наиболее распространенных типов цереброваскулярных повреждений. Ишемические состояния в головном мозге незамедлительно ведут к гибели нейронов, что часто приводит к хроническим сенсомоторным поражениям. В настоящей заявке геморрагический инсульт определяется как накопление крови в любом месте под сводом черепа. Геморрагические инсульты могут быть следствием многих причин, включая травму в результате расширяющейся гематомы, которая может разрушить или деформировать ткань.
[0056] Основным препятствием в лечении как ишемического, так и геморрагического инсультов является доставка лекарственного средства, которое достигнет пораженной ткани. Вследствие эффективности гематоэнцефалического барьера очень немногие соединения способны проникать в ткань мозга и оказывать на нее влияние. Ранее доставка соединений, таких как ангиотензин (1-7), должна была осуществляться с использованием интрацеребровентрикулярного (ICV) введения. Неожиданно было обнаружено, что варианты реализации настоящего изобретения, включая типичные пептиды ангиотензина (1-7), описанные ниже, способны пересекать гематоэнцефалический барьер без сложных систем доставки, таких как модифицированные стволовые клетки и тому подобное. Действительно, согласно некоторым вариантам реализации пептиды ангиотензина (1-7) могут быть доставлены с использованием внутривенных или подкожных путей введения. Сосудистая деменция
[0057] Сосудистая деменция является второй по распространенности формой деменции после болезни Альцгеймера. Сосудистая деменция может быть следствием проблем с кровоснабжением головного мозга, таких как проблемы, вызванные ишемическим или геморрагическим инсультом или другими причинами, которые приводят к развитию поражений головного мозга. Другие причины сосудистой деменции включают церебральную амилоидную ангиопатию, гиперхолестеринемию, сахарный диабет или сердечнососудистые заболевания. Деменция, вызванная одним или более инсультами, также известна как «одноинфарктная деменция» или «мультиинфарктная деменция», в зависимости от первопричины.
[0058] Лечение сосудистой деменции сосредоточено преимущественно на предотвращении дальнейших цереброваскулярных поражений за счет использования антитромбоцитарных лекарственных препаратов и изменения образа жизни (изменение диеты, отказ от курения и т.д.). Также было исследовано применение ингибиторов холинэстеразы, таких как галантамин, при этом клиническом сценарии, однако этот тип лечения связан с поддержанием функции ацетилхолина в головном мозге, а не восстановлением или формированием улучшенного и устойчивого кровоснабжения. Таким образом, варианты реализации настоящего изобретения представляют новый вид внутривенной и подкожной терапии, направленной на улучшение основополагающих причин заболевания, в отличие от контроля симптомов или максимизации оставшихся ресурсов тканей. Травматическое повреждение мозга
[0059] Тра