Композиция ненуклеозидного ингибитора обратной транскриптазы
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и представляет собой способ получения композиции, включающей активный фармацевтический ингредиент, который представляет собой 3-хлор-5-({1-[(4-метил-5-оксо-4,5-дигидро-1H-1,2,4-триазол-3-ил)метил]-2-оксо-4-(трифторметил)-1,2-дигидропиридин-3-ил}окси)бензонитрил или его фармацевтически приемлемую соль, и увеличивающий концентрацию полимер, который представляет собой ацетатсукцинат гидроксипропилметилцеллюлозу (HPMCAS), включающий стадии растворения активного фармацевтического ингредиента и HPMCAS в системе растворителей с образованием стабильной однофазной дисперсии, распылительную сушку полученного раствора в сушильной камере, сбор высушенных распылением частиц в контейнер для сбора продукта и проведения процесса вторичной сушки частиц. Изобретение позволяет усовершенствовать получение композиции, содержащей указанный активный фармацевтический ингредиент в аморфном состоянии, что, в свою очередь, обеспечивает улучшенную стабильность при переработке в готовую лекарственную форму и в процессе хранения, а также улучшает фармакокинетические характеристики. 11 з.п. ф-лы, 5 ил., 3 табл., 1 пр.
Реферат
УРОВЕНЬ ТЕХНИКИ
Ингибитор обратной транскриптазы (RT) 3-хлор-5-({1-[(4-метил-5-оксо-4,5-дигидро-1H-1,2,4-триазол-3-ил)метил]-2-оксо-4-(трифторметил)-1,2-дигидропиридин-3-ил}окси)бензонитрил (обозначен в изобретении как "соединение A") и способы его получения раскрыты в патентном документе WO №2011/120133 A1, опубл. 6 октября 2011 г., и в патенте США №8486975, выданном 16 июля 2013 г., содержания которых включено в изобретение путем ссылки на них.
Известно, что соединение A существует, по меньшей мере, в трех кристаллических формах, а именно форме I, форме II и форме III. Кристаллическое безводное соединение A имеет низкую растворимость и недостаточную биодоступность. Растворимость наиболее стабильной безводной кристаллической формы соединения A в воде и в смоделированном желудочном соке натощак составляет 6,3 мкг/мл. При дозе 100 мг для растворения соединения необходимо >37 л воды.
Известно много способов повышения биодоступности плохорастворимых лекарственных средств. Для облегчения абсорбции перорального лекарственного средства могут быть использованы композиции, которые позволяют достигать перенасыщения лекарственного средства и/или быстрого растворения. Композиции, которые позволяют достигать перенасыщения лекарственного средства и/или быстрого растворения, включают, но этим не ограничивая, использование систем в форме наночастиц, аморфных систем, твердых растворов, твердых дисперсий и липидных систем. В технике известны такие композиции и методы их получения. Например, твердые дисперсии могут быть получены с использованием вспомогательных веществ и методов, описанных в обзорах, например, A.T.M. Serajuddin, J Pharm Sci, 88:10, pp. 1058-1066 (1999). Системы в форме наночастиц, полученные как в результате истирания, так и прямым синтезом, также описаны в обзорах, таких как F. Kesisoglou, S. Panmai, Y. Wu, Advanced Drug Delivery Reviews, 59:7 pp 631-644 (2007). Аморфные лекарственные средства, диспергированные в полимере, могут быть приготовлены различными методами, такими как распылительная сушка или экструзия горячего расплава. Экструзия смесей лекарственное средство/полимер описана, например, в патентных документах DE-A-1224829, EP-A-204596 и в публикации P. Speiser, Pharmaceutica Acta Helv, 41 (1966), pp. 340.
Кроме того, соединения обычно могут различаться по их предрасположенности к кристаллизации. Соединение A является сильным кристаллообразователем, то есть оно имеет тенденцию очень легко кристаллизоваться и, поэтому, его трудно сохранять в аморфном состоянии. В результате, соединение A может, к сожалению, легко превращаться в кристаллическую форму при обычных условиях переработки, в силу чего возникает необходимость в создании условий переработки, которые бы снижали вероятность такого превращения или исключали его.
Настоящее изобретение относится к композиции, включающей соединение A в увеличивающем концентрацию полимере, и к способам сушки, включающим способы распылительной сушки, для получения указанной композиции, которая позволяет сохранять соединение A в аморфной форме. Композиции и способы настоящего изобретения значительно повышают биодоступность соединения A при сохранении физической стабильности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение включает в себя композицию, содержащую ингибитор обратной транскриптазы ("RT") 3-хлор-5-({1-[(4-метил-5-оксо-4,5-дигидро-1H-1,2,4-триазол-3-ил)метил]-2-оксо-4-(три-фторметил)-1,2-дигидропиридин-3-ил}окси)бензонитрил (соединение A), смешанный в соответствующем количестве с увеличивающим концентрацию полимером, и способы ее приготовления. Композиция и способы настоящего изобретения значительно повышают биодоступность упомянутого выше ингибитора RT при сохранении физической стабильности.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 показано, что в случае использования условий обработки в распылительной сушилке, позволяющих достигать температуры стеклования, превышающей на 20°C температуру хранения, ни в одном из случаев не обнаруживали кристаллическое состояние. Однако, когда разница составляла меньше 20°C, кристаллическое состояние обнаруживали за это время в 67% случаях. Когда разница составляла менее чем 5°C, кристаллическое состояние обнаруживали за это время в 100% случаев.
На фигуре 2 показаны профили растворения фармацевтических композиций, включающих аморфную твердую дисперсию, содержащую 20% лекарственного средства соединения A и увеличивающий концентрацию полимер HPMCAS, и композиции, включающей микронизированное кристаллическое лекарственное средство соединение A, физически смешанное с поверхностно-активным веществом и другими традиционными фармацевтическими вспомогательными веществами. Исследование растворимости проводили на установке для определения скорости растворения USP II со скоростью вращения лопастной мешалки 100 оборотов в минуту. В эксперименте с неуменьшающейся скоростью растворения использовали заданную концентрацию 0,2 мг/мл в среде смоделированного желудочного сока натощак.
На фигуре 3 приведена диаграмма разброса данных, демонстрирующая сильную корреляцию между насыпной плотностью высушенной распылением дисперсии и прочностью при растяжении брикетов чистого высушенного распылением промежуточного продукта (SDI). "Высушенный распылением промежуточный продукт" обозначает высушенную распылением композицию соединения A и HPMCAS перед таблетированием.
На фигуре 4 приведена диаграмма разброса данных, демонстрирующая сильную корреляцию между насыпной плотностью высушенной распылением дисперсии и прочностью при растяжении брикетов, полученных из конечных композиций (уплотненных перед вальцеванием).
На фигуре 5 приведены изображения дефектов в таблетке для композиций соединения A, образованных из высушенных распылением дисперсий, распыленных из растворителя X и обладающих насыпной плотностью > 0,25 г/см3 при обоснованных с коммерческой точки зрения скоростях уплотнения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение предлагает композиции, включающие ингибитор RT 3-хлор-5-({1-[(4-метил-5-оксо-4,5-дигидро-1H-1,2,4-триазол-3-ил)метил]-2-оксо-4-(трифторметил)-1,2-дигидропиридин-3-ил}окси)-бензонитрил, и способы их получения. Композиция и способы настоящего изобретения значительно повышают биодоступность упомянутого выше ингибитора RT при сохранении физической стабильности продукта в течение срока годности.
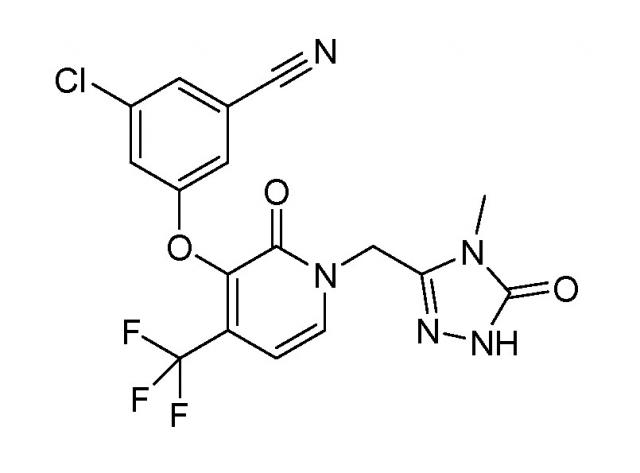
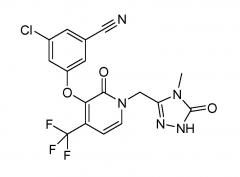
Для целей этого изобретения, обозначение "соединение A" относится к соединению, имеющему химическое название 3-хлор-5-({1-[(4-метил-5-оксо-4,5-дигидро-1H-1,2,4-триазол-3-ил)метил]-2-оксо-4-(трифторметил)-1,2-дигидропиридин-3-ил}окси)бензонитрил и следующую химическую формулу
Получение соединения A и его способность ингибировать ВИЧ обратную транскриптазу описаны в патентном документе WO №2011/120133 A1, опубл. 6 октября 2011 г., и в патенте США №8486975, выданном 16 июля 2013 г., содержание которых включено в изобретение путем ссылки на них. Соединение A применяют для лечения заражений вирусом иммунодефицита человека у людей. Известно, что соединение A существует в трех кристаллических безводных формах, обозначаемых как форма I, форма II и форма III, и в аморфной форме.
Хорошо известно, что тенденция к кристаллизации сильно зависит от природы активных фармацевтических ингредиентов (Journal of Pharmaceutical Sciences, Vol. 99, N9, September 2010), а скорость кристаллизации является функцией термодинамических движущих сил и мобильности системы (Angell, C.A., Formation of Glasses from Liquids and Biopolymers. Science, 1995. 267(5206): p. 1924-1935. Mullin, J.W., Crystallization. 4th ed. 2001, Oxford: Reed Educational and Professional Publishing Ltd. Hoffman, J.D., Thermodynamic Driving Force in Nucleation and Growth Processes. Journal of Chemical Physics, 1958. 29(5): p. 1192-1193. Adam, G. and Gibbs, J.H., On Temperature Dependence of Cooperative Relaxation Properties in Glass-Forming Liquids. Journal of Chemical Physics, 1965. 43(1): p. 139-146. Ediger, M.D., Supercooled liquids and glasses. Journal of Physical Chemistry, 1996. 100(31): p. 13200-13212.). Было обнаружено, что соединение A легко кристаллизуется в отсутствии полимера и имеет высокую температуру плавления 286°C. Чистое аморфное лекарственное средство, полученное распылительной сушкой, кристаллизуется в течение 2 недель при хранении в открытом контейнере при 5°C и относительной влажности окружающей среды (RH), при 30°C и 65% RH, при 40°C и 75% RH, и при 60°C и RH окружающей среды.
При наличии способа, который позволяет выделять аморфный материал, для сохранения материала в аморфном состоянии требуется иммобилизация молекул. Температура стеклования (Tg) представляет меру измерения мобильности. В частности, молекулы имеют высокую мобильность при температуре выше температуры стеклования и низкую мобильность при температуре ниже температуры стеклования. В результате, в случаях, когда возможно получение аморфного материала, вероятность протекания кристаллизации при температуре ниже температуры стеклования является значительно меньшей, чем при температуре выше температуры стеклования. Для чистых аморфных лекарственных средств, было сделано предположение, что кристаллизацию можно предотвратить, если поддерживать температуру на 50°C ниже температуры стеклования (Hancock et al, Pharmaceutical Research, 12:6, pp 799-806 (1995)). В присутствии ингибитора кристаллизации, в настоящий момент однозначно не ясно, как определить температуру, ниже которой можно предотвратить протекание кристаллизации. Широко представленные в научной литературе исследования, в которых пытаются предсказать тенденцию к кристаллизации аморфных твердых дисперсий, подтверждают, что изученность таких систем является недостаточной. Задачи получения аморфной твердой дисперсии и определения условий, при которых достигается сохранение аморфных материалов (предотвращение кристаллизации) не являются очевидными или легко предсказуемыми, и они требуют проведения экспериментальных проверок и разработки технических решений.
Исследования по стабильности соединения A позволило сделать предположение о вероятности протекания кристаллизации лекарственного средства в течение срока годности продукта при относительно высоком содержании лекарственного средства, обнаруживаемую методом порошкового рентгеноструктурного анализа с пределом обнаружения порядка 5 мас.% в расчете на активный фармакологический ингредиент (API), что составляет 0,5 мас.% от массы композиции. Кристаллизация может в результате приводить к более низкой биодоступности. Кроме того, на концентрацию лекарственного средства в композиции накладывались дополнительные ограничения, связанные с сохранением физической стабильности продукта в процессе его переработки. А именно, полученное лекарственное средство подвергалось значительному пластифицированию (то есть значительно понижалось Tg) после распылительной сушки, вследствие присутствия остаточного растворителя перед завершением стадии вторичной сушки. Стадия вторичной сушки дополнительно описана ниже. В частности, перед вторичной сушкой измеряли температуру стеклования для нескольких высушенных распылением материалов. На протяжении всего времени разработки способа, образцы отбирали из контейнера для сбора продукта установки для распылительной сушки ("контейнер для сбора продукта"), помещали их в герметизируемую кювету для дифференциальной сканирующей калориметрии и определяли температуру стеклования. Кроме того, образцы из этой же установки для распылительной сушки плотно упаковывали во флаконы и герметизировали, для того чтобы исключить потерю растворителя из флакона. Флаконы затем хранили при заданных температурах и постоянно проводили анализ на кристалличность в различные моменты времени вплоть до 48 ч. Временной интервал в 48 ч представляет реальную продолжительность технологической операции от момента попадания высушенного распылением порошка в контейнер для сбора продукта до момента поступления продукта на стадию вторичной сушки. Кристаллизацию соединения A ни разу не обнаруживали, если разница между измеренной температурой стеклования и температурой хранения составляла более чем 20°C, то есть, если измеренная Tg была выше температуры хранения больше чем приблизительно на 20°C. В отличие от этого, если разница между измеренной температурой стеклования и температурой на выходе составляла менее чем 20°C, то есть, если измеренная Tg была выше температуры хранения меньше чем приблизительно на 20°C, кристаллизацию обнаруживали за это время у 67% образцов. Кроме того, если разница между измеренной температурой стеклования и температурой на выходе составляла менее чем 5°C, то есть, если измеренная Tg была выше температуры хранения меньше чем приблизительно на 5°C, кристаллизацию обнаруживали за это время у 100% образцов. Смотрите фигуру 1. Было выявлено, как это проиллюстрировано в примерах, что любой параметр условий переработки (отношение жидкости к газу, размер капель, температура газа на входе, относительное насыщение и другие подобные параметры), который приводил к получению высушенного распылением материала с достаточным количеством остаточного растворителя, характеризующегося температурой стеклования выше температуры хранения меньше чем на 20°C, приводил к возникновению существенной вероятности кристаллизации соединения A. Это наблюдение находится в противоречии с композициями некоторых соединений, которые можно хранить при температуре ниже температуры стеклования композиции, и которые не кристаллизуются в течение временного интервала в 48 ч. Это также противоречит эвристическому подходу, господствующему в области разработки фармацевтических средств, согласно которому, для предотвращения кристаллизации композиция должна храниться при температуре, по меньшей мере, на 50°C выше ее температуры стеклования (например, Hancock et al, Pharmaceutical Research, 12:6, pp 799-806 (1995)). Температура хранения может быть определена как максимальная температура, воздействию которой подвергается высушенный распылением порошок (называемый также частицами) от момента его попадания в контейнер для сбора продукта установки для распылительной сушки до момента его подачи на стадию вторичной сушки. Продукт с минимальной степенью вероятности кристаллизации может быть получен, если разница между измеренной температурой стеклования и температурой хранения превышает 20°C, то есть, если измеренная Tg выше температуры хранения более чем приблизительно на 20°C. Настоящее изобретение охватывает композиции и способы, которые значительно повышают биодоступность соединения A, сохраняя при этом физическую стабильность продукта в течение его срока годности.
Для снижения содержания остаточного растворителя в продукте, выходящем из установки для распылительной сушки с целью увеличения Tg таких частиц, можно использовать модификацию условий процесса. Примеры таких модификаций включают, но этим не ограничивая, повышение температуры сушильного газа, уменьшение отношения жидкости к газу в подаваемом сырье, понижение температуры конденсатора и/или уменьшение размера капель. В качестве варианта, может быть уменьшена температура хранения.
В первом варианте осуществления, изобретение предлагает композицию, включающую активный фармацевтический ингредиент ("API"), который представляет собой соединение А или его фармацевтически приемлемую соль, смешанный в соответствующем количестве с увеличивающим концентрацию полимером и, необязательно, одним или более поверхностно-активными веществами, где композиция проявляет измеренную нестационарную концентрацию при избытке любой из кристаллических форм активного фармацевтического ингредиента в любой среде на основе воды. Термин "смешанный в соответствующем количестве" означает, что полученная многокомпонентная система не имеет значительной кристалличности, определяемой методом порошкового рентгеноструктурного анализа с пределом обнаружения порядка 5 мас.% по API в конечном продукте лекарственного средства. Описанные варианты осуществления изобретения также охватывают композиции и способы, где API представляет собой соединение А (нейтральные формы).
Термин "увеличивающий концентрацию полимер" обозначает полимер, который образует аморфную дисперсию с API, таким как соединение А, которое нерастворимо или полностью нерастворимо в воде, путем (a) растворения API или (b) взаимодействия с API таким образом, что API не образует кристаллы или кристаллические области в полимере. Увеличивающий концентрацию полимер является водорастворимым или легко диспергируемым в воде, поэтому, когда полимер помещают в воду или водную среду, также называемую в изобретении средой на основе воды (например, жидкости в желудочно-кишечном (GI) тракте или смоделированные жидкости GI), растворимость и/или биодоступность API становится выше растворимости или биодоступности кристаллического API в отсутствии полимера.
Один класс полимеров, которые могут быть применены в настоящем изобретении, включает способные к ионизации полимеры не на основе целлюлозы. Примеры полимеров включают виниловые полимеры, функционализированные карбоновой кислотой, такие как функционализированные карбоновой кислотой полиметакрилаты и функционализированные карбоновой кислотой полиакрилаты, такие как сополимеры EUDRAGITS, производимые фирмой Evonik Industries, Hanau-Wolfgang, Germany; функционализированные амином полиакрилаты и полиметакрилаты; белки; и функционализированные карбоновой кислотой крахмалы, такие как гликолят крахмала. Увеличивающие концентрацию полимеры могут также представлять собой полимеры не на основе целлюлозы, которые являются амфифильными и которые являются сополимерами относительно гидрофильного и относительно гидрофобного мономера. Примеры включают упомянутые выше сополимеры акрилата и метакрилата (EUDRAGITS). Другими примерами амфифильных полимеров являются блок-сополимеры оксида этилена (или гликоля) и оксида пропилена (или гликоля), где звенья олигомерного полипропиленгликоля являются относительно гидрофобными, а звенья полиэтиленгликоля являются относительно гидрофильными. Эти полимеры обычно продают под торговой маркой POLOXAMER®.
Другой класс полимеров включает способные к ионизации и нейтральные полимеры целлюлозы, по меньшей мере, с одним присоединенным через простой эфир и/или сложный эфир заместителем, в которых полимер имеет степень замещения, по меньшей мере, 0,1 для каждого заместителя. В соответствии с используемой в изобретении номенклатурой, присоединенные через простой эфир заместители указываются перед "целлюлозой" в виде фрагмента, присоединенного к главной цепи целлюлозы с помощью эфирной связи; например, "этоксибензойная кислота-целлюлоза" имеет заместители из этоксибензойной кислоты на главной цепи целлюлозы. Аналогично, присоединенные через сложный эфир заместители указываются после "целлюлозы" в виде карбоксилата; например, "целлюлозы фталат" имеет одну карбоновую кислоту из каждого фталатного фрагмента, соединенного через сложный эфир с полимером, при этом другие группы карбоновой кислоты из фталатной группы остаются в виде группы свободной карбоновой кислоты.
Следует также отметить, что название полимера, такое как "ацетатфталат целлюлозы" (CAP), относится к любому полимеру из семейства полимеров целлюлозы, который имеет ацетатные и фталатные группы, присоединенные через эфирные связи к значительной доле гидроксильных групп полимера целлюлозы. Обычно, степень замещения каждой замещающей группы может составлять от 0,1 до 2,9 при условии, что соблюдаются другие критерии для полимера. "Степень замещения" означает среднее число трех гидроксилов, отнесенное к одному повторяющемуся звену сахарида на цепи целлюлозы, на которой было осуществлено замещение. Например, если все гидроксилы на цепи целлюлозы были замешены на фталат, то степень фталатного замещения составляет 3.
Кроме того, каждый тип семейства полимеров включает полимеры целлюлозы, которые имеют дополнительные заместители, добавленные в относительно небольших количествах, которые существенно не изменяют характеристики полимера. Амфифильные полимеры целлюлозы могут быть получены путем замещения целлюлозы по любому или по всем 3 гидроксильным заместителям, присутствующим на каждом повторяющимся звене сахарида с помощью, по меньшей мере, одного относительно гидрофобного заместителя. Гидрофобные заместители могут представлять собой практически любой заместитель, который, в случае замещения при достаточно высоком уровне или степени замещения, может придавать полимеру целлюлозы свойство практически не растворяться в воде. Гидрофильные области полимера могут представлять собой или те его части, которые являются относительно незамещенными, так как незамещенные гидроксилы являются сами по себе относительно гидрофильными, или те области, которые замещены с помощью гидрофильных заместителей. Примеры гидрофобных заместителей включают присоединенные через простой эфир алкильные группы, такие как метил, этил, пропил, бутил и другие подобные, или присоединенные через сложный эфир алкильные группы, такие как ацетат, пропионат, бутират и другие подобные, и присоединенные через простой эфир и/или сложный эфир арильные группы, такие как фенил, бензоат или фенилат. Гидрофильные группы включают присоединенные через простой эфир и/или сложный эфир неспособные к ионизации группы, такие как гидроксиалкильные заместители гидроксиэтил, гидроксипропил, и алкилэфирные группы, такие как этоксиэтокси или метоксиэтокси. Гидрофильные заместители включают заместители, которые представляют собой присоединенные через простой эфир и/или сложный эфир способные к ионизации группы, такие как карбоновые кислоты, тиокарбоновые кислоты, замещенные феноксильные группы, амины, фосфаты или сульфонаты.
Один класс полимеров целлюлозы включает нейтральные полимеры, то есть полимеры, которые практически неспособны к ионизации в водном растворе. Такие полимеры содержат неспособные к ионизации заместители, которые могут быть присоединены или через простой эфир, или через сложный эфир. Примеры присоединенных через простой эфир неспособных к ионизации заместителей включают алкильные группы, такие как метил, этил, пропил, бутил и другие подобные; гидроксиалкильные группы, такие как гидроксиметил, гидроксиэтил, гидроксипропил и другие подобные; и арильные группы, такие как фенил. Примеры присоединенных через сложный эфир неспособных к ионизации заместителей включают алкильные группы, такие как ацетат, пропионат, бутират и другие подобные; и арильные группы, такие как фенилат. Однако, в случае введения арильных групп, может появиться необходимость в том, чтобы полимер включал достаточное количество гидрофильного заместителя, для того чтобы полимер имел, по меньшей мере, некоторую растворимость в воде при любом физиологически значимом значении pH от 1 до 8.
Примеры неспособных к ионизации полимеров, которые могут быть использованы в качестве полимера, включают ацетат гидроксипропилметилцеллюлозы, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, метилцеллюлозу, гидроксиэтилметил- целлюлозу, ацетат гидроксиэтилцеллюлозы и гидроксиэтилэтил- целлюлозу.
В варианте осуществления, нейтральные полимеры целлюлозы представляют собой полимеры, которые являются амфифильными. Примеры полимеров включают гидроксипропилметилцеллюлозу и ацетат гидроксипропилцеллюлозы, где повторяющиеся звенья целлюлозы, которые имеют относительно высокое число метильных или ацетатных заместителей по сравнению с незамещенными гидроксильными или гидроксипропильными заместителями, формируют гидрофобные области относительно других повторяющихся звеньев полимера.
Вариант осуществления полимеров целлюлозы включает полимеры, которые, по меньшей мере, частично, способны к ионизации при физиологически значимом значении pH и включают, по меньшей мере, один способный к ионизации заместитель, который может присоединен или через простой эфир, или через сложный эфир. Примеры присоединенных через простой эфир способных к ионизации заместителей включают карбоновые кислоты, такие как уксусная кислота, пропионовая кислота, бензойная кислота, салициловая кислота, алкоксибензойные кислоты, такие как этоксибензойная кислота или пропоксибензойная кислота, различные изомеры алкоксифталевой кислоты, такие как этоксифталевая кислота и этоксиизофталевая кислота, различные изомеры алкоксиникотиновой кислоты, такие как этоксиникотиновая кислота, и различные изомеры пиколиновой кислоты, такие как этоксипиколиновая кислота и другие подобные; тиокарбоновые кислоты, такие как 5-тиоуксусная кислота; замещенные феноксильные группы, такие как гидроксифенокси и другие подобные; амины, такие как аминоэтокси, диэтиламиноэтокси, триметиламиноэтокси и другие подобные; фосфаты, такие как фосфатэтокси; и сульфонаты, такие как сульфонатэтокси. Примеры присоединенных через простой эфир способных к ионизации заместителей включают карбоновые кислоты, такие как сукцинат, цитрат, фталат, терефталат, изофталат, тримеллитат, и различные изомеры пиридиндикарбоновой кислоты и другие подобные; тиокарбоновые кислоты, такие как тиосукцинат; замещенные феноксильные группы, такие как аминосалициловая кислота; амины, такие как природные или синтетические аминокислоты, такие как аланин или фенилаланин; фосфаты, такие как ацетилфосфат; и сульфонаты, такие как ацетилсульфонат. В случае полимеров, замещенных с помощью ароматических соединений, для того чтобы также иметь требуемую растворимость в воде, также желательно, чтобы к полимеру были присоединены достаточно гидрофильные группы, такие как гидроксипропильные или функциональные группы карбоновой кислоты, для того чтобы придать полимеру свойство растворимости в воде, по меньшей мере, при значениях pH, при которых любые способные к ионизации группы являются ионизированными. В некоторых случаях, ароматическая группа может быть сама по себе способной к ионизации, такая как фталат или тримеллитатные заместители.
Примеры полимеров целлюлозы, которые, по меньшей мере, частично ионизированы при физиологически значимых значениях pH, включают ацетатсукцинат гидроксипропилметилцеллюлозы, сукцинат гидроксипропилметилцеллюлозы, ацетатсукцинат гидроксипропил- целлюлозы, сукцинат гидроксиэтилметилцеллюлозы, сукцинатацетат гидроксиэтилцеллюлозы, фталат гидроксипропилметилцеллюлозы, ацетатсукцинат гидроксиэтилметилцеллюлозы, ацетатфталат гидроксиэтилметилцеллюлозы, карбоксиэтилцеллюлозу, карбокси-метилцеллюлозу, ацетатфталат целлюлозы, ацетатфталат метилцеллюлозы, этилацетатфталат целлюлозы, ацетатфталат гидроксипропилцеллюлозы, ацетатфталат гидроксипропил- метилцеллюлозы, ацетатфталатсукцинат гидроксипропилцеллюлозы, ацетатсукцинатфталат гидроксипропилметилцеллюлозы, сукцинат- фталат гидроксипропилметилцеллюлозы, пропионатфталат целлюлозы, бутиратфталат гидроксипропилцеллюлозы, ацетаттримеллитат целлюлозы, ацетаттримеллитат метилцеллюлозы, ацетаттримеллитат этилцеллюлозы, ацетаттримеллитат гидроксипропилцеллюлозы, ацетаттримеллитат гидроксипропилметилцеллюлозы, ацетат-тримеллитатсукцинат гидроксипропилцеллюлозы, пропионат- тримеллитат целлюлозы, бутираттримеллитат целлюлозы, ацетаттерефталат целлюлозы, ацетатизофталат целлюлозы, ацетат- пиридиндикарбоксилат целлюлозы, ацетат (салициловая кислота)- целлюлозы, ацетат (салициловая кислота)гидроксипропилцеллюлозы, ацетат (этилбензойная кислота)целлюлозы, ацетат (этилбензойная кислота)гидроксипропилцеллюлозы, ацетат (фталевая кислота)этил- целлюлозы, ацетат (никотиновая кислота)этилцеллюлозы и ацетат (пиколиновая кислота)этилцеллюлозы.
Примеры полимеров целлюлозы, которые подпадают под определение амфифильных, имеющих гидрофильные и гидрофобные области, включают такие полимеры, как ацетатфталат целлюлозы и ацетаттримеллитат целлюлозы, где целлюлозные повторные звенья, которые имеют один или более ацетатных заместителей, являются гидрофобными по сравнению со звеньями, которые не имеют ацетатных заместителей или имеют один или более ионизированных фталатных или тримеллитатных заместителей.
Подгруппа способных к ионизации полимеров целлюлозы включает полимеры, которые обладают, как функционализированным карбоновой кислотой ароматическим заместителем, так и алкилатным заместителем, и в силу этого являются амфифильными. Примеры полимеров включают ацетатфталат целлюлозы, ацетатфталат метилцеллюлозы, ацетатфталат этилцеллюлозы, ацетатфталат гидроксипропилцеллюлозы, фталат гидроксипропилметилцеллюлозы, ацетатфталат гидроксипропилметилцеллюлозы, ацетатфталатсукцинат гидроксипропилцеллюлозы, пропионатфталат целлюлозы, бутират- фталат гидроксипропилцеллюлозы, ацетаттримеллитат целлюлозы, ацетаттримеллитат метилцеллюлозы, ацетаттримеллитат этил- целлюлозы, ацетаттримеллитат гидроксипропилцеллюлозы, ацетаттримеллитат гидроксипропилметилцеллюлозы, сукцинат- ацетаттримеллитат гидроксипропилцеллюлозы, пропионаттримеллитат целлюлозы, бутираттримеллитат целлюлозы, ацетаттерефталат целлюлозы, ацетатизофталат целлюлозы, ацетатпиридин-дикарбоксилат целлюлозы, ацетат (салициловая кислота)целлюлозы, ацетат (салициловая кислота)гидроксипропилцеллюлозы, ацетат- (этилбензойная кислота)целлюлозы, ацетат (этилбензойная кислота)гидроксипропилцеллюлозы, ацетат (фталевая кислота)- этилцеллюлозы, ацетат (никотиновая кислота)этилцеллюлозы и ацетат (пиколиновая кислота)этилцеллюлозы.
Другая подгруппа способных к ионизации полимеров целлюлозы включает полимеры, которые обладают неароматическим карбоксилатным заместителем. Примеры полимеров включают ацетатсукцинат гидроксипропилметилцеллюлозы, сукцинат гидрокси-пропилметилцеллюлозы, ацетатсукцинат гидроксипропилцеллюлозы, ацетатсукцинат гидроксиэтилметилцеллюлозы, сукцинат гидрокси-этилметилцеллюлозы и ацетатсукцинат гидроксиэтилцеллюлозы.
Перечисленные выше самые разнообразные увеличивающие концентрацию полимеры могут быть использованы для образования аморфных дисперсий соединения А в соответствии с настоящим изобретением.
Композиции настоящего изобретения могут необязательно включать одно или более поверхностно-активных веществ, которые могут быть ионными или неионными поверхностно-активными веществами. Поверхностно-активные вещества могут увеличивать скорость растворения за счет облегчения смачивания, в результате чего увеличивается максимальная концентрация растворенного лекарственного средства. Поверхностно-активные вещества могут также способствовать более легкой переработке дисперсии. Поверхностно-активные вещества могут также стабилизировать аморфные дисперсии за счет замедления кристаллизации или осаждения лекарственного средства в результате взаимодействия с растворенным лекарственным средством в силу таких механизмов, как комплексообразование, образование комплексов включения, образование мицелл и адсорбция на поверхности твердого лекарственного средства. Подходящие поверхностно-активные вещества включают катионные, анионные и неионные поверхностно-активные вещества. Они включают, например, жирные кислоты и алкилсульфонаты; катионные поверхностно-активные вещества, такие как бензалкония хлорид (Hyamine 1622, фирмы Lonza, Inc., Fairlawn, New Jersey); анионные поверхностно-активные вещества, такие как диоктилсульфосукцинат натрия (Docusate Sodium, фирмы Mallinckrodt Spec. Chem., St. Louis, Missouri) и лаурилсульфат натрия (додецилсульфат натрия); эфиры жирных кислот и сорбитана (поверхностно-активные вещества серии SPAN); витамин Е токоферилполиэтиленгликольсукцинат; эфиры жирных кислот с полиоксиэтиленом и сорбитаном (поверхностно-активные вещества серии Tween фирмы ICI Americas Inc., Wilmington, Delaware); полиоксиэтиленовые касторовые масла и гидрированные касторовые масла, такие как Cremophor RH-40 и Cremopher EL; Liposorb P-20, фирмы Lipochem Inc., Patterson New Jersey; Capmul POE-0 фирмы Abitec Corp., Janesville, Wisconsin), и природные поверхностно-активные вещества, такие как натриевая соль таурохолевой кислоты, 1-польмитоил-2-олеолил-sn-глицеро-3-фосфохолин, лецитин и другие фосфолипиды и моно- и диглицериды.
Композиции настоящего изобретения могут необязательно включать другие вспомогательные вещества, такие как один или более разрыхлителей, разбавителей или скользящих веществ. Типичные разрыхлители могут включать кроскармеллозу натрия, крахмалгликолат натрия, кросповидон и крахмал. Типичные скользящие вещества могут включать диоксид кремния и тальк. Типичные смазывающие вещества могут включать стеарат магния, стеариновую кислоту и стеарилфумарат натрия. Типичные разбавители могут включать микрокристаллическую целлюлозу, лактозу и маннит.
Композиции настоящего изобретения получают с помощью методов, которые позволяют соединению (лекарственному средству) образовывать дисперсию (также называемую аморфной дисперсией, твердой дисперсией, твердым раствором или аморфной твердой дисперсией) в полимере, вследствие чего лекарственное средство обычно находится в аморфном состоянии. Дисперсии являются стабильными, и лекарственное средство не образует видимых невооруженным глазом кристаллов или других нерастворимых частиц. Такие методы включают методы растворения, такие как распылительная сушка, нанесение покрытия распылением, лиофилизация, и испарение сорастворителя под вакуумом или путем нагревания раствора полимера и лекарственного средства. Такие методы также включают методы, в которых смешивают твердое лекарственное средство с полимером в расплавленном состоянии, такие как экструзия горячего расплава, и методы компаундирования твердого нерасплавленного полимера и лекарственного средства при нагревании и приложения давления с образованием дисперсии. Могут также применяться методы осаждения (например, растворитель, антирастворитель).
Композиции, включающие увеличивающий концентрацию полимер, повышают концентрацию соединения А в водной среде, такой как вода, жидкость желудочно-кишечного (GI) тракта или смоделированная жидкость желудочно-кишечного (GI) тракта, приготовленная для in vitro лабораторных испытаний, по сравнению с контрольной композицией, включающей эквивалентное количество кристаллического соединения А без полимера. После введения композиции в водную среду, композиция, включающая увеличивающий концентрацию полимер и соединение А, обеспечивает создание более высокой максимальной концентрации в воде соединения А по сравнению с контрольной композицией, содержащей такую же концентрацию соединения А, но без увеличивающего концентрацию полимера. Для контроля, вместо полимера может быть использован инертный наполнитель, для того чтобы поддерживать ту же концентрацию соединения А, как и в композиции, включающей полимер. Смотрите фигуру 2.
Как показано далее в примерах, в исследовании in vivo фармакокинетики, в котором концентрацию соединения А измеряют как функцию от времени в крови или сыворотке после введения композиции испытуемому животному, композиции настоящего изобретения характеризуются площадью под кривой концентрация от времени (AUC) и максимальной концентрацией Cmax, которые больше чем эти показатели для контрольной композиции, включающей эквивалентное количество соединения без увеличивающего концентрацию полимера. Раскрытые в изобретении композиции характеризуются повышенной in vivo биодоступностью по сравнению с композициями, которые не содержат увеличивающего концентрацию полимера. Величина AUC для лекарственного средства и максимальная концентрация лекарственного средства в крови или сыворотке увеличивается при введении композиций пациенту.
Композиции соединения А и увеличивающего концентрацию полимера получают с помощью методов, которые позволяют достигать того, что, по меньшей мере, большая часть соединения А, по меньшей мере, предпочтительно, 95%, присутствует в аморфном состоянии относительно других морфологических форм соединения А. Эти методы включают механические процессы, такие как измельчение и экструзия; процессы плавления, такие как высокотемпературная гомогенизация, экструзия горячего расплава, гомогенизация, модифицированная растворителем, и процессы застывания расплава; и процессы в растворителе, в том числе процессы осаждения с помощью осадителя, нанесение покрытия распылением и распылительная сушка. Дисперсии настоящего изобретения могут быть получены любым из этих методов, и в варианте осуществления изобретения, соединение А в фармацевтической композиции является практически аморфным и практически гомогенно распределено в полимере. О