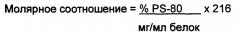Иммуногенная композиция против neisseria meningitidis (варианты)
Иллюстрации
Показать всеГруппа изобретений относится к иммунологии. Предложены иммуногенные композиции для индуцирования бактериального иммунного ответа у человека против штамма подсемейства А серологической группы В Neisseria meningitidis и против штамма подсемейства В серологической группы В Neisseria meningitidis. Композиция содержит эффективное количество первого N-терминально липидированного полипептида, содержащего аминокислотную последовательность, представленную SEQ ID NO: 1, и второго N-терминально липидированного полипептида, содержащего аминокислотную последовательность, представленную SEQ ID NO: 2. В одном варианте композиция пригодна для одновременного введения вместе с иммуногенной композицией против вируса папилломы человека. В другом варианте композиция пригодна для одновременного введения вместе с иммуногенной композицией против дифтерии, столбняка, коклюша и полиомиелита. Сильные иммунные ответы против вируса папилломы человека, дифтерии, столбняка, коклюша и полиомиелита генерировались после совместного введения композиции без негативного влияния на бактерицидный ответ против N. meningitidis. 2 н. и 2 з.п. ф-лы, 2 ил., 9 табл., 10 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает приоритет предварительной заявки на патент США номер заявки 61/875,068, поданной 8 сентября 2013, предварительной заявки на патент США номер заявки 61/926,717, поданной 13 января 2014, и предварительной заявки на патент США номер заявки 61/989,432, поданной 6 мая 2014, которые, таким образом, включены в данный документ в виде ссылки в соответствующей им полноте.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Представленное изобретение касается композиций Neisseria meningitidis и их способов.
УРОВЕНЬ ТЕХНИКИ
Neisseria meningitidis представляет собой грамотрицательную инкапсулированную бактерию, которая вызывает сепсис, менингит и смерть. N. meningitidis может быть классифицированным, по меньшей мере, на 12 серологических групп (включая серологические группы А, В, С, 29Е, Н, I, K, L, W-135, X, Y и Z), основанных на химически и антигенно-отличительных полисахаридных капсулах. Штаммы с пятью из серологических групп (А, В, С, Y, и W135) являются ответственными за большинство заболеваний.
Менингококовый менингит представляет собой тяжелое заболевание, которое может привести к смерти ребенка и молодого взрослого человека в пределах нескольких часов, несмотря на доступность антибиотиков. Существует необходимость в улучшенных иммуногенных композициях против менингококовых серологических групп А, В, С, Y и W135 и/или X.
В настоящее время, еще не существует коммерчески доступной перекрестной вакцины или композиции, эффективной против широкого спектра MnB изолятов. Например, последние опубликованные результаты, относящиеся к лицензированной многокомпонентной композиции для защиты от заболеваний серологической группы В, не продемонстрировали прямой бактерицидный иммунный ответ против нескольких штаммов, экспрессирующих гетерологичные LP2086 (fHBP) варианты, по меньшей мере, у подростков. В большинстве случаев, возникает впечатление, что последние опубликованные результаты, относящиеся к многокомпонентной композиции для защиты от заболеваний серологической группы В показывают иммуногенность против LP2086 (fHBP) вариантов, которые являются гомологичными варианту LP2086 (fHBP) в многокомпонентной композиции. Соответственно, необходимой является перекрестная вакцина или композиция, эффективная против разнообразных MnB изолятов, поскольку определяется реальный спектр действия вакцины против панели разнообразных или гетерологичных менингококовых штаммов (например, представляющих различные географические регионы).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Для удовлетворения этих и других потребностей, представленное изобретение касается Neisseria meningitidis композиций и их способов.
В одном аспекте, изобретение касается композиции, которая включает приблизительно 120 мкг/мл первого липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 1, 120 мкг/мл второго липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 2, с молярным соотношением полисорбата-80 к первому полипептиду - приблизительно 2,8, с молярным соотношением полисорбата-80 ко второму полипептиду - приблизительно 2,8, приблизительно 0,5 мг/мл алюминия, приблизительно 10 мМ гистидина, и приблизительно 150 мМ хлорида натрия. В одном варианте осуществления, первая доза составляет приблизительно 0,5 мл общего объема. В одном варианте осуществления, композиция индуцирует бактерицидный иммунный ответ против N. meningitidis серологической группы В. В одном варианте осуществления, композиция индуцирует бактерицидный иммунный ответ против N. meningitidis серологической группы А, С, 29Е, Н, I, K, L, W-135, X, Y или Z. В одном варианте осуществления, композиция, кроме того, не включает полипептид, имеющий меньше чем 100% идентичность последовательности к SEQ ID NO: 1. В одном варианте осуществления, композиция, кроме того, не включает полипептид, имеющий меньше, чем 100% идентичность последовательности к SEQ ID NO: 2. В одном варианте осуществления, первый полипептид имеет всего 258 аминокислот. В одном варианте осуществления, второй полипептид имеет всего 261 аминокислоту. В одном варианте осуществления, композиция индуцирует бактерицидный титр иммуноглобулина сыворотки, который является, по меньшей мере, в 2 раза выше у человека после получения первой дозы, чем бактерицидный титр иммуноглобулина сыворотки у человека до получения первой дозы, где увеличение бактерицидного титра измеряют при идентичных условиях в бактерицидном анализе сыворотки с использованием комплемента человека. В одном варианте осуществления, первый липидированный полипептид состоит из аминокислотной последовательности, представленной SEQ ID NO: 1. В одном варианте осуществления, второй липидированный полипептид состоит из аминокислотной последовательности представленной SEQ ID NO: 2.
В другом аспекте, изобретение касается способа индуцирования иммунного ответа против Neisseria meningitidis у человека. Способ включает введение человеку первой дозы и второй дозы эффективного количества композиции, где указанная композиция включает 120 мкг/мл первого липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 1, 120 мкг/мл второго липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 2, с молярным соотношением полисорбата-80 к первому полипептиду 2,8, с молярным соотношением полисорбата-80 ко второму полипептиду 2,8, 0,5 мг/мл алюминия, 10 мМ гистидина, и 150 мМ хлорида натрия. В одном варианте осуществления, доза композиции имеет общий объем 0,5 мл. В одном варианте осуществления, человеку вводят не больше, чем две дозы композиции. В одном варианте осуществления, человеку дополнительно не вводят ревакцинирующую дозу композиции. В одном варианте осуществления, человеку вводят третью дозу композиции. В одном варианте осуществления, человеку дополнительно не вводят ревакцинирующую дозу композиции после третьей дозы. В одном варианте осуществления, человеку дополнительно не вводят четвертую дозу композиции. В одном варианте осуществления, третью дозу вводят человеку в пределах периода приблизительно 6 месяцев после первой дозы. В одном варианте осуществления, вторую дозу вводят, по меньшей мере, через 30 дней после первой дозы. В одном варианте осуществления, способ дополнительно включает введение третьей дозы композиции, в котором третью дозу вводят, по меньшей мере, через 90 дней после второй дозы. В одном варианте осуществления, композиция индуцирует бактерицидный титр иммуноглобулина сыворотки, который является, по меньшей мере, в 2 раза выше у человека после введения первой дозы, чем бактерицидный титр иммуноглобулина сыворотки у человека до получения первой дозы, который определяют при идентичных условиях в бактерицидном анализе сыворотки с использованием комплемента человека. В одном варианте осуществления, иммунный ответ является бактерицидным против подсемейства А штамма N. meningitidis серологической группы В, которое является гетерологичным к штамму N. meningitidis, экспрессирующему А05. В одном варианте осуществления, иммунный ответ является бактерицидным против подсемейства В штамма N. meningitidis серологической группы В, которое является гетерологичным к штамму N. meningitidis, экспрессирующему В01. В одном варианте осуществления, иммунный ответ является бактерицидным против подсемейства А штамма N. meningitidis серологической группы В, которое является гетерологичным к штамму М98250771 N. meningitidis. В одном варианте осуществления, иммунный ответ является бактерицидный против подсемейства В штамма N. meningitidis серологической группы В, которое является гетерологичным к штамму CDC1127 N. meningitidis. В предпочтительном варианте осуществления, иммунный ответ является бактерицидным против подсемейства В штамма N. meningitidis серологической группы В, которое является гетерологичным к штамму CDC1573 N. meningitidis. В одном варианте осуществления, первый полипептид имеет всего 258 аминокислот. В одном варианте осуществления, второй полипептид имеет всего 261 аминокислоту. В одном варианте осуществления, первый липидированный полипептид состоит из аминокислотной последовательности, представленной SEQ ID NO: 1. В одном варианте осуществления, второй липидированный полипептид состоит из аминокислотной последовательности, представленной SEQ ID NO: 2.
В другом аспекте, изобретение касается композиции, которая включает 60 мкг первого липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 1, 60 мкг второго липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 2, с молярным соотношением полисорбата-80 к первому полипептиду 2,8, с молярным соотношением полисорбата-80 ко второму полипептиду 2,8, 0,5 мг/мл алюминия, 10 мМ гистидина, и 150 мМ хлорида натрия, где композиция имеет общий объем приблизительно 0,5 мл. В одном варианте осуществления, композиция индуцирует бактерицидный иммунный ответ против подсемейства А штамма N. meningitidis серологической группы В, которое является гетерологичным к штамму N. meningitidis, экспрессирующему А05. В одном варианте осуществления, композиция индуцирует бактерицидный иммунный ответ против подсемейства В штамма N. meningitidis серологической группы В, которое является гетерологичным к штамму N. meningitidis, экспрессирующему В01. В одном варианте осуществления, композиция индуцирует бактерицидный титр иммуноглобулина сыворотки, который является, по меньшей мере, в 2 раза выше у человека после введения первой дозы, чем бактерицидный титр иммуноглобулина сыворотки у человека до получения первой дозы, который определяют при идентичных условиях в бактерицидном анализе сыворотки с использованием комплемента человека. В одном варианте осуществления, композиция, кроме того, не включает полипептид, имеющий меньше, чем 100% идентичность последовательности к SEQ ID NO: 1. В одном варианте осуществления, композиция, кроме того, не включает полипептид, имеющий меньше, чем 100% идентичность последовательности к SEQ ID NO: 2. В одном варианте осуществления, первый полипептид имеет всего 258 аминокислот. В одном варианте осуществления, второй полипептид имеет всего 261 аминокислоту. В одном варианте осуществления, первый липидированный полипептид состоит из аминокислотной последовательности, представленной SEQ ID NO: 1. В одном варианте осуществления, второй липидированный полипептид состоит из аминокислотной последовательности, представленной SEQ ID NO: 2.
КОРОТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
ФИГ. 1 - Доля субъектов, достигающих титров hSBA ≥ LLOQ. hSBA = бактерицидный анализ сыворотки с использованием комплемента человека; LLOQ = нижний предел количественного определения.
ФИГ. 2 - Процент субъектов, достигающих 4х повышение титров hSBA к штаммам вспышки инфекции Принстонского университета и UCSB штаммам вспышки инфекции индивидуальных субъектов-людей после иммунизации rLP2086 (исследование В1971012 - описанное в примере 5, примере 6). Образцы сыворотки от девяти субъектов-людей, иммунизированных бивалентным rLP2086 в клиническом исследовании В1971012, оценивали в экспериментальной разработке hSBA с использованием MnB штаммов вспышки инфекции из Принстонского университета и из UCSB. Смотри пример 9.
ИДЕНТИФИКАТОРЫ ПОСЛЕДОВАТЕЛЬНОСТИ
SEQ ID NO: 1 представляет аминокислотную последовательность полипептидного антигена А05 варианта 2086, серологической группы В, рекомбинантного N. meningitidis.
SEQ ID NO: 2 представляет аминокислотную последовательность полипептидного антигена В01 варианта 2086, серологической группы В, рекомбинантного N. meningitidis.
SEQ ID NO: 3 представляет аминокислотные остатки в положениях 1-4 из SEQ ID NO: 1 и SEQ ID NO: 2.
SEQ ID NO: 4 представляет аминокислотную последовательность N-терминального полипептидного антигена (А05) LP2086 полипептида (rLP2086) подсемейства А рекомбинантного Neisserial.
SEQ ID NO: 5 представляет аминокислотную последовательность N-терминального полипептидного антигена (А05) полипептида LP2086 М98250771 подсемейства A Neisserial.
SEQ ID NO: 6 представляет аминокислотную последовательность для 2086 варианта В153, серологической группы В, N. meningitidis.
SEQ ID NO: 7 представляет аминокислотную последовательность для 2086 варианта А04, серологической группы В, N. meningitidis.
SEQ ID NO: 8 представляет аминокислотную последовательность для 2086 варианта А05, серологической группы В, N. meningitidis.
SEQ ID NO: 9 представляет аминокислотную последовательность для 2086 варианта А12, серологической группы В, N. meningitidis.
SEQ ID NO: 10 представляет аминокислотную последовательность для 2086 варианта А22, серологической группы В, N. meningitidis.
SEQ ID NO: 11 представляет аминокислотную последовательность для 2086 варианта В02, серологической группы В, N. meningitidis.
SEQ ID NO: 12 представляет аминокислотную последовательность для 2086 варианта В03, серологической группы В, N. meningitidis.
SEQ ID NO: 13 представляет аминокислотную последовательность для 2086 варианта В09, серологической группы В, N. meningitidis.
SEQ ID NO: 14 представляет аминокислотную последовательность для 2086 варианта В22, серологической группы В, N. meningitidis.
SEQ ID NO: 15 представляет аминокислотную последовательность для 2086 варианта В24, серологической группы В, N. meningitidis.
SEQ ID NO: 16 представляет аминокислотную последовательность для 2086 варианта В44, серологической группы В, N. meningitidis.
SEQ ID NO: 17 представляет аминокислотную последовательность для 2086 варианта В16, серологической группы В, N. meningitidis.
SEQ ID NO: 18 представляет аминокислотную последовательность для N. meningitidis, серологической группы В, 2086 варианта А07.
SEQ ID NO: 19 представляет аминокислотную последовательность для 2086 варианта А19, серологической группы В, N. meningitidis.
SEQ ID NO: 20 представляет аминокислотную последовательность для 2086 варианта А06, серологической группы В, N. meningitidis.
SEQ ID NO: 21 представляет аминокислотную последовательность для 2086 варианта А15, серологической группы В, N. meningitidis.
SEQ ID NO: 22 представляет аминокислотную последовательность для 2086 варианта А29, серологической группы В, N. meningitidis.
SEQ ID NO: 23 представляет аминокислотную последовательность для 2086 варианта В15, серологической группы В, N. meningitidis.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы представленного изобретения неожиданно обнаружили, что композиция включает первый липидированный полипептид, включающий аминокислотную последовательность, представленную SEQ ID NO: 1, и второй липидированный полипептид, включающую аминокислотную последовательность, представленную SEQ ID NO: 2. Композиция имеет приемлемый профиль безопастности у людей, и композиция неожиданно вызывает широко перекрестнореагирующий бактерицидный иммунный ответ у людей, по меньшей мере, против больше чем двух различных штаммов Neisseria meningitidis.
Авторы представленного изобретения, кроме того, обнаружили, что режим применения 2-мя дозами и режим применения 3-мя дозами неожиданно давали титры hSBA ≥ 8 против исследуемых штаммов из серологической группы В N. meningitidis, с вакциной гетерологичной LP2086 (фактор Н связывающий белок (fHBP)) подсемейства А и В у высокой доли субъектов- людей. Режим применения 3-мя дозами может обеспечивать самую широкую защиту у людей против различных MnB клинических штаммов, по сравнению с режимом применения 2-мя дозами.
Авторы представленного изобретения также неожиданно обнаружили, что сильные иммунные ответы против вируса папилломы человека и серологическая группа В N. meningitidis генерировались после совместного введения rLP2086 композиции и четырехвалентной иммуногенной композиции против вируса папилломы человека (HPV4). Например, совместное введение rLP2086 композиции и HPV4 композиции генерировало иммунный ответ, по меньшей мере, против исследуемых штаммов, экспрессирующих fHBP, серологической группы В N. meningitidis, которые являются гетерологичными к данным fHBP в rLP2086 композиции. Такие гетерологичные исследуемые штаммы включают немутантного типа штаммы серологической группы В N. meningitidis, которые экспрессируют А22 fHBP, А56 fHBP, В24 fHBP или В44 fHBP, каждый из которых является гетерологичным к fHBP в rLP2086 композиции. Смотри WO/2012/032489, WO/2013/132452, публикацию патента США номер US 20120093852 и публикацию патента США номер US 20130243807, которые описывают белки варианта fHBP, включающую А22 fHBP, А56 fHBP, В24 fHBP и В44 fHBP, среди других. Каждая из данных ссылок является включенной в виде ссылки во всей их полноте. Совместное введение также неожиданно генерировало иммунный ответ, по меньшей мере, против HPV типов 6, 11, 16 и/или 18. Иммунные ответы против HPV типов после совместного введения rLP2086 композиции и HPV4 композиции были не уступающими по сравнению с иммунным ответом, сгенерированным путем введения HPV4 композиции в отсутствие rLP2086 композиции.
Кроме того, авторы представленного изобретения неожиданно обнаружили, что сильные иммунные ответы против дифтерии, столбняка, коклюша и полиомиелита и серологической группы В N. meningitidis генерировались после совместного введения rLP2086 композиции и иммуногенной композиции против дифтерии, столбняка, коклюша и полиомиелита. Например, совместное введение rLP2086 композиции и REPEVAX композиции генерировало иммунный ответ, по меньшей мере, против исследуемых штаммов серологической группы В N. meningitidis, экспрессирующих fHBP, которые являются гетерологичными к данным fHBP в rLP2086 композиции. Совместное введение также неожиданно генерировало иммунный ответ, по меньшей мере, против 9 антигенов в REPEVAX: дифтерии, столбняк, коклюшный анатоксин, коклюшный филаментный гемагглютинин, коклюшный пертактин, коклюшный фимбриальный гемагглютинин типа 2+3, вирус полиомиелита типа 1, вирус полиомиелита типа 2, вирус полиомиелита типа 3. Иммунные ответы против REPEVAX антигенов после совместного введения rLP2086 композиции и REPEVAX композиции были не уступающими по сравнению с иммунным ответом, сгенерированным путем введения REPEVAX композиции в отсутствие rLP2086 композиции.
Более того, авторы представленного изобретения неожиданно обнаружили, что rLP2086 композиция индуцирует бактерицидный иммунный ответ против штамма ST409 N. meningitidis, который экспрессирует fHBP В153 вариант. Например, найдено, что штамм, экспрессирующий fHBP В153 вариант, был восприимчивым к уничтожению при контактировании с человеческой иммунной сывороткой с двухвалентной rLP2086 композицией, в бактерицидном анализе сыворотки с использованием комплемента человека (hSBA).
КОМПОЗИЦИЯ И ВАКЦИНА
В одном аспекте, изобретение касается композиции против Neisseria meningitidis. Композиция включает первый липидированный полипептид, имеющий аминокислотную последовательность, представленную SEQ ID NO: 1, и второй липидированный полипептид, имеющий аминокислотную последовательность, представленную SEQ ID NO: 2.
Авторы представленного изобретения неожиданно обнаружили один полипептидный компонент N. meningitidis, который индуцирует эффективный широко защитный иммунный ответ против многочисленных штаммов серологической группы В N. meningitidis. Соответственно, в одном варианте осуществления, композиция не включает слитый белок. В одном варианте осуществления, композиция не включает химерный белок. В одном варианте осуществления, композиция не включает гибридный белок. В одном варианте осуществления, композиция, кроме того, не включает пептидный фрагмент. В другом варианте осуществления, композиция, кроме того, не включает полипептид Neisserial, который не является fHBP. Например, в одном варианте осуществления, композиция не включает PorA белок. В другом варианте осуществления, композиция не включает NadA белок. В другом варианте осуществления, композиция кроме того, не включает связывающий гепарин антиген Neisserial (NHBA). В другом варианте осуществления, композиция, кроме того, не включает визикулу внешней мембраны Neisserial (OMV). В предпочтительном варианте осуществления, композиция, кроме того, не включает антигены, которые не являются первым полипептидом и вторым полипептидом.
В другом аспекте, авторы представленного изобретения неожиданно обнаружили, что полипептидные антигены, полученные не больше, чем из двух штаммов серологической группы В N. meningitidis, индуцируют эффективный широко защитный иммунный ответ против многочисленных штаммов серологической группы В N. meningitidis. Соответственно, в одном варианте осуществления, композиция, кроме того, не включает полипептид, который не получают из штамма М98250771 подсемейства А серологической группы В N. meningitidis и/или штамма CDC1573 подсемейства В серологической группы В N. meningitidis.
В одном варианте осуществления, композиция, кроме того, не включает полипептид, имеющий меньше чем 100% идентичность последовательности к SEQ ID NO: 1. В другом варианте осуществления, композиция, кроме того, не включает полипептид, имеющий меньше чем 100% идентичность последовательности к SEQ ID NO: 2. Например, композиция, кроме того, не включает полипептид, имеющий меньше чем 100% идентичность последовательности к полной длине SEQ ID NO: 1 и/или SEQ ID NO: 2.
В одном варианте осуществления, композиция дополнительно включает полисорбат-80, алюминий, гистидин и хлорид натрия. В одном варианте осуществления, композиция включает приблизительно 60 мкг первого липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 1, приблизительно 60 мкг второго липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 2, с молярным соотношением полисорбата-80 к каждому полипептиду - 2,8, 0,5 мг алюминия/мл в виде фосфата алюминия, 10 мМ гистидина, и 150 мМ хлорида натрия, где композиция предпочтительно имеет общий объем приблизительно 0,5 мл.
В другом аспекте, композиция включает приблизительно 120 мкг/мл первого липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 1, приблизительно 120 мкг/мл второго липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 2, с молярным соотношением полисорбата-80 к каждому полипептиду - 2,8, 0,5 мг алюминия/мл в виде фосфата алюминия, 10 мМ гистидина, и 150 мМ хлорида натрия.
В следующем аспекте, композиция включает а) 60 мкг первого липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 1; b) 60 мкг второго липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 2; с) 18 мкг полисорбата-80; d) 250 мкг алюминия; е) 780 мкг гистидина, и; f) 4380 мкг хлорида натрия.
В иллюстративном варианте осуществления, композиция включает приблизительно 60 мкг первого липидированного полипептида, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 1, приблизительно 60 мкг второго липидированного полипептида, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 2, с молярным соотношением полисорбата-80 к первому липидированному полипептиду и ко второму липидированному полипептиду - 2,8, 0,5 мг/мл фосфата алюминия, 10 мМ гистидина, и 150 мМ хлорида натрия, где композиция имеет общий объем приблизительно 0,5 мл. В иллюстративном варианте осуществления, композиция представляет собой стерильную изотоническую буферную жидкую суспензию. В иллюстративном варианте осуществления, композиция имеет рН 6,0. В иллюстративном варианте осуществления, первый полипептид и второй полипептид являются адсорбированными на алюминии.
В одном варианте осуществления, композиция имеет общий объем приблизительно 0,5 мл. В одном варианте осуществления, первая доза композиции имеет общий объем приблизительно 0,5 мл. "Первая доза" относится к дозе композиции, которую вводят в день 0. "Вторая доза" или "третья доза" относится к дозе композиции, которую вводят после первой дозы, которая может или не может составлять такое же количество, что и первая доза.
Композиция является иммуногенной после введения первой дозы человеку. В одном варианте осуществления, первая доза составляет приблизительно 0,5 мл в общем объеме.
Композиция индуцирует бактерицидный титр иммуноглобулина сыворотки, который является, по меньшей мере, больше чем в 1 раз выше, предпочтительно, по меньшей мере, в 2 раза выше, у человека после введения первой дозы, чем бактерицидный титр иммуноглобулина сыворотки у человека до получения первой дозы, при определении в идентичных условиях в бактерицидном анализе сыворотки с использованием комплемента человека (hSBA).
Бактерицидный титр или бактерицидный иммунный ответ является против серологической группы В N. meningitidis. В предпочтительном варианте осуществления, бактерицидный титр или бактерицидный иммунный ответ является против штамма подсемейства А серологической группы В N. meningitidis и против штамма подсемейства В серологической группы В N. meningitidis. Наиболее предпочтительно, бактерицидный титр или бактерицидный иммунный ответ является, по меньшей мере, против штамма В01, подсемейства В, серологической группы В, N. meningitidis.
В одном варианте осуществления, композиция индуцирует бактерицидный титр иммуноглобулина сыворотки, который является, по меньшей мере, больше чем в 1 раз, такой как, например, по меньшей мере 1,01 раз, 1,1 раз, 1,5 раза, 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз, 11 раз, 12 раз, 13 раз, 14 раз, 15 раз или 16 раз выше у человека после введения дозы композиции, чем бактерицидный титр иммуноглобулина сыворотки у человека до получения указанной дозы, при определении в идентичных условиях в бактерицидном анализе сыворотки с использованием комплемента человека.
В одном варианте осуществления, композиция представляет собой иммуногенную композицию. В одном варианте осуществления, композиция представляет собой иммуногенную композицию для человека. В другом варианте осуществления, композиция представляет собой вакцину. "Вакцина" относится к композиции, которая включает антиген, который содержит, по меньшей мере, один эпитоп, который индуцирует иммунный ответ, который является специфическим для такого антигена. Вакцина может быть введена непосредственно субъекту за счет подкожного, перорального, ороназального или интраназального путей введения. Предпочтительно, вакцину вводят внутримышечно. В одном варианте осуществления, композиция представляет собой вакцину для человека. В одном варианте осуществления, композиция представляет собой иммуногенную композицию против N. meningitidis.
В одном варианте осуществления, композиция представляет собой жидкую композицию. В предпочтительном варианте осуществления, композиция представляет собой жидкую суспензионную композицию. В другом предпочтительном варианте осуществления, композиция не является лиофилизированной.
ПЕРВЫЙ ПОЛИПЕПТИД
В одном варианте осуществления, композиция включает первый полипептид, имеющий аминокислотную последовательность, представленную SEQ ID NO: 1. В одном предпочтительном варианте осуществления, композиция включает приблизительно 60 мкг первого полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 1, где композиция предпочтительно имеет общий объем 0,5 мл. В другом варианте осуществления, композиция включает приблизительно 120 мкг/мл первого полипептид, включающего аминокислотную последовательность, представленную SEQ ID NO: 1. Полипептид представляет собой модифицированный фактор Н связывающий белок (fHBP) из штамма М98250771 N. meningitidis. Описание fHBP раскрывается в WO 2012032489 и публикации патента США US 2012/0093852, каждая из которых является включенной в виде ссылки во всей своей полноте. Полипептид представляет собой N-терминально липидированный тремя предоминирующими жирными кислотами С16:0, С16:1, и С18:1, ковалентно связанными в трех положениях полипептида. Первый полипептид включает всего 258 аминокислот.
Первый полипептид включает две модификации, введенные в N-терминальную область полипептида, по сравнению с соответствующим немутантным типом последовательности из штамма М98250771 N. meningitidis. Глицин во втором положении добавляют как последствие введения сайта клонирования. Вторая модификация включает делецию четырех аминокислот. Соответственно, в одном варианте осуществления, первый полипептид включает C-G-S-S последовательность (SEQ ID NO: 3) на N-конце. Смотри SEQ ID NO: 1, первые четыре аминокислотные остатки.
N-терминальные различия между первой полипептидной последовательностью и немутантным типом последовательности Neisserial показаны ниже. Соответственно, в одном варианте осуществления, первый полипептид включает, по меньшей мере, первый 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, или больше аминокислотных остатков аминокислотной последовательности, представленной SEQ ID NO: 1. Предпочтительно, первый полипептид включает, по меньшей мере, первые 4, более предпочтительно, по меньшей мере, первые 6, и наиболее предпочтительно, по меньшей мере, первые 8 аминокислотных остатков SEQ ID NO: 1.
Сравнение прогнозированных N-терминальных последовательностей рекомбинантного полипептида и полипептида LP2086 подсемейства A Neisserial
>А05 (SEQ ID NO: 1)
В одном варианте осуществления, первый полипептид включает аминокислотную последовательность, представленную SEQ ID NO: 1. В одном варианте осуществления, первый полипептид имеет всего 258 аминокислот. В одном варианте осуществления, первый полипептид не включает аминокислотную последовательность, имеющую меньше чем 100% идентичность последовательности к SEQ ID NO: 1. В другом варианте осуществления, первый полипептид состоит из аминокислотной последовательности, представленной SEQ ID NO: 1. В другом варианте осуществления, первый полипептид включает аминокислотную последовательность KDN. Смотри, например, аминокислотные остатки 73-75 из SEQ ID NO: 1. В другом варианте осуществления, первый полипептид включает аминокислотную последовательность, представленную SEQ ID NO: 3 на N-конце полипептида. В другом варианте осуществления, первый полипептид включает аминокислотную последовательность, представленную SEQ ID NO: 4 на N-конце полипептида.
В предпочтительном варианте осуществления, первый полипептид легко экспрессируется в рекомбинантной клетке-хозяине с использованием стандартных методик, известных в данной области с уровня техники. В другом предпочтительном варианте осуществления, первый полипептид включает бактерицидный эпитоп в N- и/или С-домене SEQ ID NO: 1. В одном варианте осуществления, первый полипептид включает, по меньшей мере, первые 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 аминокислотных остатков аминокислотной последовательности, представленной SEQ ID NO: 1. Предпочтительно, первый полипептид включает, по меньшей мере, первые 2, более предпочтительно, по меньшей мере, первые 4, и наиболее предпочтительно, по меньшей мере, первые 8 аминокислотных остатков SEQ ID NO: 1.
В другом варианте осуществления, первый полипептид включает, по меньшей мере, последние 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 аминокислотных остатков аминокислотной последовательности, представленной SEQ ID NO: 1.
ВТОРОЙ ПОЛИПЕПТИД
В одном варианте осуществления, композиция включает второй полипептид, имеющий аминокислотную последовательность, представленную SEQ ID NO: 2. В одном предпочтительном варианте осуществления, композиция включает приблизительно 60 мкг второго полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 2, где композиция предпочтительно имеет общий объем 0,5 мл. В другом варианте осуществления, композиция включает 120 мкг/мл второго полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 2. Полипептид представляет собой фактор Н связывающий белок (fHBP) из штамма CDC1573 N. meningitidis. Описание fHBP раскрывается в WO 2012032489 и публикации патента США US 2012/0093852, каждая из которых включена в виде ссылки во всей своей полноте. Полипептид представляет собой N-терминально липидированный тремя предоминирующими жирными кислотами С16:0, С16:1, и С18:1, ковалентно связанными в трех положениях полипептида. Второй полипептид включает всего 261 аминокислоту. В одном варианте осуществления, второй полипептид включает C-G-S-S последовательность (SEQ ID NO: 3) на N-конце. Смотри первые четыре аминокислотные остатки SEQ ID NO: 2.
>В01 (SEQ ID NO: 2)
В одном варианте осуществления, второй полипептид включает аминокислотную последовательность, представленную SEQ ID NO: 2. В одном варианте осуществления, второй полипептид имеет всего 261 аминокислоту. В одном варианте осуществления, второй полипептид состоит из аминокислотной последовательности, представленной SEQ ID NO: 2. В другом варианте осуществления, второй полипептид, кроме того, не включает полипептид, имеющий меньше чем 100% идентичность последовательности к SEQ ID NO: 2. В предпочтительном варианте осуществления, первый полипептид и второй полипептид включает C-G-S-S (SEQ ID NO: 3) последовательность на N-конце соответствующего полипептида.
В предпочтительном варианте осуществления, второй полипептид легко экспрессируется в рекомбинантной клетке-хозяине с использованием стандартных методик, известных в данной области с уровня техники. В другом предпочтительном варианте осуществления, второй полипептид включает бактерицидный эпитоп в N- и/или С-домене SEQ ID NO: 2. В одном варианте осуществления, второй полипептид включает, по меньшей мере, первые 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 аминокислотных остатков аминокислотной последовательности, представленной SEQ ID NO: 2. Предпочтительно, второй полипептид включает, по меньшей мере, первые 2, более предпочтительно, по меньшей мере, первые 4, или наиболее предпочтительно, по меньшей мере, первые 8 аминокислотных остатков из SEQ ID NO: 2.
В другом варианте осуществления, первый полипептид включает, по меньшей мере, последние 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 аминокислотных остатков аминокислотной последовательности, представленной SEQ ID NO: 2.
ПОЛИСОРБАТ-80
Полисорбат-80 (PS-80) представляет собой неионное поверхностно-активное вещество. Исследование ускоренной стабильности с использованием анализа эффективности in vitro на основе моноклонального антитела продемонстрировало нестабильность белка подсемейства В при более высоких молярных соотношениях PS-80 к MnB rLP2086 белку в конечном препарате. Дополниельные эксперименты с различными соотношениями PS-80 продемонстрировали, что оптимальное молярное соотношение PS-80 к MnB rLP2086 белку составляет приблизительно 2,8±1,4, чтобы поддерживать эффективность.
Концентрация PS-80 в композиции зависит от молярного соотношения PS-80 к полипептиду. В одном варианте осуществления, композиция включает молярное соотношение 2,8±1,4 PS-80 к первому полипептиду и ко второму полипептиду. В одном варианте осуществления, композиция включает молярное соотношение 2,8±1,1 PS-80 к первому полипептиду та ко второму полипептиду. В одном варианте осуществления, композиция включает молярное соотношение, по меньшей мере, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2 или 3,3 PS-80 к полипептиду. Предпочтительно, композиция включает молярное соотношение 2,8 PS-80 к полипептиду.
Молярное соотношение PS-80 к полипептиду определяют с помощью расчетов измеренной концентрации PS-80 и измеренной общей концентрации полипептида, в которых оба значения выражаются в молях. Например, молярное соотношение PS-80 к белку определяют с помощью расчетов измеренной концентрации PS-80 (например, с использованием обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ)) к измеренной общей концентрации белка (например, с использованием ионообменной высокоэффективной жидкостной хроматографии (ИО-ВЭЖХ)) в конечной субстанции лекарственного средства, где оба значения выражаются в молях.
ОФ-ВЭЖХ используют, чтобы количественно определить концентрацию полисорбата 80 в вакцинных препаратах. Концентрацию детергента определяют с помощью омыления фрагмента жирной кислоты; полисорбат 80 превращают в