Шаттл для гематоэнцефалического барьера
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к шаттлам для гематоэнцефалического барьера, что может быть использовано в медицине. Получают шаттл для гематоэнцефалического барьера, который связывается с рецептором трансферрина, содержит специфичный к нему scFab, линкер и эффекторный элемент для головного мозга, что используют в фармацевтических композициях для транспорта эффекторного элемента для головного мозга через гематоэнцефалический барьер. Изобретение позволяет эффективно использовать различные терапевтические средства для лечения нейродегенеративных нарушений, предпочтительно болезни Альцгеймера. 4 н. и 16 з.п. ф-лы, 16 ил., 2 табл., 11 пр.
Реферат
Настоящее изобретение относится к шаттлу для гематоэнцефалического барьера, который связывается с рецепторами на гематоэнцефалическом барьере (R/ГЭБ), и к способам его применения.
Предпосылки создания изобретения
Проникновение в головной мозг лекарственных средств для лечения неврологических нарушений, таких, например, как крупные биотерапевтические лекарственные средства и низкомолекулярные лекарственные средства, обладающие низкой способностью к проникновению в головной мозг, очень сильно ограничивается обширным и непроницаемым гематоэнцефалическим барьером (ГЭБ) наряду с другим клеточным компонентом в нейроваскулярной единице (НВЕ). Был протестирован целый ряд стратегий, предназначенных для преодоления указанного препятствия, одна из них заключается в использовании путей трансцитоза, опосредуемых эндогенными рецепторами, которые экспрессируются на эндотелии капилляров головного мозга. Были сконструированы рекомбинантные белки, такие как моноклональные антитела или пептиды, направленные к указанных рецепторам, для того, чтобы обеспечивать опосредуемую рецепторами доставку биотерапевтических лекарственных средств в головной мозг. Однако остаются неизученными стратегии, позволяющие максимизировать поглощение головным мозгом при минимизации ошибочной сортировки в эндотелиальных клетках головного мозга (ВЕС) и степень накопления в конкретных органеллах (прежде всего в органеллах, в которых происходит расщепление биотерапевтических лекарственных средств) в ВЕС.
Моноклональные антитела и другие биотерапевтические лекарственные средства обладают очень большим терапевтическим потенциалом в отношении лечения патологии центральной нервной системы (ЦНС). Однако ГЭБ препятствует их проникновению в головной мозг. В проведенных ранее исследованиях было продемонстрировано, что в компартмент ЦНС может проникать лишь очень низкий процент (примерно 0,1%) IgG, инъецированного в кровоток (Felgenhauer, Klin. Wschr. 52, 1974, сс. 1158-1164). Очевидно, что этот факт должен ограничивать любое фармакологическое действие вследствие низкой концентрации антитела в ЦНС.
Таким образом, существует необходимость в системах доставки лекарственных средств, предназначенных для лечения неврологических заболеваний, через ГЭБ, позволяющих эффективно транспортировать лекарственные средства в головной мозг.
Краткое изложение сущности изобретения
Первым объектом настоящего изобретения является шаттл, предназначенный для проникновения через гематоэнцефалический барьер (шаттл для гематоэнцефалического барьера), содержащий обладающий эффекторной функцией в отношении головного мозга элемент (эффекторный элемент для головного мозга), линкер и один одновалентный связывающий элемент, который связывается с рецептором гематоэнцефалического барьера, где линкер соединяет эффекторный элемент с одновалентным связывающим элементом, который связывается с рецептором гематоэнцефалического барьера.
В конкретном варианте шаттла для гематоэнцефалического барьера одновалентный связывающий элемент, который связывается с рецептором гематоэнцефалического барьера, выбран из группы, состоящей из белков, полипептидов и пептидов.
В конкретном варианте шаттла для гематоэнцефалического барьера одновалентный связывающий элемент, который связывается с рецептором гематоэнцефалического барьера, содержит молекулу, выбранную из группы, которая состоит из лиганда рецептора гематоэнцефалического барьера, scFv, Fv, sFab, VHH, предпочтительно sFab.
В конкретном варианте шаттла для гематоэнцефалического барьера рецептор гематоэнцефалического барьера выбран из группы, включающей рецептор трансферрина, рецептор инсулина, рецептор инсулинподобного фактора роста, белок 8, родственный рецептору липопротеинов низкой плотности, белок 1, родственный рецептору липопротеинов низкой плотности, и фактор роста, подобный гепаринсвязывающему эпидермальному фактору роста, предпочтительно он представляет собой рецептор трансферрина.
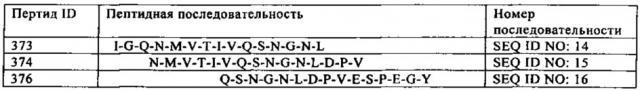
В конкретном варианте шаттла для гематоэнцефалического барьера одновалентный связывающий элемент, который связывается с рецептором гематоэнцефалического барьера, содержит один scFab, мишенью которого является рецептор трансферрина, более конкретно, scFab, который распознает эпитоп в рецепторе трансферрина, содержащийся в аминокислотной последовательности SEQ ID NO: 14, 15 или 16.
В конкретном варианте шаттла для гематоэнцефалического барьера эффекторный элемент для головного мозга выбирают из группы, включающей лекарственные средства для лечения неврологических нарушений, нейротропные факторы, факторы роста, ферменты, цитотоксические агенты, антитела, направленные к мишени в головном мозге, моноклональные антитела, направленные к мишени в головном мозге, пептиды, направленные к мишени в головном мозге.
В конкретном варианте шаттла для гематоэнцефалического барьера, мишень в головном мозге, выбрана из группы, состоящей из β-секретазы 1, Аβ, эпидермального фактора роста, рецептора эпидермального фактора роста 2, Tau, фосфорилированного Tau, аполипопротеина Е4, альфа-синуклеина, олигомерных фрагментов альфа-синуклеина, CD20, хантингтина, белка приона, содержащей богатый лейцином повтор киназы 2, паркина, пресенилина 2, гамма-секретазы, рецептора смерти 6, белка-предшественника амилоида, рецептора нейтрофина р75 и каспазы 6.
В конкретном варианте шаттла для гематоэнцефалического барьера эффекторный элемент для головного мозга выбирают из группы, состоящей из белков, полипептидов и пептидов.
В конкретном варианте шаттла для гематоэнцефалического барьера одновалентный связывающий элемент, который связывается с рецептором гематоэнцефалического барьера, выбран из группы, состоящей из белков, полипептидов и пептидов, и указанный одновалентный связывающий элемент соединен с С-концом эффекторного элемента для головного мозга с помощью линкера.
В конкретном варианте шаттла для гематоэнцефалического барьера эффекторный элемент для головного мозга содержит полноразмерное антитело, направленное к мишени в головном мозге, предпочтительно полноразмерный IgG.
В конкретном варианте шаттла для гематоэнцефалического барьера шаттл для гематоэнцефалического барьера содержит полноразмерное антитело IgG-типа в качестве эффекторного элемента для головного мозга, линкер и один scFab в качестве одновалентного связывающего элемента, который связывается с рецептором гематоэнцефалического барьера, где scFab соединен с помощью линкера с С-концом Fc-фрагмента одной из тяжелых цепей антитела IgG-типа.
В конкретном варианте шаттла для гематоэнцефалического барьера эффекторный элемент для головного мозга представляет собой полноразмерное антитело, направленное к Аβ.
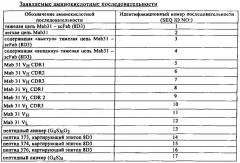
В конкретном варианте шаттла для гематоэнцефалического барьера антитело, направленное к Аβ, содержит (a) H-CDR1, содержащий аминокислотную последовательность SEQ ID NO: 5, (б) H-CDR2, содержащий аминокислотную последовательность SEQ ID NO: 6, (в) H-CDR3, содержащий аминокислотную последовательность SEQ ID NO: 7, (г) L-CDR1, содержащий аминокислотную последовательность SEQ ID NO: 8, (д) L-CDR2, содержащий аминокислотную последовательность SEQ ID NO: 9, и (е) L-CDR3, содержащий аминокислотную последовательность SEQ ID NO: 10.
В конкретном варианте шаттла для гематоэнцефалического барьера антитело, направленное к Абета содержит VH-домен, содержащий аминокислотную последовательность SEQ ID NO: 11, и VL-домен, содержащий аминокислотную последовательность SEQ ID NO: 12.
В конкретном варианте шаттла для гематоэнцефалического барьера эффекторный элемент представляет собой полноразмерное антитело, направленное к Аβ, и одновалентный связывающий элемент представляет собой scFab, направленный к рецептору трансферрина, более конкретно scFab, распознающий эпитоп в рецепторе трансферрина, содержащийся в аминокислотной последовательности SEQ ID NO: 14, 15 или 16.
В конкретном варианте шаттла для гематоэнцефалического барьера первая тяжелая цепь антитела, направленного к мишени в головном мозге, присутствующего в шаттле для проникновения через гематоэнцефалический барьер, содержит первый модуль димеризации, а вторая тяжелая цепь антитела, направленного к мишени в головном мозге, присутствующего в шаттле для гематоэнцефалического барьера, содержит второй модуль димеризации, что позволяет осуществлять гетеродимеризацию двух тяжелых цепей.
В конкретном варианте шаттла для гематоэнцефалического барьера первый модуль димеризации в первой тяжелой цепи антитела, направленного к мишени в головном мозге, которое присутствует в шаттле для гематоэнцефалического барьера, содержит «выступы», а модуль димеризации во второй тяжелой цепи антитела, направленного к мишени в головном мозге, которое присутствует в шаттле для гематоэнцефалического барьера, содержит «впадины» в соответствии со стратегией «knobs-into holes».
В конкретном варианте шаттла для гематоэнцефалического барьера эффекторный элемент представляет собой полноразмерное антитело, направленное к фосфорилированному Tau, и одновалентный связывающий элемент представляет собой один scFab, направленный к рецептору трансферрина.
В конкретном варианте шаттла для гематоэнцефалического барьера эффекторный элемент представляет собой полноразмерное антитело, направленное к альфа-синуклеину, и одновалентный связывающий элемент представляет собой один scFab, направленный к рецептору трансферрина.
В конкретном варианте шаттла для гематоэнцефалического барьера линкер представляет собой пептидный линкер, предпочтительно пептид, имеющий аминокислотную последовательность длиной по меньшей мере 25 аминокислот, более предпочтительно длиной от 30 до 50 аминокислот, указанный линкер представляет собой, прежде всего (G4S)6G2 или (G4S)4.
Представленные ниже три варианта осуществления изобретения относятся к шаттлу для гематоэнцефалического барьера, в котором эффекторный элемент для головного мозга представляет собой белок, полипептид или пептид при условии, что эффекторный элемент для головного мозга не представляет собой полноразмерное антитело, прежде всего полноразмерный IgG.
В конкретном варианте шаттла для гематоэнцефалического барьера одновалентный связывающий элемент, который связывается с рецептором гематоэнцефалического барьера, содержит СН2-СН3-домен Ig и один sFab, который связывается с рецептором гематоэнцефалического барьера, где sFab соединен с С-концом СН2-СН3-домена Ig с помощью второго линкера.
В конкретном варианте шаттла для гематоэнцефалического барьера шаттл для гематоэнцефалического барьера содержит эффекторный элемент для головного мозга, линкер, домен СН2-СН3 Ig, второй линкер и один sFab, который связывается с рецептором гематоэнцефалического барьера, где эффекторный элемент для головного мозга соединен с помощью первого линкера с N-концом СН2-СН3-домена Ig и sFab соединен с С-концом СН2-СН3-домена Ig с помощью второго линкер.
В конкретном варианте шаттла для гематоэнцефалического барьера СН2-СН3-домен Ig представляет собой СН2-СН3-домен IgG.
Кроме того, настоящее изобретение относится к выделенной нуклеиновой кислоте, кодирующей шаттл для гематоэнцефалического барьера, клетке-хозяину, содержащей выделенную нуклеиновую кислоту, кодирующую шаттл для гематоэнцефалического барьера, и фармацевтической композиции, содержащей шаттл для гематоэнцефалического барьера.
Шаттл для гематоэнцефалического барьера, предлагаемый в настоящем изобретении, можно применять в качестве лекарственного средства, прежде всего его можно применять для лечения неврологического нарушения, такого, например, как болезнь Альцгеймера.
Шаттл для гематоэнцефалического барьера, предлагаемый в настоящем изобретении, можно применять для того, чтобы транспортировать эффекторный элемент для головного мозга через гематоэнцефалический барьер.
В конкретном варианте осуществления изобретения тяжелая цепь антитела IgG-типа в шаттле для гематоэнцефалического барьера, предлагаемом в настоящем изобретении, соединенная на С-конце его Fc-фрагмента с scFab в качестве одновалентного связывающего элемента, который связывается с рецептором гематоэнцефалического барьера, имеет следующую структуру:
- тяжелая цепь IgG,
- линкер, соединяющий С-конец Fc-фрагмента тяжелой цепи IgG с N-концом VL-домена scFab,
- вариабельный домен легкой цепи (VL) и домен легкой С-каппа-цепи scFab,
- линкер, соединяющий С-конец домена легкой С-каппа цепи scFab с N-концом VH-домена scFab,
- вариабельный домен тяжелой цепи (VH) антитела в виде scFab и СН3-домен тяжелой цепи IgG.
Вторым объектом настоящего изобретения является слитый белок, предназначенный для транспортирования эффекторного элемента для головного мозга через гематоэнцефалический барьер, содержащий СН2-СН3-домен Ig, линкер и один sFab, мишенью которого является рецептор гематоэнцефалического барьера, в котором sFab соединен с С-концом СН2-СН3-домена Ig с помощью линкера.
В конкретном варианте слитого белка, предлагаемого в настоящем изобретении, слитый белок, предлагаемый в настоящем изобретении, дополнительно содержит линкер на N-конце СН2-СН3-домена Ig для соединения эффекторного элемента для головного мозга с N-концом СН2-СН3-домена Ig.
В конкретном варианте слитого белка, предлагаемого в настоящем изобретении, эффекторный элемент для головного мозга выбирают из группы, состоящей из лекарственного средства для лечения неврологического нарушения, нейротропных факторов, факторов роста, ферментов, цитотоксических агентов, фрагментов антитела или пептидов, направленных к мишени в головном мозге, которые выбраны из группы, состоящей из scFv, Fv, scFab, Fab, VHH, F(ab')2.
В конкретном варианте слитого белка, предлагаемого в настоящем изобретении, sFab, направленный к рецептору гематоэнцефалического барьера, представляет собой sFab, направленный к рецептору трансферрина, предпочтительно scFab, распознающий эпитоп в рецепторе трансферрина, который содержится в аминокислотной последовательности SEQ ID NO: 14, 15 или 16.
В конкретном варианте слитого белка, предлагаемого в настоящем изобретении, линкер представляет собой пептидный линкер, прежде всего пептид, имеющий аминокислотную последовательность длиной по меньшей мере 15 аминокислот, более предпочтительно длиной от 20 до 50 аминокислот, наиболее предпочтительно указанный линкер имеет аминокислотную последовательность (G4S)6G2 (SEQ ID NO: 13) или (G4S)4 (SEQ ID NO: 17).
В конкретном варианте слитого белка, предлагаемого в настоящем изобретении, СН2-СН3-домен Ig представляет собой СН2-СН3-домен IgG.
Кроме того, в настоящем изобретении предложена нуклеиновая кислота, кодирующая слитый белок, предлагаемый в настоящем изобретении, и клетка-хозяин, содержащая нуклеиновую кислоту, кодирующую слитый белок, предлагаемый в настоящем изобретении.
Третьим объектом настоящего изобретения является конъюгат, содержащий слитый белок, предлагаемый в настоящем изобретении, и эффекторный элемент для головного мозга, соединенный с N-концом СН2-СН3-домена Ig слитого белка, предлагаемого в настоящем изобретении, с помощью линкера.
В конкретном варианте конъюгата, предлагаемого в настоящем изобретении, эффекторный элемент для головного мозга представляет собой нейротропный фактор, а линкер, соединяющий нейротропный фактор с N-концом СН2-СН3-домена Ig, представляет собой пептидный линкер.
Кроме того, в настоящем изобретении предложена фармацевтическая композиция, содержащая конъюгат, предлагаемый в настоящем изобретении, и фармацевтический носитель, применение конъюгата в качестве лекарственного средства, прежде всего, применение конъюгата для лечения нейродегенеративного нарушения, прежде всего болезни Альцгеймера.
Краткое описание чертежей
На чертежах показано:
на фиг. 1 - различные форматы шаттлов (слитых белков) для гематоэнцефалического барьера, использованных в примерах. 1А: конструкция, содержащая IgG, направленный к Аβ (mAb31). 1Б: конструкция, содержащая один Fab (sFab), направленный к TfR, который соединен с Fc-фрагментом IgG, направленным к Аβ (mAb31). 1В: конструкция, содержащая два Fab (dFab), направленных к TfR, которые соединены с Fc-фрагментом IgG, направленным к Аβ (mAb31). Структура scFab слита с С-концом тяжелой цепи антитела IgG-типа;
на фиг. 2 - данные, характеризующие способность слитых белков к связыванию с Aβ-структурами. Аффинность связывания оценивали с использованием системы для ELISA, результаты свидетельствуют о том, что содержащие Fab конструкции сохраняли способность связываться с Aβ. Связывание конструкций mAb31-8D3 с фибриллами Абета. В то время как антитело 8D3 (незакрашенные квадраты) не связывалось с иммобилизованными фибриллами Абета, для mAb31-8D3-dFab (закрашенные квадраты), mAb31-8D3-sFab (незакрашенные треугольники) и mAb31 (закрашенные треугольники) такое связывание имело место и оно характеризовалось сопоставимыми величинами аффинности;
на фиг. 3 - данные, характеризующие способность конструкций к связыванию с рецептором трансферрина (TfR). Аффинность связывания оценивали с использованием системы для ELISA, результаты свидетельствуют о том, что только содержащие Fab конструкции связывались с рецептором трансферрина (TfR) и конструкция, содержащая двойной Fab, обладала немного более высокой кажущейся аффинностью, обусловленной двухвалентным форматом связывания. Связывание конструкций mAb31-8D3 с mTfR. В то время как mAb31 (закрашенные треугольники) не связывалось с иммобилизованным mTfR, аффинность связывания mAb31-8D3-dFab (закрашенные квадраты) была сопоставима с аффинностью родительского антитела 8D3 (незакрашенные квадраты). Одновалентная конструкция mAb31-8D3-sFab (незакрашенные треугольники) характеризовалась промежуточной величиной аффинности;
на фиг. 4 - результаты «декорирования» (окрашивания) бляшек моноклональным антителом к Аβ mAb31 (фиг. 4А), конструкцией «один Fab mAb31» (один Fab-фрагмент, слитый с С-концом mAb31) (фиг. 4Б) и конструкцией «два Fab mAb31» (два Fab-фрагмента, слитых с С-концом mAb31) (фиг. 4В). Конструкции инъецировали мышам линии PS2APP (n=3/конструкцию), вводя внутривенно однократную дозу 10 мг/кг, и затем осуществляли перфузию головного мозга в течение 8 ч после введения дозы. Анализ включал исследование связывания с бляшками с помощью иммуногистохимии и конфокальной микроскопии. Результаты свидетельствуют о том, что только конструкция «один Fab-mAb31» обладала способностью пересекать ГЭБ и связываться с бляшками. На чертеже представлена только одна репрезентативная область головного мозга для всех животных;
на фиг. 5 - результаты количественной оценки конструкции «два Fab-mAb31». Осуществляли количественную оценку окрашивания бляшек и капилляров в трех различных областях для всех трех обработанных животных (в общей сложности по 9 областей для каждой конструкции). Результаты свидетельствуют о том, что только в капиллярах имело место увеличение уровней конструкции «два Fab-mAb31» по сравнению с mAb31. В бляшках (внутри головного мозга) не было обнаружено повышения уровней конструкции «два Fab-mAb31». Представлено сравнение результатов количественной оценки mAb31 (HEK-клетки в качестве контроля) с конструкцией «два Fab-mAb3», 10 мг/кг, через 8 ч после введения дозы;
на фиг. 6 - результаты количественной оценки конструкции «один Fab-mAb31». Осуществляли количественную оценку окрашивания бляшек и капилляров в трех различных областях для всех трех обработанных животных (в общей сложности по 9 областей для каждой конструкции). Результаты свидетельствуют о том, что в бляшках имело место очень значительное увеличение уровня конструкции «один Fab-mAb31» по сравнению с mAb31. Количественная оценка флуоресцентного сигнала выявила более чем 50-кратное увеличение уровня конструкции «один Fab-mAb31» по сравнению с конструкцией mAb31. Имело место также кратковременное окрашивание конструкцией «один Fab-mAb31», сопоставимое с mAb31, в капиллярах, свидетельствующее о пересечении ГЭБ. Представлено сравнение результатов количественной оценки mab31 (HEK-клетки в качестве контроля) с конструкцией «один Fab-mab3», 10 мг/кг, через 8 ч после введения дозы и 25 мг/кг через 24 ч после введения дозы;
на фиг. 7 - окрашивание бляшек моноклональным антителом к Аβ mAb31, взятым в двух различных дозах, и конструкцией «один Fab-mAb31» (один Fab-фрагмент, слитый с С-концом mAb31), взятой в очень низкой дозе. Конструкцию инъецировали мышам линии PS2APP (n=3/конструкцию) путем однократного внутривенного введения дозы, и затем осуществляли перфузию головного мозга в различные моменты времени после введения дозы. Анализ включал исследование связывания с бляшками с помощью иммуногистохимии и конфокальной микроскопии. Результаты свидетельствуют о том, что только конструкция «один Fab-mAb31» обладала способностью пересекать ГЭБ и связываться с бляшками. В случае конструкции «один Fab-mAb31» экспозиция в головном мозге была очень быстрой, и окрашивание бляшек сохранялась по меньшей мере в течение одной недели после однократного введения;
на фиг. 8 - результаты количественной оценки экспрессии на клеточной поверхности TfR после обработки конструкциями «один Fab-mAb31» или «два Fab-mAb31». Проиллюстрирована понижающая регуляция рецептора трансферрина (TfR) на клеточной поверхности конструкцией «два Fab-mAb31». Эндотелиальные клетки головного мозга, экспрессирующие TfR, инкубировали в течение 24 ч в присутствии либо конструкции «один Fab-mAb31» (фиг. 8А), либо конструкции «два Fab-mAb31» (фиг. 8Б). Продемонстрировано, что только конструкция «два Fab-mAb31» снижала уровень экспрессированного на клеточной поверхности TfR;
на фиг. 9 - результаты оценки in vivo клеточного трафика TfR после обработки конструкциями «один Fab-mab31» или «два Fab-mAb31». Представлены результаты исследования окрашивания капилляров и бляшек in vivo в первые моменты времени. Как sFab-MAb31 (фиг. 9А), так и dFab-MAb31 (фиг. 9Б), окрашивали сосудистую сеть головного мозга через 15 мин после инъекции, при этом не выявлено различий в их распределении. Через 8 ч после инъекции конструкция sFab-MAb31 достигала паренхимы и окрашивала амилоидные бляшки (стрелки, фиг. 9В), в то время как конструкция dFab-MAb31 оставалась внутри сосудистой сети головного мозга, при этом картина была сходной с той, которая была установлена в момент времени 15 мин (фиг. 9Г). В амилоидных бляшках, присутствующих в паренхиме конструкция dFab-MAb31 не обнаружена;
на фиг. 10 - результаты оценки in vivo клеточного трафика TfR после обработки конструкциями «один Fab-mab31» или «два Fab-mAb31». Для контроля целостности всех конструкций, применявшихся в исследовании, осуществляли окрашивание криосрезов головного мозга трансгенных по АРР мышей возрастом 18 месяцев с использованием mAb31 (фиг. 10А), sFab-mAb31 (фиг. 10Б) или dFab-mAB31 (фиг. 10В). На фиг. 10Г представлены результаты, полученные для контроля. Результаты свидетельствуют о том, что все 3 конструкции обнаружены в амилоидных бляшках головного мозга трансгенных мышей;
на фиг. 11 - результаты оценки in vivo клеточного трафика TfR после обработки конструкцией «один Fab-mab31». Исследование с помощью конфокальной микроскопии высокого разрешения, проведенное на обработанных in vivo образцах, продемонстрировало, что конструкция sFab-MAb31 не окрашивала обращенную в просвет сторону капилляров, но она содержались в везикулоподобных структурах, пересекающих обращенную в просвет мембрану эндотелиальных клеток, и в цитозоле эндотелиальных клеток. Стрелками на фиг. 11 указаны везикулы, содержащие конструкции sFab-MAb31 на внепросветной стороне ядер эпителиальных клеток. Указанные данные позволяют предположить, что sFab-MAb31 может, как проникать в эндотелиальные клетки головного мозга, так и пересекать сосудистую сеть и достигать амилоидных бляшек в паренхимальном пространстве головного мозга (ср. с фиг. 9А и 9В);
на фиг. 12 - результаты оценки in vivo клеточного трафика TfR, обработанного конструкцией «два Fab-mab31». Исследование, проведенное с помощью конфокальной микроскопии высокого разрешения на обработанных in vivo образцах, продемонстрировало, что конструкция dFab-MAb31 не окрашивала обращенную в просвет сторону капилляров, но она содержалась в везикулоподобных структурах, пересекающих обращенную в просвет мембрану эндотелиальных клеток, и в цитозоле эндотелиальных клеток. Стрелками на фиг. 12 указаны везикулы, содержащие конструкции dFab-MAb31 на внепросветной стороне ядер эпителиальных клеток. Указанные данные позволяют предположить, что конструкция dFab-MAb31 может проникать в эндотелиальные клетки головного мозга, но она захватывается и не может пересекать сосудистую сеть и, следовательно, достигать амилоидных бляшек в паренхимальном пространстве головного мозга (ср. с фиг. 9Б и 9Г);
на фиг. 13 - экспозиция головного мозга и результаты окрашивания бляшек после i.v.-введения. На фиг. 13А: конструкции mAb31, dFab и sFab вводили путем внутривенной инъекции трансгенным животным линии PS2APP в дозе 10 мг/кг, животных подвергали перфузии и умерщвляли через 8 ч после инъекции. Не обнаружено значительного увеличения окрашивания бляшек при использовании dFab по сравнению с mAb31. На основе измерений при 555 нм интенсивности флуоресценции от идентифицирующего антитела установлено, что при использовании конструкции sFab имело место в 55 раз более высокое окрашивание бляшек, чем при использовании родительского mAb31. Представлены репрезентативные результаты иммуногистохимического окрашивания в коре головного мозга с использованием mAb31 (фиг. 13Б), dFab (фиг. 13В) и sFab (фиг. 13Г) через 8 ч после инъекции. dFab-конструкция приводила только к окрашиванию микрососудов, в то время как sFab-конструкция интенсивно окрашивала бляшки амилоида-β. На фиг. 13Д продемонстрировано, что sFab-конструкция при ее введении в низкой дозе (2,66 мг/кг) быстро и в значительном количестве достигал бляшек в головном мозге в отличие от mAb31 при его введении как в дозе 2 мг/кг, так и в дозе 10 мг/кг. Включение sFab-конструкции в мишень сохранялось в течение по меньшей мере одной недели после инъекции. С помощью иммуногистохимического окрашивания выявлено окрашивание бляшек через 7 дней после инъекции при использовании mAb31 в дозе 2 мг/кг (фиг. 13Е) и sFab в дозе 2,66 мг/кг (фиг. 13Ж);
на фиг. 14 - результаты оценки эффективности in vivo, полученные в долгосрочном исследовании на несущих бляшки мышах линии PS2APP, которых обрабатывали путем 14 еженедельных i.v.-инъекций. На фиг. 14А-Г представлено связывание с бляшками-мишенями введенных конструкций, связанных с оставшимися бляшками по окончании исследования, после введения mAb31 в низкой дозе, введения mAb31 в средней дозе, введения sFab в низкой дозе и вводимого sFab в средней дозе соответственно. Представлены результаты количественного морфометрического анализа после иммуногистохимического окрашивания бляшек в коре головного мозга и гиппокампе (фиг. 14Д). Загрузка бляшками, выявленная у необработанных животных, которых умерщвляли в возрасте 4,5 месяцев, представлена в качестве исходного уровня амилоидоза при начале исследования. Четко видно значимое снижение количества бляшек после обработки sFab в средней дозе по сравнению с прогрессирующим образованием бляшек у обработанных наполнителем животных; тенденция к снижению образования бляшек проявлялась даже при введении sFab в низкой дозе. Таким образом, конструкция sFab значимо снижала количество бляшек, как в коре головного мозга, так и в гиппокампе. Анализ размеров бляшек позволил установить, что снижение количества бляшек наиболее выражено для бляшек малого размера: *р≤0,05, **р≤0,01, ***р≤0,001;
на фиг. 15 - данные, демонстрирующие, что антитела с мультимерными scFab-фрагментами к TfR, слитые с С-концом Fc, не индуцируют ADCC. NK92-опосредованное уничтожение эритролейкозных клеток мышей линии BA/F3 количественно оценивали на основе измерения высвобождения LDH. Только мультимерные конструкции, в которых TfR-связывающий Fab-фрагмент находился в «канонической» «N-концевой относительно Fc» ориентации, индуцировали значительную ADCC, в то время как имеющие обратную ориентацию шаттл-конструкции для головного мозга не обладали активностью;
на фиг. 16 - данные, демонстрирующие, что конструкция scFab 8D3, мишенью которой является рецептор трансферрина, связывается с тремя различными пептидами во внеклеточном домене мышиного рецептора трансферрина. Связывание антитела 8D3 с 15-мерными пептидами, перекрывающимся на три аминокислоты, выявляли путем хемилюминисцентного обнаружения антитела, инкубированного на предметном стекле CelluSpot, несущем иммобилизованные mTfR-пептиды. Контур: пептиды №№373, 374 и 376, связанные 8D3 (SEQ ID NO: 14, 15 и 16).
Подробное описание предпочтительных вариантов осуществления изобретения
Определения
Понятие «гематоэнцефалический барьер» или «ГЭБ» относится к физиологическому барьеру между периферическим кровотоком и головным мозгом и спинным мозгом, который формируется в результате плотных контактов в эндотелиальных плазматических мембранах капилляров головного мозга, создающих плотный барьер, который ограничивает транспорт молекул в головной мозг, даже очень малых молекул, таких как мочевина (60 Да). ГЭБ в головном мозге, барьер между кровью и спинным мозгом в спинном мозге и гематоретинальный барьер в сетчатке представляют собой непрерывные капиллярные барьеры в ЦНС и в настоящем описании они в целом обозначены как гематоэнцефалический барьер или ГЭБ. ГЭБ включает также барьер между кровью и СМЖ (хороидальное сплетение), в котором барьер содержит эпендимальные клетки, а не капиллярные эндотелиальные клетки.
Модули димеризации по типу «knobs into holes» и их применение для конструирования антител описаны у Carter P., Ridgway J.B.B., Presta L.G., Immunotechnology, том 2, номер 1, февраль 1996 г., сс. 73-73(1).
Понятие «ЦНС» или «центральная нервная система» относится к комплексу нервных тканей, которые контролируют функцию организма, и включают головной мозг и спинной мозг.
«Рецептор гематоэнцефалического барьера» (в настоящем описании сокращенно обозначен как «R/ГЭБ») представляет собой внеклеточный сцепленный с мембраной рецепторный белок, экспрессируемый на эндотелиальных клетках головного мозга, который обладает способностью транспортировать молекулы через ГЭБ или который можно использовать для транспорта экзогенных вводимых молекул. В контексте настоящего описания примерами R/ГЭБ являются: рецептор трансферрина (TfR), рецептор инсулина, рецептор инсулинподобного фактора роста (IGF-R), рецепторы липопротеинов низкой плотности, включая (но, не ограничиваясь только ими) белок 1 родственный рецептору липопротеинов низкой плотности (LRP1), белок 8, родственный рецептору липопротеинов низкой плотности (LRP8), и фактор роста, подобный гепаринсвязывающему эпидермальному фактору роста (НВ-EGF). В контексте настоящего описания примером R/ГЭБ является рецептор трансферрина (TfR).
Понятие «эффекторный элемент для головного мозга» относится к молекуле, предназначенной для транспортировки в головной мозг через ГЭБ. Как правило, эффекторный элемент обладает характерной терапевтической активностью, которую требуется реализовать в головном мозге. К эффекторным элементам относятся лекарственные средства для лечения неврологических нарушений и цитотоксические агенты, такие, например, как пептиды, белки и антитела, прежде всего моноклональные антитела или их фрагменты, направленные к мишени в головном мозге.
Понятие «одновалентный связывающий элемент» относится к молекуле, обладающей способностью к специфическому связыванию и к связыванию в одновалентном формате с R/ГЭБ. Шаттл и/или конъюгат для гематоэнцефалического барьера, предлагаемый в настоящем изобретении, отличаются наличием одной единицы одновалентного связывающего элемента, т.е. шаттл и/или конъюгат для гематоэнцефалического барьера, предлагаемый в настоящем изобретении, содержат одну единицу одновалентного связывающего элемента. К одновалентным связывающим элементам относятся (но, не ограничиваясь только ими) белки, полипептиды, пептиды и фрагменты антител, включая Fab, Fab', Fv-фрагменты, молекулы одноцепочечных антител, такие, например, как одноцепочечный Fab, scFv. Одновалентный связывающий элемент может представлять собой, например, каркасный белок, сконструированный с помощью известных в данной области технологий, таких как фаговый дисплей или иммунизация. Одновалентный связывающий элемент может представлять собой также пептид. В конкретных вариантах осуществления изобретения одновалентный связывающий элемент содержит СН2-СН3-домен Ig и один Fab (sFab), мишенью которого является рецептор гематоэнцефалического барьера. sFab соединен с С-концом СН2-СН3-домена Ig с помощью линкера. В конкретных вариантах осуществления изобретения мишенью sFab является рецептор трансферрина.
Понятие «одновалентный формат связывания» относится к специфическому связыванию с R/ГЭБ, при котором взаимодействие между одновалентным связывающим элементом и R/ГЭБ осуществляется через один единичный эпитоп. Одновалентный формат связывания предупреждает любую димеризацию/мультимеризацию R/ГЭБ вследствие того, что точка взаимодействия представляет собой один эпитоп. Одновалентный формат связывания предупреждает изменение внутриклеточной сортировки R/ГЭБ.
Понятие «эпитоп» включает любую полипептидную детерминанту, обладающую способностью к специфическому связыванию с антителом. В конкретных вариантах осуществления изобретения, эпитопная детерминанта включает химически активную поверхностную группировку молекул, таких как аминокислоты, боковые цепи Сахаров, фосфорил или сульфонил, и, в конкретных вариантах осуществления изобретения, она может иметь специфические трехмерные структурные характеристики и/или специфические характеристики заряда. Эпитоп представляет собой область антигена, с которой связывается антитело.
«Рецептор трансферрина» («TfR») представляет собой трансмембранный гликопротеин (с молекулярной массой примерно 180000), состоящий из двух связанных дисульфидом субъединиц (каждая имеет молекулярную массу примерно 90000), который участвует в поглощении железа у позвоночных. В контексте настоящего описания в одном из вариантов осуществления изобретения TfR представляет собой человеческий TfR, который содержит, например, аминокислотную последовательность, представленную у Schneider и др., Nature 311, 1984, сс. 675-678.
В контексте настоящего описания понятие «неврологическое нарушение» относится к заболеванию или нарушению, которое поражает ЦНС и/или этиология которого связана с ЦНС. Примерами заболеваний или нарушений ЦНС являются (но, не ограничиваясь только ими) невропатия, амилоидоз, рак, глазное заболевание или нарушение, вирусная или микробная инфекция, воспаление, ишемия, нейродегенеративное заболевание, эпилептический припадок, нарушения поведения и лизосомная болезнь накопления. Для целей настоящей заявки следует иметь в виду, что ЦНС включает глаз, который, в норме отделен от остальной части организма гематоретинальным барьером. Конкретными примерами неврологических нарушений являются (но, не ограничиваясь только ими) нейродегенеративные заболевания (включая, но, не ограничиваясь только ими, болезнь (диффузных) телец Леви, постмиелитический синдром, синдром Шая-Дрейджера, оливопонтоцеребеллярную атрофию, болезнь Паркинсона, мультисистемную атрофию, стриатонигральную дегенерацию), тауопатии (включая, но, не ограничиваясь только ими, болезнь Альцгеймера и супрануклеарный паралич), прионные заболевания (включая, но, не ограничиваясь только ими, бычью спонгиформную энцефалопатию, скрепи, синдром Крейтцфельдта-Якоба, куру, болезнь Герстманна-Штросслера-Шейнкера, хроническую изнуряющую болезнь и фатальную семейную бессонницу), бульварный паралич, болезнь двигательных нейронов и гетеродегенеративные нарушения нервной системы (включая, но, не ограничиваясь только ими, болезнь Канавана, болезнь Гентингтона, нейронный цероидный липофусциноз, болезнь Александера, синдром Туретта, синдром курчавых волос Менкеса, синдром Коккейна, синдром Галлервордена-Шпатца, болезнь Лафоры, синдром Ретта, гепатолентикулярную дегенерацию, синдром Леша-Найхана и синдром Унферрихта-Лундборга), деменцию (включая, но не ограничиваясь только ими, болезнь Пика и спиноцеребеллярную атаксию), рак (например, рак ЦНС и/или головного мозга, включая метастазы в головной мозг, образующиеся от рака в какой-либо области организма).
«Лекарственное средство для лечения неврологических нарушений» Представляет собой лекарственное средство или терапевтический агент, которым лечат одн