Анти-cxcr3 антитела
Иллюстрации
Показать всеНастоящее изобретение относится к иммунологии. Предложены антитело и его антигенсвязывающий фрагмент, способные связываться с CXCR3, а также содержащие их конъюгат и фармацевтическая композиция. Кроме того, описано применение антитела или его фрагмента для предупреждения, лечения или подавления прогрессирования впервые выявленного диабета типа 1 (T1D) и in vitro-способ обнаружения присутствия или определения концентрации CXCR3 в тест-образце. Данное изобретение может найти дальнейшее применение в терапии заболеваний, связанных с CXCR3. 5 н. и 12 з.п. ф-лы, 28 ил., 13 пр., 13 табл.
Реферат
В настоящей заявке, в соответствии со ст. 35 § 119 Кодекса законов США, испрашивается приоритет на основании предварительной заявки на патент США №61/588936, поданной 20 января 2012 года, которая во всей своей полноте включена в настоящее описание посредством ссылки.
Настоящее изобретение относится к антителам и к способам применения антител для лечения расстройств, ассоциированных с передачей CXCR3-сигнала, таких как сахарный диабет типа 1 (диабет типа I; T1D).
Диабет характеризуется хронической гипергликемией, вызываемой отсутствием инсулиновой активности, а также различными характерными метаболическими расстройствами. Диабет может быть подразделен на две широкие категории: диабет типа I и типа II. T1D характеризуется потерей панкреатических β-клеток островков Лангерганса, а диабет типа II характеризуется снижением уровня секреции инсулина и чувствительности к инсулину (инсулинорезистентностью). В Соединенных Штатах диабетом страдает приблизительно 2-4 процента населения, причем на диабет типа I (также известный как инсулинзависимый диабет или ИЗСД) приходится приблизительно 7-10 процентов от всех случаев заболевания диабетом.
Диабет типа I характеризуется низким продуцированием инсулина, то есть на уровне, недостаточном для поддержания гомеостаза глюкозы. Такое расстройство, вероятно, инициируется разрушением панкератических β-клеток, опосредуемых аутоиммунным заболеванием. В развитии аутоиммунного заболевания, ассоциированного с диабетом типа I, участвуют аутореактивные B- и T-лимфоциты. Действительно, до 98% пациентов, страдающих диабетом типа I, имеют антитела против одного или более собственных β-клеточных антигенов, включая инсулин, (глутаминовая кислота)декарбоксилазу (GAD), антиген-2 инсулиномы и антиген-2b инсулиномы (IA-2 и IA-2β), и гетерогенные цитоплазматические антигены островковых клеток (ICA). Уровень одного или более аутоантител обычно коррелирует с уровнем деструкции β-клеток, хотя это не всегда может быть определено. Irvine, et al., Diabetes, 26:138-47 (1997); Riley, et al., N. Engl. J. Med., 323:1167-72 (1990). В соответствии с этим, аутоантитела могут служить индикаторами развития аутоиммунного диабета и, вместе с метаболическими расстройствами, позволяют предсказать риск развития диабета T1D у родственников пациентов.
Развитие диабета типа I может опосредоваться аутореактивными T-клетками, о чем свидетельствуют тканевые биоптаты, полученные на время диагностирования T1D и указывающие на инфильтрацию островков активированными Т-клетками. Bottazzo et al., N. Engl J. Med., 313:353-60 (1985); Hanninen et al., J. Clin. Invest, 90:1901-10 (1992); Itoh et al., J. Clin, invest, 92:2313-22 (1993); Imagawa, et al., Diabetes, 50:1289-73 (2001).
Хемокиновый (мотив C-X-C) рецептор 3 (CXCR3), также известный как связанный с G-белком рецептор 9 (GPR9), CD183, рецептор IP-10 и рецептор Mig представляют собой хемокиновые рецепторы, экспрессированные на аутореактивных T-клетках, которые участвуют в различных физиологических процессах и в развитии ассоциированных с ними расстройств, таких как T1D. CXCR3 в основном отсутствует в «необученных» T-клетках, но индуцируется после активации этих клеток антигеном и рекрутинга активированных клеток на участки воспаления тканей в ответ на действие первичных лигандов: CXCL9, CXCL10 и CXCL11. Было обнаружено, что β-клетки преимущественно экспрессируют CXCL10, а также CXCL9 на низком уровне у мышей с моделью T1D (Christen et al The Journal of Immunology, 2003, 171:6838-6845; Morimoto et al. J. Immunol 2004; 173;7017-7024; Sarkar et al. Diabetes. 2012 Feb; 61 (2):436-46); и в островковых клетках у пациентов с T1D, страдающих инсулитом (Uno et al 2010; Roep et al. Clinical and Experimental Immunology, 2003, 159: 338-343; Sarkar et al. Diabetes. 2012 Feb; 61 (2):436-46). Кроме того, было обнаружено, что T-клетки, инфильтрирующиеся в поджелудочную железу, экспрессируют CXCR3 у мышей с моделью T1D и в образцах поджелудочной железы, взятых у пациентов с диабетом типа 1 (Christen et al., The Journal of Immunology, 2003, 171: 6838-6845; Van Halteren et al., Diabetologia 48:75-82 (2005); Uno et al 2010; Roep et al., Clinical and Experimental immunology, 2003, 159: 338-343; Sarkar et al., Diabetes. 2012 Feb; 61 (2):436-46). Кроме того, у мышей, дефицитных по CXCR3 («нокаут»-мышей), наблюдалось значительное замедление начала развития T1D и снижение заболеваемости T1D (Frigerio et al., Nature Medicine 8:1414-1420 (2002)), а сверхэкспрессия CXCL10 в островках трансгенных мышей приводила к стимуляции инфильтрации Т-клеток и к ускорению начала развития T1D (Rhode et al., J. Immunol. 175(6): 3516-24 (2005)). Было показано, что нейтрализация CXCL10 путем лечения антителом оказывала протективное действие (Christen et al., The Journal of immunology, 2003, 171: 6838-6845).
Существуют три изоформы CXCR3, обозначенные A, B и Alt., которые были идентифицированы у человека (Lasagni et al., J. Exp. Med. 2003 197:1537; Ehlert et al, J. Immunol. 2004; 173; 6234-6240). CXCR3-A связывается с CXC-мотивом хемокинов CXCL9 (MIG), CXCL10 (IP-10) и CXCL11 (I-TAC); CXCR3-B также связывается с этими мишенями, но он также связывается с CXCL4; а CXCR3-Alt, очевидно, взаимодействует с CXCL11. Хотя альтернативный сплайсинг приводит к генерированию нескольких изоформ белка CXCR3, однако, доминирующей формой in vivo является CXCR3-A, тогда как GXCR3-B и CXCR3-Alt экспрессируются на гораздо более низких уровнях белка. Lasagni et al., J. Exp. Med. 2003 197:1537; Ehlert et al., J. Immunol. 2004; 173; 6234-6240.
Попытки нарушить CXCR3-путь с использованием низкомолекулярных ингибиторов CXCR3 оказались абсолютно неэффективными. Christen et al., Clin Exp. Immunol. 165: 318-328 (2011). В соответствии с этим были исследованы антитела и другие методы, направленные на разрушение CXCL10, главным образом, до начала развития диабета. Morimoto et al., J. Immun. 173: 7017-7024 (2004); Oikawa et al., Rev. Diabet Stud. 7: 209-224 (2010).
Поскольку T1D и другие расстройства, в развитии которых участвует CXCR3, являются широко распространенными, то необходимо разработать дополнительные способы, нацеленные на подавление передачи CXCR3-сигнала, например, для лечения или подавления прогрессирования у пациента такого расстройства, как T1D.
В настоящей заявке описаны антитела и способы применения антител, обладающих способностью связываться с CXCR3. В некоторых вариантах осуществления изобретения, антитела могут быть использованы для предупреждения, лечения или подавления прогрессирования T1D на ранней стадии у индивидуума посредством ингибирования CXCR3-пути. При проведении исследований с применением антител и соответствующих способов было неожиданно обнаружено, что нейтрализующие антитела, направленные на CXCR3, по меньшей мере отчасти, могут предупреждать начало развития T1D у NOD-мышей при введении им этих антител до начала развития заболевания, либо они могут индуцировать обратное развитие заболевания при введении этих антител NOD-мышам на начальной стадии развития T1D. Кроме того, нейтрализация активности CXCR3 не связана со значительным нарушением нормальной функции иммунной системы пациента, а поэтому она не будет вызывать значительные нежелательные побочные эффекты при терапии антителами.
В соответствии с этим, в одном из своих аспектов настоящее изобретение относится к антителам и к их антигенсвязывающим фрагментам, способным нейтрализовать активность CXCR3. В некоторых вариантах осуществления изобретения, CXCR3-нейтрализующие антитела могут быть охарактеризованы как антитела, обладающие способностью связываться с пептидами, выбранными из остатков 1-58, 1-16 или 1-37 SEQ ID NO:1. В некоторых вариантах осуществления изобретения указанные антитела содержат все клоны антител или их части (Cl), обозначенные Cl 12, Cl 135, Cl 82, Cl 53 и/или Cl 4. В некоторых своих вариантах настоящее изобретение относится к вариантам антител Cl 12, Cl 135, Cl 82, Cl 53 и/или Cl 4, включая CDR-привитые варианты, гуманизированные варианты, варианты с обратной мутацией и полностью человеческие варианты описанных антител. В конкретных вариантах осуществления изобретения антитело содержит одну или более определяющих комплементарность областей (CDR), например, одну или более CDR1, CDR2 и CDR3 тяжелой цепи, и/или одну или более CDR1, CDR2 и CDR3 легкой цепи, происходящих от клонов Cl 12, C1 135, Cl 82, Cl 53 и/или Cl 4 или любых вариантов клонов 4, 12, 53, 82 и 135, описанных в настоящей заявке. В некоторых вариантах осуществления изобретения, антитела, происходящие от Cl 12, Cl 135, Cl 82, Cl 53 и/или Cl 4, или их химерные или гуманизированные варианты обладают некоторыми более предпочтительными свойствами, чем клоны анти-CXCR3 антител 5H7, 7H5, V44D7, 1C6 и/или 49801. Так, например, описанные здесь антитела могут обладать более высокой аффинностью связывания по сравнению с клонами анти-hCXCR3 антител 5H7, 7H5, V44D7, 1C6 и 49801. Так, например, указанное антитело может обладать аффинностью, которая в 1, 2, 3, 4, 5 или более раз (или в любое промежуточное число раз) превышает аффинность анти-CXCR3 антител, таких как 1C6, например, как было измерено методом поверхностного плазмонного резонанса (например, с помощью анализа BiACORE™). Описанные здесь гуманизированные антитела также обладают прогнозируемой способностью к снижению иммуногенности по сравнению с клонами мышиных анти-hCXCR3 антител 5H7, 7H5, V44D7, 1C6 и 49801. Кроме того, тяжелые цепи описанных здесь клонов 4.7-4.11 были оптимизированы для удаления сайта дезамидирования в положениях 58 и 59 (в соответствии с нумерацией IMGT) и для повышения стабильности по сравнению с последовательностью CDR2 вариабельного домена (VH) тяжелой цепи исходного мышиного анти-hCXCR3 антитела.
В другом своем аспекте настоящее изобретение относится к способам профилактики начала развития T1D, а также к способам лечения или замедления прогрессирования впервые выявленного T1D у индивидуума путем введения эффективного количества CXCR3-нейтрализующего антитела. В конкретных вариантах осуществления изобретения указанным индивидуумом является млекопитающее, например, человек.
В некоторых вариантах осуществления изобретения, индивидуума, у которого был впервые выявлен T1D, подвергают лечению описанными здесь способами через 6 месяцев после установления клинического диагноза. В других вариантах осуществления изобретения, индивидуума подвергают лечению в течение более 6 месяцев после установления клинического диагноза, где у указанного индивидуума сохраняются общие остаточные уровни С-пептидов в сыворотке натощак, составляющие по меньшей мере приблизительно 0,2 нмоль/л.
В некоторых вариантах осуществления изобретения индивидуумы могут быть охарактеризованы как индивидуумы, у которых наблюдаются повышенные уровни глюкозы в крови натощак в отсутствие экзогенного инсулина, превышающие 120 мг/дл, или аномально низкий общий уровень С-пептидов в сыворотке натощак, составляющий приблизительно 0,033-1,0 нмоль/л в минуту во время стимуляции C-пептидом. В конкретных вариантах осуществления изобретения, CXCR3-нейтрализующее антитело вводят в дозе приблизительно 0,03-3,7 мг/кг/дозу. В некоторых вариантах осуществления изобретения индивидууму вводят по меньшей мере одну дозу антитела. В некоторых вариантах осуществления изобретения индивидууму повторно вводят дозы антитела (например, по меньшей мере ежегодно, один раз в три месяца, один раз в два месяца, один раз в месяц, один раз в две недели, один раз в неделю или ежедневно). В других вариантах осуществления изобретения описанные выше способы могут также включать стадию введения иммунодепрессанта и/или агента, стимулирующего β-клетки, и одновременное или последовательное введение (перед этой стадией или после нее) CXCR3-нейтрализующего антитела.
В различных вариантах осуществления изобретения описанные здесь анти-CXCR3 антитела вводят для лечения состояния, характеризующегося аномальной экспрессией CXCR3. В некоторых вариантах осуществления изобретения, анти-CXCR3 антитела вводят для лечения любого состояния, которое может поддаваться лечению посредством ингибирования и/или нейтрализации активности CXCR3. В некоторых вариантах осуществления изобретения описанные здесь анти-CXCR3 антитела вводят для лечения T1D.
Другие варианты и преимущества настоящего изобретения будут представлены ниже и будут отчасти более очевидны из нижеследующего описания либо из описания практического осуществления настоящего изобретения. Такие варианты и преимущества настоящего изобретения могут быть реализованы и достигнуты с использованием элементов и их комбинаций, указанных, в частности, в прилагаемой формуле изобретения.
Совершенно очевидно, что представленное выше общее описание и представленное ниже подробное описание имеют лишь иллюстративный характер и приводятся для лучшего понимания настоящего изобретения, но при этом они не должные рассматриваться как ограничение заявленного объема изобретения.
Прилагаемое описание графического материала, которое вводится в описание настоящей заявки и составляет ее часть, представлено в целях иллюстрации одного (или нескольких) из вариантов осуществления изобретения, и вместе с таким описанием позволяет лучше понять принципы настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКОГО МАТЕРИАЛА
На фиг. 1 проиллюстрирована экспрессия инсулина (левая панель), CXCL10 (центральная панель) и CD3 (правая панель) в срезах поджелудочной железы, взятых у 6-недельных самок NOD-мышей (первый ряд), у 10-недельных самок NOD-мышей (второй ряд), и у самок NOD-мышей с только что зарегистрированным диабетом (третий ряд).
На фиг. 2 проиллюстрирован проточный цитометрический анализ на экспрессию CXCR3 на T-клетках поджелудочной железы самок NOD-мышей с только что зарегистрированным диабетом. CD4+- и CD8+-T-клетки идентифицировали и окрашивали на экспрессию CXCR3, как показано сплошной линией на двух нижних графиках. Окрашивание контрольного изотипа показано на заштрихованной кривой на тех же самых двух графиках.
На фиг. 3 указаны проценты самок NOD-мышей с отсутствием диабета в зависимости от времени, которым, по достижении ими 10-недельного возраста, вводили PBS, анти-CXCR3 антитело и контрольный IgG до начала развития диабета. Результаты двух независимых исследований представлены на фиг. 3A и 3B.
На фиг. 4 показаны срезы поджелудочной железы 26-недельных самок NOD-мышей с отсутствием диабета, которым, по достижении ими 10-недельного возраста, вводили анти-CXCR3 антитело в профилактических целях, где указанные срезы были окрашены на инсулин (левая панель) или CD3/Foxp3 (центральная и правая панели). На правой панели показана увеличенная фотография среза, представленного на центральной панели.
На фиг. 5 указаны величины уровней глюкозы в крови, ежедневно регистрируемые утром у самок NOD-мышей, обработанных PBS, анти-CXCR3 антителом, контрольным IgG, мышиным антителом против глобулина тимоцитов (мышиного тимоглобулина, mATG), через 3-4 дня после предполагаемого развития диабета у мышей. Каждая линия представляет отдельную мышь. Стрелками указаны дни обработки.
На фиг. 6A представлены гистограммы, на которых указан процент T-клеток самок NOD-мышей, обработанных PBS, анти-CXCR3 антителом, контрольным IgG и антителом против mATG, где указанными Т-клетками являются CD4+-клетки (левая панель) и CD8+-клетки (правая панель). Поджелудочную железу брали у мышей во время обработки после 5-й инъекции тестируемого препарата и у mATG-обработанных мышей соответствующего возраста. На фиг. 6B представлен график зависимости уровня экспрессии CD44 (вертикальная ось) и экспрессии CD62L (горизонтальная ось) на CD4+-клетках, выделенных из поджелудочной железы мышей, обработанных PBS, контрольным антителом или анти-CXCR3 антителом. G1 и G2 относятся к гейтированным Т-клеткам с высоким уровнем CD44/низким уровнем CD62L и с низким уровнем CD44/низким уровнем CD62L соответственно. На фиг. 6С проиллюстрирован уровень экспрессии CXCR3 на CD4+-клетках в G1 и G2, по сравнению с уровнем экспрессии CXCR3 на клетках, окрашенных антителом контрольного изотипа и гейтированных на лимфоцитах.
На фиг.7 показаны срезы поджелудочной железы самок NOD-мышей, обработанных контрольным IgG (левые панели), анти-CXCR3 антителом (центральные панели) и mATG (правые панели), где указанные срезы были окрашены на инсулин (верхний ряд) или CD3/Foxp3 (нижний ряд).
На фиг. 8A-D представлен график зависимости уровней глюкозы в крови, регистрируемых после введения глюкозы самкам NOD-мышей соответствующего возраста с отсутствием диабета (фиг. 8A), NOD-мышам с диабетом, обработанных PBS (фиг. 8В), NOD-мышам с ремиссией заболевания, обработанных анти-CXCR3 антителом (фиг. 8С), и NOD-мышам с диабетом, обработанных контрольным антителом IgG (фиг. 8D). Введение глюкозы мышам проводили через 100 дней после появления первых признаков диабета и распределения мышей по группам исследования. Каждая линия представляет данные для каждого отдельного животного.
На фиг. 9A-B указаны проценты мышей с отсутствием диабета в зависимости от времени для NOD.Scid-мышей, которым вводили пулы донорных CD4+- и CD8+-Т-клеток, выделенных у самок NOD-мышей, обработанных PBS, анти-CXCR3 антителом, контрольным IgG или анти-mATG антителом. Т-клетки были выделены у самок NOD-мышей с диабетом приблизительно через 80-90 дней после введения PBS или контрольного IgG, или у самок NOD-мышей с ремиссией заболевания приблизительно через 80-90 дней после введения анти-CXCR3 антитела или анти-mATG антитела. Результаты этих двух независимых исследований представлены на фиг. 9A и 9B.
На фиг. 10A указан процент донорных CD4+- и CD8+-Т-клеток, выделенных у самок NOD-мышей, обработанных PBS, анти-CXCR3 антителом, контрольным IgG или анти-mATG антителом (левая панель), как описано на фиг. 9. Процент эффекторных клеток и центральных клеток памяти в пулах донорных CD4+- и CD8+-Т-клеток для каждой группы обработки представлен на правых панелях фиг. 10А. На фиг. 10B указан процент регуляторных Т-клеток в пулах донорных Т-клеток, идентифицированных по экспрессии CD4 и CD25 или по экспрессии CD4, CD25 и Foxp3. На фиг. 10C указан процент CD8+-клеток (левая панель) и CD4+-клеток (правая панель) в пулах донорных Т-клеток, которые также экспрессируют CXCR3.
На фиг. 11A-B указан процент мышей с отсутствием диабета в зависимости времени после адоптивного переноса Т-клеток, взятых у донорных OVA-специфических TCR-трансгенных мышей, мышам-реципиентам RIP-OVA, которых либо не обрабатывали, либо обрабатывали анти-CXCR3 антителом или контрольным IgG. Результаты этих двух исследований представлены на фиг. 11А и 11В.
На фиг. 12A проиллюстрирована экспрессия CXCR3 на донорных Т-клетках, проанализированная с помощью проточной цитометрии до адоптивного переноса этих клеток мышам-реципиентам RIP-OVA (заштрихованная кривая). Окрашивание антителом контрольного изотипа проиллюстрировано на затененной кривой. На фиг. 12B указан процент донорных клеток в крови, селезенке и лимфоузлах поджелудочной железы мышей-реципиентов, обработанных анти-CXCR3 антителом или контрольным антителом IgG на дни 2, 4, 7, 9 и 15 после адоптивного переноса. На фиг. 12C указан процент пролиферирующих донорных клеток в крови, селезенке и лимфоузлах поджелудочной железы мышей-реципиентов, обработанных анти-CXCR3 антителом или контрольным антителом IgG после адоптивного переноса. На фиг. 12D указан процент донорных CXCR3+-клеток в крови, селезенке и лимфоузлах поджелудочной железы мышей-реципиентов, обработанных анти-CXCR3 антителом или контрольным антителом IgG после адоптивного переноса.
На фиг. 13 показаны срезы поджелудочной железы необработанных мышей-реципиентов RIP-OVA, и эти срезы были окрашены на инсулин (вверху слева) или CD3 (вверху справа), или срезы мышей, которые были обработаны анти-CXCR3 антителом, и эти срезы были окрашены на инсулин (внизу слева) или CD3 (внизу справа). Поджелудочную железу выделяли через 60 дней после адоптивного переноса донорных Т-клеток.
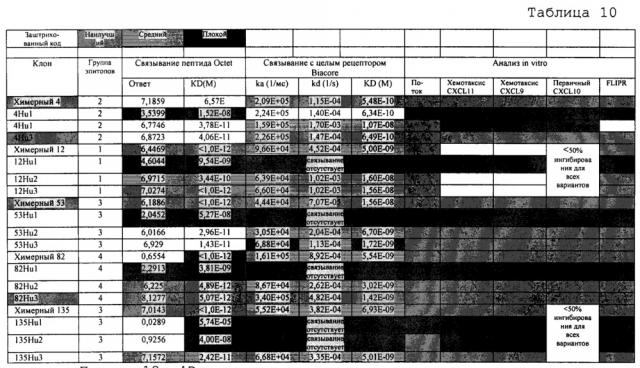
На фиг. 14A-C представлен уровень ингибирования CXCR3-опосредуемого хемотаксиса CXCL11, опосредуемого клонами Cl 4, 12, 53, 82 и 135. Данные выражены как средние относительные единицы флуоресценции (RFU) мигрирующих клеток в анализе на хемотаксис. На фиг. 14D указана концентрация антитела, необходимая для ингибирования мобилизации кальция на 50% клонами антител Cl 4, 12, 53 и 135.
На фиг. 15A-C представлен уровень ингибирования CXCR3-опосредуемого хемотаксиса CXCL9 (фиг. 15A), CXCL10 (фиг. 15B) и CXCL11 (фиг. 15C), опосредуемого клонами Cl 4, 12, 53, 82 и 135. Данные выражены как средние относительные единицы флуоресценции (RFU) мигрирующих клеток в анализе на хемотаксис.
На фиг. 16 графически представлены гистограммы, на которых проиллюстрировано связывание антитела с клетками, экспрессирующими различные другие хемокиновые рецепторы. Концентрация связанного антитела увеличивается по горизонтальной оси на каждой из гистограмм.
На фиг. 17A проиллюстрировано выравнивание вариабельных доменов тяжелой (VH) и легкой (VK) цепей клона 4.0 (называемого «родительским» клоном) и некоторых гуманизированных вариантов (обозначенных VH1-3 и 7-11 и VK1-3). На фиг. 17А указаны последовательности тяжелой цепи, представленные как SEQ ID NO:18, 20, 22, 24, 29-33 и 659, и последовательности легкой цепи, представленные как SEQ ID NO:19, 25, 21, 23 и 660, где все указанные последовательности, соответственно, приводятся для иллюстрации выравнивания. На фиг. 17B проиллюстрировано выравнивание вариабельных доменов тяжелой (VH) и легкой (VK) цепей клона 12.0 (называемого «родительским» клоном) и некоторых гуманизированных вариантов (обозначенных VH1-3 и VK1-3). На фиг. 17В указаны последовательности тяжелой цепи, представленные как SEQ ID NO:2, 4, 6, 8 и 661, и последовательности легкой цепи, представленные как SEQ ID NO:3, 5, 7, 9 и 662, где все указанные последовательности, соответственно, приводятся для иллюстрации выравнивания. На фиг. 17C проиллюстрировано выравнивание вариабельных доменов тяжелой (VH) и легкой (VK) цепей клона 53.0 (называемого «родительским» клоном) и некоторых гуманизированных вариантов (обозначенных VH1-6 и VK1-9). На фиг. 17С указаны последовательности тяжелой цепи, представленные как SEQ ID NO:38, 40, 42, 44, 46-48 и 663, и последовательности легкой цепи, представленные как SEQ ID NO:39, 41, 43, 45,49-54 и 664, где все указанные последовательности, соответственно, приводятся для иллюстрации выравнивания. На фиг. 17D проиллюстрировано выравнивание вариабельных доменов тяжелой (VH) и легкой (VK) цепей клона 82.0 (называемого «родительским» клоном) и некоторых гуманизированных вариантов (обозначаемых VH1-3 и VK1-3). На фиг. 17D указаны последовательности тяжелой цепи, представленные как SEQ ID NO:55, 57, 59, 61 и 665, и последовательности легкой цепи, представленные как SEQ ID NO:56, 58, 60, 62 и 666, где все указанные последовательности, соответственно, приводятся для иллюстрации выравнивания. На фиг. 17E проиллюстрировано выравнивание вариабельных доменов тяжелой (VH) и легкой (VK) цепей клона 135.0 (называемого «родительским» клоном) и некоторых гуманизированных вариантов (обозначенных VH1-3 и VK1-3). На фиг. 17E указаны последовательности тяжелой цепи, представленные как SEQ ID NO:10, 12, 14, 16 и 667, и последовательности легкой цепи, представленные как SEQ ID NO:11, 13, 15, 17 и 668, где все указанные последовательности, соответственно, приводятся для иллюстрации выравнивания. На фиг. 17F проиллюстрировано выравнивание вариабельных доменов тяжелой (VH) и легкой (VK) цепей клона 4.0 (называемого «родительским» клоном) и некоторых гуманизированных вариантов (обозначенных VH4-8 и VK4-7). На фиг. 17F указаны последовательности тяжелой цепи, представленные как SEQ ID NO:19, 34-37 и 669, и последовательности легкой цепи, представленные как SEQ ID NO:18, 27, 28 и 26, где все указанные последовательности, соответственно, приводятся для иллюстрации выравнивания. На фиг. 17G проиллюстрировано выравнивание вариабельных доменов тяжелой (VH) и легкой (VK) цепей клона 53.0 (называемого «родительским» клоном) и некоторых гуманизированных вариантов (обозначенных VH7-10 и VK10-13). На фиг. 17G указаны последовательности тяжелой цепи, представленные как SEQ ID NO:38, 63-66 и 663, и последовательности легкой цепи, представленные как SEQ ID NO:39, 67-70 и 664, где все указанные последовательности, соответственно, приводятся для иллюстрации выравнивания. Нижняя последовательность в каждом выравнивании на фиг. 17A-G представляет собой последовательность, наиболее сходную с последовательностями человеческой зародышевой линии. В черных рамках указаны домены CDR, в которых затененные остатки в этой последовательности отличаются от соответствующих остатков зародышевой линии (фиг. 17A-E) или от соответствующих родительских остатков (фиг. 17F-G), где остатки пронумерованы в соответствии с IMGT и где используется делимитация границ CDR. На фиг. 17H проиллюстрировано выравнивание вариабельных доменов тяжелой (VH) и легкой (VK) цепей клонов 4.0, 12.0, 82.0 и 135, а также клонов антител 5H7 и 7H5. На фиг. 17H указаны последовательности тяжелой цепи, представленные как SEQ ID NO:18, 2, 38, 55, 10 и 670-671, и последовательности легкой цепи, представленные как SEQ ID NO:19, 3, 39, 56, 11 и 672-673, где все указанные последовательности, соответственно, приводятся для иллюстрации выравнивания. В черных рамках указаны домены CDR, в которых затененные остатки в этой последовательности отличаются от предыдущей выравниваемой последовательности, где остатки пронумерованы в соответствии с IMGT.
На фиг. 18 показаны границы остатков минимальных эпитопов для клонов антител 4, 12, 53, 82 и 135. Остатки, играющие важную роль в активности связывания, обозначены X. На фиг. 18 указана SEQ ID NO:81.
На фиг. 19 представлены гистограммы, иллюстрирующие связывание антитела с клетками 300.19, трансфицированным человеческим CXCR3 для химерных клонов 4, 12, 53, 82 и 135, а также для гуманизированных вариантов Hu1, Hu2, Hu3. Антитело вводили в концентрации 5 мкг/мл (черная линия), 0,5 мкг/мл (темно-серая линия) или 0,1 мкг/мл (черная пунктирная линия), либо вводили 5 мкг/мл только «второго» антитела (гистограмма, закрашенная серым), и по этим данным строили график зависимости числа клеток (по горизонтальной оси) от процента максимальной флуоресценции.
На фиг. 20A-C указан процент ингибирования миграции (вертикальная ось) клеток, трансфицированных человеческим CXCR3, в направлении CXCL9 (фиг. 20A), CXCL10 (фиг. 20B) и CXCL11 (фиг. 20C) в отсутствие или в присутствии 10 мкг/мл химерных (Chim) или гуманизированных (Hu1, Hu2 или Hu3) вариантов клонов антител 4, 12, 53, 82 и 135, или коммерчески доступного клона 1C6.
На фиг. 21 представлен график, на котором проиллюстрирована способность химерных (Chim) и гуманизированных (Hu1, Hu2 или Hu3) вариантов клонов антител 4, 12, 53, 82 и 135 и коммерчески доступного клона 1C6 ингибировать мобилизацию кальция в GXCR3-Gqi4qi4-трансфицированных клетках CHO. На графике представлена зависимость концентрации антитела (горизонтальная ось) от процента максимального ингибирования (вертикальная ось).
На фиг. 22A-D проиллюстрировано влияние обработки анти-CXCR3 антителом на процентное соотношение CD3+/CD4+-T-клеток (фиг. 22A), CD3+/CD8+ -T-клеток (фиг. 22D) у NOD-scid IL2rγnull (NSG)-мышей. HulgG1 означает человеческий IgG1 (герцептин), а термин «клоны 4, 12, 53, 82 и 135» означает клоны химерного антитела.
На фиг. 23A представлены аминокислотные последовательности тяжелой и легкой цепей клонов антитела 12.0. На фиг. 23B представлены аминокислотные последовательности тяжелой и легкой цепей клонов антитела 12.1. На фиг. 23C представлены аминокислотные последовательности тяжелой и легкой цепей клонов антитела 12.2. На фиг. 23D представлены аминокислотные последовательности тяжелой и легкой цепей клонов антитела 12.3.
На фиг. 24A представлены аминокислотные последовательности тяжелой и легкой цепей клонов антитела 135.0. На фиг. 24B представлены аминокислотные последовательности тяжелой и легкой цепей клонов антитела 135.1. На фиг. 24C представлены аминокислотные последовательности тяжелой и легкой цепей клонов антитела 135.2. На фиг. 24D представлены аминокислотные последовательности тяжелой и легкой цепей клонов антитела 135.3.
На фиг. 25A представлены аминокислотные последовательности тяжелой и легкой цепей клонов антитела 4.0. На фиг. 25B представлены аминокислотные последовательности тяжелой и легкой цепей клонов антитела 4.1. На фиг. 25C представлены аминокислотные последовательности тяжелой и легкой цепей клонов антитела 4.2. На фиг. 25D представлены аминокислотные последовательности тяжелой и легкой цепей клонов антитела 4.3. На фиг. 25E представлены аминокислотные последовательности тяжелой цепи клона антитела 4.4. На фиг. 25F представлены аминокислотные последовательности тяжелой цепи клона антитела 4.5. На фиг. 25G представлены аминокислотные последовательности тяжелой цепи клона антитела 4.6. На фиг. 25H представлены аминокислотные последовательности тяжелой цепи клона антитела 4.7. На фиг. 25I представлены аминокислотные последовательности тяжелой цепи клона антитела 4.8. На фиг. 25J представлены аминокислотные последовательности тяжелой цепи клона антитела 4.9. На фиг. 25K представлены аминокислотные последовательности тяжелой цепи клона антитела 4.10. На фиг. 25L представлены аминокислотные последовательности тяжелой цепи клона антитела 4.11. На фиг. 25M представлены аминокислотные последовательности легкой цепи клона антитела 4.4. На фиг. 25N представлены аминокислотные последовательности легкой цепи клона антитела 4.5. На фиг. 25О представлены аминокислотные последовательности легкой цепей клона антитела 4.6. На фиг. 25P представлены аминокислотные последовательности легкой цепи клона антитела 4.7.
На фиг. 26A представлены аминокислотные последовательности тяжелой и легкой цепей клонов антитела 53.0. На фиг. 26B представлены аминокислотные последовательности тяжелой и легкой цепей клонов антитела 53.1. На фиг. 26C представлены аминокислотные последовательности тяжелой и легкой цепей клонов антитела 53.2. На фиг. 26D представлены аминокислотные последовательности тяжелой и легкой цепей клонов антитела 53.3. На фиг. 26E представлены аминокислотные последовательности тяжелой цепи клона антитела 53.4. На фиг. 26F представлены аминокислотные последовательности тяжелой цепи клонов антитела 53.5. На фиг. 26G представлены аминокислотные последовательности тяжелой цепи клона антитела 53.6. На фиг. 26H представлены аминокислотные последовательности легкой цепи клона антитела 53.4. На фиг. 26I представлены аминокислотные последовательности легкой цепи клона антитела 53.5. На фиг. 26J представлены аминокислотные последовательности легкой цепи клона антитела 53.6. На фиг. 26K представлены аминокислотные последовательности легкой цепи клона антитела 53.7. На фиг. 26L представлены аминокислотные последовательности легкой цепи клона антитела 53.8. На фиг. 26М представлены аминокислотные последовательности легкой цепи клона антитела 53.9. На фиг. 26N представлены аминокислотные последовательности тяжелой цепи клона антитела 53.7. На фиг. 26О представлены аминокислотные последовательности тяжелой цепи клона антитела 53.8. На фиг. 26P представлены аминокислотные последовательности тяжелой цепи клона антитела 53.9. На фиг. 26Q представлены аминокислотные последовательности тяжелой цепи клона антитела 53.10. На фиг. 26R представлены аминокислотные последовательности легкой цепи клона антитела 53.10. На фиг. 26S представлены аминокислотные последовательности легкой цепи клона антитела 53.11. На фиг. 26T представлены аминокислотные последовательности легкой цепи клона антитела 53.12. На фиг. 26U представлены аминокислотные последовательности легкой цепи клона антитела 53.13.
На фиг. 27A представлены аминокислотные последовательности тяжелой и легкой цепей клона антитела 82.0. На фиг. 27B представлены аминокислотные последовательности тяжелой и легкой цепей клона антитела 82.1. На фиг. 27C представлены аминокислотные последовательности тяжелой и легкой цепей клона антитела 82.2. На фиг. 27D представлены аминокислотные последовательности тяжелой и легкой цепей клона антитела 82.3.
На фиг. 28A-P представлены последовательности нуклеиновой кислоты тяжелой цепи клонов антител 12.0-12.3 и легкой цепи клонов антител 12.0-12.3, тяжелой цепи клонов антител 135.0-135.3 и легкой цепи клонов антител 135.0-135.3, тяжелой цепи клонов антител 4.0-4.11 и легкой цепи клонов антител 4.0-4.7, тяжелой цепи клонов антител 53.0-53.6 и легкой цепи клонов антител 53.0-53.9, и тяжелой цепи клонов антитела 82.0-82.3 и легкой цепи клонов антител 82.0-82.3.
РЕПРЕЗЕНТАТИВНЫЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Ниже подробно описаны некоторые репрезентативные варианты осуществления изобретения, некоторые примеры которых проиллюстрированы в прилагаемом графическом материале.
CXCR3
CXCR3 (MIM: 300574, человеческий GeneID: 2833, хемокиновый (мотив C-X-C) рецептор 3; также известный как CD182, CD183, CKR-L2, CKAR3, GPR9, IP10-R, Mig-R, MigR, рецептор 9, связанный с G-белком; рецептор IP-10, рецептор Mig, хемокиновый (C-X-C) рецептор 3, рецептор индуцируемого интерфероном белка 10) представляет собой хемокиновый рецептор, который в основном отсутствует в «необученных» T-клетках, но индуцируется после активации антигеном и осуществляет рекрутинг этих клеток в сайты воспаления ткани в ответ на первичные лиганды: CXCL9 (человеческий GeneID: 4283), CXCL10 (человеческий GeneID: 3627) и CXCL11 (человеческий GeneID: 6373). β-клетки островков Лангерганса экспрессируют CXCL9 и CXCL10 (Frigerio et al., Nature Medicine 8:1414-1420 (2002), а T-клетки, которые инфильтрируют поджелудочную железу, экспрессируют CXCR3 (Christen et al, The Journal of Immunology, 2003, 171: 6838-6845; Van Halteren et al., Diabetologia 48:75-82 (2005); Uno et al 2010; Roep et al., Clinical and Experimental Immunology, 2003, 159: 338-343; Tanaka et al., Diabetes 58: 2285-2291 (2009); Sarkar et al., Diabetes. 2012 Feb; 61(2):436-46).
CXCR3 экспрессируется в различных организмах, включая, например, человека, мышей, крыс, коров, шимпанзе, макак, собак, лягушек, утконосов, свиней и рыбу-зебру. В таблице 1 приводится список последовательностей, имеющихся в банке GeneID Национального центра биотехнологической информации США (U.S. National Center for Biotechnology Information (NCBI)), и эталонная последовательность белка CXCR3 различных организмов. SEQ ID NO:1 представляет собой полноразмерную человеческую последовательность CXCR3 (вариант сплайсинга A). Пептидная последовательность варианта сплайсинга B представлена как эталонная последовательность NP_001136269.1. Предсказанные внеклеточные домены варианта сплайсинга А человеческого CXCR3 описаны в публикации Colvin et al., Mol. Cell. Bio., 26: 5838-49 (2006) и включают остатки 1-58, 1-16, 111-126, 190-223, 278-301 SEQ ID NO:1, указанные ниже.
SEQ ID NO:1 NP_001495 изоформы А человеческого CXCR3:
1 mvievsdhqv lndaevaall enfsssydyg enesdsccts ppcpqdfsin fdraflpaly
61 sllfllgllg ngavaavlls rrtalsstdt fllhlavadt llvltlpiwa vdaavqwvfg
121 sglckvagal fninfyagal llacisfdry lnivhatqly rrgpparvtl tclavwglcl
181 lfalpdfifl sahhderlna thcqynfpqv grtalrvlgl vagfllpllv maycyahila
241 vllvsrgqrr lramrlvvvv vvafalcwtp yhlwlvdil mdlgalarnc gresrvdvak
301 svtsglgymh cclnpllyaf vgvkfrermw mlllrlgcpn qrglqrqpss srrdsswset
361 seasysgl
CXCR3 и CXCL10 экспрессируются у человека, страдающего T1D. Uno et al., Endocrine J. 57: 991-996 (2010); Roep et al., Clin, and Exp. Immun. 159: 338-343 (2009); Tanaka et al., Diabetes 58: 2285-2291 (2009). У этих пациентов, CXCL10 экспрессируется в имеющихся инсулин-продуцирующих бета-клетках островков. CXCR3 экспрессируется в инвазивных Т-клетках, окружающих островки. Аналогичные паттерны экспрессии были репродуцированы у мышей с диабетом, не страдающих ожирением (NOD), и у мышей с моделями диабета. Morimoto et al., J. Immun., 173: 7017-7024 (2004); Li et al., World J. Gastroenterol, 11 (30): 4750-4752 (2005); Sarkar et al. Diabetes, 2012 Feb; 61 {2):436-46).
CXCR3 также экспрессируется в T-клетках, присутствующих в воспаленных тканях некоторых типов, а CXCL9, CXCL10 и CXCL11 часто продуцируются клетками, присутствующими на участках воспаления. В соответствии с этим, в некоторых вариантах осуществления изобретения описана терапия диабета T1D, проводимая посредством разрушения CXCR3.
Антитела
Используемый здесь термин «антитело» означает любой полипептид, содержащий антигенсвязывающий сайт, независимо от его источника, вида и происхождения, от метода его продуцирования и/или свойств, и охватывает иммуноглобулины или их антигенсвязывающие части или фрагменты. Термин «антитело» включает, но не ограничивается ими, антитела, происходящие от человека, орангутангов, мышей, крыс, коз, овец и кур. Этот термин включает, но не ограничивается ими, поликлональные антитела, моноклональные антитела, моноспецифические антитела, полиспецифические антитела, неспецифические антитела, гуманизированные антитела, полностью человеческие антитела, верблюжьи антитела, одноцепочечные антитела, химерные антитела, синтетические антитела, рекомбинантные антитела, гибридные антитела, мутированные антитела, антитела с обратной мутацией и CDR-привитые антитела. Термин «антитело», употребляемый в настоящем изобретении, также включает, если это не оговорено особо, фрагменты антител, такие как Fab, F(ab')2, Fv, scFv, Fd, dAb, VHH (также называемые наноантителами), и другие фрагменты антител, сохраняющие антигенсвязывающую функцию исходных антител, включая биспецифические или мультиспецифические антитела. Термин «антитело» также означает антигенсвязывающие молекулы, которые не происходят от иммуноглобулинов. Так, например, не-иммуноглобулиновыми каркасами, известными специалистам, являются небольшие модульные иммунофармацевтические средства (смотрите, например, публикации заявок на патент США №№20080181892 и 20080227958, опубликованные 31 июля 2008 года и 18 сентября 2008 года, соответственно), тетранектины, домены фибронектина (например, AdNectins, смотрите публикацию заявки на патент США №2007/0082365, опубликованную 12 апреля 2007 года), белок A, липокалины (смотрите, например, патент США № 7118915), анкириновые повторы и тиоредоксин.
Термин «антигенсвязывающий домен»