Способ фармакологической защиты от ионизирующих излучений
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к радиологии, и может быть использовано для фармакологической защиты против ионизирующих излучений. Способ включает парентеральное введение 1-изобутаноил-2-изопропилизотиомочевины гидробромида (соединение Т1023) в дозе от 1/12 до 1/4 ЛД16 за 20-60 минут до радиационного воздействия и через 10-20 минут после радиационного воздействия вводят 5-метокситриптамина гидрохлорид в дозе 1/24-1/6 ЛД16. Использование изобретения позволяет обеспечивать высокую противолучевую эффективность при сочетанном применении относительно низких, более безопасных доз фармакологических компонентов за счет их синергического действия. 1 з.п. ф-лы, 2 ил., 7 табл., 4 пр.
Реферат
Изобретение относится к способам лечения, включающим введение фармацевтических композиций, которые обладают выраженным радиозащитным действием и могут применяться в качестве радиопротекторов и средств профилактики осложнений лучевой терапии.
Проблемы разработки эффективных и безопасных противолучевых лекарственных средств актуальны не только в связи с возрастающими рисками радиационных инцидентов, но и рисками лучевых повреждений, связанных с расширением применения в медицине радиологических методов лечения и диагностики (Иванов В.К., Цыб А.Ф., Метлер Ф.А. Радиационные риски медицинского облучения. Радиация и риск. 2011. 20(2): 17-29) и связанным с этим риском осложнений лучевой терапии (Бардычев М.С., Цыб А.Ф. Местные лучевые повреждения - М.: Медицина, 1985. Пасов В.В., Бардычев М.С. Хирургическая коррекция местных лучевых повреждений у больных раком молочной железы: пособие для врачей - Обнинск: ФГБУ МРНЦ МЗ РФ, 2002).
На сегодняшний день известно значительное число соединений различных химических классов, обладающих противолучевым действием (Hosseinimehr S.J. Foundation review: Trends in the development of radioprotective agents. Drugs Discov. Today. 2007, 12(19/20): 794-805. Васин M.B. Классификация противолучевых средств как отражение современного состояния и перспективы развития радиационной фармакологии. Радиац. биол. Радиоэкол. 2013, 53(5): 459-467). Некоторые из них в настоящее время входят в обеспечение медицинских служб в качестве радиопротекторов экстренного действия: цистамин и индралин - в Российской Федерации; амифостин - в странах НАТО. Во многих экспериментальных работах показана эффективность этих средств в профилактике лучевых повреждений нормальных тканей. Однако их применение в онкологической практике чрезвычайно проблематично в связи с низкой переносимостью и потенциальной токсичностью для человека таких препаратов в эффективных радиозащитных дозах.
Известен единственный, допущенный к клиническому применению в качестве средства профилактики осложнений радиотерапии опухолей, разработанный в США аминотиоловый радиопротектор амифостин, который ограниченно используется при лечении некоторых видов новообразований (Kouvaris J.R. Kouloulias V.E., Vlahos L.J. Amifostine: the first selective-target and broad-spectrum radioprotector. Oncologist. 2007, 12(6): 738-747. Hensley M.L., Hagerty K.L., Kewalramani T. et al. American Society of Clinical Oncology 2008 clinical practice guideline update: use of chemotherapy and radiation therapy protectants. J. Clin. Oncol. 2009. 27(1): 127-145. Рождественский Л.М. Актуальные вопросы поиска и исследования противолучевых средств. Радиац. биол. Радиоэкол. 2013. 53(5): 513-520).
Недостатки амифостина обусловлены высокой токсичностью его эффективных радиозащитных доз, что ограничивает его применение у онкологических больных.
Попытки повысить эффективность действия амифостина стимулируют проведение масштабных исследований по поиску и дизайну более безопасных, приемлемых для клинического применения радиозащитных средств, в которых участвуют десятки научных и коммерческих лабораторий мира. В настоящее время ведутся работы по поиску более приемлемых аналогов амифостина (Peebles D.D., Soref С.М., Сорр R.R. et al. ROS-scavenger and radioprotective efficacy of the new PrC-210 aminothiol. Radiat. Res. 2012, 178(1): 57-68. Copp R.R., Peebles D.D., Soref C.W. et al. Radioprotective efficacy and toxicity of a new family of aminothiol analogs. Int. J. Radiat. Biol. 2013. 89(7): 485-492. Chen C.H., Kuo M.L., Wang J.L. et al. CCM-AMI, a polyethylene glycol micelle with amifostine, as an acute radiation syndrome protectant in C57BL/6 mice. Health Phys. 2015. 109(3): 242-248), изучается целесообразность применения с этой целью адреномиметиков, СОД-миметиков и ингибиторов апоптоза (Bourgier С., Levy A., Vozenin М.С. et al. Pharmacological strategies to spare normal tissues from radiation damage: useless or overlooked therapeutics? Cancer Metastasis Rev. 2012. 31(3-4): 699-712. Prasanna P.G., Stone H.B., Wong R.S. et al. Normal tissue protection for improving radiotherapy: Where are the Gaps? Transl. Cancer Res. 2012. 1(1): 35-48. Fahl W.E. Effect of topical vasoconstrictor exposure upon tumorocidal radiotherapy. Int. J. Cencer. 2014. 135(4): 981-989. Maier P., Wenz F., Herskind С. Radioprotection of normal tissue cells. Strahlenther. Oncol. 2014. 190(8): 745-752. Аклеев A.B. Радиобиологические закономерности реакции нормальных тканей при лучевой терапии опухолей. Радиац. биол. Радиоэкол. 2014. 54(3): 241-255).
Однако в представленных исследованиях убедительных практических результатов на сегодняшний день не достигнуто.
Прототипом предлагаемого технического решения является способ применения средства, обладающего радиозащитным действием (М.В. Филимонова, Л.И. Шевченко, В.М. Макарчук, А.С. Шевчук, Г.А. Лушникова. Вазоконстрикторное средство // Бюллетень изобретений №5 от 20.02.2013, патент № RU 2475479). Радиозащитное средство - ингибитор синтаз оксида азота (NOS) из класса N,S-замещенных изотиомочевин - 1-изобутаноил-2-изопропилизотиомочевины гидробромид (далее - соединение Т1023) - вводят парентерально за 20-60 мин до радиационного воздействия в дозе 0,2-0,4 ЛД50.
Соединение Т1023 - производное изотиомочевины (фиг. 1), водорастворимое, умеренно токсичное соединение (для мышей при внутрибрюшинном (в/б) введении ЛД16, ЛД50 и ЛД84 составляют 268, 410 и 552 мг/кг), являющееся эффективным субстрат-подобным, конкурентным ингибитором NOS с умеренной селективностью к эндотелиальной и индуцибельной изоформам NOS (ИК50 для nNOS, iNOS и eNOS составляют 40,2, 3,2 и 5,1 мкмоль).
Недостатком прототипа является то, что указанное соединение в дозах 0,2-0,4 ЛД50 может вызывать нежелательные побочные реакции у ослабленных людей и онкологических больных.
Технический результат предлагаемого изобретения заключается в снижении токсичности и обеспечении эффективной защиты пациентов при радиотерапевтическом облучении, а также при радиационных инцидентах.
Проведенные нами экспериментальные исследования свидетельствуют о том, что соединение Т1023 при парентеральном введении в высоких дозах (от 1/8 ЛД16) оказывает выраженное сосудосуживающее действие и представляет основу противолучевой активности (Филимонова М.В., Шевченко Л.И., Трофимова Т.П. и др. К вопросу о механизме радиозащитного действия ингибиторов NO-синтаз. Радиац. биол. Радиоэкол. 2014. 54(5): 500-506). Изучение противолучевых свойств Т1023 показало, что соединение является эффективным и относительно безопасным радиопротектором.
В отличие от многих известных радиопротекторов, эффективных только в максимально переносимых дозах, соединение Т1023 проявляет максимальное противолучевое действие уже при дозах порядка 1/4 ЛД16 (75 мг/кг) и при этом в эффективности не уступает цистамину и амифостину - фактор изменения дозы (ФИД) γ-излучения по тесту выживаемости мышей составляет 1,45 (Филимонова М.В., Шевченко Л.И., Макарчук В.М. и др. Радиозащитные свойства ингибитора NO-синтаз Т1023: I. Показатели противолучевой активности и взаимодействие с другими радиопротекторами. Радиац. биол. Радиоэкол. 2015. 55(3): 250-259).
Сущность предлагаемого изобретения на начальном этапе включает парентеральное введение средства с радиопротекторным действием - ингибитора синтаз оксида азота (NOS) из класса N,S-замещенных изотиомочевин - 1-изобутаноил-2-изопропилизотиомочевины гидробромида (далее - соединение Т1023) в дозе от 1/12 до 1/4 ЛД16 за 20-60 мин до радиационного воздействия γ-излучения. Через 10-20 минут после радиационного воздействия осуществляют парентеральное введение 5-метокситриптамина гидрохлорида в дозе от 1/24 до 1/60 ЛД16.
Перечень фигур
Фиг. 1. Структурная формула соединения Т1023
Фиг. 2. Структурная формула соединения 5-метокситриптамина гидрохлорида
Порядок реализации способа.
При реализации способа вначале, за 20-60 минут до радиационного воздействия, обрабатывают область инъекции раствором антисептика, например, 96% раствором этилового спирта. В обработанную область парентерально вводят соединение Т1023 в дозе 1/12-1/4 ЛД16.
В наших экспериментальных исследованиях установлено, что соединение Т1023, благодаря способности эффективно ингибировать эндотелиальную NOS и подавлять в эндотелии сосудов NO/cGMP-сигнальные пути, при парентеральном введении вызывает у подопытных животных вазопрессорный эффект, защитные рефлекторные изменения в гемодинамике (брадикардию и снижение сердечного выброса), приводящие к развитию транзиторной циркуляторной гипоксии, что является основой его выраженной противолучевой эффективности.
Далее, через 10-20 минут после первой инъекции, осуществляют парентеральное введение 5-метокситриптамина гидрохлорида в дозе 1/24-1/60 ЛД16.
5-метокситриптамина гидрохлорид (фиг. 2) имеет сходные с соединением Т1023 вазоактивные и противолучевые свойства. Являясь неселективным миметиком серотониновых рецепторов, он также оказывает выраженное сосудосуживающее действие и в радиозащитных дозах вызывает сходные с Т1023 изменения в гемодинамике, что способно приводить к развитию транзиторной циркуляторной гипоксии. При этом 5-метокситриптамина гидрохлорид является умеренно безопасным и эффективным радиопротектором - при оптимальных радиозащитных дозах порядка 1/6 ЛД16 (20 мг/кг) ФИД γ-излучения по тесту выживаемости мышей составляет от 1,3 до 1,4.
Наряду с очевидным сходством физиологических процессов развития противолучевых эффектов Т1023 и 5-метокситриптамина гидрохлорида, действие этих соединений принципиально различается по молекулярным механизмам. Сосудосуживающий эффект соединения Т1023 развивается вследствие подавления каталитической активности eNOS в клетках эндотелия сосудов, блокирующего NO/cGMP-путь релаксации, что приводит к снижению в миоцитах концентрации cGMP. Сосудосуживающее действие 5-метокситриптамина гидрохлорида реализуется при его взаимодействии с серотониновыми рецепторами гладкомышечных клеток сосудов, активирующим аденилатциклазный путь, что приводит к росту в миоцитах концентрации сАМР. Рассматриваемые процессы совмещаются на конечных этапах сокращения миофибрилл и проявляются в виде повышения концентрации Са+2 в цитоплазме миоцитов, фосфорилирования легких цепей миозина, а также формирования актин-миозиновых сшивок.
Полученные результаты вазопрессорного действия, протекающие по различным путям, приводят не только к аддитивному, но и к синергическому эффекту, который взаимно усиливает противолучевое действие при сочетанном применении соединений Т1023 и 5-метокситриптамина гидрохлорида. Об этом свидетельствуют приведенные ниже результаты экспериментальных исследований.
Примеры реализации способа.
Пример 1
В первой серии опытов проводилось изучение противолучевых эффектов по методу селезеночных эндоколоний при раздельном и сочетанном введении соединения Т1023 и 5-метокситриптамина гидрохлорида в различных дозах.
Исследования выполнены на 196 самцах мышей-гибридов F1 (CBA×C57BL/6), распределенных методом рандомизации в 10 экспериментальных групп (по 19-20 особей в каждой): контрольную и девять подопытных. Все животные получали общее воздействие γ-излучения в дозе 6 Гр на установке «Луч-1» с источником 60Сo (Россия) при мощности дозы 10 мГр/с. Животным подопытных групп перед облучением проводилось раздельное или сочетанное однократное в/б введение изучаемых веществ: соединения Т1023 в дозах 25-75 мг/кг в виде 0,25-0,75% раствора; 5-метокситриптамина гидрохлорида в дозах 5-20 мг/кг в виде 0,05-0,25% раствора (дозы соединений и их сочетания отражены в табл. 1). При раздельном применении вещества вводили за 30 мин до облучения, при сочетанном применении Т1023 вводили за 30 мин, а 5-метокситриптамина гидрохлорид - за 15 мин до лучевого воздействия. Определение числа эндогенных колониеобразующих единиц в селезенке (КОЕ-С-8), отражающего количество жизнеспособных гемопоэтических стволовых клеток, проводили стандартным методом на 8-е сутки после радиационного воздействия.
Результаты показали, что во всех подопытных группах мышей, получавших раздельное или сочетанное воздействие Т1023 и 5-метокситриптамина гидрохлорида, наблюдался отчетливый противолучевой эффект, проявлявшийся статистически достоверным увеличением числа селезеночных эндоколоний, в сравнении с контрольными облученными животными (табл. 1). Т1023 и 5-метокситриптамина гидрохлорид при их раздельном применении в оптимальных радиозащитных дозах (75 и 20 мг/кг, соответственно) в данном опыте реализовали характерный для этих соединений противолучевой эффект, проявляющийся 4-5-кратным повышением числа жизнеспособных колониеобразующих гемопоэтических клеток. Более того, практически при всех использованных вариантах сочетанного воздействия (от оптимальных доз - 75/20 мг/кг, до малых доз - 25/5 мг/кг) наблюдалось 1,5-2-кратное, статистически достоверное повышение радиозащитного действия в сравнении с самостоятельным действием Т1023 и 5-метокситриптамина гидрохлорида, и количественная выраженность противолучевого действия при всех сочетаниях была равноэффективной (статистически не различалась).
При сочетании оптимальных радиозащитных доз Т1023 и 5-метокситриптамина гидрохлорида реализовалось аддитивное противолучевое действие этих радиопротекторов -расчетный уровень аддитивного эффекта для данного опыта при независимом действии Т1023 в дозе 75 мг/кг и 5-метокситриптамина гидрохлорида в дозе 20 мг/кг (31,9±6,2) статистически совпадал с наблюдаемыми показателями в группе, получавшей сочетанное воздействие в этих дозах.
Особый интерес в данном опыте вызывает наличие выраженного эффекта в группе, получавшей Т1023 и 5-метокситриптамина гидрохлорида в низких дозах (25 и 5 мг/кг), не вызывающих значимого радиозащитного эффекта при их изолированном применении. И высокий противолучевой эффект при таком сочетании свидетельствует о синергическом, взаимно усиливающем фармакодинамическом взаимодействии Т1023 и 5-метокситриптамина гидрохлорида. Кроме того, очевидно, что обеспечение равноэффективного действия меньшими дозами фармакологических средств более целесообразно и с точки зрения безопасности воздействия.
Примечания. Статистически значимое различие (р<0,05) по критерию Данна: 1 - с контролем; 2 - с группой, получавшей только Т1023; 3 - с группой, получавшей только 5-МТ.
Пример 2.
Исследование противолучевой эффективности и характера фармакодинамического взаимодействия при сочетанном применении соединения Т1023 в дозе 25 мг/кг и 5-метокситриптамина гидрохлорида в дозе 5 мг/кг проведено методом экзогенных селезеночных эндоколоний.
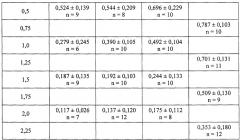
Исследования выполнены на 189 самцах мышей-гибридов F1 (CBA×C57BL/6). Радиационное воздействие на животных осуществляли в тех же физико-дозиметрических условиях, как и в примере 1. Мышей-реципиентов подвергали воздействию γ-излучения в дозе 8 Гр за 1 сутки до трансплантации костного мозга. Мышей-доноров облучали в дозах 0,5-2,25 Гр за 1 сутки до извлечения костного мозга. При этом донорам подопытных групп по схеме, аналогичной Примеру 1, вводили раздельно и сочетано соединение Т1023 в дозе 25 мг/кг и 5-метокситриптамина гидрохлорида в дозе 5 мг/кг. Трансплантацию костного мозга проводили реципиентам путем в/в введения суспензии 105 кариоцитов. Подсчет числа экзогенных колоний в селезенке мышей-реципиентов и расчет выживаемости колониеобразующих гемопоэтических клеток (КОЕ-С-8) в костном мозге мышей-доноров проводили на 8-е сутки после трансплантации.
Полученные в этом опыте показатели выживаемости КОЕ-С-8 во всех экспериментальных группах носили отчетливую экспоненциальную зависимость от дозы воздействия γ-излучения (табл. 2) и с точки зрения статистики надежно описывались часто используемой в радиобиологии простой экспоненциальной регрессией: S=Exp(-D/D0), где S - выживаемость, D - доза лучевого воздействия, D0 - доза, снижающая выживаемость в е раз (табл. 3).
В этой связи, стандартные показатели, характеризующие противолучевой эффект в различных экспериментальных группах в данном опыте были рассчитаны на основе анализа этих регрессий (табл. 4). Полученные результаты свидетельствовали, что соединение Т1023 в дозе 25 мг/кг при самостоятельном применении, как и ожидалось, практически не оказывало противолучевого действия и значимо не повышало выживаемость клоногенных гемопоэтических клеток в костном мозге облученных мышей. В малой дозе (5 мг/кг) 5-метокситриптамина гидрохлорид при самостоятельном применении оказывал статистически достоверный, умеренный радиозащитный эффект - показатель ФИД достигал 1,35. Но в группе животных, получавших сочетанное воздействие, наблюдалось резкое повышение противолучевого эффекта. По сути, в этом опыте при сочетанном применении Т1023 и 5-метокситриптамина гидрохлорида наблюдалась максимально эффективная защита гемопоэтических клеток - показатель ФИД достигал максимального уровня, теоретически возможного для радиопротекторов экстренного действия - 3,02.
Полученные данные также свидетельствуют о наличии синергического, взаимно усиливающего фармакодинамического взаимодействия при сочетанном применении Т1023 в дозе 25 мг/кг и 5-метокситриптамина гидрохлорида в дозе 5 мг/кг. Как показано в табл. 4, наблюдаемые показатели противолучевого эффекта в группе, получавшей сочетанное фармакологическое воздействие, в данном случае более чем в 2 раза превышают уровень аддитивного, независимого действия данных радиопротекторов в таких же дозах.
Пример 3.
Методы, использованные в Примерах 1 и 2, отражают радиозащитное действие в отношении кроветворения - критической системы человека и млекопитающих, поражение которой играет ведущую клиническую роль при среднелетальных и летальных дозах лучевого воздействия. И полученные результаты свидетельствуют, что предложенный способ позволяет обеспечивать высокоэффективную защиту кроветворной системы при воздействии γ-излучения. В то же время значительный практический интерес при разработке радиозащитных средств представляет вопрос об их противолучевой эффективности при сверхлетальных дозах облучения, когда доминирующую клиническую роль играет лучевое поражение кишечного эпителия.
С этой целью было проведено изучение противолучевой эффективности при сочетанном применении соединения Т1023 в дозе 25 мг/кг и 5-метокситриптамина гидрохлорида в дозе 5 мг/кг по тесту 30-суточной выживаемости животных, при котором лучевое воздействие проводится в широком диапазоне - от среднелетальных до сверхлетальных доз.
Исследование проведено на 180 самцах мышей-гибридов F1 (CBA×C57BL/6), разделенных на 12 групп по 15 особей в каждой: 5 контрольных и 7 подопытных. Радиационное воздействие на животных осуществляли в тех же физико-дозиметрических условиях, как и в Примере 1. Мышей контрольных групп подвергали общему воздействию γ-излучения в дозах 6,5-8,5 Гр, мышей подопытных групп облучали в дозах 9-13,8 Гр. При этом животным подопытных групп перед лучевым воздействием проводили сочетанное введение соединения Т1023 в дозе 25 мг/кг и 5-метокситриптамина гидрохлорида в дозе 5 мг/кг по схеме, использованной в Примерах 1 и 2. Далее регистрировали динамику гибели животных в экспериментальных группах, и стандартным методом пробит-анализа, проводили расчет показателей противолучевой эффективности - ЛД50 γ-излучения в группах и показателя ФИД.
Результаты этого исследования подтвердили способность такого сочетанного воздействия эффективно защищать кроветворную систему. Как показано в табл. 5, в дозах облучения, при которых характерно развитие костномозговой формы лучевой болезни (в данном случае - до 10 Гр γ-излучения), данный способ фармакологической защиты обеспечивал выживаемость 100% облученных животных, в то время как в контрольных группах все животные погибали уже при дозе 8,5 Гр. При выходе лучевого воздействия в область сверхлетальных доз (в данном случае - свыше 10 Гр γ-излучения), для которых характерно развитие кишечной формы острой лучевой болезни, радиозащитные возможности такого способа фармакологической защиты достаточно быстро ослабевают (что характерно для подавляющего числа радиопротекторов). Тем не менее, и при дозах облучения 13-14 Гр радиозащитный эффект присутствовал - наблюдалась выживаемость 15-30% животных, тогда как все незащищенные животные при таком уровне лучевого воздействия гибнут уже к 5-7 суткам.
Расчеты средних летальных доз в данном опыте показали, что ЛД50 γ-излучения для контрольных животных составляет 6,69 (5,80÷7,07) Гр, а для мышей, получавших сочетанное воздействие Т1023 и 5-метокситриптамина гидрохлорида - 11,55 (11,02÷12,15) Гр, и показатель ФИД составил 1,73 (1,56÷2,09).
Согласно литературным данным, по данному тесту для таких животных этот показатель у известных эффективных радиопротекторов находится в пределах 1,3-1,5. По данным наших исследований, ФИД соединения Т1023 при самостоятельном применении в оптимальной дозе (75 мг/кг) составляет 1,45, аналогичный показатель 5-метокситриптамина гидрохлорида в дозах 20-30 мг/кг - 1,3-1,4.
Сопоставление этих значений с полученной в данном опыте величиной ФИД, которая обеспечивается при сочетанном применении в 3-4 раза меньших доз действующих компонент, свидетельствует, что предлагаемый способ позволяет в данном случае усилить на 20-30%, специфическую фармакологическую (радиозащитную) эффективность.
Пример 4
При разработке лекарственных средств наряду со специфической эффективностью важным аспектом является их безопасность. Очевидно, что выигрыш в радиозащитной эффективности предложенного способа может быть перечеркнут усилением токсических свойств соединения Т1023 и 5-метокситриптамина гидрохлорида при их сочетанном применении.
Для начальной оценки наличия подобного токсического взаимодействия было проведено сравнительное изучение острой токсичности 5-метокситриптамина гидрохлорида при его самостоятельном применении и острой токсичности 5-метокситриптамина гидрохлорида в сочетании с соединением Т1023 в дозе 25 мг/кг.
Исследование проведено на 60 самцах белых аутбредных мышей по стандартному тесту острой токсичности при однократном в/б введении. Животные были распределены в 12 экспериментальных групп по 5 особей в каждой - 5 контрольных и 7 подопытных. Животным подопытных групп однократно в/б вводили соединение Т1023 в дозе 25 мг/кг и через 15-20 минут однократно в/б вводили раствор 5-метокситриптамина гидрохлорида в дозах 114-298 мг/кг (использованные дозы отражены в табл. 6). Контрольным животным вместо соединения Т1023 в эти же сроки и таким же способом вводили эквивалентный объем физиологического раствора. Дальнейшее наблюдение за животными осуществляли в течение 15 суток. Регистрировали картину интоксикации и сроки гибели животных.
Результаты исследований показали, что как у контрольных животных, так и у животных, предварительно получавших Т1023, 5-метокситриптамина гидрохлорид в использованных дозах вызывал сходную картину острой интоксикации, которая проявлялась одышкой в первые минуты после инъекции и в дальнейшем - заторможенностью и адинамией. С увеличением дозы 5-метокситриптамина гидрохлорида картина интоксикации отягощалась развитием уже в первые 10-20 минут непродуктивного дыхания и судорог, на пике которых регистрировалась гибель. У выживших животных явления интоксикации начинали ослабевать через 90 минут после инъекции. Через 1 сутки после введения 5-метокситриптамина гидрохлорида у выживших животных во всех группах не наблюдалось каких-либо изменений во внешнем виде, поведении, двигательной и пищевой активности в сравнении с интактными животными.
Следует отметить, что у животных, предварительно получавших Т1023, в большей степени отмечались внешние признаки гипоксии периферических тканей - цианотичность слизистых оболочек и кожного покрова, выраженность которых возрастала с увеличением дозы 5-метокситриптамина гидрохлорида.
Показатели 15-суточной выживаемости в контрольных и подопытных группах при равных дозах 5-метокситриптамина гидрохлорида различались слабо (табл. 6). И сопоставление показателей острой токсичности у контрольных и подопытных животных (табл. 7), рассчитанных по этим данным, не выявило признаков усиления токсических свойств 5-метокситриптамина гидрохлорида на фоне предварительного введения соединения Т1023.
Полученные в данном исследовании результаты позволяют утверждать, что сочетанное применение Т1023 в дозе 25 мг/кг и 5-метокситриптамина гидрохлорида в дозе 5 мг/кг, при котором наблюдается синергическое усиление противолучевого действия и достигается радиозащитный эффект, превышающий максимальные эффекты при изолированном применении этих соединений, не сопровождается усилением острой токсичности. И по формальным признакам - в связи со снижением используемых доз компонентов, такое сочетание следует рассматривать, как более безопасное в сравнении Т1023 и 5-метокситриптамина гидрохлорида в оптимальных радиозащитных дозах.
Доказательство достижения технического результата
Представленные в примерах результаты свидетельствуют о том, что способ обеспечивает высокую противолучевую эффективность при сочетанном использовании малых, более безопасных доз противолучевых средств, обладающих сходным вазотропным действием, реализуемым по различным, независимым молекулярным механизмам.
Анализ результатов собственных экспериментальных исследований по сравнению с данными в опубликованной научной литературе свидетельствует, что ингибитор синтаз оксида азота (NOS) из класса N,S-замещенных изотиомочевин - 1-изобутаноил-2-изопропилизотиомочевины гидробромид (соединение Т1023) и 5-метокситриптамина гидрохлорид являются вазоактивными гипоксическими радиопротекторами. Сосудосуживающее действие, лежащее в основе противолучевой активности обоих соединений, реализуется с помощью различных, во многом независимых молекулярных механизмов. Это создает условия для реализации аддитивного (взаимно дополняющего) и синергического (взаимно усиливающего) противолучевого действия этих соединений при их сочетанном применении, соответственно, в оптимальных радиозащитных дозах (75/20 мг/кг) и в меньших дозах (вплоть до - 25/5 мг/кг).
Более того, в экспериментах установлено, что при сочетанном применении этих соединений в относительно малых дозах (Т1023 в дозе 25 мг/кг и 5-метокситриптамина гидрохлорида в дозе 5 мг/кг) наблюдается выраженное радиозащитное действие в отношении кроветворной системы, близкое к максимально возможному - ФИД достигает значения 3,0. И при таком сочетании Т1023 и 5-метокситриптамина гидрохлорида отмечается также и выраженное радиозащитное действие в отношении кишечного эпителия - по выживаемости животных ЛД50 γ-излучения повышается от 6,7 до 11,6 Гр, а показатель ФИД составляет 1,73, что на 20-30% превышает аналогичные показатели при изолированном применении этих соединений.
Важным результатом, свидетельствующим в пользу перспективности предложенного способа фармакологической противолучевой защиты, является установленное в экспериментах отсутствие усиления токсических характеристик (по крайней мере, острой токсичности) при сочетанном применении соединения Т1023 и 5-метокситриптамина гидрохлорида.
Такой результат потенциально способен создать новые возможности для разработки оптимальных по эффективности и безопасности средств и методов фармакологической защиты против ионизирующих излучений, и приемлемых для клинического применения средств и методов профилактики осложнений лучевой терапии злокачественных новообразований.
1. Способ фармакологической защиты от ионизирующих излучений, включающий парентеральное введение средства с радиопротекторным действием - ингибитора синтаз оксида азота (NOS) из класса N,S-замещенных изотиомочевин - 1-изобутаноил-2-изопропилизотиомочевины гидробромида (соединение Т1023), отличающийся тем, что соединение Т1023 вводят в дозе от 1/12 до 1/4 ЛД16 за 20-60 минут до радиационного воздействия и через 10-20 минут после радиационного воздействия вводят 5-метокситриптамина гидрохлорид в дозе от 1/24 до 1/6 ЛД16.
2. Способ по п. 1, отличающийся тем, что путем комбинированного введения малых и безопасных доз указанных фармакологических средств повышают радиозащитное действие от 2 до 3 раз.