Маркеры, ассоциированные с ингибиторами wnt
Иллюстрации
Показать всеПредложенная группа изобретений относится к области фармакогеномики. Предложены способы и набор для прогнозирования чувствительности пациента со злокачественным новообразованием к лечению ингибитором Wnt посредством измерения дифференциальной экспрессии биомаркера Notch1 в образце злокачественного новообразования. Предложено применение ингибитора Wnt 2-[5-метил-6-(2-метилпиридин-4-ил)пиридин-3-ил]-N-[5-(пиразин-2-ил)пиридин-2-ил]ацетамида или его фармацевтически приемлемой соли для лечения пациента со злокачественным новообразованием. Предложены фармацевтические композиции, содержащие указанный ингибитор. Предложенная группа изобретений обеспечивает эффективное определение чувствительности клеток к ингибиторам Wnt посредством использования специфичных биомаркеров. 9 н. и 14 з.п. ф-лы, 16 ил., 1 табл., 8 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области фармакогеномики и применению биомаркеров, применимых в определении чувствительности пациента перед лечением, после ответа пациента после лечения, чувствительности злокачественного новообразования, скрининге соединений, способах лечения и фармацевтической композиции для применения в лечении.
УРОВЕНЬ ТЕХНИКИ
Передача сигнала Wnt является одним из ключевых онкогенных путей во многих злокачественных новообразованиях1,2. После связывания с его рецепторами, белком, родственным рецепторам липопротеинов низкой плотности, 5/6 (LRP5/6) и Frizzled (FZD) (оба являются рецепторами с одним трансмембранным участком, необходимыми для передачи сигнала Wnt), на цитоплазматической мембране лиганд Wnt запускает нарушение механизма деградации β-катенина, состоящего из аксина 2, GSK3, APC и других белков, что приводит к накоплению β-катенина в цитоплазме3. В конечном итоге, повышенные уровни β-катенина приводят к его транслокации в ядро с образованием комплекса с LEF/TCF и запускают нижележащую экспрессию генов3.
Дисрегуляция передачи сигнала1 может происходить в результате мутаций нижележащих компонентов, таких как APC и β-катенин, что хорошо описано при раке толстого кишечника1. Кроме того, при различных злокачественных новообразованиях зарегистрированы гиперэкспрессия лигандов Wnt или костимуляторов, таких как RSPO2/3, или сайленсинг Wnt-ингибирующих генов1,4. Кроме того, мутации общих компонентов пути Wnt, таких как аксин 1/2 или корецепторов RSPO RNF43/ZNFR3, играют потенциально ключевую роль при карциноме поджелудочной железы, карциноме толстой кишки и печеночноклеточной карциноме4-6. При ненаправленных и направленных мутациях пути Wnt в моделях на животных наблюдали функционирование передачи онкогенного сигнала этого пути7,8. В дополнение к каноническому пути Wnt, появляются данные о том, что неканоническая передача сигнала Wnt через FZD и VANGL является критической для различных аспектов образования опухоли, включая клеточную миграцию и метастазирование9.
Активности канонической и неканонической передачи сигнала Wnt зависят от лиганда Wnt. При биосинтезе лигандов Wnt Wnt подвергается посттрансляционному ацилированию, опосредованному поркупином (PORCN), мембраносвязанной O-ацилтрансферазой3,10. PORCN является специфичным и предназначен для посттрансляционного ацилирования Wnt, необходимого для последующего секреции Wnt11. Утрата PORCN приводит к ингибированию активности передачи сигнала, запускаемой лигандом Wnt, на моделях нокаутных мышей12,13. У людей мутация с потерей функции (LoF) гена PORCN вызывает фокальную гипоплазию кожи, X-сцепленное доминантное нарушение, ассоциированное с множеством наследственных аномалий у гетерозигот и индивидуумов с мозаицизмом по гену PORCN. Этот фенотип согласуется с ролью пути передачи сигнала Wnt в течение эмбриогенеза и развития14,15.
К настоящему времени успех терапевтического воздействия на передачу сигнала Wnt ограничен. Главным образом, это происходит из-за отсутствия эффективных терапевтических средств для мишеней в пути Wnt и отсутствия определенной популяции пациентов, которые были бы чувствительны к ингибитору Wnt. В результате различий в сложном каскаде механизмов регуляции клеточного цикла и дифференциальной экспрессии гена различные типы злокачественных новообразований могут по-разному отвечать на одно и то же активное соединение. Данные о специфичных биомаркерах, свидетельствующие о чувствительности клеток к терапии ингибитором PORCN или ингибитором Wnt, также немногочисленны.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к анализу того, что Notch1, Notch2, Notch3, AXIN2, LEF1, NKD1, SFRP2, FRZB, SFRP4, DKK2, FAM58A, FLJ43860, CDKN2A, CCDC168, ZNF527, HRAS, FAT1, OR7G3, WNT1 1, WNT10A, WNT3, WNT7A и/или DTX3L действуют как специфичные биомаркеры при определении чувствительности клеток к ингибиторам Wnt. Изобретение относится к анализу того, что по меньшей мере один из биомаркеров, выбранных из таблицы 1, представляет собой "генетическую сигнатуру" для ингибитора Wnt, обладающую повышенной точностью и специфичностью при прогнозировании того, какие злокачественные клетки или злокачественные новообразования будут чувствительными к ингибитору Wnt. С помощью способа анализируют экспрессию, экспрессию гена, мутационный статус, уровень белка или функцию по меньшей мере одного из биомаркеров, выбранных из таблицы 1, в образце злокачественного новообразования, взятого у пациента и сравниваемого с контролем, и прогнозируют чувствительность образца злокачественного новообразования к ингибитору Wnt. Профиль изменений уровня экспрессии может свидетельствовать о благоприятном ответе или неблагоприятном ответе. Кроме того, генетическая сигнатура, выбранная из таблицы 1, имеет повышенное прогностическое значение, т.к. она также свидетельствует о том, что путь Wnt является функциональным. Изобретение также относится к примеру "персонализированной медицины", где пациентов лечат с учетом функциональной геномной сигнатуры, специфичной для этого индивидуума.
Прогностическое значение по меньшей мере одного биомаркера, представленного в настоящем описании, также можно использовать после лечения ингибитором Wnt для определения того, остается ли пациент чувствительным к лечению. После введения ингибитора Wnt биомаркеры используют для мониторинга сохраняющейся чувствительности пациента к лечению ингибитором Wnt. Изобретение также относится к позитивной или негативной регуляции экспрессии идентифицированных генов до и после лечения ингибитором Wnt. Это также применимо в определении того, проводят ли пациентам правильный курс лечения. Изобретение включает способ прогнозирования и мониторинга чувствительности пациента к лечению ингибитором Wnt. Способ включает этап введения ингибитора Wnt пациенту и измерение экспрессии гена-биомаркера в биологическом образце, взятом у пациента. Ответ пациента оценивают с учетом детекции экспрессии гена по меньшей мере одного биомаркера, выбранного из таблицы 1. Детекция и/или изменение уровня экспрессии по меньшей мере одного биомаркера по сравнению с контролем свидетельствует о чувствительности пациента к лечению. Профиль изменений уровня экспрессии может свидетельствовать о благоприятном ответе пациента или неблагоприятном ответе пациента.
Изобретение также относится к ингибиторам Wnt для применения в лечении рака головы и шеи. В частности, хороший терапевтический ответ прогнозируют у пациентов, в образцах злокачественных новообразований которых имеет место дифференциально негативно регулируемая экспрессия по меньшей мере одного биомаркера, выбранного из таблицы 1, по сравнению с контролем.
Аспекты, характерные черты и варианты осуществления настоящего изобретения приведены в следующих пунктах, и их можно использовать соответствующим образом по отдельности или в комбинации:
1. Способ прогнозирования чувствительности пациента со злокачественным новообразованием к лечению ингибитором Wnt, включающий:
a) получение образца злокачественного новообразования от пациента со злокачественным новообразованием;
b) измерение дифференциальной экспрессии гена по меньшей мере одного биомаркера, выбранного из таблицы 1, в образце злокачественного новообразования, полученном от пациента; и
c) сравнение дифференциальной экспрессии гена по меньшей мере одного биомаркера с экспрессией гена указанного биомаркера в контрольном образце;
d) определение корреляции повышения или снижения экспрессии гена при сравнении с чувствительностью пациента к лечению ингибитором Wnt.
2. Способ лечения пациента со злокачественным новообразованием ингибитором Wnt, включающий:
a) получение образца злокачественного новообразования от пациента со злокачественным новообразованием;
b) измерение дифференциальной экспрессии гена по меньшей мере одного биомаркера, выбранного из таблицы 1, в образце злокачественного новообразования, полученном от пациента;
c) сравнение дифференциальной экспрессии гена по меньшей мере одного биомаркера с экспрессией гена биомаркера в контрольном образце;
d) определение чувствительности пациента к ингибитору Wnt; и
e) введение эффективного количества ингибитора Wnt пациенту, которого определяли как чувствительного к ингибитору Wnt.
3. Способ прогнозирования чувствительности злокачественной клетки к ингибитору Wnt, включающий: a) измерение дифференциальной экспрессии гена по меньшей мере одного биомаркера, выбранного из таблицы 1, в клетке; b) сравнение дифференциальной экспрессии гена по меньшей мере одного биомаркера, выбранного из таблицы 1, с экспрессией гена в нормальной или контрольной клетке;
c) прогнозирование чувствительности злокачественной клетки к ингибитору Wnt на основе сравнения дифференциальной экспрессии гена.
4. Способ определения чувствительности злокачественной клетки к ингибитору Wnt, включающий:
a) приведение злокачественной клетки в контакт по меньшей мере с одним ингибитором Wnt;
b) измерение дифференциальной экспрессии гена по меньшей мере одного биомаркера, выбранного из таблицы 1, в клетке, приведенной в контакт с ингибитором Wnt;
c) сравнение дифференциальной экспрессии гена по меньшей мере одного биомаркера с экспрессией гена биомаркера в необработанной или обработанной плацебо контрольной клетке;
d) определение корреляции повышения или снижения экспрессии по меньшей мере одного биомаркера при сравнении с экспрессией по меньшей мере одного биомаркера в необработанной или обработанной плацебо контрольной клетке с чувствительностью злокачественной клетки к ингибитору Wnt.
5. Способ по любому из пп.1-4, где несколько биомаркеров выбраны из таблицы 1.
6. Способ по любому из пп.1-5, где биомаркер является Notch1.
7. Способ по п.6, где Notch1 содержит мутацию во внеклеточном домене.
8. Способ по любому из пп.1-7, где сравнение дифференциальной экспрессии гена по меньшей мере одного биомаркера с экспрессией гена в контрольном образце свидетельствует о функциональном пути Wnt.
9. Способ по любому из пп.1-8, где злокачественное новообразование является плоскоклеточной карциномой головы и шеи.
10. Способ по п.2 или 4, где злокачественное новообразование лечат ингибитором Wnt и наблюдают дифференциальную экспрессию аксина 2, LEF1 и/или NKD1 по сравнению с экспрессией в образце злокачественного новообразования, чувствительном к ингибитору Wnt.
11. Способ по любому из пп.1-10, где IC50 злокачественной клетки, приведенной в контакт по меньшей мере с одним ингибитором Wnt, составляет менее 1 мкМ, предпочтительно менее 0,5 мкМ, более предпочтительно менее 0,2 мкМ.
12. Способ по п.11, где клетку приводят в контакт с ингибитором Wnt по меньшей мере в два разных момента времени.
13. Способ по любому из пп.4, 11 или 12, где на этапе a) клетку приводят в контакт с двумя различными ингибиторами Wnt одновременно или последовательно.
14. Способ по любому из пп.4 или 11-13, где этапы b) и c) повторяют в моменты времени, выбранные из группы, состоящей из: 4 часов, 8 часов, 16 часов, 24 часов, 48 часов, 3 дней, 1 недели, 1 месяца и нескольких месяцев после введения каждой дозы ингибитора Wnt.
15. Ингибитор Wnt для применения в лечении злокачественного новообразования у пациента, где пациента выбирают на основе:
a) измерения дифференциальной экспрессии гена по меньшей мере одного биомаркера, выбранного из таблицы 1, в образце злокачественного новообразования, полученного от пациента;
b) сравнения дифференциальной экспрессии гена по меньшей мере одного биомаркера с экспрессией гена биомаркера в контрольном образце;
c) определения чувствительности пациента к ингибитору Wnt; и
d) выбора пациента, чувствительного к ингибитору Wnt.
16. Ингибитор Wnt для применения в лечении злокачественного новообразования у пациента, имеющего дифференциальную экспрессию гена по меньшей мере одного биомаркера, выбранного из таблицы 1, по сравнению с экспрессией гена в контроле, где дифференциальная экспрессия гена коррелирует с тем, что пациент является чувствительным к ингибитору Wnt.
17. Ингибитор Wnt для применения в лечении злокачественного новообразования по пп.15 или 16, где несколько биомаркеров выбраны из таблицы 1.
18. Ингибитор Wnt для применения в лечении злокачественного новообразования по любому из пп.15-17, где биомаркер является Notch1.
19. Ингибитор Wnt для применения в лечении злокачественного новообразования по любому из пп.15-18, где Notch1 содержит мутацию во внеклеточном домене.
20. Ингибитор Wnt для применения в лечении злокачественного новообразования по любому из пп.15-19, где злокачественное новообразование является плоскоклеточной карциномой головы и шеи, предпочтительно, образец злокачественного новообразования после лечения ингибитором Wnt демонстрирует экспрессию аксина 2, LEF1 и/или NKD1 образца злокачественного новообразования, чувствительного к ингибитору Wnt.
21. Фармацевтическая композиция, содержащая ингибитор Wnt, для применения в лечении злокачественного новообразования у пациента, где пациента выбирают на основе наблюдения экспрессии гена по меньшей мере одного биомаркера, выбранного из таблицы 1, в образце злокачественных клеток, полученном от указанного пациента, по сравнению с нормальным контрольным образцом клеток, где дифференциальная экспрессия гена коррелирует с тем, что пациент является чувствительным к ингибитору Wnt.
22. Фармацевтическая композиция, содержащая ингибитор Wnt, для применения в лечении злокачественного новообразования у пациента, демонстрирующего дифференциальную экспрессию гена по меньшей мере одного биомаркера, выбранного из таблицы 1, по сравнению с экспрессией гена в контроле, где дифференциальная экспрессия гена коррелирует с тем, что пациент является чувствительным к ингибитору Wnt.
23. Фармацевтическая композиция, содержащая ингибитор Wnt, для применения в лечении злокачественного новообразования по пп.21 или 22, где несколько биомаркеров выбраны из таблицы 1.
24. Фармацевтическая композиция, содержащая ингибитор Wnt, для применения в лечении злокачественного новообразования по любому из пп.21-23, где биомаркер является Notch1.
25. Фармацевтическая композиция, содержащая ингибитор Wnt, для применения в лечении злокачественного новообразования по любому из пп.21-24, где Notch1 содержит мутацию во внеклеточном домене.
26. Фармацевтическая композиция, содержащая ингибитор Wnt, для применения в лечении злокачественного новообразования по любому из пп.21-25, где злокачественное новообразование является плоскоклеточной карциномой головы и шеи.
27. Набор для прогнозирования чувствительности пациента со злокачественным новообразованием к лечению ингибитором Wnt, содержащий:
i) средства детекции экспрессии биомаркеров, выбранных из таблицы 1; и
ii) инструкции по применению указанного набора.
28. Применение набора по п.27 для любого из способов по пп.1-14.
29. Ингибитор Wnt для применения в лечении плоскоклеточной карциномы головы и шеи.
30. Ингибитор Wnt для применения в лечении плоскоклеточной карциномы головы и шеи по п.29, где ингибитор Wnt вводят пациенту со злокачественным новообразованием, демонстрирующему дифференциальную экспрессию гена по меньшей мере одного биомаркера, выбранного из таблицы 1, по сравнению с экспрессией гена в контроле, где дифференциальная экспрессия гена коррелирует с тем, что пациент является чувствительным к ингибитору Wnt.
31. Ингибитор Wnt для применения в лечении плоскоклеточной карциномы головы и шеи по п. 30, где биомаркер является Notch1.
32. Способ по любому из пп.1-14, ингибитор Wnt для применения в лечении злокачественного новообразования по любому из пп.15-20, фармацевтическая композиция по любому из пп.21-26 или ингибитор Wnt для применения в лечении плоскоклеточной карциномы головы и шеи по п.29, где ингибитор Wnt вводят в терапевтически эффективном количестве.
33. Ингибитор Wnt для применения в лечении злокачественного новообразования у пациента по любому из пп.15-20, где пациенту вводят терапевтически эффективное количество ингибитора Wnt.
34. Ингибитор Wnt для применения в лечении злокачественного новообразования у пациента по п.33, где терапевтически эффективное количество ингибитора Wnt избирательно вводят пациенту, которого определяли как чувствительного к ингибитору Wnt, или пациенту избирательно вводят терапевтически эффективное количество лекарственного средства, иного, чем ингибитор Wnt, на основе того, что пациент не является чувствительным к ингибитору Wnt.
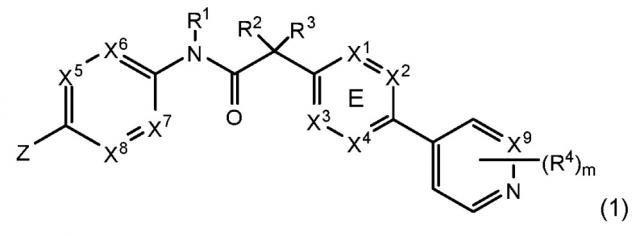
35. Способ по любому из пп.1-14, ингибитор Wnt для применения в лечении злокачественного новообразования по любому из пп.15-20, 33 или 34, фармацевтическая композиция по любому из пп.21-26, набор по п. 27 или ингибитор Wnt для применения в лечении плоскоклеточной карциномы головы и шеи по любому из пп.29-32, где ингибитор Wnt является соединением формулы (1):
или его физиологически приемлемой солью, где:
где X1, X2, X3 и X4 выбран из N и CR7;
один из X5, X6, X7 и X8 является N, а другие являются CH;
X9 выбран из N и CH;
Z выбран из фенила, пиразинила, пиридинила, пиридазинила и пиперазинила; где каждый фенил, пиразинил, пиридинил, пиридазинил или пиперазинил Z необязательно замещен R6-группой; R1, R2 и R3 представляют собой водород;
m является 1;
R4 выбран из водорода, галогена, дифторметила, трифторметила и метила;
R6 выбран из водорода, галогена и -C(O)R10; где R10 является метилом; и
R7 выбран из водорода, галогена, цианогруппы, метила и трифторметила.
36. Способ по любому из пп.1-14, ингибитор Wnt для применения в лечении злокачественного новообразования по любому из пп.15-20, 33 или 34, фармацевтическая композиция по любому из пп.21-26, набор по п. 27 или ингибитор Wnt для применения в лечении плоскоклеточной карциномы головы и шеи по любому из пп.29-32, где ингибитор Wnt является соединением, выбранным из группы N-[5-(3-фторфенил)пиридин-2-ил]-2-[5-метил-6-(пиридазин-4-ил)пиридин-3-ил]ацетамида;
2-[5-метил-6-(2-метилпиридин-4-ил)пиридин-3-ил]-N-[5-(пиразин-2-ил)пиридин-2-ил]ацетамида;
N-(2,3'-бипиридин-6'-ил)-2-(2',3-диметил-2,4'-бипиридин-5-ил)ацетамида;
N-(5-(4-ацетилпиперазин-1-ил)пиридин-2-ил)-2-(2'-метил-3-(трифторметил)-2,4'-бипиридин-5-ил)ацетамида;
N-(5-(4-ацетилпиперазин-1-ил)пиридин-2-ил)-2-(2'-фтор-3-метил-2,4'-бипиридин-5-ил)ацетамида; и
2-(2'-фтор-3-метил-2,4'-бипиридин-5-ил)-N-(5-(пиразин-2-ил)пиридин-2-ил)ацетамида;
или их фармацевтически приемлемой соли.
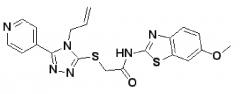
37. Способ по любому из пп.1-14, ингибитор Wnt для применения в лечении злокачественного новообразования по любому из пп.15-20, 33 или 34, фармацевтическая композиция по любому из пп.21-26, набор по п.27 или ингибитор Wnt для применения в лечении плоскоклеточной карциномы головы и шеи по любому из пп.29-32, где ингибитор Wnt является 2-[5-метил-6-(2-метилпиридин-4-ил)пиридин-3-ил]-N-[5-(пиразин-2-ил)пиридин-2-ил]ацетамидом.
38. Любой из пп.1-37, где экспрессия или экспрессия гена является экспрессией ДНК, количеством копий ДНК, экспрессией мРНК, экспрессией кДНК, транскрипцией белка, экспрессией белка, модификацией ДНК, модификацией кДНК, модификацией мРНК, модификацией белка, функцией ДНК, функцией кДНК, функцией мРНК, функцией белка, мутацией ДНК, мутацией кДНК, мутацией мРНК, мутацией белка или их комбинациями; предпочтительно является мутацией ДНК.
39. Любой из пп.1-38, где биомаркер выбран из группы Notch1, Notch2, Notch3, AXIN2, LEF1, NKD1, SFRP2, FRZB, SFRP4, DKK2, FAM58A, FLJ43860, CDKN2A, OR7G3, WNT11, WNT10A, WNT3, WNT7A и DTX3L.
40. Любой из пп.1-38, где биомаркер выбран из группы Notch1, Notch2, Notch3, AXIN2, LEF1, NKD1, SFRP2, FRZB, SFRP4, DKK2, FAM58A, FLJ43860, CDKN2A, CCDC168, ZNF527, HRAS, FAT1, OR7G3, WNT11, WNT10A, WNT3, WNT7A и DTX3L.
41. Любой из пп.1-38, где биомаркер выбран из группы Notch1, Notch2, Notch3, SFRP2, FRZB, SFRP4 и DKK2.
42. Любой из пп.1-38, где биомаркер выбран из группы Notch1, Notch2 и Notch3.
43. Любой из пп.1-38, где биомаркер является Notch1.
44. Любой из пп.1-38, где биомаркер выбран из группы Notch1, Notch2, Notch3, SFRP2, FRZB, SFRP4, DKK2, FAM58A, FLJ43860, CDKN2A, CCDC168, ZNF527, HRAS, FAT1, OR7G3, WNT1 1, WNT10A, WNT3 и WNT7A.
45. Любой из пп.1-38, где биомаркер является HRAS или FAT1.
46. Любой из пп.1-38, где биомаркер выбран из группы, состоящей из FAM58A, FLJ43860, NOTCH1, OR7G3, CCDC168, ZNF527 и CDKN2A.
47. Вариант осуществления любого из пп. 1-38, где биомаркер выбран из группы Notch1, Notch2, Notch3, FAM58A, FLJ43860, CDKN2A, CCDC168, ZNF527, HRAS, FAT1, OR7G3, WNT11, WNT10A, WNT3, WNT7A и DTX3L, предпочтительно из группы Notch1, Notch2, Notch3, FAM58A, FLJ43860, CDKN2A, CCDC168, ZNF527, HRAS, FAT1, OR7G3 и DTX3L.
48. Применение соединения, выбранного из таблицы 1, в качестве биомаркера.
49. Применение соединения, выбранного из группы Notch1, Notch2, Notch3, AXIN2, LEF1, NKD1, SFRP2, FRZB, SFRP4, DKK2, FAM58A, FLJ43860, CDKN2A, OR7G3, WNT11, WNT10A, WNT3, WNT7A и DTX3L, в качестве биомаркера.
50. Применение соединения, выбранного из группы Notch1, Notch2, Notch3, SFRP2, FRZB, SFRP4 и DKK2, в качестве биомаркера.
51. Применение соединения, выбранного из группы Notch1, Notch2 и Notch3, в качестве биомаркера.
52. Применение соединения Notch1 в качестве биомаркера.
53. Применение соединения, выбранного из группы Notch1, Notch2, Notch3, SFRP2, FRZB, SFRP4, DKK2, FAM58A, FLJ43860, CDKN2A, CCDC168, ZNF527, HRAS, FAT1, OR7G3, WNT11, WNT10A, WNT3 и WNT7A, в качестве биомаркера.
54. Применение соединения, выбранного из группы Notch1, Notch2, Notch3, AXIN2, LEF1, NKD1, SFRP2, FRZB, SFRP4, DKK2, FAM58A, FLJ43860, CDKN2A, CCDC168, ZNF527, HRAS, FAT1, OR7G3, WNT11, WNT10A, WNT3, WNT7A и DTX3L, в качестве биомаркера.
55. Применение соединения HRAS или FAT1 в качестве биомаркера.
56. Применение соединения, выбранного из группы, состоящей из FAM58A, FLJ43860, NOTCH1, OR7G3, CCDC168, ZNF527 и CDKN2A в качестве биомаркера.
57. Применение соединения, выбранного из группы Notch1, Notch2, Notch3, FAM58A, FLJ43860, CDKN2A, CCDC168, ZNF527, HRAS, FAT1, OR7G3, WNT11, WNT10A, WNT3, WNT7A и DTX3L, предпочтительно из группы Notch1, Notch2, Notch3, FAM58A, FLJ43860, CDKN2A, CCDC168, ZNF527, HRAS, FAT1, OR7G3 и DTX3L, в качестве биомаркера.
58. Применение соединения по любому из пп.48-57, где применение свидетельствует о чувствительности пациента со злокачественным новообразованием к лечению ингибитором Wnt.
59. Любой из пп.39-42, 44-51 или 53-58, где по меньшей мере два биомаркера, по меньшей мере три или по меньшей мере четыре биомаркера используют совместно для определения чувствительности пациента со злокачественным новообразованием к лечению ингибитором Wnt.
60. Любой из пп.1-59, где
- экспрессия WNT11, WNT10A, WNT3 или WNT7A в образце от пациента является более высокой по сравнению с контролем, указанная экспрессия свидетельствует о чувствительности пациента к лечению ингибитором Wnt;
- экспрессия AXIN2, LEF1 или NKD1 в образце от пациента после лечения снижается по сравнению с контролем до лечения, указанная экспрессия свидетельствует о чувствительности пациента к лечению ингибитором Wnt;
- снижается экспрессия Notch1, Notch2 или Notch3, в частности, активность или функция снижена/повышена в образце от пациента по сравнению с контролем, указанная экспрессия, в частности, снижение активности или функции, свидетельствует о чувствительности пациента к лечению ингибитором Wnt;
- экспрессия SFRP2, FRZB, SFRP4 или DKK2 в образце от пациента является более низкой по сравнению с контролем, указанная экспрессия свидетельствует о чувствительности пациента к лечению ингибитором Wnt;
- экспрессия FAM58A, FLJ43860, CDKN2A, CCDC168, ZNF527, FAT1, OR7G3 или DTX3L является более низкой, в частности, потеря функции является более высокой в образце от пациента по сравнению с контролем, указанная экспрессия, в частности, потеря функции, свидетельствует о чувствительности пациента к лечению ингибитором Wnt;
- экспрессия HRAS является более высокой, в частности, приобретением функции, в образце от пациента по сравнению с контролем, и свидетельствует о чувствительности пациента к лечению ингибитором Wnt.
61. П.60, где ингибитор Wnt определен в любом из пп.35-37.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1A представлена структура СОЕДИНЕНИЯ A. На фигуре 1B представлена структура СОЕДИНЕНИЯ B.
На фигуре 2A представлено связывание 3H-меченого соединения B с PORCN. За специфичное взаимодействие СОЕДИНЕНИЯ B и PORCN может конкурировать немеченое СОЕДИНЕНИЕ B (фигура 2A). На фигуре 2B представлено связывание СОЕДИНЕНИЯ A с PORCN.
На фигуре 3A представлено мощное ингибирование СОЕДИНЕНИЕМ A передачи сигнала Wnt в анализе Wnt посредством совместного культивирования с IC50 0,4 нМ. На фигуре 3B показано, что ингибиторный эффект восстанавливали добавлением кондиционированной среды с экзогенным Wnt3A.
На фигуре 4 показан эффект различных доз СОЕДИНЕНИЯ A по отношению к клеткам 293A, трансфицированным с использованием HA-Wnt3A. Как показано на фигуре 4, СОЕДИНЕНИЕ A мощное снижает избыток HA-Wnt3A в супернатанте, одновременно не действуя на лизат HA-Wnt3A, что позволяет предполагать, что секрецию Wnt3A, по существу, ингибировали СОЕДИНЕНИЕМ A дозозависимым образом.
На фигуре 5A показано, что СОЕДИНЕНИЕ A, фактически, сильно блокирует Wnt-зависимое фосфорилирование LRP6 в аутокринных клетках L-Wnt3A, линии клеток молочной железы мыши, гиперэкспрессирующих Wnt3A. На фигуре 5B показано, что остатки вокруг предполагаемого участка пальмитоилирования Wnt, Ser209, являются консервативными среди всех 19 Wnt. На фигуре 5C показано, что СОЕДИНЕНИЕ A демонстрировало сравнимую ингибиторную активность по отношению ко всем тестируемым Wnt, включая Wnt1, 2, 3, 3A, 6, 7A и 9A.
Фигура 6. Ответ различных клеточных линий по типу злокачественного новообразования на обработку СОЕДИНЕНИЕМ A. Отвечающую клеточную линию определяют как достигающую более чем 50% снижения мРНК AXIN2 после обработки 10-100 нМ СОЕДИНЕНИЯ A в течение 48 часов. Как показано на фигуре 6, линии клеток рака головы и шеи (HNSCC) находятся среди типов злокачественных новообразований, наиболее отвечающих на СОЕДИНЕНИЕ A.
На фигуре 7 показано, что среди клеточных линий HNSCC 31 из 96 демонстрировала ингибирование пути Wnt после обработки СОЕДИНЕНИЕМ A.
На фигуре 8A показано, что СОЕДИНЕНИЕ A мощно ингибировало Wnt-зависимую продукцию AXIN2 в HN30 с IC50 0,3 нМ. На фигуре 8B показано, что СОЕДИНЕНИЕ A сильно снижало колониеобразование HN30, хотя и со сдвинутым вправо IC50.
На фигуре 9A показано, что эффект снижения колониеобразования СОЕДИНЕНИЕМ A можно частично восстанавливать посредством гиперэкспрессии доминантного β-катенина. На фигуре 9B представлено подтверждение того, что клеточный эффект СОЕДИНЕНИЯ A соответствовал ингибированию PORCN-зависимой передачи сигнала Wnt; shRNA против PORCN, по существу, ингибировала экспрессию гена-мишени Wnt AXIN2. На фигуре 9C показано, что shRNA против PORCN также ингибировала колониеобразование клеток HN30 in vitro.
На фигуре 10 представлена противоопухолевая активность СОЕДИНЕНИЯ A in vivo; т.е. на модели подкожного ксенотрансплантата HNSCC HN30 мыши. При введении дозы один раз в сутки СОЕДИНЕНИЕ A индуцировало дозозависимую эффективность и снижало массу опухоли (фигура 10A). После однократной дозы СОЕДИНЕНИЯ A 3 мг/кг уровни экспрессии мРНК AXIN2 в опухолях снижались на ~60-95% в течение 5-10 часов после введения дозы (фигура 10B). Кроме того, как показано на фигуре 10C, уровни pLRP6 в опухолях HN30, по существу, снижались в зависимости от времени.
Фигура 11. Лучшие онкогены или гены опухолевых супрессоров, имеющие мутации, в наборе клеточных линий HNSCC.
Фигура 12. Лучшие гены-кандидаты, мутации с потеря функции которых в совокупности наилучшим образом коррелировали с данными об ответ PD на СОЕДИНЕНИЕ A, из клеточных линий HNSCC.
На фигуре 13A и фигуре 13B показаны часто встречающиеся мутации с потерей функции (LoF) Notch1 в отвечающих на СОЕДИНЕНИЕ A клеточных линиях рака головы и шеи. A) Диаграммы потенциальных мутаций LoF Notch1 в клеточных линиях рака головы и шеи. N: N-конец; C: C-конец; LNR: повтор Lin12-Notch; TMD: трансмембранный домен; PEST: домен, богатый пролином, глутаминовой кислотой, серином, треонином (PEST). Мутации со сдвигом рамки считывания (fs) и нонсенс-мутации (X) включают E488fs, A495fs, K538fs, G192X, P460fs, E216X и выделены красным цветом. B) Список мутации со сдвигом рамки считывания и нонсенс-мутаций Notch1 в клеточных линиях рака головы и шеи. C) C478F Notch1 демонстрировала полное снижение активности по сравнению с диким типом при анализе репортерного гена Notch1 со стимуляцией DLL1 или без нее.
На фигуре 14 представлена эффективность СОЕДИНЕНИЯ A in vivo. В модели ксенотрансплантата мыши SNU1076 СОЕДИНЕНИЕ A в дозе 5 мг/кг значительно снижало рост опухоли (T/C: 25%) через 14 дней после введения (фигура 14A). СОЕДИНЕНИЕ A по существу ингибировало путь Wnt, на что указывает 70% снижение AXIN2 (фигура 14B).
На фигуре 15 представлены мутации FAT1 в клеточных линиях рака головы и шеи. Мутации FAT1 повышены в отвечающих на СОЕДИНЕНИЕ A клеточных линиях рака головы и шеи.
На фигуре 16 представлены мутации HRAS в клеточных линиях рака головы и шеи. Мутации HRAS повышены в отвечающих на СОЕДИНЕНИЕ A клеточных линиях рака головы и шеи.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Как применяют в описании и формуле изобретения, единственное число включает ссылки на множественное число, если контекст четко не указывает на иное. Например, термин "клетка" включает множество клеток, включая их смеси.
Все численные обозначения, например, pH, температура, время, концентрация и молекулярная масса, включая диапазоны, являются приближениями, варьирующимися (+) или (-) с шагом 0,1. Следует понимать, хотя это и не всегда явно указано, что всем численным обозначениям предшествует термин "приблизительно". Также следует понимать, хотя это и не всегда явно указано, что реагенты, представленные в настоящем описании, являются исключительно примерами, и что в этой области известны их эквиваленты.
В настоящем описании термины "маркер" или "биомаркер" используют взаимозаменяемо. Биомаркер является нуклеиновой кислотой или полипептидом и наличием, отсутствием или дифференциальной экспрессией нуклеиновой кислоты или полипептида, параметром, с помощью которого описывают количество генов, мутацию, функцию или активность гена или белка, и его используют для определения чувствительности к любому ингибитору Wnt. Например, Notch1 является биомаркером, и экспрессия мРНК Notch1 в образце злокачественных клеток снижается по сравнению с экспрессией Notch1 в нормальной (неопухолевой) ткани или контрольной ткани.
Термин "PORCN" относится к поркупину, мембраносвязанной ацилтрансферазе, необходимой для посттрансляционной модификации Wnt. Как применяют в настоящем описании, если конкретно не указано иначе, PORCN относится к PORCN человека под регистрационными номерами NM_017617.3/NP_060087 (4851/P46531.4).
Термин "Notch1" относится к гомологу Notch 1. Он является рецептором с одним трансмембранным доменом в пути передачи сигнала Notch. Как применяют в настоящем описании, если конкретно не указано иначе, Notch1 относится к Notch1 человека под регистрационными номерами NM_017617.3/NP_060087/GI:148833508 (4851/P46531.4). Термин "Notch2" относится к нейрогенному локусу, гомологу 2 белка notch, рецептору с одним трансмембранным доменом в пути передачи сигнала Notch. Как применяют в настоящем описании, если конкретно не указано иначе, Notch2 относится к Notch2 человека по регистрационными номерами NM_024408.3/NP_077719/GI:24041035 (4853/Q04721.3). Термин "Notch3" относится к нейрогенному локусу, гомологу 3 белка notch, рецептору с одним трансмембранным доменом в пути передачи сигнала Notch. Как применяют в настоящем описании, если конкретно не указано иначе, Notch3 относится к Notch3 человека под регистрационными номерами NM_000435.2/NP_000426/GI:134244285 (4854/Q9UM47.2).
Термин "AXIN2" относится к белку 2 ингибирования AXIS. Он является цитозольным белком с важной ролью в регуляции стабильности бета-катенина. Как применяют в настоящем описании, если конкретно не указано иначе, AXIN2 относится к AXIN2 человека под регистрационными номерами NM_004655.3/NP_004646/GI:195927059 (8313/Q9Y2T1).
Термин "LEF1" относится к лимфоидному энхансер-связывающему фактору-1. Он является ядерным белком, образующим комплекс с β-катенином и запускающим нижележащую экспрессию гена-мишени. Как применяют в настоящем описании, если конкретно не указано иначе, LEF1 относится к LEF1 человека под регистрационными номерами NM_016269/NP_001124185/GI:7705917 (51 176/Q9UJU2.1).
Термин "NKD1" относится к naked cuticle 1. Он является цитозольным белком, взаимодействующим с Disheveled. Как применяют в настоящем описании, если конкретно не указано иначе, NKD1 относится к NKD1 человека под регистрационными номерами NM_0331 19/NPJ49110/GI:14916433 (85407/Q969G9.1).
Термин "SFRP2" относится к секретируемому frizzled-родственному белку 2. Он является растворимым модулятором передачи сигнала Wnt. Как применяют в настоящем описании, если конкретно не указано иначе, SFRP2 относится к SFRP2 человека под регистрационными номерами NM_003013.2/NP_003004/GI:48475052 (6423/Q96HF1.2).
Термин "FRZB" относится к frizzled-родственному белку, также растворимому модулятору передачи сигнала Wnt. Как применяют в настоящем описании, если конкретно не указано иначе, FRZB относится к FRZB человека под регистрационными номерами NM_001463.3/NP_001454/GI:38455388 (2487/Q92765.2).
Термин "SFRP4" относится к секретируемому frizzled-родственному белку 4, также растворимому модулятору передачи сигнала Wnt. Как применяют в настоящем описании, если конкретно не указано иначе, SFRP4 относится к SFRP4 человека под регистрационными номерами NM_003014.3/NP_003005/GI:170784838 (6424/Q6FHJ7.2).
Термин "DKK2" относится к dickkopf-родственному белку 2, также растворимому модулятору передачи сигнала Wnt. Как применяют в настоящем описании, если конкретно не указано иначе, DKK2 относится к DKK2 человека под регистрационными номерами NM_014421.2/NP_055236/GI:7657023 (27123/Q9UBU2.1).
Термин "WNT11" относится к WNT11. Он является секретируемым белком-лигандом Wnt. Как применяют в настоящем описании, если конкретно не указано иначе, WNT11 относится к WNT11 человека под регистрационными номерами NM_004626.2/NP_004617/GI:17017974 (7481/O96014).
Термин "WNT10A" относится к WNT10A, также секретируемому белку-лиганду Wnt. Как применяют в настоящем описании, если конкретно не указано иначе, WNT10A относится к WNT10A человека под регистрационными номерами NM_025216.2/NP_079492/GI: 16936520 (80326/Q9GZT5).
Термин "WNT3" относится к WNT3, также секретируемому белку-лиганду Wnt. Как применяют в настоящем описании, если конкретно не указано иначе, WNT3 относится к WNT3 человека под регистрационными номерами NM_030753.3/NP_110380/GI:13540477 (7473/P56703).
Термин "WNT7A" относится к WNT7A, также секретируемому белку-лиганду Wnt. Как применяют в настоящем описании, если конкретно не указано иначе, WNT7A относится к WNT7A человека под регистрационными номерами NM_004625.3/NP_004616/GI: 7505191 (7476/O00755).
Термин "FAM58A" относится к семейству со схожестью последовательностей 58, члену A. Этот ген содержит домен сворачивания циклинового бокса, может играть роль в контроле циклов деления клеточного ядра. Как применяют в настоящем описании, если конкретно не указано иначе, FAM58A относится к FAM58A человека под регистрационными номерами NM_152274.3/NP_689487/GI:196049382 (92002/Q8N1B3).
Термин "FLJ43860" относится к белку FLJ43860, неохарактеризованному белку с неизвестной функцией. Как применяют в настоящем описании, если конкретно не указано иначе, FLJ43860 относится к FLJ43860 человека под регистрационными номерами NM_207414.2/NP_997297/GI:148727311 (389690/Q6ZUA9).
Термин "CDKN2A" относится к ингибитору 2A циклин-зависимых киназ, ключевому ингибитору для прохождения клеточного цикла. Как применяют в настоящем описании, если конкретно не указано иначе, CDKN2A относится к CDKN2A человека под регистрационными номерами NM_000077.4/NP_478104/GI:4502749 (1029/P42771).
Термин "OR7G3" относится к обонятельному рецептору 7G3, одному из обонятельных сопряженных с G-белком рецепторов (GPCR). Как применяют в настоящем описании, если конкретно не указано иначе, OR7G3 относится к OR7G3 человека под регистрационными номерами NM_001001958.1/NP_001001958/GI:50080201 (390883/Q8NG95).
Термин "DTX3L" относится к Deltex 3-подобной, убиквитиновой лигазе E3, ее гомолог у Drosophila Deltex является положительным регулятором передачи сигнала Notch у Drosophila. Как применяют в настоящем описании, если конкретно не указано иначе, DTX3L относится к DTX3L человека под регистрационными номерами NM_138287.3/NP_612144.1/GI:19923717 (151636/Q8TDB6).
Термин "CCDC168" относится к содержащему биспиральные домены белку 168, является белком с биспиральными доменами. Как применяют в настоящем описании, если конкретно не указано иначе, CCDC168 относится к CCDC168 человека под регистрационными номерами NM_001146197.1/NP_001139669.1/GI:226246553 (643677/Q8NDH2).
Термин "ZNF527" относится к белку 527 с цинковыми пальцами, принадлежащему к семейству белков с цинковыми пальцами. Как применяют в настоящем описании, если конкретно не указано иначе, ZNF527 относится к ZNF527 человека под регистрационными номерами NM_032453.1/NP_115829/GI:149192840 (84503/Q8NB42).
Термин "HRAS" относится к гомологу вирусного онкогена саркомы крыс Harvey, являющемуся небольшим G-белком, активирующим путь MAP-киназ. Как применяют в настоящем описании, если конкретно не указано иначе, HRAS относится к HRAS человека под регистрационными номерами NM_005343.2/NM_176795.3 NM_001130442.1/NP_001123914.1/G1:47117697/G1:194363760/G1:194363761 (3265/P01112).
Термин "FAT1" относится к FAT1, являющемуся протокадгериновым белком, как сообщают, связывающимся с β-катенином и предотвращающим его ядерную транслокацию. Если конкре