5-фтор-2-(4-этоксикарбонилпиперазин-1-ил)-1,3-бензотиазин-4-он, обладающий противотуберкулезной активностью
Иллюстрации
Показать всеИзобретение относится к области органической химии, а именно 5-фтор-2-(4-этоксикарбонилпиперазин-1-ил)-1,3-бензотиазин-4-ону формулы (4), обладающему противотуберкулезной активностью, в том числе по отношению к штаммам микобактерий с множественной лекарственной устойчивостью. Технический результат: получено новое гетероциклическое соединение, обладающее полезными биологическими свойствами. 4 табл., 1 пр.
Реферат
Изобретение касается области медицинской химии и относится к новому производному 1,3-бензотиазин-4-она, а именно 5-фтор-2-(4-этоксикарбонилпиперазин-1-ил)-1,3-бензотиазин-4-ону, который обладает противотуберкулезной активностью и может найти применение в медицине и ветеринарии.
Бактериальные инфекции занимают важное место в структуре социально значимых заболеваний, а туберкулез является одной из 10 ведущих причин смертности. В 2016 г. в мире зафиксировано 10,4 млн новых случаев заражения туберкулезом, а смертность составила 1,7 млн человек, в том числе 0,4 миллиона человек с ВИЧ (WHO Global tuberculosis report 2017; http://www.who.int/tb/publications/global_report/en/2017). В 2016 году 87% новых случаев заболевания туберкулезом произошло в 30 странах с тяжелым бременем туберкулеза. Борьба с туберкулезом является одной из наиболее важных задач отечественного здравоохранения, поскольку в Российской Федерации заболеваемость туберкулезом превышает в 5-8 раз показатели стран Европейского союза. Возросла заболеваемость туберкулезом у детей и подростков, отмечается тенденция роста заболеваемости и смертности женщин в репродуктивном возрасте 25-35 лет. Почти на 40% увеличилось количество больных, зараженных штаммами микобактерий туберкулеза (МБТ) с множественной лекарственной устойчивостью (МЛУ) - штаммами, устойчивыми как минимум к двум основным противотуберкулезным препаратам: изониазиду и рифампицину. По оценкам ВОЗ, произошло 600000 новых случаев туберкулеза с устойчивостью к рифампицину - самому эффективному препарату первой линии, - из которых в 490000 случаях зарегистрирован туберкулез с множественной лекарственной устойчивостью (МЛУ-ТБ) (http://www.who.int/mediacentre/ factsheets/fs104/ru/). Эти данные свидетельствуют, насколько велико социально-экономическое значение разработки новых противотуберкулезных средств.
МБТ гипермутабельна - при попадании внутрь клетки начинаются ее многочисленные мутации, ведущие к ее резистентности, повышению скорости роста и другим неприятным качествам этого патогена. К основным проблемам лечения туберкулеза относятся ограниченность арсенала противотуберкулезных средств и развитие МЛУ.
В настоящее время противотуберкулезные средства представлены препаратами первой линии (изониазид, рифампицин, пиразинамид, этамбутол), а также препаратами второй-третьей линий (стрептомицин, офлоксацин, этионамид, циклосерин, линезолид и др.). Новые производные 2-циклоалкилимино-6-трифторметил-8-нитро-1,3-бензотиазин-4-она - препараты BTZ-043 и PBTZ-169, находятся на стадии клинических испытаний противотуберкулезной активности [S. Chetty, М. Ramesh, A. Singh-Pillay, M.E.S. Soliman. Recent advancements in the development of anti-tuberculosis drugs // Bioorg. Med. Chem. Lett. 2017. V. 27. P. 370-386]. Обнаружен синергетический эффект одного из исследуемых препаратов - PBTZ-169, с бедаквиллином (новым противотуберкулезным препаратом группы диарилхинолинов) (http://www.newtbdrugs.org).
Главной мишенью бензотиазинонов является фермент декапренилфосфорил-β-D-рибоза-2-эпимераза (DprE1), который катализирует эпимеризацию декапренилфосфорил-β-D-рибозы (DPR) в декапренилфосфориларабинозу (DPA) - ключевой интермедиат в синтезе арабинана клеточной стенки МБТ [S. Glover, L.J. Alderwick, А.K. Mishra, K. Krumbach, J. Marienhagen, L. Eggeling, A. Bhatt, G.S.J. Besra. Benzothiazinones Mediate Killing of Corynebacterineae by Blocking Decaprenyl Phosphate Recycling Involved in Cell Wall Biosynthesis // Biolog. Chem. 2014. V. 289. P. 6177-6187].
Повышенное внимание к новым фторорганическим соединениям, включая фторсодержащие бензазины, обусловлен их уникальными физико-химическими и биологическими свойствами, такими как способность ингибировать специфичные ферменты и проникать через клеточные мембраны, а также повышенная растворимость в липидах. Атом фтора в ароматическом кольце является уникальным модулятором биологических свойств, что обусловлено такими свойствами атома фтора, как электроотрицательность, небольшой размер, липофильность, способность к электростатическим взаимодействиям. Введение атомов фтора в молекулы биологически активных веществ эффективно используют для блокировки метаболического окисления под действием ферментов-цитохромов Р450.
Благодаря введению атома фтора в 4-оксо-1,4-дигидрохинолин-3-карбоновые кислоты было разработано новое поколение антибактериальных препаратов, так называемых "фторхинолонов". В настоящее время на фармацевтическом рынке около 25% лекарственных препаратов и более 30% агрохимикатов представляют собой фторорганические производные [J. Wang, М. , J. L. , С.delPozo, A.E. Sorochinsky, S. Fustero, V.A. Soloshonok, H. Liu. Fluorine in Pharmaceutical Industry: Fluorine-Containing Drugs Introduced to the Market in the Last Decade (2001-2011) // Chem. Rev. 2014. V. 114. P. 2432-2506].
Синтез новых соединений, сочетающих в одной молекуле фторбензольный и 2-циклоалкилимино-1,3-тиазин-4-оновый фрагменты, может представлять интерес с точки зрения расширения спектра их действия на патоген.
Задача предлагаемого изобретения - поиск нового соединения с высокой антимикобактериальной активностью, в том числе по отношению к мультирезистентным штаммам микобактерий, расширяющего арсенал известных противотуберкулезных средств.
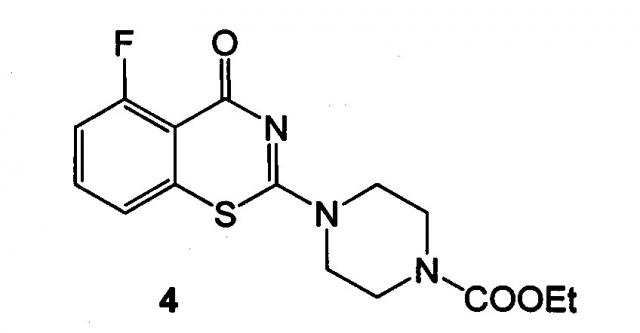
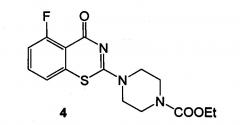
Техническим результатом данного изобретения является создание нового химического соединения - 5-фтор-2-(4-этоксикарбонилпиперазин-1-ил)-1,3-бензотиазин-4-она формулы (4):
Соединение 4, его физико-химические характеристики, а также способ его получения в литературе не описаны.
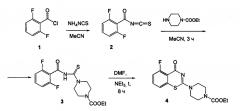
Соединение формулы (4) может быть получено в три стадии из доступного 2,6-дифторбензоилхлорида (1).
Соединение 1 нагревают с роданистым аммонием в ацетонитриле при температуре 40°C, в результате получают 2,6-дифторбензоилизотиоцианат (2). Далее осуществляют взаимодействие изотиоцианата 2 с этиловым эфиром 1-пиперазинкарбоновой кислоты в ацетонитриле при комнатной температуре в течение 3 ч с образованием 2,6-дифтор-N-(4-этоксикарбонилпиперазин-1-карботиоил)бензамида (3). Целевой бензотиазинон 4 получают внутримолекулярной циклизацией соединения 3 при кипячении в диметилформамиде в присутствии триэтиламина в течение 8 ч.
Характеристики соединений приведены в примерах конкретного выполнения.
Структуры соединений подтверждают методами элементного анализа, ЯМР 1Н, 19F и масс-спектрами. Элементный анализ выполняют на автоматическом CHNS-O анализаторе РЕ 2400 серия II (Perkin Elmer). Спектры ЯМР 1Н регистрируют на приборе Bruker DRX-400 (400 МГц) в ДМСО-d6 с SiMe4 в качестве внутреннего стандарта при 25°C. Химические сдвиги (δ) приводят в миллионных долях (м.д.), а константы спин-спинового взаимодействия (J) в герцах. Спектры ЯМР 19F регистрируют на приборах Bruker Avance 500 (500 МГц) в ДМСО-d6. Химические сдвиги (δ) приводят в миллионных долях (м.д.). Масс-спектры регистрируют на спектрометре Shimadzu GCMS-QP 2010 «Ultra». Условия съемки: энергия ионизирующих электронов 70 эВ, прямой ввод образца в источник. Температуры плавления соединений определяют на приборе Stuart SMP3 (Barloworld Scientific).
Примеры конкретного выполнения.
Пример 1. Синтез 5-фтор-2-(4-этоксикарбонилпиперазин-1-ил)-1,3-бензотиазин-4-она (4).
Стадии 1-2. Синтез 2,6-дифтор-N-(4-этоксикарбонилпиперазин-1-карботиоил)бензамида (3).
К раствору 2,6-дифторбензоилхлорида 1 (1.13 мл, 1.587 г, 9 ммоль) в ацетонитриле (3 мл) добавляют раствор роданистого аммония (0.684 г, 9 ммоль) в ацетонитриле (27 мл). Реакционную смесь перемешивают при 40°C в течение 5 мин, осадок NH4Cl отфильтровывают, и к раствору 2,6-дифторбензоилизотиоцианата 2 добавляют этиловый эфир 1-пиперазинкарбоновой кислоты (1.318 мл, 1.42 г, 9 ммоль). Смесь перемешивают при комнатной температуре в течение 3 ч, затем концентрируют в вакууме. Остаток промывают диэтиловым эфиром (8 мл) и перекристаллизовывают из этанола. Выход 2.67 г (83%), т.пл. 154-156°C.
Найдено, %: С 50.35; Н 4.71; N 11.83. Вычислено для C15H17F2N3O3S (М 357.32), %: С 50.41; Н 4.79; N 11.76.
Спектр ЯМР1Н (400 МГц, ДМСО-d6): 1.26 (т, 3Н, СН3), 3.57 (м, 4Н, N(CH2)2), 3.72 (м, 2Н, NCH2), 4.10 (м, 4Н, ОСН2, NCH2), 7.11 (д.д.д, 2Н, Н-3, Н-5, J 10.8, 7.9. 2.5), 7.50 (т.т, 1Н, Н-4, J 8.4, 6.5), 11.3 (уш. с, 1Н, NH).
Спектр ЯМР 19F {1H}(470.5 МГц, DMSO-d6): -113.01 (с).
Стадия 3. Синтез 5-фтор-2-(4-этоксикарбонилпиперазин-1-ил)-1,3-бензотиазин-4-она (4).
К раствору 2,6-дифтор-N-(4-этоксикарбонилпиперазин-1-карботиоил)бензамида (3) (2.55 г, 7.14 ммоль) в ДМФА (6 мл) добавляют триэтиламин (2.14 мл, 14.3 ммоль). Реакционную массу кипятят в течение 8 ч, затем охлаждают. Выпавший осадок отфильтровывают, промывают водой (20 мл) и перекристаллизовывают бензотиазинон (4) из этанола. Выход 1.88 г (78%), т.пл. 172-174°C.
Найдено, %: С 53.35; Н 4.71; N 12.53. Вычислено для C15H16FN3O3S. (М 337.31), %: С 53.40; Н 4.78; N 12.45.
Спектр ЯМР 1Н (400 МГц, ДМСО-d6): 1.27 (т, 3Н, СН3), 3.56 (м, 4Н, N(CH2)2), 3.84 (м, 4Н, N(CH2)2), 4.11 (кв, 2Н, ОСН2), 7.20 (д.д.д, 1Н, Н-6, 3J 10.7, 3J 8.9, 4J 0.5), 7.36 (д.д, 1Н, Н-8, 3J 8.0, 4J 0.5), 7.65 (т.д, 1Н, Н-7, 3J 8.1, 4J 5.0).
Спектр ЯМР 19F {1H} (470.5 МГц, ДМСО-d6): -108.25 (с).
Масс-спектр, m/z (Iотн., > 7%): 337 [М]+ (8), 269 (16), 222 (41), 209 (40), 182 (14), 157 (17), 155 (18), 154 (100), 128 (19), 126 (22), 110 (20), 69 (14), 56 (34), 55 (11), 42 (16).
Биологическая активность
Туберкулостатическую активность изучали в лаборатории экспериментальных и диагностических исследований ФГБУ «Уральского научно-исследовательского института фтизиопульмонологии» Минздрава России (ФГБУ «УНИИФ»), г. Екатеринбург.
Изучение туберкулостатической активности соединений проводят методом вертикальной диффузии с использованием лабораторного штамма H37Rv на плотной питательной среде «Новая».
Питательную среду разливают в пробирки по 5 мл, свертывая в наклонном положении таким образом, чтобы 1/2 часть дна пробирки оставалась свободной. Свернутую среду засевают по 0,1 мл взвеси микобактерий туберкулеза (МБТ) штамма H37Rv, разведенного по стандарту мутности 10 ед. ГКИ, и в наклонном положении помещают в термостат на 24 часа для выращивания МБТ. Через сутки пробирки ставят в вертикальное положение и по свободному краю закапывают по 0,3 мл субстанции раствора соединений в исследуемых концентрациях: 12,5; 6,25; 3,1; 1,5; 0,75 мкг/мл. Затем пробирки помещают в термостат при температуре 37°C и инкубируют в течение 10 суток. Оценку роста МБТ проводят по стандартной методике, где появление зон задержки роста МБТ (более 10 мм) свидетельствует о наличии туберкулостатических свойств в исследуемой концентрации соединений. Величина зоны задержки роста МБТ (в мм) пропорциональна степени туберкулостатической активности соединений. Задержка роста 100 мм и более расценивается как полная задержка роста МБТ. Соединение 4 проявило высокую туберкулостатическую активность в отношении лабораторного штамма H37Rv (таблица 1).
Изучение туберкулостатической активности в отношении резистентных штаммов проводят методом вертикальной диффузии на плотной питательной среде «Новая» с использованием лабораторных и клинических штаммов микобактерий туберкулеза с множественной лекарственной устойчивостью (МЛУ), выделенных от больных, находящихся на лечении в клинике ФГБУ «УНИИФ».
Питательную среду разливают в пробирки по 5 мл, свертывая в наклонном положении таким образом, чтобы 1/2 часть дна пробирки оставалась свободной. Свернутую среду засевают по 0,1 мл суспензией микобактерий различных штаммов, разведенных по стандарту мутности 10 ед. ГКИ, и в наклонном положении помещают в термостат на 24 часа для выращивания МБТ. Через сутки пробирки ставят в вертикальное положение и по свободному краю закапывают по 0,3 мл раствора соединений в исследуемых концентрациях: 12,5; 6,2; 3,1; 1,5; 0,7 мкг/мл. Затем пробирки помещают в термостат при температуре 37°C и инкубируют в течение 10 суток. Оценку роста МБТ проводят по стандартной методике, где появление зон задержки роста МБТ (более 10 мм) свидетельствует о наличии туберкулостатических свойств в исследуемой концентрации соединений. Величина зоны задержки роста МБТ (в мм) пропорциональна степени туберкулостатической активности соединений. Задержка роста 100 мм и более расценивается как полная задержка роста МБТ. Данные представлены в Таблице 1.
Из данных Таблицы 1 следует, что соединение 4 проявляет высокую туберкулостатическую активность (МИК 0,7 мкг/мл) как в отношении лабораторного штамма H37Rv, так и в отношении ряда лекарственно устойчивых штаммов МБТ. Следует подчеркнуть, что соединение 4 проявило активность в отношении штамма МЛУ, в отношении которого известный противотуберкулезный препарат, изониазид, не активен.
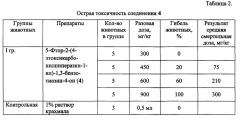
Для заявляемого соединения 4 изучена острая токсичность и определена летальная доза LD50 в опытах на животных (in vivo). Определяют максимально переносимую дозу (МПД), при которой не наблюдалось гибели животных и дозу, вызывающую гибель 50% животных (ЛД50). В соответствии с методикой (Г.Н. Першин, 1971. М.) расчет ЛД50 проводят по формуле, определяя среднюю смертельную дозу:
х. среднее = [(a+b) (m-n)]:200,
где (а+b) - сумма смежных доз; (m-n) разность % смертности от 2-х последних доз.
Исследование острой токсичности и отработку летальной дозы ЛД50 соединения 4 проводят на белых мышах весом 17-20 г. Для препарата отбирают индивидуальные дозы: минимальная 300 мг/кг, средняя 450 мг/кг или 600 мг/кг и максимальная 900 мг/кг. Для каждой дозы берут по 5 белых мышек, которым вводят препараты в желудок в объеме 0,5 мл в 1% растворе крахмального клейстера. Контрольной группе вводят только 1% раствор крахмального клейстера.
Наблюдение за животными проводят в течение 14 дней. У всех животных, павших в процессе опыта, проводят макроскопические и гистологические исследования внутренних органов (печени, почек, легких, селезенки). У выживших животных после забоя также проводят гистологические исследования внутренних органов.
Данные по острой токсичности соединения 4 представлены в Таблице 2.
Из представленных в Таблице 2 данных следует, что при введении животным соединения 4 в дозе 300 мг/кг гибель животных не отмечена через 24 часа после введения. При введении животным соединения 4 в дозе 450 мг/кг, гибель животных наступает через 2 часа после приема (20%). При введении животным соединения 4 в дозе 600 мг/кг, гибель животных наступает через 30-60 мин после приема (60%). При введении животным соединения 4 в дозе 900 мг/кг, гибель животных наступает в 100% случаев. В печени у животных, которые получали бензотиазинон 4, были выявлены незначительные макроскопические изменения, что подтверждено гистологическими исследованиями.
В результате проведенного исследования для соединения 4 установлено, что максимально переносимая доза (МПД) составляет 450 мг/кг, значение ЛД50 составляет 600 мг/кг (гибель животных более чем в 50% случаев).
Изучение терапевтического действия бензотиазинона 4 в сравнении с изониазидом проводилось на морских свинках весом 340-350 г в течение двух месяцев. Вес животных в группе, пролеченных бензотиазиноном 4, достоверно увеличивался по сравнению с массой нелеченых животных (Таблица 3). Динамика роста веса животных, леченных изониазидом, была достоверно ниже по сравнению с экспериментальной группой. Животные, получавшие бензотиазинон 4, развивались благоприятно, прибавка массы составила около 85% (у животных контрольной группы без лечения прибавка массы составила около 82%).
По окончании лечения животных подвергали эфтаназии, после чего проводили макроскопическое исследование и определяли индекс поражения внутренних органов. Экстракты легкого, печени, селезенки исследовали на наличие микобактерий микроскопически и путем высева на плотные питательные среды. Экспериментальные животные всех четырех групп были забиты через 2 месяца после лечения. На вскрытии у животных, леченых бензотиазиноном 4, макроскопически были выявлены единичные туберкулезные изменения в легких и селезенке в основном в подгруппе самок. Макроскопических туберкулезных поражений печени не выявлялось. Внутригрудные лимфоузлы уплотнены. Индекс поражения внутренних органов составил 3.4. (У животных, леченых изониазидом, при вскрытии макроскопических туберкулезных изменений в легких, печени, селезенке не было выявлено за исключением внутригрудных лимфоузлов, которые были уплотнены; индекс поражения внутренних органов составил 2.0.) Отмечается слабое терапевтическое действие изученного соединения.
У экспериментальных животных во время забоя брали кровь и из показателей гемограммы определяли гемоглобин, количество лейкоцитов и эритроцитов, а также лейкоцитарную формулу (Таблица 4). При лечении бензотиазиноном показатели красной крови существенно не меняются, но сохраняется лейкоцитоз. Показатели гемоглобина увеличиваются на фоне лечения изониазидом остаются выше, чем показатели гемоглобина у животных, леченых бензотиазиноном. Показатели крови у животных, леченых бензотиазиноном, говорят о фазе гематогенной диссеминации. После оценки гемограммы животных был сделан вывод, что бензотиазинон 4 в дозе 10 мг/кг при лечении экспериментального туберкулеза существенно не влияет на красную кровь и проявляет терапевтическое действие.
В ходе эксперимента определяли характер воздействия исследуемого соединения 4 на биохимические показатели в сыворотке крови. Для животных, получавших бензотиазинон 4, наблюдалась более низкая активность трансаминаз, по сравнению с показателями сыворотки крови у животных леченых изониазидом. Исследуемое соединение 4 не оказывает прямого цитолитического действия на гепатоцидность. Показано, что снижается активность аланинаминотрансферазы (АЛТ) печени, что приводит к понижению фермента в сыворотке крови. У зараженных животных леченых изониазидом и бензотиазиноном 4 показатели аспартатаминотрансферазы (ACT) были увеличены почти в два раза по сравнению со здоровыми животными, что свидетельствует о токсическом воздействии этих препаратов на сердечную мышцу. Показатели концентрации глюкозы, мочевины, общего билирубина и холестерина оставались в пределах допустимых норм.
В группе животных, леченых бензотиазиноном 4, в 23% случаев признаков туберкулезного поражения не выявлено. Специфическая продуктивная реакция в легких определена у 8% экспериментальных животных. В лимфатических узлах продуктивно-некротическая тканевая реакция с признаками активности процесса выявлена в 21% случаев, исключительно продуктивная тканевая реакция в 38% случаев. Специфические изменения без признаков некрозов выявлено в селезенке в 54% случаев и в печение в 8% случаев.
5-Фтор-2-(4-этоксикарбонилпиперазин-1-ил)-1,3-бензотиазин-4-он формулы (4):
обладающий противотуберкулезной активностью.