Новые пиридазоны и триазиноны для лечения и профилактики заражения вирусом гепатита b
Иллюстрации
Показать всеИзобретение относится к соединению формулы (I) или его фармацевтически приемлемым солям. В формуле (I) R1 представляет собой фенил, замещенный один или два раза C1-6алкилом, галогеном, трифторметилом или циано; R2 представляет собой C1-6алкил; R3 представляет собой фенил, замещенный один или два раза C1-6алкилом, галогеном, трифторметилом, циано, С1-6алкокси, трифторметокси, -С(О)-C1-6алкокси, или -C(O)-NR4R5, где один из R4 и R5 представляет собой водород или C1-6алкил, а другой представляет собой C1-6алкил или С3-7циклоалкил; а является одинарной связью, X представляет собой СН2 или NH. Изобретение также относится к индивидуальным соединениям, выбранным из группы, к фармацевтической композиции, ингибирующей продукцию или секрецию HBsAg, к применениям соединения и к способу лечения или профилактики инфекции ВГВ. Технический результат: получены новые соединения формулы (I), применяемые в качестве ингибитора продукции или секреции HBsAg. 8 н. и 10 з.п. ф-лы, 1 табл., 65 пр.
Реферат
Изобретение относится к органическим соединениям, полезным для лечения и/или профилактики у млекопитающих, в частности к ингибиторам HBsAg (поверхностный антиген ВГВ) полезным для лечения инфекции ВГВ.
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым пиридазонам и триазинонам, обладающим фармацевтической активностью, их производству, содержащим их фармацевтическим композициям и их возможному применению в качестве лекарственных средств.
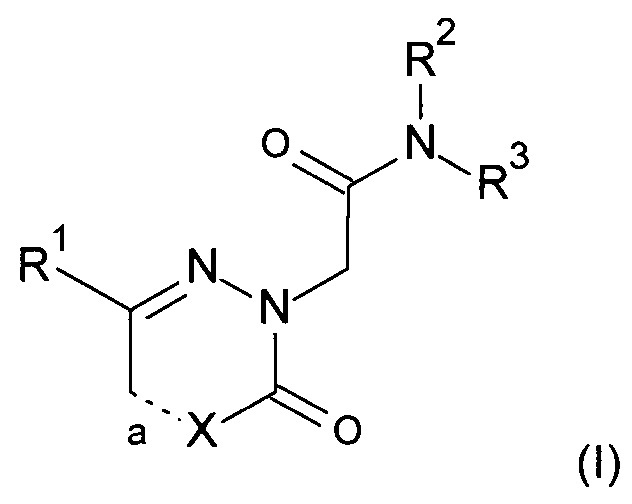
Настоящее изобретение относится к соединениям формулы (I)
где R1-R3, X и а являются такими, как описано далее, или его фармацевтически приемлемым солям.
Вирус гепатита В (ВГВ) представляет собой оболочечный, вирус с частично двухцепочечной ДНК. Компактный геном ВГВ 3,2 кб состоит из четырех перекрывающихся открытых рамок считывания (ORF), которые кодируют ядро, полимеразу (Pol), оболочку и Х-белки. ORF полимеразы является самой длинной и ORF оболочки находится внутри нее, в то время как ORF Х-белков и ядра перекрываются с Pol ORF. Жизненный цикл ВГВ имеет два основных события: 1) формирование замкнутой кольцевой ДНК (ковалентно замкнутая кольцевая ДНК) из расслабленного круговой (RC ДНК), и 2) обратная транскрипция прегеномной РНК (pgRNA) для получения RC ДНК. До инфицирования клеток-хозяев, геном ВГВ существует внутри вириона как RC ДНК. Было установлено, что ВГВ вирионы способны проникать в клетки-хозяева посредством неспецифического связывания с отрицательно заряженными протеогликанами, присутствующими на поверхности человеческих гепатоцитов (Schulze, А., P. Gripon & S. Urban. Hepatology, 46, (2007), 1759-68) и с помощью специфического связывания поверхностных антигенов ВГВ (HBsAg) с рецептором натрий-таурохолат котранспортирующего полипептида (NTCP) гепатоцитов (Yan, H. et al. J Virol, 87, (2013), 7977-91). После того, как вирион вошел в клетку, вирусные ядра и заключенная в капсид RC ДНК транспортируются факторами хозяина посредством сигналов ядерной локализации в ядро через рецепторы ядерного транспорта Impβ/Impα. Внутри ядра ферменты репарации ДНК хозяина преобразуют RC ДНК в ковалентно замкнутую кольцевую ДНК (сссДНК). СссДНК выступает в качестве шаблона для всех вирусных мРНК и, как таковая, несет ответственность за выживаемость ВГВ у инфицированных лиц. Транскрипты, полученные из ковалентно замкнутой кольцевой ДНК, группируются в две категории; прегеномная РНК (pgRNA) и субгеномная РНК. Субгеномные транскрипты кодируют три оболочечных (L, М и S) и X белки, а pgRNA кодирует преядерный, ядерный и Pol белки (Quasdorff, М. & U. Protzer. J Viral Hepat, 17, (2010), 527-36). Подавление экспрессии генов ВГВ или синтеза РНК ВГВ приводит к торможению репликации ВГВ вируса и производства антигенов (Мао, R. et al. PLoS Pathog, 9, (2013), e1003494; Mao, R. et al. J Virol, 85, (2011), 1048-57). Например, было показано, что ИФН-а ингибирует репликацию ВГВ и вирусную продукцию HBsAg путем снижения транскрипции pgRNA и субгеномной РНК из ковалентно замкнутой кольцевой ДНК (сссДНК) минихромасомы ВГВ. (Belloni, L. et al. J Clin Invest, 122, (2012), 529-37; Mao, R. etal. J Virol, 85, (2011), 1048-57).
Все вирусные мРНК ВГВ копированы и полиаденилированы, и затем экспортируются в цитоплазму для трансляции. В цитоплазме инициируется сборка новых вирионов и образующиеся pgRNA упаковываются с вирусной Pol, таким образом, что может начаться обратная транскрипция pgRNA, через одноцепочечную промежуточную ДНК, в RC ДНК. Зрелые нуклеокапсиды, содержащие RC ДНК окружены клеточными липидами и вирусными L, М, и S белками и затем инфекционные частицы ВГВ высвобождаются отпочковыванием на внутриклеточной мембране (Locarnini, S. Semin Liver Dis, (2005), 25 Suppl 1, 9-19). Интересно отметить, что также продуцируются неинфекционные частицы, число которых значительно превышает число инфекционных вирионов. Эти пустые оболочечные частицы (L, М и S), называются субвирусными. Важно отметить, что так как субвирусные частицы содержат одни и те же белки оболочки как и инфекционные частицы, было высказано предположение, что они действуют в качестве приманок для иммунной системы хозяина и используются для ВГВ вакцин. Белки оболочки S, М, L экспрессируются из одной ORF, которая содержит три различных стартовых кодона. Все три белка имеют последовательность 226 аминокислот, S-домен на своем С-конце. М и L имеют дополнительные пред-S домены, Pre-S2 и Pre-S2 и Pre-S1, соответственно. Тем не менее, это S-домен, который имеет HBsAg эпитоп (Lambert, С.& R. Prange. Virol J, (2007), 4, 45).
Для контроля вирусной инфекции необходимо внимательное наблюдение за врожденной иммунной системой хозяина, которая может реагировать в течение от нескольких минут до часов после заражения, чтобы воздействовать на начальный рост вируса и ограничить развитие хронической и персистирующей инфекции. Несмотря на имеющиеся современные способы лечения, основанные на ИФН и нуклеоз(т)идных аналогах, инфекция вируса гепатита В (ВГВ) остается одной из основных проблем здравоохранения во всем мире, которая затрагивает примерно 350 миллионов хронических носителей, которые имеют более высокий риск развития цирроза печени и гепатоцеллюлярной карциномы.
Секреция противовирусных цитокинов в ответ на ВГВ-инфекцию гепатоцитами и/или клеток иммунной системы внутри печени играет центральную роль в элиминации вируса из инфицированной печени. Тем не менее, хронически инфицированные пациенты проявляют только слабый иммунный ответ, из-за различных стратегий избегания адаптированных вирусом от противодействия системе распознавания клеток хозяина и последующих противовирусных ответов.
Множество наблюдений показали, что некоторые вирусные белки ВГВ могут противодействовать первоначальному клеточному ответу хозяина, путем интерференции с системой распознавания вирусных сигналов и последующей противовирусной активностью интерферона (ИФН). Среди них, чрезмерная продукция пустых субвирусных частиц ВГВ (SVP, HBsAg) может участвовать в поддержании иммунологического толерантного состояния, наблюдаемого у хронически инфицированных больных (ХГВ). Постоянное воздействие HBsAg и других вирусных антигенов может привести к делеции ВГВ-специфических Т-клеток или прогрессирующей функциональной недостаточности (Kondo et al. Journal of Immunology (1993), 150, 4659-4671; Kondo et al. Journal of Medical Virology (2004), 74, 425-433; Fisicaro et al. Gastroenterology, (2010), 138, 682-93). К тому же HBsAg, как сообщается, подавляет функцию иммунных клеток, таких как моноциты, дендритные клетки (ДК) и природные клетки-киллеры (NK) путем прямого взаимодействия (Op den Brouw et al. Immunology, (2009b), 126, 280-9; Woltman et al. PLoS One, (2011), 6, e15324; Shi et al. J Viral Hepat. (2012), 19, e26-33; Kondo et al. ISRN Gasteroenterology, (2013), Article ID 935295).
Количественное определение HBsAg является важным биомаркером для прогноза и ответного лечения хронического гепатита В. Однако достижение потери HBsAg и сероконверсия редко наблюдаются у хронически инфицированных пациентов, но остаются конечной целью терапии. Современные лекарственные средства, такие как нуклеоз(т)идные аналоги представляют собой молекулы, которые ингибируют синтез ДНК ВГВ, но не направленные на снижение уровня HBsAg. Нуклеоз(т)идные аналоги, даже при длительной терапии, продемонстрировали показатели клиренса HBsAg, сопоставимые с таковыми, встречающимися в природе (в диапазоне от -1% -2%) (Janssen et al. Lancet, (2005), 365, 123-9; Marcellin et al. N. Engl. J. Med., (2004), 351, 1206-17; Buster et al. Hepatology, (2007), 46, 388-94). Поэтому нацеливание на HBsAg вместе с уровнями ДНК ВГВ у больных ХГВ может значительно улучшить иммунной реактивации и ремиссию у пациентов с хроническим ВГВ (Wieland, S.F. & F.V. Chisari. J Virol, (2005), 79, 9369-80; Kumar et al. J Virol, (2011), 85, 987-95; Woltman et al. PLoS One, (2011), 6, e15324; Op den Brouw et al. Immunology, (2009b), 126, 280-9).
Краткое изложение сущности изобретения
Настоящее изобретение относится к новым соединениям формулы (I)
где
R1 представляет собой фенил; или фенил замещенный один или два раза С1-6алкилом, галогеном, трифторметилом или циано;
R2 представляет собой C1-6алкил;
R3 представляет собой фенил; или фенил замещенный один или два раза С1-6алкилом, галогеном, трифторметилом, циано, С1-6алкокси, трифторметокси, -С(O)-С1-6алкокси, или -C(O)-NR4R5, где один из R4 и R5 представляет собой водород или С1-6алкил, а другой представляет собой С1-6алкил или С3-7циклоалкил;
а является одинарной связью, когда X представляет собой СН2 или NH;
или
а является двойной связью, когда X представляет собой СН или N;
или его фармацевтически приемлемой соли.
Настоящее изобретение также относится к их получению, лекарственным средствам на основе соединения по настоящему изобретению и их изготовлению, а также к применению соединений формулы I в качестве ингибиторов HBsAg. Соответственно, соединения формулы I являются полезными для лечения или профилактики инфекции ВГВ.
Подробное описание изобретения
Если не определено иначе, все технические и научные термины, используемые здесь, имеют то же значение, обычно понимаемое специалистом в области техники, к которой относится данное изобретение. Кроме того, следующие далее определения приведены для иллюстрации и определения значения и объема различных терминов, используемых для описания изобретения.
Определения
Как здесь используется, термин "C1-6алкил" самостоятельно или в комбинации означает насыщенную, линейную или разветвленную алкильную группу, содержащую от 1 до 6, предпочтительно от 1 до 4 атомов углерода, например, метил, этил, пропил, изопропил, 1-бутил, 2-бутил, трет-бутил и т.п. Предпочтительными "С1-6алкильными" группами являются метил, этил, изопропил, и трет-бутил.
Термин "С3-7циклоалкил", самостоятельно или в комбинации, относится к насыщенному углеродному кольцу, содержащему от 3 до 7 атомов углерода, в частности от 3 до 6 атомов углерода, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и т.д. В частности группами "С3-7циклоалкил" являются циклопропил, циклопентил и циклогексил.
Термин "С1-6алкокси" самостоятельно или в комбинации означает группу C1-6алкил-O-, где "С1-6алкил" определен выше; например, метокси, этокси, пропокси, изопропокси, н-бутокси, изобутокси, 2-бутокси, трет-бутокси и т.п. Предпочтительными С1-6алкокси группами являются метокси и этокси и более предпочтительно метокси.
Термин "трифторметил" самостоятельно или в комбинации относится к группе -CF3.
Термин "трифторметокси" самостоятельно или в комбинации относится к группе -O-CF3.
Термин "циано" самостоятельно или в комбинации относится к группе -CN.
Термин "галоген" означает фтор, хлор, бром или йод. Галогеном является, в частности, фтор хлор или бром.
Термин "соединение (-ия) по настоящему изобретению " и "соединение (ия) настоящего изобретения" относятся к соединениям формулы I и их стереоизомерам, сольватам или солям (например, фармацевтически приемлемым солям).
Термин "заместитель" означает атом или группу атомов, заменяющих атом водорода на родительской молекуле.
Соединения согласно настоящему изобретению могут существовать в форме их фармацевтически приемлемых солей. Термин "фармацевтически приемлемая соль" относится к обычным кислотно-аддитивным или основно-аддитивным солям, которые сохраняют биологические эффективность и свойства соединений формулы (I) и образуются из подходящих нетоксичных органических или неорганических кислот или органических или неорганических оснований. Кислотно-аддитивные соли включают, например, соли, полученные из неорганических кислот, таких как соляная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, сульфаминовая кислота, фосфорная кислота и азотная кислота, и соли, полученные из органических кислот, таких как п-толуолсульфоновая кислота, салициловая кислота, метансульфоновая кислота, щавелевая кислота, янтарная кислота, лимонная кислота, яблочная кислота, молочная кислота, фумаровая кислота, и т.п. Основно-аддитивные соли включают соли, полученные из аммония, калия, натрия и гидроксидов четвертичного аммония, такие как, например, тетраметиламмония гидроксид. Химическая модификация фармацевтического соединения в соль является способом, хорошо известным химикам-фармацевтам с целью получить улучшенную физическую и химическую стабильность, гигроскопичность, сыпучесть и растворимость соединений. Это описано, например, в Bastin R.J., et. al., Organic Process Research & Development 2000, 4, 427-435. Предпочтительными являются натриевые соли соединений формулы (I).
Соединения общей формулы I, которые содержат один или несколько хиральных центров могут быть представлены в виде рацематов, смесей диастереомеров, или оптически активных одиночных изомеров. Рацематы могу быть разделены на энантиомеры в соответствии с известными способами. Предпочтительно, диастереомерные соли, которые могут быть разделены кристаллизацией, образуются из рацемических смесей посредством взаимодействия с оптически активной кислотой, такой как, например, D- или L-винная кислота, миндальная кислота, яблочная кислота, молочная кислота или камфорсульфоновая кислота.
ИНГИБИТОРЫ HBsAg
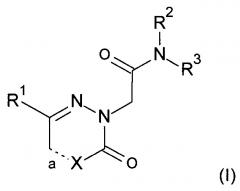
Настоящее изобретение относится к (i) соединению формулы (I):
где
R1 представляет собой фенил; или фенил замещенный один или два раза С1-6алкилом, галогеном, трифторметилом или циано;
R2 представляет собой С1-6алкил;
R3 представляет собой фенил; или фенил замещенный один или два раза С1-6алкилом, галоген, трифторметилом, циано, С1-6алкокси, трифторметокси, -С(O)-С1-6алкокси, или -C(O)-NR4R5, где один из R4 и R5 представляет собой водород или C1-6алкил, а другой представляет собой С1-6алкил или С3-7циклоалкил;
а является одинарной связью, когда X представляет собой СН2 или NH; или
а является двойной связью, когда X представляет собой СН или N;
или его фармацевтически приемлемым солям.
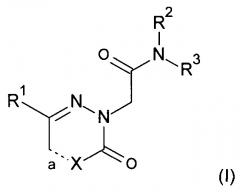
Другим воплощением настоящего изобретения является (и) соединение формулы (I) где
R1 представляет собой фенил; или фенил замещенный один или два раза метилом, фтором, хлором, бромом, трифторметилом или циано;
R2 представляет собой метил;
R3 представляет собой фенил; или фенил замещенный один или два раза метилом, фтором, хлор, трифторметилом, циано, метокси, трифторметокси, метоксикарбонилом или -C(O)-NR4R5, где один из R4 и R5 представляет собой водород, метил или изопропил, а другой представляет собой изопропил, пентанил или циклогексил;
а является одинарной связью, когда X представляет собой СН2 или NH; или
а является двойной связью, когда X представляет собой СН или N;
или его фармацевтически приемлемые соли.
Другим воплощением настоящего изобретения является (iii) соединение формулы (I), где R1 представляет собой фенил, замещенный один или два раза галогеном или трифторметилом.
Дополнительным воплощением настоящего изобретения является (iv) соединение формулы (I), где R1 представляет собой фенил, замещенный один или два раза фтором, хлором или трифторметилом.
Другим воплощением настоящего изобретения является (v) соединение формулы (I), где R3 представляет собой фенил, или фенил замещенный один или два раза галогеном или трифторметилом.
Дополнительным воплощением настоящего изобретения является (vi) соединение формулы (I) где R3 представляет собой фенил, или фенил замещенный один или два раза фтором, хлором или трифторметилом.
Другим воплощением настоящего изобретения является (vii) соединение формулы (I), где X представляет собой СН2 или СН.
Другим воплощением настоящего изобретения является (viii) соединение формулы (I), где
R1 представляет собой фенил, замещенный один или два раза галогеном или трифторметилом;
R2 представляет собой С1-6алкил;
R3 представляет собой фенил, или фенил замещенный один или два раза галогеном или трифторметилом;
а является одинарной связью, когда X представляет собой СН2; или
а является двойной связью, когда X представляет собой СН;
или его фармацевтически приемлемые соли.
Дополнительным воплощением настоящего изобретения является (ix) соединение формулы (I), где
R1 представляет собой фенил, замещенный один или два раза фтором, хлором или трифторметилом;
R2 представляет собой метил;
R3 представляет собой фенил, или фенил замещенный один или два раза фтором, хлором или трифторметилом;
а является одинарной связью, когда X представляет собой СН2; или
а является двойной связью, когда X представляет собой СН;
или его фармацевтически приемлемые соли.
Конкретными соединениями формулы (I) в соответствии с настоящим изобретением являются следующие:
N-(4-хлорфенил)-2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-ацетамид;
2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-[4-фтор-3-(трифторметил)фенил]-N-метил-ацетамид;
2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-[3-фтор-4-(трифторметил)фенил]-N-метил-ацетамид;
N-(4-хлор-3-фтор-фенил)-2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-ацетамид;
2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-(3-метоксифенил)-N-метил-ацетамид;
2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-(4-фторфенил)-N-метил-ацетамид;
2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-N-(р-толил)ацетамид;
2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-(3,4-дихлорфенил)-N-метил-ацетамид;
2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-N-[4-(трифторметил)фенил]ацетамид;
2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-(4-цианофенил)-N-метил-ацетамид;
Метил 4-[[2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]ацетил]-метил-амино]бензоат;
4-[[2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]ацетил]-метил-амино]-N,N-диизопропил-бензамид;
2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-(2,4-дифторфенил)-N-метил-ацетамид;
4-[[2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]ацетил]-метил-амино]-N-метил-N-пентил-бензамид;
4-[[2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]ацетил]-метил-амино]-N-циклогексил-бензамид;
2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-N-[4-(трифторметокси)фенил]ацетамид;
2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-(3-фторфенил)-N-метил-ацетамид;
N-(3-хлорфенил)-2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-ацетамид;
2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-N-[3-(трифторметил)фенил]ацетамид;
2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-(4-метоксифенил)-N-метил-ацетамид;
2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-N-(т-толил)ацетамид;
2-[3-(4-хлор-3-фтор-фенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-(4-фторфенил)-N-метил-ацетамид;
2-[3-(4-хлор-3-фтор-фенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-(3-фторфенил)-N-метил-ацетамид;
2-[3-(4-хлор-3-фтор-фенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-(3-хлорфенил)-N-метил-ацетамид;
2-[3-(4-хлор-3-фтор-фенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-N-[4-(трифторметил)фенил]ацетамид;
2-[3-(4-хлор-2-метил-фенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-(4-хлорфенил)-N-метил-ацетамид;
2-[3-(4-хлор-2-метил-фенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-(3-хлорфенил)-N-метил-ацетамид;
2-[3-(4-хлор-2-метил-фенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-(3-фторфенил)-N-метил-ацетамид;
2-[3-(4-хлор-2-метил-фенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-N-[3-(трифторметил)фенил]ацетамид;
2-[3-(2,4-дифторфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-N-[4-(трифторметил)фенил]ацетамид;
2-[3-(2,4-дифторфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-N-[3-(трифторметил)фенил]ацетамид;
2-[3-(2,4-дифторфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-[4-фтор-3-(трифторметил)фенил]-N-метил-ацетамид;
N-(4-хлорфенил)-2-[3-(2,4-дифторфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-ацетамид;
2-[3-(2,4-дифторфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-(3-фторфенил)-N-метил-ацетамид;
2-[3-(4-фтор-3-метил-фенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-N-[3-(трифторметил)фенил]ацетамид;
2-[3-(4-фтор-3-метил-фенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-N-[4-(трифторметил)фенил]ацетамид;
2-[3-(4-фтор-3-метил-фенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-[4-фтор-3-(трифторметил)фенил]-N-метил-ацетамид;
2-[3-(4-фтор-3-метил-фенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-[3-фтор-4-(трифторметил)фенил]-N-метил-ацетамид;
N-(3-хлорфенил)-N-метил-2-[6-оксо-3-[4-(трифторметил)фенил]-4,5-дигидропиридазин-1-ил]ацетамид;
N-метил-2-[6-оксо-3-[4-(трифторметил)фенил]-4,5-дигидропиридазин-1-ил]-N-[4-(трифторметил)фенил]ацетамид;
N-метил-2-[6-оксо-3-[4-(трифторметил)фенил]-4,5-дигидропиридазин-1-ил]-N-[3-(трифторметил)фенил]ацетамид;
N-(3-фторфенил)-N-метил-2-[6-оксо-3-[4-(трифторметил)фенил]-4,5-дигидропиридазин-1-ил]ацетамид;
N-(4-фторфенил)-N-метил-2-[6-оксо-3-[4-(трифторметил)фенил]-4,5-дигидропиридазин-1-ил]ацетамид;
N-(4-хлорфенил)-N-метил-2-[6-оксо-3-[4-(трифторметил)фенил]-4,5-дигидропиридазин-1-ил]ацетамид;
2-[3-(3,4-дихлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-N-[4-(трифторметил)фенил]ацетамид;
N-(4-хлорфенил)-2-[3-(3,4-дихлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-ацетамид;
2-[3-(4-фторфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-N-фенил-ацетамид;
N-(4-хлорфенил)-2-[3-(4-фторфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-ацетамид;
2-[3-(4-бромфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-N-фенил-ацетамид;
2-[3-(4-бромфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-(4-хлорфенил)-N-метил-ацетамид;
2-[3-(4-бромфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-N-[4-(трифторметил)фенил]ацетамид;
2-[3-(3,4-дифторфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-N-[3-(трифторметил)фенил]ацетамид;
2-[3-(3,4-дифторфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-N-[4-(трифторметил)фенил]ацетамид;
N-(4-хлорфенил)-2-[3-(2,4-дихлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-ацетамид;
N-(4-хлорфенил)-2-[3-(4-цианофенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-ацетамид;
N-(4-хлорфенил)-N-метил-2-[6-оксо-3-(р-толил)-4,5-дигидропиридазин-1-ил]ацетамид;
N-(4-хлорфенил)-2-[3-(3-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-ацетамид;
2-[3-(4-хлорфенил)-6-оксо-пиридазин-1-ил]-N-метил-N-[4-(трифторметил)фенил]ацетамид;
2-[3-(4-хлор-3-фтор-фенил)-6-оксо-пиридазин-1-ил]-N-метил-N-[4-(трифторметил)фенил]ацетамид;
2-[3-(4-хлор-2-фтор-фенил)-6-оксо-пиридазин-1-ил]-N-метил-N-[4-(трифторметил)фенил]ацетамид;
2-[3-(2-хлор-6-фтор-фенил)-6-оксо-пиридазин-1-ил]-N-метил-N-[4-(трифторметил)фенил]ацетамид;
N-(4-хлорфенил)-2-[3-(4-хлорфенил)-6-оксо-пиридазин-1-ил]-N-метил-ацетамид;
2-[6-(4-хлорфенил)-3-оксо-4,5-дигидро-1,2,4-триазин-2-ил]-N-метил-N-[4-(трифторметил)фенил]ацетамид;
N-(4-хлорфенил)-2-[6-(4-хлорфенил)-3-оксо-1,2,4-триазин-2-ил]-N-метил-ацетамид;
или его фармацевтически приемлемые соли.
Более конкретно, настоящее изобретение относится к следующим соединениям формулы (I):
2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-[3-фтор-4-(трифторметил)фенил]-N-метил-ацетамид;
2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-(3,4-дихлорфенил)-N-метил-ацетамид;
2-[3-(4-хлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-Ы-[4-(трифторметил)фенил]ацетамид;
2-[3-(4-хлор-3-фтор-фенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-(3-фторфенил)-N-метил-ацетамид;
2-[3-(4-хлор-3-фтор-фенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-(3-хлорфенил)-N-метил-ацетамид;
2-[3-(4-хлор-3-фтор-фенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-N-[4-(трифторметил)фенил]ацетамид;
2-[3-(2,4-дифторфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-N-[4-(трифторметил)фенил]ацетамид;
N-(3-хлорфенил)-N-метил-2-[6-оксо-3-[4-(трифторметил)фенил]-4,5-дигидропиридазин-1-ил]ацетамид;
N-метил-2-[6-оксо-3-[4-(трифторметил)фенил]-4,5-дигидропиридазин-1-ил]-N-[3-(трифторметил)фенил]ацетамид;
N-(3-фторфенил)-N-метил-2-[6-оксо-3-[4-(трифторметил)фенил]-4,5-дигидропиридазин-1-ил]ацетамид;
2-[3-(3,4-дихлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-N-[4-(трифторметил)фенил]ацетамид;
N-(4-хлорфенил)-2-[3-(3,4-дихлорфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-ацетамид;
2-[3-(3,4-дифторфенил)-6-оксо-4,5-дигидропиридазин-1-ил]-N-метил-N-[3-(трифторметил)фенил]ацетамид;
2-[3-(4-хлор-3-фтор-фенил)-6-оксо-пиридазин-1-ил]-N-метил-N-[4-(трифторметил)фенил]ацетамид;
или их фармацевтически приемлемым солям.
Следует понимать, что соединения общей формулы (I) в настоящем изобретении могут быть дериватизированы по функциональным группам с получением производных, которые способны превращаться обратно в исходное соединение в естественных условиях. Физиологически приемлемые и метаболически лабильные производные, которые способны превращаться в исходные соединения общей формулы (I) в естественных условиях, также входят в объем данного изобретения.
СИНТЕЗ
Соединения настоящего изобретения могут быть получены любыми общеизвестными средствами. Подходящими способами для синтеза этих соединений, а также исходных соединений для их получения предложены на схемах, приведенных далее, и в примерах. Все заместители, в частности, R1-R3, X и а являются такими, как определено выше, если не указано иного. Более того, и если специально не указано иного, все реакции, реакционные условия, аббревиатуры и обозначения обладают значениями, хорошо известными квалифицированному специалисту в области органической химии.
Соединения настоящего изобретения могут быть получены любыми обычными средствами. Подходящие способы для синтеза этих соединений, а также соответствующие исходные соединения представлены на схемах ниже и в примерах. Все заместители являются такими, как определено выше, если не указано иного. Более того, если явно не указано иного, все взаимодействия, условия реакций, сокращения и обозначения обладают значениями, хорошо известными квалифицированным в органической химии специалистам.
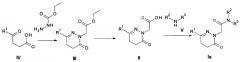
Схема 1
Соединение формулы Ia может быть получено в соответствии со Схемой 1. Реакция циклоконденсации производных бензоилпропионовой кислоты IV с этилгидразиноацетата гидрохлоридом в растворителе, таком как этанол или 2-пропанол приводит к дигидропиридазиноновому промежуточному соединению III. Последующий гидролиз соединения III дает кислоту II. Эта реакция может проводиться в присутствии сильного основания щелочного металла, такого как гидроксид натрия, гидроксид лития или гидроксид калия в смешанном растворителе тетрагидрофуран/вода или метанол/вода. Соединение II может быть конвертировано в амидные производные Ia посредством взаимодействия с подходящим амином в органическом растворителе, таком как метиленхлорид или тетрагидрофуран с дегидратирующим реагентов, например, HATU, РуВrОР или Т3Р в присутствии триалкиламина, например триэтиламина.
Схема 2
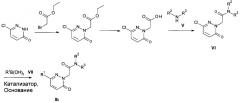
Соединение формулы Ib может быть получено в соответствии со Схемой 2. Алкилирование 3-хлор-1Н-пиридазин-6-она с помощью этил 2-бромацетата дает этил 2-(3-хлор-6-оксо-пиридазин-1-ил)ацетат с использованием основания, например, карбоната калия, карбоната цезия, или гидрида натрия в инертном растворителе, таком как диметилформамид или ацетонитрил. Гидролиз этил 2-(3-хлор-6-оксо-пиридазин-1-ил)ацетата дает 2-(3-хлор-6-оксо-пиридазин-1 -ил)уксусную кислоту. Эта реакция может быть проведена в присутствии сильного основания щелочного металла, такого как гидроксид натрия, гидроксид лития или гидроксид калия, в смешанном растворителе тетрагидрофуран/вода или метанол/вода. 2-(3-хлор-6-оксо-пиридазин-1-ил)уксусная кислота может быть конвертирована в амидные производные VI посредством взаимодействия с подходящим амином V в органическом растворителе, таком как метиленхлорид, с помощью дегидратирующего реагента, например, HATU или Т3Р в присутствии триалкиламина, например, триэтиламина. Катализируемая палладием реакция кросс-сочетания Сузуки соединения VI с арилбороновым соединением VII дает соединения Ib. Реакция подходяще катализируется применением катализатора на основе переходного металла, такого как палладий, например Pd(PPh3)4.
Схема 3
Альтернативно, соединение Ia может быть окислено до пиридазинона Ib с использованием окислительного агента, например MnO2, CuCl2, DDQ или оксид селения.
Схема 4
Соединение формулы Ic может быть получено в соответствии со Схемой 4. Алкилирование 2,4-тиазолидиндиона с помощью R1COCH2Br (IX) дает соединение VIII с использованием основания, например карбоната калия, карбоната цезия или гидрида натрия, в инертном растворителе, таком как диметилформамид или ацетонитрил.
Взаимодействие соединения VIII с этилгидразинацетата гидрохлоридом дает соединения X в растворителе, таком как этанол или 2-пропанол. Гидролиз соединения X приводит к соединению XI. Эта реакция проводится в смешанном растворителе метанол/вода или тетрагидрофуран/вода с использованием сильного основания щелочного металла, такого как гидроксид лития, гидроксид натрия или гидроксид калия. Соединение XI может быть конвертировано в амидные производные Ic посредством взаимодействия с подходящим амином V в органическом растворителе, таком как метиленхлорид, с помощью дегидратирующего реагента, например, HATU, PyBrOP или Т3Р в присутствии триалкиламина, например триэтиламина.
Схема 5
Соединение формулы Id может быть получено в соответствии со Схемой 5. Взаимодействие соединения VIII с гидратгидразином дает соединение XII. Эта реакция может быть проведена в растворителе, таком как этанол или 2-пропанол, при кипении с обратным холодильником. Окисление соединения XII с использованием натриевой соли 3-нитробензолсульфоновой кислоты дает соединение XIII. Алкилирование соединения XIII с помощью соединения IX дает соединение Id посредством использования основания, например карбоната калия, карбоната цезия или гидрида натрия, в инертном растворителе, таком как диметилформамид или ацетонитрил.
Настоящее изобретение также относится к способу получения соединения формулы (I), содержащему одну из следующих стадий:
(а) взаимодействие соединения формулы (А)
в присутствии дегидратирующего реагента и триалкиламина, где X представляет собой СН2 или NH;
(b) взаимодействие соединения формулы (В)
с R1B(OH)2 в присутствии катализатора на основе переходного металла, где Y представляет собой галоген;
(c) взаимодействие соединения формулы (С)
с окисляющим реагентом; или
(d) взаимодействие соединения формулы (D)
в присутствии основания в инертном растворителе;
где R1-R3 являются такими, как определено выше, если не указано иного.
На стадии (а), дегидратирующим реагентом может быть, например, HATU, PyBrOP или Т3Р. Триалкиламином может быть, например, триэтиламин.
На стадии (b), катализатором на основе переходного металла может быть, например, палладиевый катализатор, в частности, Pd(PPh3)4.
На стадии (с), окисляющим реагентом может быть, например, MnO2, CuCl2, DDQ или оксид селена.
На стадии (d), основанием может быть, например, карбонат калия, карбонат цезия или гидрид натрия. Инертным растворителем может быть, например, диметилформамид или ацетонитрил.
Соединение формулы (I), полученное вышеуказанным способом, также является объектом настоящего изобретения.
Фармацевтические композиции и введение
Настоящее изобретение также относится к соединению формулы I для применения в качестве терапевтически активного вещества.
В другом воплощении предложены фармацевтические композиции или лекарственные средства, содержащие соединения по настоящему изобретению и терапевтически инертный носитель, разбавитель или эксципиент, а также способы применения соединений по настоящему изобретению для изготовления таких композиций и лекарственных средств. В одном примере, соединения формулы (I) могут быть приготовлены путем смешивания при температуре окружающей среды при подходящем рН и в нужной степени чистоты, с физиологически приемлемыми носителями, то есть носителями, которые являются нетоксичными для реципиентов в используемых в галеновых формах дозах и концентрациях. РН композиции в основном зависит от конкретного применения и концентрации соединения, но предпочтительно находится в пределах где-то от примерно 3 до примерно 8. В одном примере, соединение формулы I готовят в ацетатном буфере при рН 5. В другом воплощении, соединения формулы I являются стерильными. Соединение может храниться, например, в виде твердого вещества или аморфной композиции, в виде лиофилизированного препарата или в виде водного раствора.
Композиции составляют, дозируют и вводят способами в соответствии с надлежащей медицинской практикой. Факторы для рассмотрения в данном контексте, включают конкретное заболевание, подлежащее лечению, конкретного млекопитающего, подвергаемого лечению, клиническое состояние конкретного пациента, причину расстройства, место доставки агента, способ введения, схему введения и другие факторы, известные практикующим врачам. Эффективное количество соединения для введения будет определяться из таких соображений, и минимального количества, необходимого для ингибирования HBsAg. Например, такое количество может быть ниже такого, которое является токсичным для нормальных клеток или млекопитающих в целом.
В одном примере терапевтически эффективное количество соединения по настоящему изобретению вводят парентерально в дозе, которая находится в диапазоне от приблизительно 0,01 до приблизительно 100 мг/кг, альтернативно приблизительно, например, от 0,01 до приблизительно 20 мг/кг веса тела пациента в день, при обычном начальном диапазоне используемого соединения от приблизительно 0,3 до приблизительно 15 мг/кг/день. В другом воплощении, пероральные дозированные единичные формы, такие как таблетки и капсулы, предпочтительно содержат от приблизительно 0,1 до приблизительно 1000 мг соединения по настоящему изобретению.
Соединения по изобретению могут вводиться любым подходящим способом, включая пероральный, местный (включая буккальный и сублингвальный), ректальный, вагинальный, трансдермальный, парентеральный, подкожный, внутрибрюшинный, внутрилегочный, внутрикожный, интратекальный и эпидуральный и интраназальный, и, если необходимо для местного лечения, внутриочаговое введение. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение.
Соединения по настоящему изобретению можно вводить в любой удобной форме введения, например, таблетки, порошки, капсулы, растворы, дисперсии, суспензии, сиропы, аэрозоли, суппозитории, гели, эмульсии, пластыри и т.п. Такие композиции могут содержать компоненты, обычные в фармацевтических композициях, например, разбавители, носители, модификаторы рН, подсластители, наполнители и дополнительные активные агенты.
Типичную композицию готовят путем смешивания соединения по настоящему изобретению и носителя или эксципиента. Подходящие носители и эксципиенты хорошо известны специалистам в данной области техники и подробно описаны в, например, Ansel, Howard С., et al., Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems. Philadelphia: Lippincott, Williams & Wilkins, 2004; Gennaro, Alfonso R., et al. Remington: The Science and Practice of Pharmacy. Philadelphia: Lippincott, Williams & Wilkins, 2000; and Rowe, Raymond C. Handbook of Pharmaceutical Excipients. Chicago, Pharmaceutical Press, 2005. Композиции могут также включать один или более буферов, стабилизирующих агентов, поверхностно-активных веществ, смачивающих агентов, смазывающих агентов, эмульгаторов, суспендирующих агентов, консервантов, антиоксидантов, кроющих агентов, глидантов, технологических добавок, красителей, подсластителей, отдушек, ароматизаторов, разбавителей и других известных добавок, с целью обеспечить элегантное представление препарата (то есть, соединения по настоящему изобретению или его фармацевтической композиции) или облегчить изготовление фармацевтического продукта (т.е. лекарственного средства).
Примером подходящей пероральной дозированной формы является таблетка, содержащая от 0,1 мг до 1000 мг соединения по настоящему изобретению, смешанного с приблизительно 0 до приблизительно 2000 мг безводной лактозы, от приблизительно 0 до приблизительно 2000 мг кросскармелозы натрия, от приблизительно 0 до 2000 мг поливинилпирролидона (PVP) К30, и от приблизительно 0 до приблизитель