Комплексы типа сахаридная цепочка-полипептид
Иллюстрации
Показать всеИзобретение относится к комплексам типа сахаридная цепочка-полипептид, которые могут образовывать прозрачный и однородный гидрогель в широком диапазоне рН. Комплексы сахаридная цепочка-полипептид характеризуются тем, что данный полипептид представляет собой полипептид, содержащий аминокислотную последовательность, состоящую из 8-34 аминокислотных остатков, в которой чередуются полярные и неполярные аминокислотные остатки, и с данным полипептидом связана одна или несколько сахаридных цепочек, и общее число сахаридных остатков, присутствующих в одной или нескольких сахаридных цепочках, связанных с указанным полипептидом, составляет 5 или больше. 6 н. и 9 з.п. ф-лы, 7 ил., 6 табл., 10 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение касается комплексов типа сахаридная цепочка-полипептид, у которых сахаридная цепочка связана с полипептидом.
Уровень техники
Биогели типа гидрогеля и фибринового клея применяются в качестве опытного матрикса для трехмерных культур, хирургического матрикса типа пре/постоперационных гемостатиков или пластырей для заживления ран, систем доставки лекарственных средств (DDS) и пр.
Однако, поскольку во многих из них используются материалы биологического происхождения, то при их применении возникают такие риски, как заражение микроорганизмами типа вирусов, иммуногенность и перенос болезней. Например, хотя фибриновый клей имеет высокую применимость в качестве кровоостанавливающего средства при операциях, однако, поскольку исходный материал получают из человеческой крови, то при его практическом применении в хирургии было много случаев заражения пациентов вирусом гепатита, которым был загрязнен фибриновый клей, что вызывает большие социальные проблемы. Существует также и проблема того, что не всегда можно обеспечить однородное качество геля у биогелей биологического происхождения.
В отличие от биогелей биологического происхождения, у биогелей, полученных путем химического синтеза, как известно, нет риска инфекции и они способны обеспечить гели однородного качества (Патентный документ 1). Однако известные к настоящему времени биогели требуют таких процедур, как замена буфера или добавление и смешивание нескольких веществ при получении геля, что осложняет работу. Кроме того, не только существуют ограничения на совместное использование реагентов или растворителей вследствие низкой растворимости в зависимости от диапазона pH, но существуют и такие проблемы, как ограниченность участков для применения (пораженных участков) и закупоривание шприцев или трубочек при использовании. Кроме того, низкая растворимость (т.е. непрозрачность), в особенности в нейтральном диапазоне, близком к биологическим значениям pH, усложняет применение в ситуациях, требующих видимости, как-то в области хирургии.
Список цитированной литературы
[Патентный документ 1] U.S. Patent No. 5670483.
Раскрытие изобретения
Цели и задачи изобретения
Предметом настоящего изобретения является получение таких комплексов типа сахаридная цепочка-полипептид (sugar chain-polypeptide complex), которые могут образовывать прозрачный и однородный гидрогель в широком диапазоне рН.
Средства решения задач
В результате обширных исследований, проведенных авторами настоящего изобретения для решения данной проблемы, неожиданно оказалось, что комплексы типа сахаридная цепочка-полипептид, полученные при связывании сахаридной цепочки с полипептидом, содержащим такую аминокислотную последовательность, в которой чередуются полярные и неполярные аминокислотные остатки, проявляют высокую растворимость в воде и образуют прозрачный и однородный гидрогель в широком диапазоне pH, в частности, в нейтральном диапазоне, что и привело к совершению настоящего изобретения.
Иными словами, настоящим изобретением предусмотрены комплексы сахаридная цепочка-полипептид, отличающиеся тем, что данный полипептид представляет собой полипептид, содержащий аминокислотную последовательность, состоящую из 8-34 аминокислотных остатков, в которой чередуются полярные и неполярные аминокислотные остатки, и с данным полипептидом связана одна или несколько сахаридных цепочек.
Далее, одно воплощение настоящего изобретения характеризуется тем, что данные комплексы типа сахаридная цепочка-полипептид могут образовывать гидрогель, включающий структуру β-листа, при самосборке в водном растворе при близких к нейтральным значениях рН.
Далее, одно воплощение настоящего изобретения характеризуется тем, что каждый из указанных полярных аминокислотных остатков представляет собой аминокислотный остаток, выбранный из группы, состоящей из остатка аспартата, остатка глутамата, остатка аргинина, остатка лизина, остатка гистидина, остатка тирозина, остатка серина, остатка треонина, остатка аспарагина, остатка глутамина и остатка цистеина.
Далее, одно воплощение настоящего изобретения характеризуется тем, что каждый из указанных неполярных аминокислотных остатков представляет собой аминокислотный остаток, выбранный из группы, состоящей из остатка аланина, остатка валина, остатка лейцина, остатка изолейцина, остатка метионина, остатка фенилаланина, остатка триптофана, остатка пролина и остатка глицина.
Далее, одно воплощение настоящего изобретения характеризуется тем, что каждый из указанных полярных аминокислотных остатков представляет собой аминокислотный остаток, выбранный из группы, состоящей из остатка аспартата, остатка глутамата, остатка аргинина и остатка треонина, а каждый из указанных неполярных аминокислотных остатков представляет собой остаток аланина.
Далее, одно воплощение настоящего изобретения характеризуется тем, что данная аминокислотная последовательность представляет собой повторяющуюся последовательность "RADA" или повторяющуюся последовательность "RATARAEA".
Далее, одно воплощение настоящего изобретения характеризуется тем, что данная аминокислотная последовательность представляет собой аминокислотную последовательность, выбранную из группы, состоящей из RADARADARADARADA (SEQ ID NO. 1), RADARADARADARADARADA (SEQ ID NO. 2) и RATARAEARATARAEA (SEQ ID NO. 3).
Далее, одно воплощение настоящего изобретения характеризуется тем, что общее число сахаридных остатков, присутствующих в одной или нескольких сахаридных цепочках, связанных с данным полипептидом, составляет 5 или больше.
Далее, одно воплощение настоящего изобретения характеризуется тем, что количество сахаридных цепочек, связанных с данным полипептидом, составляет 1, 2 или 3.
Далее, одно воплощение настоящего изобретения характеризуется тем, что сахаридные цепочки связаны с каждой аминокислотой вплоть до положения x, считая от аминокислотного остатка, расположенного на N-конце данного полипептида, и каждой аминокислотой вплоть до положения y, считая от аминокислотного остатка, расположенного на С-конце (где x и y - целые числа, x≥0, y≥0, а x+y есть общее количество сахаридных цепочек, связанных с полипептидом).
Далее, одно воплощение настоящего изобретения характеризуется тем, что количество сахаридных цепочек, связанных с данным полипептидом, составляет 1, 2 или 3, причем, если количество сахаридных цепочек, связанных с данным полипептидом, составляет 1, то данная одна сахаридная цепочка связана с аминокислотным остатком, расположенным на N-конце данного полипептида, или с аминокислотным остатком, расположенным на С-конце,
если количество сахаридных цепочек, связанных с данным полипептидом, составляет 2, то данные две сахаридные цепочки связаны с аминокислотными остатками, выбранными из группы, состоящей из пунктов 1-3 ниже:
(1) первого и второго аминокислотных остатков, считая от аминокислотного остатка, расположенного на N-конце данного полипептида,
(2) первого и второго аминокислотных остатков, считая от аминокислотного остатка, расположенного на С-конце данного полипептида, и
(3) аминокислотного остатка, расположенного на N-конце данного полипептида, и аминокислотного остатка, расположенного на С-конце данного полипептида, а
если количество сахаридных цепочек, связанных с данным полипептидом, составляет 3, то данные три сахаридные цепочки связаны с любыми аминокислотными остатками, выбранными из группы, состоящей из пунктов 1-4 ниже:
(1) первого, второго и третьего аминокислотных остатков, считая от аминокислотного остатка, расположенного на N-конце данного полипептида,
(2) первого, второго и третьего аминокислотных остатков, считая от аминокислотного остатка, расположенного на С-конце данного полипептида,
(3) первого и второго аминокислотных остатков, считая от аминокислотного остатка, расположенного на N-конце данного полипептида, а также от аминокислотного остатка, расположенного на С-конце данного полипептида, и
(4) аминокислотного остатка, расположенного на N-конце данного полипептида, а также аминокислотных остатков, расположенных в положениях 1 и 2, считая от С-конца данного полипептида.
Далее, одно воплощение настоящего изобретения характеризуется тем, что данная сахаридная цепочка представляет собой сахаридную цепочку с разветвлением.
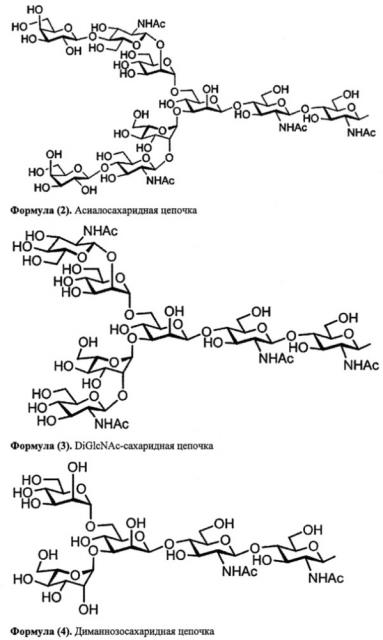
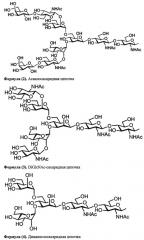
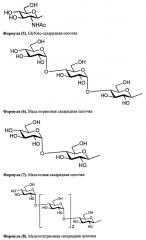
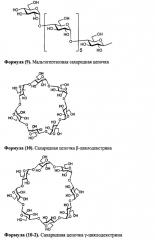
Далее, одно воплощение настоящего изобретения характеризуется тем, что данная сахаридная цепочка представляет собой сахаридную цепочку, выбранную из группы, состоящей из дисиалосахаридной цепочки, асиалосахаридной цепочки, diGlcNAc-сахаридной цепочки, диманнозосахаридной цепочки, GlcNAc-сахаридной цепочки, мальтотриозной сахаридной цепочки, мальтозной сахаридной цепочки, мальтотетраозной сахаридной цепочки, мальтогептаозной сахаридной цепочки, β-циклодекстрина и γ-циклодекстрина.
Далее, одно воплощение настоящего изобретения характеризуется тем, что оно представляет собой композицию для получения гидрогеля, содержащую комплекс типа сахаридная цепочка-полипептид по настоящему изобретению. Кроме того, такая композиция для получения гидрогеля может представлять собой гемостатическую фармацевтическую композицию, композицию носителя для контролируемого высвобождения или композицию матрикса для культивирования.
Далее, одно воплощение настоящего изобретения характеризуется тем, что оно представляет собой композицию, содержащую комплекс сахаридная цепочка-полипептид по настоящему изобретению, причем данная композиция находится в состоянии гидрогеля. Кроме того, такая композиция для получения гидрогеля может представлять собой гемостатическую фармацевтическую композицию, композицию носителя для контролируемого высвобождения или композицию матрикса для культивирования.
Специалистам в данной области должно быть понятно, что любые комбинации одной или нескольких характеристик настоящего изобретения, описанных выше, также входят в рамки настоящего изобретения.
Эффекты изобретения
Поскольку комплексы типа сахаридная цепочка-полипептид по настоящему изобретению обладают высокой растворимостью в воде в широком диапазоне pH, включая и нейтральный диапазон, и образуют однородный и прозрачный гидрогель, то они менее подвержены ограничениям по реагентам или растворителям, которые применяются в комбинации, и могут использоваться для различных применений. Кроме того, поскольку они могут применяться в широком диапазоне pH, то они менее подвержены ограниченности участков для применения (пораженных участков).
Далее, поскольку комплексы типа сахаридная цепочка-полипептид по настоящему изобретению обладают высокой растворимостью в воде в широком диапазоне pH, включающем и нейтральный диапазон, и образуют однородный и прозрачный гидрогель, то при нейтральном рН могут обратимо присутствовать состояния золя и геля. Иными словами, комплексы типа сахаридная цепочка-полипептид могут сначала образовать состояние геля, а затем перейти в состоянии золя при механическом перемешивании и опять перейти в состояние геля. Соответственно, они могут расширяться в состоянии геля (т.е. в готовом к применению состоянии) и не требуют сложных операций, как с другими пептидными гелями, типа замены (или добавления) буфера для достижения нейтрального рН после образования геля при подходящем для гелеобразования рН (например, при кислом рН). Иными словами, комплексы сахаридная цепочка-полипептид по настоящему изобретению сильно превосходят по работоспособности другие пептидные гели. Кроме того, поскольку диапазон pH, при котором могут применяться комплексы сахаридная цепочка-полипептид по настоящему изобретению, шире, то будут реже возникать такие проблемы, как закупоривание шприцев или трубок при использовании.
Далее, поскольку комплексы типа сахаридная цепочка-полипептид по настоящему изобретению модифицированы такими сахаридными цепями, которые существуют in vivo у животных, то уменьшается антигенность по сравнению с пептидами без каких-либо модификаций. Кроме того, комплексы типа сахаридная цепочка-полипептид по настоящему изобретению почти не дают риска возникновения токсичности типа той, что наблюдается у соединений, модифицированных, например, полиэтиленгликолем (ПЭГ). Соответственно, комплексы типа сахаридная цепочка-полипептид по настоящему изобретению обладают высокой безопасностью для биологического применения.
Далее, из приведенных здесь примеров также видно, что комплексы типа сахаридная цепочка-полипептид по настоящему изобретению образуют более прозрачный и однородный гидрогель по сравнению с полипептидами, связанными с ПЭГ.
Далее, поскольку комплексы типа сахаридная цепочка-полипептид по настоящему изобретению образуют однородный и прозрачный гидрогель при физиологических условиях (нейтральный диапазон рН) и обладают низкой антигенностью, то они предпочтительны в качестве гидрогеля для применения на животных in vivo.
В частности, поскольку для гидрогелей, содержащих комплексы типа сахаридная цепочка-полипептид по настоящему изобретению, характерна сохранность состояния прозрачного и однородного геля даже в условиях, включающих высокую концентрацию плазмы крови при нейтральном pH, то они имеют высокую применимость, например, в качестве кровоостанавливающих средств.
Далее, поскольку гидрогели, содержащие комплексы типа сахаридная цепочка-полипептид по настоящему изобретению, дают высокое контролируемое высвобождение при инкапсуляции и кислых, и основных белков при нейтральном pH, то они имеют высокую применимость в качестве носителя для контролируемого высвобождения различных веществ.
Краткое описание фигур
На фиг. 1 представлены фотографии, показывающие результаты испытания на нагрузку стальным шариком для (RADA)4 и C(diGlcNAc)-(RADA)4 при различных значениях рН.
На фиг. 2 представлены фотографии, показывающие результаты испытания на нагрузку стальным шариком для (RADA)4 и C(diGlcNAc)-(RADA)4 при содержании плазмы крови в различных концентрациях.
На фиг. 3 представлены графики, показывающие результаты измерения эффекта контролируемого высвобождения для (RADA)4 и C(diGlcNAc)-(RADA)4 при инкапсулировании кислого белка.
На фиг. 4 представлены графики, показывающие результаты измерения эффекта контролируемого высвобождения для (RADA)4 и C(diGlcNAc)-(RADA)4 при инкапсулировании основного белка.
На фиг. 5 представлены графики, показывающие результаты измерения кругового дихроизма (CD) для (RADA)4 при рН 2 или рН 7.
На фиг. 6 представлены графики, показывающие результаты измерения кругового дихроизма (CD) для C(diGlcNAc)-(RADA)4 при рН 2 или рН 7.
На фиг. 7 представлены графики, показывающие результаты измерения кинетической вязкости для (RADA)4 и C(diGlcNAc)-(RADA)4 при рН 7.
Осуществление изобретения
Комплексы типа сахаридная цепочка-полипептид по настоящему изобретению могут иметь биологическое происхождение или могут быть получены путем химического синтеза, но предпочтительно их получают путем химического синтеза по соображениям устойчивости и безопасности или качества и однородности сахаридных цепей.
Комплексы типа сахаридная цепочка-полипептид по настоящему изобретению могут образовываться, например, путем самосборки в водном растворе посредством таких взаимодействий, как электростатические взаимодействия между пептидными молекулами, водородные связи и гидрофобные взаимодействия. "Самосборка" комплексов сахаридная цепочка-полипептид в водном растворе в настоящем изобретении означает то, что полипептиды спонтанно собираются друг с другом посредством какого-либо рода взаимодействий (например, электростатических взаимодействий, водородных связей, ван-дер-ваальсовых сил или гидрофобного взаимодействия) в водном растворе, и это не должно восприниматься в ограничительном смысле.
Комплексы типа сахаридная цепочка-полипептид по настоящему изобретению могут подвергаться самосборке с образованием структуры β-листа в водном растворе. Далее, при многократном наслаивании данных β-листовых структур может образоваться гидрогель. Методы для подтверждения того, что комплекс типа сахаридная цепочка-полипептид образует структуру β-листа в водном растворе, не имеют особых ограничений, так что это можно проверить, например, путем измерения кругового дихроизма (CD) водного раствора, содержащего комплекс сахаридная цепочка-полипептид. Поскольку вообще для молекул, имеющих структуру β-листа, характерно положительное поглощение при длине волны около 197 нм и отрицательное поглощение при длине волны около 216 нм, то образование структур типа β-листа может быть подтверждено путем проверки пиков вокруг этих длин волн путем измерения кругового дихроизма.
Поскольку комплексы типа сахаридная цепочка-полипептид по настоящему изобретению содержат аминокислотную последовательность, в которой чередуются полярные и неполярные аминокислотные остатки, то при формировании структуры β-листа в водном растворе на одной стороне β-листовой структуры могут располагаться только полярные аминокислотные остатки, а на другой стороне могут располагаться только неполярные аминокислотные остатки. Соответственно, такие β-листовые структуры могут собираться таким образом, чтобы гидрофобные стороны (стороны только с неполярными аминокислотными остатками) складывались с образованием двухслойной структуры. Затем эта сложенная β-листовая структура будет наращиваться по мере прогрессирования молекулярной самосборки с образованием трехмерной конформации (например, гидрогеля). Полипептид, имеющий такую природу, может быть описан здесь как SAP (самособирающийся пептид).
"Значение рН близко к нейтральному" в настоящем изобретении означает то, что значение рН составляет около 7,0, более конкретно рН находится в диапазоне 5,0-9,0, а предпочтительно рН находится в диапазоне 6,0-8,0.
Одно воплощение настоящего изобретения характеризуется тем, что комплексы типа сахаридная цепочка-полипептид могут подвергаться самосборке в водном растворе при близком к нейтральному рН с образованием гидрогеля, содержащего структуры типа β-листа. При этом не исключаются и такие, которые могут подвергаться самосборке даже в водном растворе с другим значением pH, а не близким к нейтральному, с образованием гидрогеля, содержащего структуры β-листа, если только они обладают данной характеристикой.
Комплексы типа сахаридная цепочка-полипептид по настоящему изобретению включают полипептиды, содержащие аминокислотную последовательность, в которой чередуются полярные и неполярные аминокислотные остатки. Длина такой аминокислотной последовательности не имеет ограничений, а предпочтительно такая аминокислотная последовательность может состоять из 8-34 аминокислотных остатков, более предпочтительно из 12-25 аминокислотных остатков и еще более предпочтительно из 16-21 аминокислотного остатка.
Комплексы типа сахаридная цепочка-полипептид по настоящему изобретению включают полипептиды, содержащие аминокислотную последовательность, в которой чередуются полярные и неполярные аминокислотные остатки. При этом термин "аминокислота" применяется в самом широком смысле и включает не только входящие в состав белков аминокислоты, но и не входящие в состав белков аминокислоты типа вариантов и производных аминокислот. Специалистам должно быть известно, в свете этого широкого определения, что примеры аминокислот включают входящие в состав белков L-аминокислоты; D-аминокислоты; химически модифицированные аминокислоты типа вариантов и производных аминокислот; не входящие в состав белков аминокислоты, как-то норлейцин, β-аланин и орнитин, а также химически синтезированные соединения, обладающие хорошо известными, характерными для аминокислот свойствами. Примеры не входящих в состав белков аминокислот включают α-метиламинокислоты (типа α-метилаланина), D-аминокислоты, гистидиноподобные аминокислоты (как-то 2-аминогистидин, β-гидроксигистидин, гомогистидин, α-фторметилгистидин и α-метилгистидин), аминокислоты с липшим метиленом в боковой цепи ("гомо"-аминокислоты) и такие аминокислоты, у которых карбоксильная функциональная группа в боковой цепи аминокислоты замещена сульфонатной группой (типа цистеиновой кислоты). В предпочтительном аспекте настоящего изобретения используются такие аминокислоты, которые входят в состав белков.
Полярные аминокислотные остатки в настоящем изобретении не имеют особых ограничений, если только это аминокислотные остатки, у которых боковые цепи могут обладать полярностью, а примеры таковых включают кислые аминокислотные остатки и основные аминокислотные остатки. При этом примеры кислых аминокислотных остатков включают остатки аспарагиновой кислоты (Asp/D) и глутаминовой кислоты (Glu/E), а примеры основных аминокислот включают аргинин (Arg/R), лизин (Lys/K) и гистидин (His/H).
Отметим, что такие обозначения, к примеру, как "аспарагиновая кислота (Asp/D)" в настоящем изобретении означают то, что для сокращенного обозначения аспарагиновой кислоты может использоваться и трехбуквенное обозначение "Asp", и однобуквенное обозначение "D".
Кроме того, в настоящем описании из числа остатков нейтральных аминокислот к полярным аминокислотным остаткам относятся аминокислотные остатки, содержащие гидроксильную группу, кислую амидную группу, тиоловую группу и т.п., поскольку они обладают полярностью. Например, в настоящем описании тирозин (Tyr/Y), серии (Ser/S), треонин (Thr/T), аспарагин (Asn/N), глутамин (Gln/Q) и цистеин (Cys/C) относятся к полярным аминокислотным остаткам.
Неполярные аминокислотные остатки в настоящем изобретении не имеют особых ограничений, если только это аминокислотные остатки, у которых боковые цепи не обладают полярностью, а примеры таковых включают аланин (Ala/А), валин (Val/V), лейцин (Leu/L), изолейцин (Ile/I), метионин (Met/M), фенилаланин (Phe/F), триптофан (Trp/W), глицин (Gly/G) и пролин (Pro/Р).
У комплексов типа сахаридная цепочка-полипептид по настоящему изобретению "аминокислотная последовательность, в которой чередуются полярные и неполярные аминокислотные остатки" предпочтительно такова, что она представляет собой повторяющуюся последовательность "RADA" (2-8 повторов, предпочтительно 3-6 повторов) или повторяющуюся последовательность "RATARAEA" (1-4 повтора, предпочтительно 2-3 повтора), а более предпочтительно она представляет собой аминокислотную последовательность, выбранную из группы, состоящей из RADARADARADARADA (SEQ ID NO. 1), RADARADARADARADARADA (SEQ ID NO. 2) и RATARAEARATARAEA (SEQ ID NO. 3).
"Сахаридная цепочка" в настоящем изобретении означает соединение, состоящее из цепочки из одного или нескольких звеньев сахаридов (моносахаридов и/или их производных). Если это цепочка из двух звеньев сахаридов, то каждое звено сахарида соединяется друг с другом гликозидной связью путем дегидратационной конденсации. Примеры таких сахаридных цепочек включают, без ограничения, широкий спектр моносахаридов и полисахаридов, встречающихся in vivo (глюкоза, галактоза, манноза, фукоза, ксилоза, N-ацетилглюкозамин, N-ацетилгалактозамин, сиаловая кислота и их комплексы и производные), а также сахаридные цепочки, которые являются продуктами деградации или разрушения сложных биомолекул типа продуктов деградации полисахаридов, гликопротеинов, протеогликанов, гликозаминогликанов и гликолипидов. Сахаридные цепочки могут быть линейными или разветвленными.
"Сахаридные цепочки" в настоящем изобретении также включают и производные сахаридные цепочки. Примеры производных сахаридных цепочек включают, без ограничения, такие сахаридные цепочки, в которых сахарид, конфигурирующий сахаридную цепочку, представлен, к примеру, сахаридом, содержащим карбоксильную группу (например, альдоновой кислотой, у которой положение С-1 подверглось окислению до карбоновой кислоты типа D-глюконовой кислоты, которая является окисленной D-глюкозой, или уроновой кислотой, у которой концевой атом С превратился в карбоновую кислоту типа D-глюкуроновой кислоты, которая является окисленной D-глюкозой), сахаридом, содержащим аминогруппу или производное аминогруппы типа D-глюкозамина и D-галактозамина, сахаридом, содержащим и амино-, и карбоксильную группу типа N-гликозилнейраминовой кислоты и N-ацетилмурамовой кислоты), дезоксилированным сахаром типа 2-дезокси-D-рибозы, сульфатированным сахаром, содержащим сульфатную группу, или фосфорилированным сахаром, содержащим фосфатную группу.
У комплексов типа сахаридная цепочка-полипептид по настоящему изобретению сахаридная цепочка, которая соединяется с полипептидом, не имеет особых ограничений, но предпочтительно это сахаридная цепочка, которая существует in vivo в виде гликоконъюгата типа гликопептида или гликопротеина, протеогликана или гликолипида, по соображениям биосовместимости. Такие сахаридные цепочки включают N-связанные сахаридные цепи, О-связанные сахаридные цепи и т.п., то есть сахаридные цепочки, которые связаны in vivo с пептидами или белками в виде гликопептидов или гликопротеинов.
У комплексов типа сахаридная цепочка-полипептид по настоящему изобретению для сахаридной цепочки, которая соединяется с полипептидом, может использоваться, к примеру, дисиалосахаридная цепочка, асиалосахаридная цепочка, diGlcNAc-сахаридная цепочка, диманнозосахаридная (diMan) цепочка, GlcNAc-сахаридная цепочка, мальтотриозная сахаридная цепочка, мальтозная сахаридная цепочка, мальтотетраозная сахаридная цепочка, мальтогептаозная сахаридная цепочка, сахаридная цепочка β-циклодекстрина и сахаридная цепочка γ-циклодекстрина.
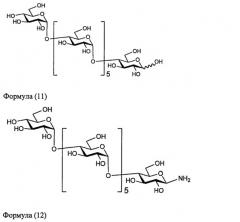
В частности, сахаридная цепочка, используемая в настоящем изобретении, может представлять собой дисиалосахаридную цепочку, представленную следующей формулой (1), асиалосахаридную цепочку, представленную следующей формулой (2), diGlcNAc-сахаридную цепочку, представленную следующей формулой (3), диманнозосахаридную цепочку, представленную следующей формулой (4), GlcNAc-сахаридную цепочку, представленную следующей формулой (5), мальтотриозную сахаридную цепочку, представленную следующей формулой (6), мальтозную сахаридную цепочку, представленную следующей формулой (7), мальтотетраозную сахаридную цепочку, представленную следующей формулой (8), мальтогептаозную сахаридную цепочку, представленную следующей формулой (9), сахаридную цепочку β-циклодекстрина, представленную следующей формулой (10), или сахаридную цепочку γ-циклодекстрина, представленную следующей формулой (10-2).
В настоящем изобретении можно использовать и такие сахаридные цепочки, у которых отсутствует один или несколько сахаров из невосстанавливающегося конца вышеприведенной дисиалосахаридной цепочки, асиалосахаридной цепочки, diGlcNAc-сахаридной цепочки, диманнозосахаридной цепочки или мальтогептаозной сахаридной цепочки.
В настоящем изобретении остаток аминокислоты, с которым связана сахаридная цепочка, не имеет особых ограничений. Например, сахаридная цепочка может быть связана с цистеином (Cys/C) или аспарагином (Asn/N), предпочтительно с цистеином (Cys/C).
В настоящем изобретении способ связывания сахаридной цепочки с аминокислотой не имеет особых ограничений. Например, сахаридная цепочка может непосредственно связываться с остатком аминокислоты или же она может связываться с остатком аминокислоты через линкер.
Кроме того, в настоящем изобретении остаток аминокислоты, с которым связана сахаридная цепочка, может непосредственно связываться с "аминокислотной последовательностью, в которой чередуются полярные и неполярные аминокислотные остатки" или же он может связываться, например, через линкер.
Примеры таких линкеров включают алкильные цепи или цепи PEG, содержащие амино- и карбоксигруппы на обоих концах так, что они могут образовывать пептидные связи с аминокислотами. Примеры таких линкеров включают -NH-(CH2)n-CO- (где n означает целое число без ограничений, если только оно не ингибирует нужную функцию линкера, а предпочтительно оно составляет 1-15) или -NH-(CH2CH2O)m-CH2CH2-CO- (где m означает целое число без ограничений, если только оно не ингибирует нужную функцию линкера, а предпочтительно оно составляет 1-7), в частности -NH-(CH2)11-CO-(С12-линкер) или -NH-(CH2CH2O)3-СН2СН2-СО- (PEG-линкер) и др.
Комплексы типа сахаридная цепочка-полипептид по настоящему изобретению могут быть получены путем добавления стадии гликозилирования в метод синтеза полипептидов, хорошо известный специалистам. Хотя для гликозилирования можно применять методы с использованием ферментов, представленных трансглутаминазой, но при этом возникают такие проблемы, как необходимость добавления большого количества сахаридной цепочки, сложности с очисткой после заключительной стадии и ограниченность положений гликозилирования и тех сахаридных цепочек, которые можно добавлять. Поэтому, хотя он может применяться при небольших масштабах синтеза, как-то для анализа, однако его нельзя назвать практическим способом для производства в больших масштабах.
В качестве конкретных примеров легкого способа получения комплексов типа сахаридная цепочка-полипептид по настоящему изобретению ниже будет представлен способ получения комплексов типа сахаридная цепочка-полипептид с помощью Asn, содержащего связанную с ним сахаридную цепочку (гликозилированного Asn), с применением таких хорошо известных методов синтеза пептидов, как твердофазный и жидкофазный синтез (способ А), и способ получения комплексов типа сахаридная цепочка-полипептид путем получения полипептида, в котором произвольный аминокислотный остаток представлен Cys, в соответствии с хорошо известным методом пептидного синтеза, с последующим гликозилированием этого Cys путем химического синтеза (способ В). Специалисты в данной области смогут получать комплексы типа сахаридная цепочка-полипептид различными методами, исходя из этих способов получения.
Эти способы А и В также могут выполняться в виде комбинации из двух или нескольких. В случае синтеза в небольших масштабах типа для анализа и т.п., вышеуказанный способ также может применяться в сочетании с реакцией элонгации сахаридной цепочки при помощи трансферазы. Способ А описан в WO No. 2004/005330 (US 2005222382 А1), а способ В описан в WO No. 2005/010053 (US 2007060543 A1), содержание которых включено сюда путем ссылки во всей полноте. Кроме того, получение сахаридных цепочек, имеющих однородную структуру, используемых в способах А и В, описано, например, в WO No. 03/008431 (US 2004181054 A1), WO No. 2004/058984 (US 2006228784 A1), WO No. 2004/058824 (US 2006009421 A1), WO No. 2004/070046 (US 2006205039 A1) и WO No. 2007/011055, содержание которых включено сюда путем ссылки во всей полноте.
Способ получения комплексов сахаридная цепочка-полипептид (способ А)
Как изложено ниже, комплексы типа сахаридная цепочка-полипептид могут быть получены, например, методом твердофазного синтеза с использованием Asn, содержащего связанную с ним сахаридную цепочку.
(1) Карбоксильная группа аминокислоты, у которой азот аминогруппы блокирован липофильной защитной группой, связывается со смолой. При этом, поскольку азот аминогруппы этой аминокислоты блокирован липофильной защитной группой, то предотвращается автоконденсация аминокислот друг с другом, а аминокислота реагирует со смолой с образованием связи.
(2) Липофильная защитная группа полученного реактанта отделяется с образованием свободной аминогруппы.
(3) Эта свободная аминогруппа подвергается реакции амидирования с карбоксильной группой другой аминокислоты, у которой азот аминогруппы блокирован липофильной защитной группой.
(4) Данная липофильная защитная группа отделяется с образованием свободной аминогруппы.
(5) Вышеприведенные стадии (3) и (4) повторяются один или несколько раз, образуя пептид из любого количества соединенных вместе аминокислот, который связан со смолой на одном конце и содержит свободную аминогруппу на другом конце.
(6) Если свободная аминогруппа пептида, синтезированного на стадии (5), должна быть защищена ацетильной группой, то она предпочтительно ацетилируется с помощью уксусного ангидрида, уксусной кислоты и т.п.
(7) Наконец, смола отщепляется с помощью кислоты и получается пептид, имеющий искомую аминокислотную последовательность.
При этом, если вместо аминокислоты, у которой азот аминогруппы блокирован липофильной защитной группой, использовать гликозилированный Asn, у которого азот аминогруппы блокирован липофильной защитной группой, и провести реакцию карбоксильной группы данной молекулы аспарагина с гидроксильной группой смолы на стадии (1), то можно получить пептид, содержащий гликозилированный Asn на С-конце.
Более того, если после стадии (2) или после повторения стадий (3) и (4) любое количество раз, то есть один или несколько раз, вместо аминокислоты, у которой азот аминогруппы блокирован липофильной защитной группой, на стадии (3) использовать гликозилированный Asn, у которого азот аминогруппы блокирован липофильной защитной группой, то можно связать сахаридную цепочку в любом положении полипептида.
Таким образом, если на любой из стадий (1) и (3) вместо аминокислоты, у которой азот аминогруппы блокирован липофильной защитной группой, два или несколько раз использовать гликозилированный Asn, у которого азот аминогруппы блокирован липофильной защитной группой, то можно связать сахаридные цепочки в любых двух или нескольких положениях полипептида.
Если после связывания гликозилированного Asn отделить липофильную защитную группу с образованием свободной аминогруппы и сразу же после этого провести стадию (7), то можно получить полипептид, содержащий гликозилированный Asn на N-конце.
Смолой, обеспечивающей С-конец в виде амидной группы, может быть смола, которая обычно используется при твердофазном синтезе. Например, предпочтительно используется смола Rink-Amide, которая функционализирована аминогруппой (фирмы Merck & Co., Inc.), смола Rink-Amide-PEGA (фирмы Merck & Co., Inc.) или смола NH-SAL (фирмы Watanabe Chemical Industries, Ltd.). Кроме того, смола Fmoc-NH-SAL-линкер (фирмы Watanabe Chemical Industries, Ltd.) и т.п. может связываться со смолой Arnino-PEGA, которая функционализирована аминогруппой (фирмы Merck & Co., Inc.) и др. С-концевую аминокислоту пептида можно амидировать путем отщепления пептида от этой смолы с помощью кислоты.
Кроме того, примерами смол, превращающих С-конец в карбоновую кислоту, которые можно использовать, являются 2-хлортритилхлоридная смола, функционализированная хлором (фирмы Merck & Co., Inc.), смола Amino-PEGA, функционализированная аминогруппой (фирмы Merck & Co., Inc.), спиртовая смола NovaSyn TGT, содержащая гидроксильные группы (фирмы Merck & Co., Inc.), смола Wang (фирмы Merck & Co., Inc.), смола HMPA-PEGA (фирмы Merck & Co., Inc.) и др. Кроме того, между смолой Amino-PEGA и аминокислотой может находиться линкер, а примеры таких линкеров включают 4-гидроксиметилфеноксиуксусную кислоту (НМРА), 4-(4-гидроксиметил-3-метоксифенокси)-бутилуксусную кислоту (НМРВ) и др. Также можно использовать смолу H-Cys(Trt)-Trityl Nova PEG, у которой С-концевая аминокислота заранее связана со смолой (фирмы Merck & Co., Inc.).
В отношении связывания между собой смолой и аминокислотой, у которой азот аминогруппы блокирован липофильной защитной группой, например, для того, чтобы использовать смолу, содержащую гидроксильные группы, или смолу, функционализированную хлором, карбоксигруппу аминокислоты подвергают сложноэфирной связи со смолой. Кроме того, при использовании смолы, функционализированной аминогруппой, карбоксигруппу аминокислоты связывают со смолой посредством амидной связи.
Следует отметить, что 2-хлортритилхлоридная смола предпочтительна тем, что она может предотвратить рацемизацию концевого Cys при удлинении пептидной цепи при твердофазном синтезе.
Способ получения комплексов сахаридная цепочка-полипептид (способ А-2)
Как изложено ниже, комплексы типа сахаридная цепочка-полипептид могут быть получены, например, методом жидкофазного синтеза с использованием Asn, содержащего связанную с ним сахаридную цепочку.
(1) Карбоксильная группа аминокислоты, у которо