Способ получения n-циклоалкилзамещенных 1,5,3-дитиазепанов
Иллюстрации
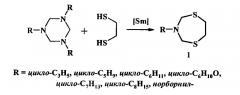
Показать всеИзобретение относится к способу получения N-циклоалкилзамещенных 1,5,3-дитиазепанов общей формулы (1)
где R = цикло-С3Н5, цикло-С5Н9, цикло-С6Н11, цикло-С5Н9О, цикло-С7Н13, цикло-C8H15, норборнил-, в котором 1,3,5-трициклоалкил(циклопропил, или циклопентил, или циклогексил, или тетрагидропиранил, или циклогептил, или циклооктил, или норборнил)-1,3,5-триазин подвергают взаимодействию с 1,2-этандитиолом в присутствии катализатора SmCl3⋅6H2O, взятыми в мольном соотношении 1,3,5-трициклоалкил-1,3,5-триазин : 1,2-этандитиол : SmCl3⋅6H2O = 1:1:(0.03-0.07), предпочтительно 1:1:0.05, при комнатной температуре (~20°C) и атмосферном давлении в среде растворителей метанол-хлороформ (1:1, объемное соотношение) в течение 2.5-3.5 ч. Технический результат: предложен способ получения N-циклоалкилзамещенных 1,5,3-дитиазепанов общей формулы (1) с высоким выходом. 1 табл., 2 пр.
Реферат
Предлагаемое изобретение относится к области органической химии, в частности к способу получения N-циклоалкилзамещенных 1,5,3-дитиазепанов общей формулы (1)
R = цикло-С3Н5, цикло-С5Н9, цикло-С6Н11, цикло-С5Н9О, цикло-С7Н13, цикло-C8H15, норборнил-.
Интерес к S,N-содержащим гетероциклам обусловлен возможностью их практического применения в качестве фунгицидов (В.Р. Ахметова, Е.Б. Рахимова, А.Б. Миннебаев, Р.В. Кунакова, Н.Ф. Галимзянова, ЖОрХ, 2012, 48, 2, 214-220; Е.Б. Рахимова, Р.А. Исмагилов, Р.А. Зайнуллин, Н.Ф. Галимзянова, А.Г. Ибрагимов, ЖПХ, 2013, 86, 10, 1547-1551; Е.Б. Рахимова, Р.А. Исмагилов, Н.Ф. Галимзянова, А.Г. Ибрагимов, ЖОрХ, 2015, 51, 11, 1636), противомикробных (Bialy Serry А.А., Abdelal А.М., El-Shorbagi А., Kheira Samy М.М. Archiv der Pharmazie, 2005, 338, 1, 38-43) и противовоспалительных агентов (Akhmetova V.R., Khairullina R.R., Parfenova T.I., Sufiyarova R.Sh., Bashkatov S.A., Kunakova R.V. Pharmaceutical Chemistry Journal, 2011, 44, 10, 534-535), селективных комплексообразователей (Galves-Ruiz J.C., Noth H., Flores-Parra A. Inorg. Chem., 2003, 42, 7569-7578; Tian M., Ihmels H. Chem. Commun., 2009, 3175; Akhmetova V.R., Rakhimova E.B., Vagapov R.A., Minnebaev A.B., Kopylova E.V., Buslaeva T.M., Kunakova R.V. Trends in Heterocycl. Chem., 2011, 15, 9, 33), ионофоров (Granzhan A., Ihmels H., Tian M. Arkivoc, 2015, vi, 494).
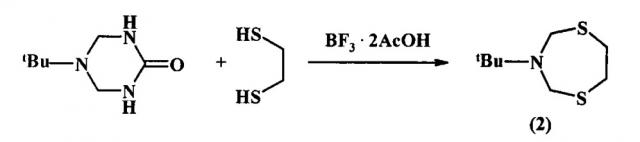
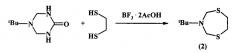
Известен способ (U. Wellmar. J. Heterocyclic Chem., 1998, 35, 1531) получения 3-(трет-бутил)пергидро-1,5,3-дитиазепина (2) взаимодействием 5-(трет-бутил)-2-оксогексагидро-1,3,5-триазина с 1,2-этандитиолом в присутствии BF3⋅2AcOH.
Известным способом не могут быть получены N-циклоалкилзамещенные 1,5,3-Дитиазепаны общей формулы (1).
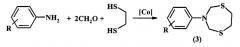
Известен способ (Мурзакова Н.Н., Прокофьев К.И., Тюмкина Т.В., Ибрагимов А.Г. ЖОрХ, 2012, 48, 4, 590) получения N-арил-1,5,3-дитиазепанов (3) конденсацией анилинов с CH2O и 1,2-этандитиолом в присутствии катализатора на основе кобальта.
R=Н, м-СН3, n-СН3, о-СН3, м-ОСН3, n-ОСН3, o-NO2, м-NO2, n-NO2.
Известным способом не могут быть получены N-циклоалкилзамещенные 1,5,3-дитиазепаны общей формулы (1).
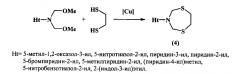
Известен способ (Н.Н. Махмудиярова, К.И. Прокофьев, Л.В. Мударисова, А.Г. Ибрагимов, У.М. Джемилев. ЖОрХ, 2013, 49, 5, 658) получения 3-гетарил-1,5,3-дитиазепанов (4) реакцией N,N-бис(метоксиметил)гетариламинов с 1,2-этандитиолом под действием медного катализатора.
Известным способом не могут быть получены N-циклоалкилзамещенные 1,5,3-дитиазепаны общей формулы (1).
Таким образом, в литературе отсутствуют сведения по получению N-циклоалкилзамещенных 1,5,3-дитиазепанов общей формулы (1).
Предлагается новый способ получения N-циклоалкилзамещенных 1,5,3-Дитиазепанов общей формулы (1).
Сущность способа заключается во взаимодействии 1,3,5-трициклоалкил(циклопропил, или циклопентил, или циклогексил, или тетрагидропиранил, или циклогептил, или циклооктил, или норборнил)-1,3,5-триазина с 1,2-этандитиолом в присутствии катализатора SmCl3⋅6Н2О, взятыми в мольном соотношении 1,3,5-трициклоалкил-1,3,5-триазин: 1,2-этандитиол: 8 SmCl3⋅6Н2О = 1:1:(0.03-0.07), предпочтительно 1:1:0.05, при комнатной температуре (~20°С) и атмосферном давлении в среде растворителей метанол-хлороформ (1:1, объемное соотношение) в течение 2.5-3.5 ч. Выход N-циклоалкилзамещенные 1,5,3-дитиазепанов (1) составляет 58-75%. Реакция протекает по схеме
N-Циклоалкилзамещенные 1,5,3-дитиазепаны общей формулы (1) образуются только лишь с участием 1,3,5-трициклоалкил-1,3,5-триазинов и 1,2-этандитиола, взятых в стехиометрических количествах. При другом соотношении исходных реагентов снижается селективность реакции. Без катализатора SmCl3⋅6Н2О реакция идет с выходом, не превышающим 10%. Проведение реакции в присутствии катализатора SmCl3⋅6Н2О больше 7 мол.% по отношению к 1,3,5-трициклоалкил-1,3,5-триазину не приводит к существенному увеличению выхода целевого продукта (1). Использование в реакции катализатора SmCl3⋅6Н2О менее 3 мол.% снижает выход (1), что связано с уменьшением каталитически активных центров в реакционной массе. Реакции проводили при комнатной температуре ~20°С. При более высокой температуре (например, 60°С) увеличиваются энергозатраты, при меньшей температуре (например, 0°С) снижается скорость реакции. Опыты проводили в среде растворителей метанол-хлороформ (1:1, объемное соотношение), т.к. в них хорошо растворяются исходные реагенты и целевые продукты.
Существенные отличия предлагаемого способа.
В известном способе реакция идет с участием в качестве исходных реагентов 5-(трет-бутил)-2-оксогексагидро-1,3,5-триазина и 1,2-этандитиола в присутствии катализатора BF3⋅2AcOH с образованием 3-(трет-бутил)пергидро-1,5,3-дитиазепина (2). Известный способ не позволяет получать N-циклоалкилзамещенные 1,5,3-дитиазепаны общей формулы (1).
В предлагаемом способе в качестве исходных реагентов применяются 1,3,5-трициклоалкил(циклопропил, циклопентил, циклогексил, тетрагидропиранил, циклогептил, циклооктил, норборнил)-1,3,5-триазины и 1,2-этандитиол. Реакция идет под действием катализатора SmCl3⋅6Н2О.
Предлагаемый способ обладает следующими преимуществами.
Способ позволяет получать с высокой селективностью индивидуальные N-циклоалкилзамещенные 1,5,3-дитиазепаны общей формулы (1), синтез которых в литературе не описан.
Способ поясняется следующими примерами.
ПРИМЕР 1. Синтез 1,3,5-трициклопропил-1,3,5-триазина: смесь 171 мг (3 ммоль) циклопропиламина и 90 мг (3 ммоль) параформа в 10 мл метанола перемешивают 3 ч при 60°С, экстрагируют СНСl3, упаривают и выделяют 1,3,5-трициклопропил-1,3,5-триазин.
ПРИМЕР 2. В круглодонную колбу, установленную на магнитной мешалке, помещают 207 мг (1 ммоль) 1,3,5-трициклопропил-1,3,5-триазина в 5 мл метанола, 18 мг (0.05 ммоль) SmCl3⋅6Н2О и 0.08 мл (1 ммоль) 1,2-этандитиола в 5 мл хлороформа. Реакционную смесь перемешивают при температуре ~20°С в течение 3 ч, колоночной хроматографией на SiO2 выделяют 3-циклопропил-1,5,3-дитиазепан с выходом 63%.
Другие примеры, подтверждающие способ, приведены в таблице 1.
Все опыты проводили при комнатной температуре (~20°С) в среде растворителей метанол-хлороформ (1:1, объемное соотношение), т.к. в них растворяются исходные и целевые продукты.
Спектральные характеристики 3-циклопропил-1,5,3-дитиазепана1: (1Контроль реакции осуществляли методом ТСХ на пластинах Sorbfil (ПТСХ-АФ-В), проявляли парами I2. Для колоночной хроматографии использовали силикагель КСК (100-200 мкм). Спектры ЯМР 1D (1Н, 13С) и 2D (COSY, HSQC, НМВС) сняты на спектрометре Bruker Avance 400 (100.62 МГц для 13С и 400.13 МГц для 1Н) по стандартным методикам фирмы Bruker, внутренний стандарт Me4Si, растворитель - CDCl3. Масс-спектры получены на приборе MALDI TOF/TOF AUTOFLEX III фирмы Bruker.)/
Элюент PhMe-EtOAc-Me2CO (4:1:1), Rf 0.5, nD20 1.6112.
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.47-0.49 м (2Н, СН2, H9a,10a), 0.54-0.58 м (2Н, СН2, H9b,10b), 2.36-2.39 т (1Н, СН, Н8, J 8 и 4 Гц), 3.06 уш.с (4Н, СН2, Н6,7), 4.25 уш.с (4Н, СН2, H2,4).
Спектр ЯМР 13С, δ, м.д.: 6.87 (С9,10), 33.05 (С8), 36.39 (С6,7), 59.52 (С2,4).
Масс-спектр (MALDI TOF/TOF), m/z (Iотн., %): 174 [М-Н]+ (100%).
Спектральные характеристики 3-циклопентил-1,5,3-дитиазепана
Элюент PhMe-EtOAc-Me2CO (4:1:1), Rf 0.7, nD20 1.5962.
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.39-1.44 м (2Н, СН2, H9a,12a); 1.60-1.65 м (2Н, СН2, H10a,11a); 1.68-1.75 м (2Н, СН2, H10b,11b); 1.89-1.95 м (2Н, СН2, H9b,12b); 3.08 уш. с (4Н, СН2, Н6,7); 3.28-3.37 м (1Н, СН, H8); 4.25 уш. с (4Н, СН2, H2,4).
Спектр ЯМР 13С, δ, м.д.: 23.53 (С10,11), 30.74 (С9,12), 36.05 (С6,7), 58.77 (С2,4), 60.06 (С8).
Масс-спектр (MALDI TOF/TOF), m/z (Iотн,, %): 202 [М-Н]+ (100%).
Элюент PhMe-EtOAc-Me2CO (4:1:1), Rf 0.7, т.пл. 29-31°С.
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.15-1.34 м (5Н, СН2, H9a,10а,11а,12a,13а); 1.61-1.65 м (1Н, СН2, H11b); 1.76-1.82 м (2Н, СН2, H10b,12b); 1.94 д (2Н, СН2, H9b,13b, J 12 Гц); 2.81-2.87 м (1Н, СН, H8); 3.05 уш. с (4Н, СН2, Н6,7); 4.33 уш.с (4Н, СН2, H2,4).
Спектр ЯМР 13С, δ, м.д.: 25.23 (С10,12), 25.94 (С11), 30.35 (C9,13), 36.37 (С6,7), 56.75 (С2,4), 57.48 (С8).
Масс-спектр (MALDI TOF/TOF), m/z (Iотн., %): 218 [М+H]+ (100%).
Элюент EtOAc-n-С6Н14 (5:1), Rf 0.6, т.пл. 59-62°С.
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.49-1.55 м (2Н, СН2, H9a,13a); 1.85-1.89 м (2Н, СН2, H9b,13b); 3.05 уш. с (4Н, СН2, Н6,7); 3.10-3.15 м (1Н, СН, H8); 3.42-3.49 м (2Н, СН2, H10a,12a); 4.00-4.07 м (2Н, СН2, H10b,12b); 4.26 уш.с (4Н, СН2, H2,4).
Спектр ЯМР 13С, δ, м.д.: 30.66 (С9,13), 36.07 (С6,7), 53.84 (С8), 56.35 (С2,4), 66.88 (С10,12).
Масс-спектр (MALDI TOF/TOF), m/z (Iотн., %): 218 [М-Н]+ (100%).
Элюент PhMe-EtOAc-Me2CO (4:1:1), Rf 0.5. nD20 1.6021.
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.37-1.46 м (2Н, СН2, H10a,13a); 1.48-1.57 м (6Н, СН2, Н9а,14а, Н11,12); 1.60-1.65 м (2Н, СН2, H10b,13b); 1.82-1.85 м (2Н, СН2, H9b,14b); 2.88-2.92 м (1Н, СН, H8); 2.95 уш.с (4Н, СН2, Н6,7); 4.27 уш.с (4Н, СН2, Н2,4).
Спектр ЯМР 13С, δ, м.д.: 24.72 (С10,13), 27.97 (С11,12), 31.56 (С9,14), 36.96 (С6,7), 56.88 (С2,4), 61.57 (С8).
Масс-спектр (MALDI TOF/TOF), m/z (Iотн., %): 230 [М-Н]+ (100%).
Элюент PhMe-EtOAc-Me2CO (4:1:1), Rf 0.6. nD20 1.5971.
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.46-1.52 м (5Н, СН2, H10a,11a,12a,13a,14a); 1.55-1.64 м (5Н, СН2, H9a,15a, H10b,12b,14b); 1.68-1.77 м (2Н, СН2, H11b,13b); 1.84-1.92 м (2Н, СН2, H9b,15b); 3.07 уш.с (4Н, СН2, Н6,7; 1Н, СН, Н8); 4.35 уш.с (4Н, СН2, Н2,4).
Спектр ЯМР 13С, δ, м.д.: 24.17 (C11,13), 25.82 (С12), 27.25 (С10,14), 29.28 (С9,15), 36.73 (С6,7), 57.17 (С2,4), 59.24 (С8).
Масс-спектр (MALDI TOF/TOF), m/z (Iотн., %): 244 [М-Н]+ (100%).
Элюент EtOAc-n-С6Н14 (5:1), Rf 0.7, nD20 1.5989.
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.12 уш. с (1Н, СН2, Н10а); 1.14 уш. с (1H, СН2, Н14а); 1.17-1.22 м (1Н, СН2, H13a); 1.44-1.47 м (4Н, СН2, H10b,14b, Н12); 1.54-1.61 м (1H, СН2, H13b); 2.27 уш. с (1Н, СН, Н11); 2.35 уш. с (1Н, СН, Н9); 2.94-2.96 м (1Н, СН, H8); 2.99-3.06 м (2Н, СН2, Н6а,7a); 3.09-3.16 м (2Н, СН2, H6b,7b); 4.21 д (2Н, СН2, H2a,4a, J 19 Гц); 4.23 д (2Н, СН2, H2b,4b, J 19 Гц). Спектр ЯМР 13С, δ, м.д.: 27.55 (С13), 28.37 (С14), 35.22 (С10), 35.80 (С6,7), 36.20 (С11), 37.33 (С12), 38.17 (С9), 57.28 (С2,4), 61.53 (С8).
Масс-спектр (MALDI TOF/TOF), m/z (Iотн., %): 228 [М-Н]+ (100%).
Способ получения N-циклоалкилзамещенных 1,5,3-дитиазепанов общей формулы (1)
где R = цикло-С3Н5, цикло-С5Н9, цикло-С6Н11, цикло-С5Н9О, цикло-С7Н13, цикло-C8H15, норборнил-,
отличающийся тем, что 1,3,5-трициклоалкил(циклопропил, или циклопентил, или циклогексил, или тетрагидропиранил, или циклогептил, или циклооктил, или норборнил)-1,3,5-триазин подвергают взаимодействию с 1,2-этандитиолом в присутствии катализатора SmCl3⋅6H2O, взятыми в мольном соотношении 1,3,5-трициклоалкил-1,3,5-триазин : 1,2-этандитиол : SmCl3⋅6H2O = 1:1:(0.03-0.07), предпочтительно 1:1:0.05, при комнатной температуре (~20°C) и атмосферном давлении в среде растворителей метанол-хлороформ (1:1, объемное соотношение) в течение 2.5-3.5 ч.