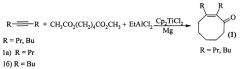Способ получения 2,3-диалкил-2-циклооктен-1-онов
Иллюстрации
Показать всеНастоящее изобретение относится к способу получения 2,3-диалкил-2-циклооктен-1-онов общей формулы (1):
, которые используют в качестве исходных синтонов для создания биологически активных соединений, проявляющих противовирусные, противогрибковые и противоопухолевые свойства. Способ характеризуется тем, что диалкилацетилены общей формулы R-C≡C-R, где R=С3Н7 или С4Н9, подвергают взаимодействию с двукратным избытком метилового эфира адипиновой кислоты CH3CO2(СН2)4СО2СН3 и EtAlCl2 в присутствии магния (Mg, порошок) и катализатора Cp2TiCl2, реакцию проводят при мольном соотношении RC≡CR : CH3CO2(СН2)4СО2СН3 : EtAlCl2 : Mg : Cp2TiCl2=10:20:(40-60):(40-60):(1.8-2.2), в тетрагидрофуране в атмосфере аргона при 60°С и атмосферном давлении в течение 4-8 ч. Предлагаемый способ позволяет получить целевые продукты с выходом 59-83%. 1 табл., 10 пр.
Реферат
Предлагаемое изобретение относится к области органической химии, в частности к новому способу получения циклических кетонов формулы (1):
Предлагаемые соединения представляют интерес в качестве исходных синтонов для создания биологически активных соединений медицинского назначения, проявляющих противовирусные, противогрибковые, противоопухолевые, свойства ([1] S.F. Brady, М.P. Singh, J.Е. Janso, Clardy guanacastepene, a fungal-derived diterpene antibiotic with a new carbon skeleton. J. Am. Chem. Soc. 2000, 122, 2116-2117; [2] K.R. Gustafson, J.H. Cardellina, J.B. McMahon, RJ. Gulakowski, J. Ishitoya, Z. Szallasi, N.E. Lewin, P.M. Blumberg, O.S. Weislow, J.A. Beutler, R.W. Buckheit, G.M. Cragg, P.A. Cox, J.P. Bader, M.R. Boyd. A nonpromoting phorbol from the samoan medicinal plant homalanthus nutans inhibits cell killing by HIV-1. J. Med. Chem. 1992, 35, 1978-1986. [3] R. Wada, Y. Suto, M. Kanai, M. Shibasaki. Dramatic switching of protein kinase с agonist/antagonist activity by modifying the 12-ester side chain of phorbol esters. J. Am. Chem. Soc. 2002, 124, 10658-10659).
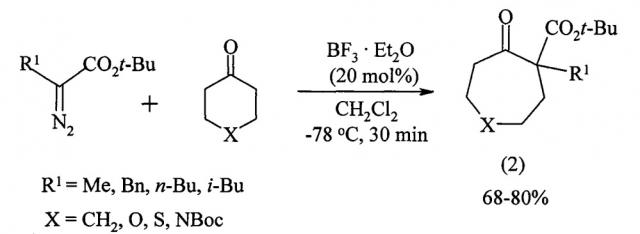
Известен способ ([4] Т. Hashimoto, Y. Naganawa, K. Maruoka. Stereoselective construction of seven-membered rings with an all-carbon quaternary center by direct Tiffeneau-Demjanov-type ring expansion. J. Am. Chem. Soc. 2009, 131, 6614-6617) получения циклических кетонов (2) путем взаимодействия циклогексанонов с α-замещенными диазоацетатами в присутствии эфирата трехфтористого бора в хлористом метилене в течение 30 минут при температуре -78°С с выходом 68-80%.
Известным способом не могут быть получены 2,3-диалкил-2-циклооктен-1-оны формулы (1).
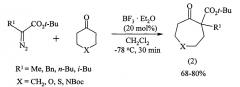
Известен способ ([5] Y. Takada, K. Nomura, S. Matsubara. Preparation of a cycloheptane ring from a 1,2-diketone with high stereoselectivity. Org. Let. 2010, 12, 22, 5204-5205) получения циклических кетонов (4) реакцией 1,6-диалкилгекса-1,5-диен-3,4-дионов с бис(йодцинк)метаном в тетрагидрофуране в течение 3 часов при температуре -78°С с выходом 41-99%.
Известным способом не могут быть получены 2,3-диалкил-2-циклооктен-1-оны формулы (1).
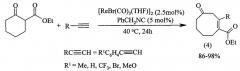
Известен способ ([6] Y. Kuninobu, A. Kawata, K. Takai. Efficient catalytic insertion of acetylenes into a carbon-carbon single bond of nonstrained cyclic compounds under mild conditions. J. Am. Chem. Soc. 2006, 128, 11368-11369) получения циклических кетонов (5) реакцией этил-2-оксоциклогексанкарбоксилата с терминальными ацетиленами в присутствии бензилизоцианида катализируемой комплексом [ReBr(CO)3(THF)]2 в течение 24 ч при температуре 40°С с выходом 86-99%.
Известным способом не могут быть получены 2,3-диалкил-2-циклооктен-1-оны формулы (1).
Предлагается новый способ получения 2,3-диалкил-2-циклооктен-1-онов формулы (1). Сущность способа заключается во взаимодействии дизамещенного ацетилена RC≡CR, где R=Pr или Bu с двойным избытком метилового эфира адипиновой кислоты и EtAlCl2 в присутствии магния (Mg, порошок) и катализатора Cp2TiCl2, взятых в мольном соотношении ацетилен: CH3CO2(СН2)4CO2CH3 : EtAlCl2 : Mg : Cp2TiCl2 = 10:20:(40-60):(40-60):(1.8-2.2), предпочтительно 10:20:50:50:2 ммоль. Реакцию проводят в тетрагидрофуране, в атмосфере аргона при температуре 60°С и атмосферном давлении. Время реакции 4-8 ч. Целевые продукты образуются в виде смеси 2,3-диалкил-2-циклооктен-1-онов (1) в соотношении 1:1 с общим выходом 59-83%. Реакция протекает по схеме:
Целевые продукты (1) образуются только лишь с участием дизамещенных ацетиленов RC≡CR, этилалюминийдихлорида (EtAlCl2), метилового эфира адипиновой кислоты CH3CO2(СН2)4CO2CH3 и магния (акцептор ионов хлора). В присутствии других соединений алюминия (например, Et2AlCl, Et3Al, Bui3Al, i-Bu2AlH), других эфиров (например простые эфиры, эфиры монокарбоновых кислот), других непредельных соединений (например, терминальные ацетилены, дизамещенные олефины) или других металлов (например Al, Cu, Fe) целевые продукты (1) не образуются.
Изменение соотношения исходных реагентов в сторону увеличения их содержания по отношению к диалкилзамещенному ацетилену не приводит к существенному повышению выхода целевых продуктов (1). Снижение количества EtAlCl2, CH3CO2(CH2)4CO2CH3 или Mg по отношению к диалкилзамещенному ацетилену уменьшает выход 2,3-диалкил-2-циклооктен-1-онов (1).
Проведение указанной реакции в присутствии катализатора Cp2TiCl2 больше 2.2 ммолей приводит к образованию побочных продуктов (гексазамещенных бензолов) и существенному уменьшению выхода целевых продуктов (1). Использование катализатора Cp2TiCl2 менее 1.8 ммолей снижает выход 2,3-диалкил-2-циклооктен-1-онов (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Реакции проводили при температуре 60°С. При более высокой температуре (например, 80°С) увеличиваются энергозатраты на проведение процесса, а при меньшей температуре (например, 40°С) снижается скорость реакции.
Существенные отличия предлагаемого способа:
В известном способе используются в качестве исходных реагентов терминальные ацетилены и этил-2-оксоциклогексанкарбоксилат. Предлагаемый способ базируется на использовании в качестве исходных реагентов диалкилацетиленов (RC≡CR), метилового эфира адипиновой кислоты CH3CO2(СН2)4СО2СН3 этилалюминийдихлорида, магния (Mg порошок) и катализатора Cp2TiCl2, взятых в мольном соотношении 10:20:50:40:2 ммоль.
Способ поясняется следующими примерами:
ПРИМЕР 1. В стеклянный реактор, установленный на магнитной мешалке, при охлаждении до 0°С, в атмосфере аргона помещают 20 мл тетрагидрофурана, 7,1 мл (50 ммолей) EtAlCl2, 0,97 г (40 ммоль) магния, 0,5 г (2 ммоль) катализатора Cp2TiCl2. Перемешивают при 0°С в течение 1 ч, после чего добавляют 1,1 г (10 ммоль) окт-4-ина и 4,04 г (20 ммоль) диметилового эфира адипиновой кислоты CH3CO2(СН2)4CO2CH3. Реакционную массу нагревают с обратным холодильником до 60°С в течение 6 часов. Получают смесь 2,3-диалкил-2-циклооктен-1-онов в соотношении 1:1 с общим выходом 79%.
Спектральные характеристики 2,3-дипропил-2-циклооктен-1-онов (1а).
Спектр ЯМР 1Н, CDCl3, δ, м.д.: 0.90-0.95 (м, 6Н, СН3), 1.28-1.48 (м, 6Н, СН2), 1.71-1.79 (м, 2Н, СН2), 1.85-1.92 (м, 2Н, СН2), 2.05-2.09 (м, 2Н, СН2), 2.21-2.26 (м, 2Н, СН2), 2.41 (т, J=6 Гц, 2Н, СН2), 2.49 (т, J=6.0 Гц, 2Н, СН2). Спектр ЯМР 13С, δ, м.д.: 13.98, 14.35, 14.44, 21.54, 22.47, 23.03, 23.09, 25.24, 25.31, 29.96, 29.99, 30.45, 31.47, 32.80, 33.75, 35.13, 36.00, 43.32, 133.42, 148.25, 205.44. ИК: 1742, 1673, 2951, 2930, 2873, 1462. Масс-спектр, m/z: 208 (М+). Вычислено, (%): С 80.71; Н 11.61, C14H24O. Найдено: С 80.46; Н 11.48. Удвоение сигналов в спектре ЯМР 13С связано с наличием конформеров с различным положением кетогруппы относительно плоскости двойной связи.
ПРИМЕР 2. Аналогично примеру 1, но в качестве ацетиленового производного используется дец-5-ин.
Спектральные характеристики 2,3-дибутил-2-циклооктен-1-онов (1б).
Спектр ЯМР 1Н, CDCl3, δ, м.д.: 0.89-0.95 (м, 6Н, СН3), 1.26-1.46 (м, 10Н, СН2), 1.70-1.82 (м, 2Н, СН2), 1.80-1.96 (м, 2Н, СН2), 2.05-2.10 (м, 2Н, СН2), 2.21-2.28 (м, 2Н, СН2), 2.41 (т, J=6.8 Гц, 2Н, СН2), 2.48 (т, J=6.8 Гц, 2Н, СН2). Спектр ЯМР 13С, δ, м.д.: 14.00, 14.03, 22.45, 22.54, 23.06, 23.09, 25.20, 25.29, 27.84, 27.95, 30.63, 30.93, 32.70, 32.85, 33.07, 33.78, 34.00, 43.27, 133.17, 148.84, 206.02. Масс-спектр: m/z 236 [М]+. Вычислено, (%): С 81.29; Н 11.94, C16H28O. Найдено, (%): С 81.11; Н 11.82.
Удвоение сигналов в спектре ЯМР 13С связано с наличием конформеров с различным положением кетогруппы относительно плоскости двойной связи. Другие примеры, подтверждающие способ, приведены в табл. 1.
Реакции проводили при температуре 60°C в тетрагидрофуране.
Способ получения 2,3-диалкил-2-циклооктен-1-онов общей формулы (1):
характеризующийся тем, что диалкилацетилены общей формулы R-C≡C-R, где R=С3Н7 или С4Н9, подвергают взаимодействию с двукратным избытком метилового эфира адипиновой кислоты CH3CO2(СН2)4СО2СН3 и EtAlCl2 в присутствии магния (Mg, порошок) и катализатора Cp2TiCl2, реакцию проводят при мольном соотношении RC≡CR : CH3CO2(СН2)4СО2СН3 : EtAlCl2 : Mg : Cp2TiCl2=10:20:(40-60):(40-60):(1.8-2.2), в тетрагидрофуране в атмосфере аргона при 60°С и атмосферном давлении в течение 4-8 ч.